生物絮凝劑的制備及其在蔗汁澄清的應(yīng)用探索
李雨虹,曾練強(qiáng),馬 步,鐘志才,常國煒,黎志德,徐艷芳,梁達(dá)奉,
(1廣州甘蔗糖業(yè)研究所 廣東省甘蔗改良與生物煉制重點(diǎn)實(shí)驗(yàn)室,廣東廣州510136;2廣西糖業(yè)研發(fā)中心,廣西南寧530002;3廣西大學(xué)輕工與食品工程學(xué)院,廣西南寧530004)
生物絮凝劑的制備及其在蔗汁澄清的應(yīng)用探索
李雨虹1,曾練強(qiáng)1,馬 步2,鐘志才1,常國煒1,黎志德1,徐艷芳3,梁達(dá)奉1,2
(1廣州甘蔗糖業(yè)研究所 廣東省甘蔗改良與生物煉制重點(diǎn)實(shí)驗(yàn)室,廣東廣州510136;2廣西糖業(yè)研發(fā)中心,廣西南寧530002;3廣西大學(xué)輕工與食品工程學(xué)院,廣西南寧530004)
以地衣芽孢桿菌(Bacillus licheniformis)為出發(fā)菌株,通過紫外誘變選育出一株產(chǎn)絮凝劑的高效菌株,經(jīng)過搖瓶發(fā)酵生產(chǎn)生物絮凝劑(MBF)對甘蔗中和汁進(jìn)行澄清試驗(yàn)。結(jié)果表明,突變株比出發(fā)菌株產(chǎn)MBF的絮凝活性提高17%;10 U/mL 的MBF與2 mg/kg聚丙烯酰胺(PAM)處理甘蔗中和汁澄清效果相當(dāng)。MBF取代PAM作為糖用絮凝劑具有可行性。
紫外誘變;生物絮凝劑;甘蔗中和汁;澄清
0 引言
蔗汁澄清是制糖工藝中的關(guān)鍵環(huán)節(jié),絮凝劑在其中起著重要的作用。我國的制糖工業(yè)在上世紀(jì)60年代后期開始在蔗汁澄清中采用高分子聚合物作絮凝劑,目前國內(nèi)糖廠澄清應(yīng)用效果最好的是聚丙烯酰胺(PAM),但其潛在的使用安全性和二次污染問題卻越來越受到關(guān)注[1-3]。伴隨人們環(huán)保意識的增強(qiáng)和行業(yè)管理越來越規(guī)范化,特別在食品行業(yè)對絮凝劑的安全性和環(huán)保性提出了更高的要求,開發(fā)安全無毒、無二次污染的糖用生物絮凝劑對食糖的安全具有重要的現(xiàn)實(shí)意義。
迄今為止,已經(jīng)報(bào)導(dǎo)的生物絮凝劑(MBF)產(chǎn)生菌就有超過60多種,但絮凝劑用量大,成本高等問題制約了生物絮凝劑在工業(yè)上廣泛應(yīng)用[4]。因此,
尋找高效微生物絮凝劑產(chǎn)生菌,提高絮凝活性,降低絮凝劑用量,成為生物絮凝劑能否在工業(yè)上推廣的關(guān)鍵。微生物誘變育種能夠分離篩選優(yōu)良的菌株,已被廣泛應(yīng)用。常用的微生物育種方法,主要有物理誘變、化學(xué)誘變和兩者復(fù)合誘變[5]。作為物理誘變的一種,紫外誘變具有設(shè)備簡單、效率高、操作簡單等優(yōu)點(diǎn)。本試驗(yàn)以地衣芽孢桿菌(Bacillus licheniformis)為出發(fā)菌株,通過紫外誘變選育出一株產(chǎn)絮凝劑的高效菌株,搖瓶發(fā)酵制備生物絮凝劑應(yīng)用于廣西農(nóng)墾糖業(yè)集團(tuán)金光制糖有限公司的甘蔗中和汁進(jìn)行澄清試驗(yàn)。
1 材料與方法
1.1 材料
1.1.1 試驗(yàn)菌株
絮凝劑產(chǎn)生菌地衣芽孢桿菌(Bacillus licheniformis),由廈門大學(xué)提供。
1.1.2 樣品
硫熏中和汁來自廣西農(nóng)墾糖業(yè)集團(tuán)金光制糖有限公司2014/15年榨季生產(chǎn)線取樣。
1.1.3 培養(yǎng)基
1.1.3.1 種子培養(yǎng)基(g/L)
葡萄糖10,酵母膏0.5,尿素0.5,KH2PO40.1,K2HPO40.1,NaCl 0.1,MgSO40.2,pH 7.2
1.1.3.2 平板培養(yǎng)基(g/L)
蔗糖10,酵母膏1,尿素1,NaCl 0.1, KH2PO40.1,K2HPO40.1,MgSO40.2,瓊脂15.0,pH 7.2
1.1.3.3 發(fā)酵培養(yǎng)基(g/L)
葡萄糖13.4,酵母膏0.6,尿素2.35,KH2PO45.6,K2HPO41.4,NaCl 2,MgSO40.055,pH 7.2
1.2 方法
1.2.1 培養(yǎng)方法
1.2.1.1 菌種活化
將出發(fā)菌轉(zhuǎn)接到新鮮斜面培養(yǎng)基內(nèi),37℃培養(yǎng)12 h。
1.2.1.2 種子培養(yǎng)
取一環(huán)活化后的菌株接入裝有50 mL種子培養(yǎng)基的250 mL三角瓶中,于37℃、200 r/min下?lián)u瓶培養(yǎng)16 h。
1.2.1.3 發(fā)酵培養(yǎng)
以2%的接種量(v/v)將種子液接入發(fā)酵培養(yǎng)基中,于37℃、200 r/min下?lián)u床培養(yǎng)48 h。
1.2.2 紫外線誘變[6]
將地衣芽孢桿菌新鮮斜面用0.85%的生理鹽水將菌苔洗下,3000 r/min離心10 min,棄上清,用生理鹽水洗滌菌體2-3次,制成單細(xì)胞菌懸液,用顯微鏡直接計(jì)數(shù)法調(diào)整細(xì)胞濃度為108個(gè)/mL。取5 mL菌懸液于9 cm內(nèi)有磁力攪拌子的無菌平皿中,置于磁力攪拌器上,于波長253.7 nm,功率 8 W的紫外燈下,距離20cm,照射60 s后開蓋振蕩照射。照射20、25、30、35、40、50、60 s分別取樣,放置于冰水中1~2 h,采用10倍稀釋法,選擇每個(gè)平板上長有50~200個(gè)菌落的稀釋度涂布平板培養(yǎng)基,每個(gè)稀釋度3個(gè)平行,于37℃進(jìn)行暗培養(yǎng)24 h。并設(shè)立對照,最后進(jìn)行活菌計(jì)數(shù),計(jì)算致死率。致死率=﹙1-誘變后活菌數(shù)/誘變前活菌數(shù)﹚×100%。
1.2.3 突變株的篩選
挑選形態(tài)大,表面光滑,周邊粘稠的單菌落初篩,接至斜面培養(yǎng)基培養(yǎng)保存。在發(fā)酵培養(yǎng)基中,對初篩得到的單菌落復(fù)篩,37℃、200 r/min下?lián)u床培養(yǎng)48 h后測定絮凝率,保存絮凝活性較高的菌種。
1.2.4 菌種穩(wěn)定性考察
將復(fù)篩得到的菌株與出發(fā)菌株進(jìn)行平行繼代遺傳穩(wěn)定性實(shí)驗(yàn),轉(zhuǎn)接5代,再進(jìn)行搖瓶發(fā)酵,測定發(fā)酵液的絮凝活性,觀察其遺傳穩(wěn)定性。
1.2.5 絮凝率的測定
50 mL具塞比色管中加入40 mL 10 g/L高嶺土懸浮液,2.5 mL 10 g/LCaCl2溶液,1 mL發(fā)酵液,加蒸餾水至刻度,搖勻后靜置5 min,用分光光度計(jì)在550 nm處測定吸光度A,以空白發(fā)酵培養(yǎng)基的吸光度A0為對照確定培養(yǎng)液的絮凝活性,以絮凝率表示:絮凝率(%)=(A0-A)/A0×100%。
1.2.6 絮凝活性成分的穩(wěn)定性
1.2.6.1 絮凝活性成分的熱穩(wěn)定性
取發(fā)酵液于若干試管中(10 mL/管),分別在20、30、40、50、60、70、80、90、100℃溫度下水浴加熱30 min,按1.2.5節(jié)方法測定它們的絮凝活性。
1.2.6.2 絮凝活性成分pH穩(wěn)定性
取發(fā)酵液于若干個(gè)試管中(每管10 mL),分別在pH 2、3、4、5、6、7、8、9、10、11下,4℃放置24 h后按照1.2.5節(jié)方法測定它們的絮凝活性。
1.2.7 絮凝實(shí)驗(yàn)
取生產(chǎn)流程上的硫熏中和汁(硫熏強(qiáng)度20 cc,pH 7.0~7.2),加熱煮沸,加MBF或PAM(絮凝劑
用量按實(shí)驗(yàn)定量),攪拌均勻,迅速倒入500 mL的量筒中沉降,計(jì)時(shí)并記錄沉降速度,取清汁分析。
2 結(jié)果與分析
2.1 誘變時(shí)間的選擇
紫外線照射時(shí)間對菌株致死率的影響見圖1。在照射20 s時(shí),其致死率己達(dá)到66.4%,由此可見出發(fā)菌株對紫外線較敏感。根據(jù)致死率為90%左右的誘變效果最好[7],選取誘變時(shí)間為25 s。
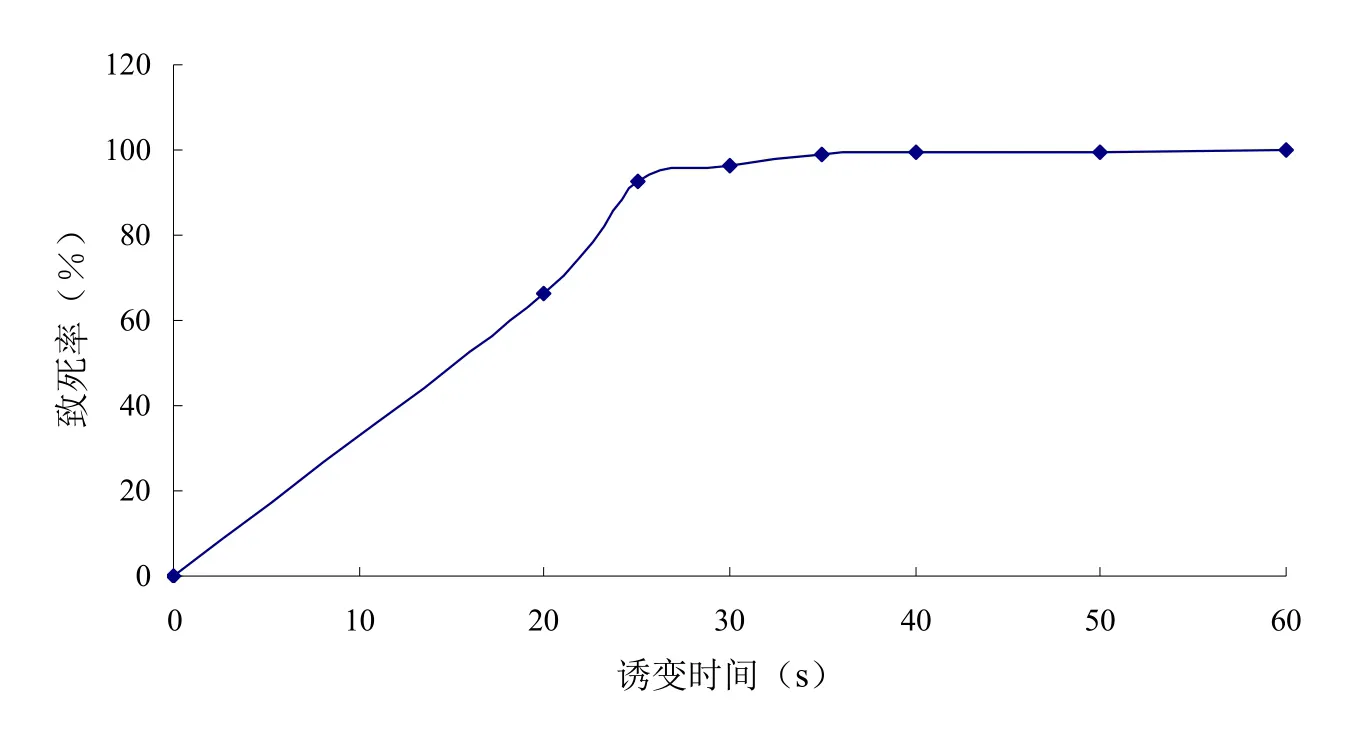
圖1 紫外誘變菌株致死率曲線
2.2 菌種篩選
出發(fā)菌株(絮凝率65.0%)經(jīng)過紫外線照射誘變后,篩選得到絮凝活性較高的正突變菌株,經(jīng)過反復(fù)篩選,獲得1株絮凝率達(dá)76.0%的正突變菌株。
由于誘變菌株的性狀常常不穩(wěn)定,尤其是在連續(xù)傳代培養(yǎng)時(shí),為了檢測菌株性狀是否穩(wěn)定,將誘變出的菌株在斜面繼代培養(yǎng)5代,分別檢測每代的絮凝率,最后得到1株絮凝性能穩(wěn)定的菌株,每代的絮凝率分別為76.0、74.3、75.2、73.8、74.9、73.1%,5代絮凝率沒有顯著性差異。說明傳代次數(shù)對絮凝率影響不顯著,誘變菌株遺傳性能穩(wěn)定。
2.3 絮凝劑的熱穩(wěn)定性
為了考察該絮凝劑的熱敏性,將發(fā)酵液分別在不同的溫度下水浴加熱30 min后,測定其絮凝活性變化情況,由絮凝活性的變化趨勢來確定該絮凝劑對溫度的敏感程度,結(jié)果如圖2所示。由圖2可知,高溫加熱對絮凝劑的活性影響不大。
2.4 絮凝劑的pH穩(wěn)定性
將發(fā)酵液的pH調(diào)至不同的值,于4℃冰箱放置24 h后,測定其絮凝活。結(jié)果如圖3所示。由圖3可知,絮凝劑定pH為3~11范圍內(nèi)保持了良好的絮凝穩(wěn)定穩(wěn)。
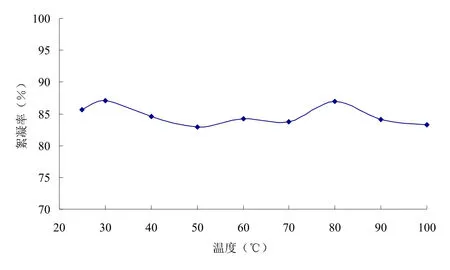
圖2 生物絮凝劑的熱穩(wěn)定性
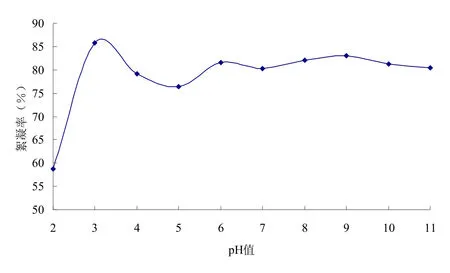
圖3 生物絮凝劑的pH穩(wěn)定性
2.5 最適生物絮凝劑添加量確定
取約3500 mL硫熏中和汁,加熱煮沸后分別量取500 mL各加入2 ppm PAM(0.067%濃度1.5mL)、5、10、15、20 U/mL MBF,以不加任何絮凝劑的中和汁為空白,攪拌均勻后迅速倒入500 mL量筒中。觀察并記錄沉降速度,靜置30 min后分別取上清汁分析錘度、pH值、色值、純度,結(jié)果見表1。
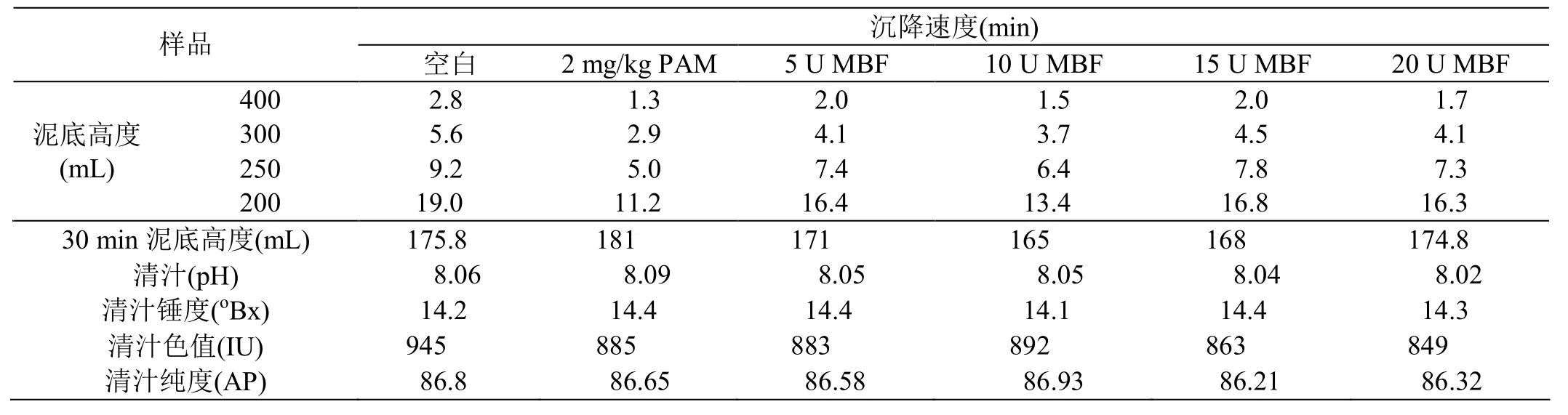
表1 最適生物絮凝劑添加量
由表1可知,中和汁加熱至100℃,無論是否加絮凝劑都能沉降,絮凝劑加入量不同沉降速度也不同。其中不加絮凝劑的空白組沉降速度最慢,且肉眼能觀測到清汁有微粒懸浮;加絮凝劑組的泥汁顆粒較大,沉降速度較快。加2 mg/kg PAM組沉降速度最快,加MBF組的沉降速度以10 U/mL組的沉降速度接近加2 mg/kg PAM組沉降速度,多于10 U/mL組的沉降速度反而下降,因此選擇10 U/mL MBF替代PAM進(jìn)行下一步試驗(yàn)。
2.6 PAM、MBF及復(fù)合絮凝劑的澄清工藝比較
取約3500 mL硫熏中和汁,加熱煮沸后分別量取500 mL各加入2 mg/kg PAM、10 U/mL MBF、5 U/mL MBF+1 ppm PAM攪拌均勻后迅速倒入500 mL量筒中。觀察并記錄沉降速度,靜置30 min后取上清汁分析錘度、pH值、色值、純度。傾出清汁留125 mL泥汁進(jìn)行泥汁過濾效果評價(jià),數(shù)據(jù)見表2。結(jié)果表明復(fù)合絮凝劑組的沉降速度優(yōu)于MBF組,更接近PAM組。對清汁質(zhì)量指標(biāo)及泥汁過濾效果進(jìn)行比較,從清汁質(zhì)量指標(biāo)看,各組的沉降清汁pH、錘度、色值、純度均沒有很大的差異。從泥汁過濾速度來看,PAM組的過濾速度明顯快些,應(yīng)該與泥汁顆粒大小有關(guān),這個(gè)因素有待進(jìn)一步實(shí)驗(yàn)探討。
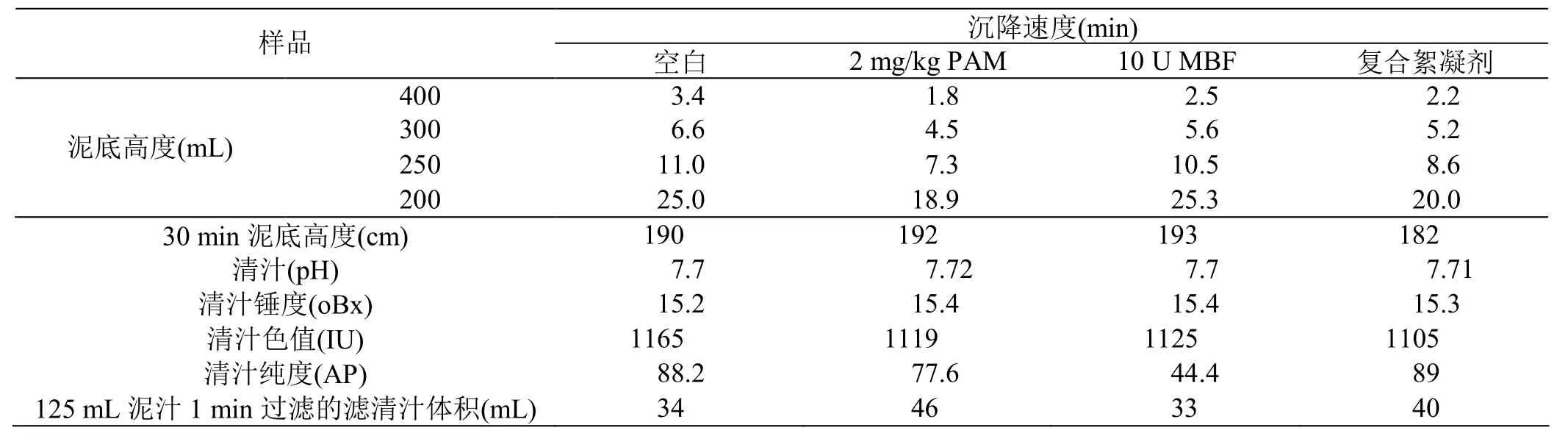
表2 PAM、MBF及復(fù)合絮凝劑對中和汁的絮凝效果
3 結(jié)論
本研究用紫外線誘變處理地衣芽孢桿菌,經(jīng)初篩、復(fù)篩最終得到1株產(chǎn)絮凝劑的高效菌株,其絮凝活性較出發(fā)菌株提高17%。穩(wěn)定性試驗(yàn)結(jié)果表明該菌株具有良好的熱穩(wěn)定性及廣泛的pH穩(wěn)定性。
蔗汁澄清是制糖工業(yè)生產(chǎn)的關(guān)鍵環(huán)節(jié),絮凝劑在其中起著至關(guān)重要的作用。就當(dāng)前而言,仍未有一種十分滿意的糖用絮凝劑。通過上述試驗(yàn)可以看到,生物絮凝劑具有取代聚丙烯酰胺的潛力,可以應(yīng)用在蔗汁澄清工藝;生物絮凝劑與聚丙烯酰胺協(xié)同使用,蔗汁的沉降速度與單獨(dú)使用聚丙烯酰胺接近,且清汁各項(xiàng)質(zhì)量指標(biāo)均沒有明顯差異。將具有安全無二次污染等優(yōu)點(diǎn)的生物絮凝劑應(yīng)用于制糖工業(yè),部分或完全取代有毒性殘留隱患的聚丙烯酰胺在技術(shù)上是可行的。糖用生物絮凝劑的開發(fā),將會對我國制糖工業(yè)提高經(jīng)濟(jì)效益、提高產(chǎn)品質(zhì)量起到良好的促進(jìn)作用。
[1] 李善斌,孫衛(wèi)東. 糖用絮凝劑在制糖過程中的應(yīng)用進(jìn)展[J]. 廣西輕工業(yè),2010,26(2):6-7,48.
[2] 鐘志才,徐杰榮,黃俊生,等. 糖廠常用絮凝劑的應(yīng)用研究和新型絮凝劑的展望[J]. 廣西糖業(yè),2014(6):34-40.
[3] CHAI S L, JOHN R, MEI F C. A review on application of flocculants in wastewater treatment[J]. Process Safety and Environmental Protection, 2014, 92(6): 489-508.
[4] 李雨虹,梁達(dá)奉,常國煒,等. 微生物絮凝劑研究進(jìn)展[J].甘蔗糖業(yè),2014(5):51-56.
[5] 吳煥利,馮貴穎,趙淑艷,等. 紫外誘變選育高效微生物絮凝劑產(chǎn)生茵及其應(yīng)用[J]. 西北農(nóng)林科技大學(xué)學(xué)報(bào):自然科學(xué)版,2008,36(8):113- 118.
[6] 沈萍,陳向東. 微生物學(xué)實(shí)驗(yàn):4版[M]. 北京:高等教育出版社,2008:127.
[7] 施巧琴,吳松剛. 工業(yè)微生物育種學(xué):3版[M]. 北京:科學(xué)出版社,2009:37-38.
(本篇責(zé)任編校:朱滌荃)
Preparation of Bioflocculant and Its Application in Clarification Process of Sugarcane Juice
LI Yu-hong1, ZENG Lian-qiang1, MA-Bu2, ZHONG Zhi-cai1, CHANG Guo-wei1, LI Zhi-de1, XU Yan-fang3,
LIANG Da-feng1,2
(1Guangzhou Sugarcane Industry Research Institute/Guangdong Key Lab of Sugarcane Improvement & Biorefinery, Guangzhou 510136;2Guangxi Sugarcane Industry R & D Center, Nanning, Guangxi 53000;3Insitute of Light Industry and Food Engineering, Guangxi University, Nanning, Guangxi 530004)
A bioflocculant production mutant was screened from Bacillus licheniformis by ultraviolet (UV), and tested the flocculation in clarification of the neutral juice. The results showed that flocculation rate of mutant was increased by 17% compared with the original strain. The 10 U/mL bioflocculant had comparative effect in clarification of the neutral juice with 2 mg/kg polyacrylamide, indicating the possibility of bioflocculant application in sugar industry.
Ultraviolet mutagenesis; Bioflocculant; Neutra1 juice; Clarification
TS244+.2
A
1005-9695(2015)05-0033-05
2015-09-15;
2015-10-15
南寧市工信委技術(shù)創(chuàng)新項(xiàng)目(編號2014-1-30);八桂學(xué)者建設(shè)工程專項(xiàng)經(jīng)費(fèi)資助
李雨虹(1981-),女,工程師,主要從事食品生物技術(shù)研究工作
*通訊作者:梁達(dá)奉(1964-),男,博士,教授級高級工程師,國家甘蔗產(chǎn)業(yè)技術(shù)體系崗位科學(xué)家,主要研究方向:制糖生物技術(shù);
E-mail:ldfjt@126.com
李雨虹,曾練強(qiáng),馬步,等. 生物絮凝劑的制備及其在蔗汁澄清的應(yīng)用探索[J]. 甘蔗糖業(yè),2015(5):33-37.

