麝香醒腦滴丸對腦缺血再灌注損傷的保護作用
胡 文,尹艷艷,王玉嬋,吳陽洋,何 燦,李維祖
(安徽醫科大學藥理學教研室,安徽合肥 230032)
隨著社會老齡化的加速,心腦血管疾病已經成為危害人群健康的主要原因,發病率呈逐年增高的趨勢,尤以缺血性腦血管病最為常見[1]。目前,缺血性腦血管疾病具有患病率高、致殘率高、病死率高、治療費用高等特點[2],嚴重影響病人的健康和生活質量,給社會和家庭帶來沉重負擔。因此尋找治療缺血性腦血管病的有效藥物已經成為藥理學科的重要課題。麝香醒腦滴丸(Shexiang Xingnao dropping pills,SXD)由傳統中藥精制而成,主要成分有麝香、川芎、冰片、水蛭、丹參等。研究表明,麝香、川芎、冰片具有醒腦開竅的功效,水蛭、丹參等具有活血化瘀抑制血栓形成的功能,因此它們對缺血性腦損傷具有保護作用[3-4]。本實驗通過建立大鼠局灶性腦缺血(MCAO)再灌注模型,研究麝香醒腦滴丸對局腦缺血的保護作用及其機制。
1 材料與方法
1.1 實驗動物 清潔級SD大鼠,雄性,268~310 g,購自安徽醫科大學實驗動物中心,動物許可證號:SCXK(皖)2011-002。大鼠自由進食、飲水,飼養3 d適應后進行實驗。
1.2 藥品與試劑 麝香醒腦滴丸(SXD),安徽省華方醫藥科技有限公司,批號:20120601。麝香心腦通膠囊(SXJ),吉林省輝南輝發制藥股份有限公司,批號:20110901;紅四氮唑(2,3,5-三苯基氯化四氮唑,TTC),中國醫藥(集團)上海化學試劑公司產品;水合三氯乙醛,天津市光復精細化工研究所產品;乳酸脫氫酶(LDH)測定試劑盒、丙二醛(MDA)測定試劑盒、超氧化物歧化酶(SOD)測定試劑盒和考馬斯亮蘭蛋白測定試劑盒,全部由南京建成生物工程研究所提供;直徑0.235 mm魚線,日本PATU公司產品。
1.3 實驗儀器 FA1004型電子天平,上海天平儀器廠產品;GKC型可控硅恒溫水浴鍋,上海錦屏儀器儀表有限公司;SpectraMax 190型全波長酶標儀,美國MD公司;WG-2003臺式干燥箱,惠陽南方電氣實驗設備廠;LG10-2.4A型超速離心機,北京醫用離心機廠產品;LBY-NJ4血小板聚集儀,北京普利生儀器有限公司。
1.4 方法
1.4.1 分組及給藥 取雄性SD大鼠,體重268~310 g,隨機分成 6組:模型組、假手術組,SXD(0.21、0.42、0.84 g·kg-1)3 個劑量組和 SXJ(0.42 g·kg-1)組。用藥組灌胃(ig)給藥,模型組和假手術組ig給等容量蒸餾水7 d。第7天給藥后1 h,采用線栓法阻塞大鼠大腦中動脈2 h建立MCAO再灌注模型,再灌注8 h時重復給藥1次。
1.4.2 大鼠MCAO再灌注模型的建立 參照改進的Longa等[5]方法建立大鼠MCAO再灌注模型。術后出現Horner氏征視為造模成功。假手術組只暴露頸內外動脈分叉,無需閉塞大腦中動脈(MCA)。造模前后適宜溫度常規飼養。
1.4.3 考察SXD對MCAO再灌注大鼠神經功能損傷評分的影響 大鼠MCAO后2 h即再灌注0 h,以及再灌注4、8、22 h時,按照Bederson的方法對大鼠的神經功能損傷進行評分[6]。
1.4.4 考察SXD對MCAO再灌注大鼠腦梗死百分比的影響 大鼠MCAO再灌注22 h,將大鼠麻醉后固定,腹主動脈取血后處死大鼠,快速斷頭取腦。將腦置于冰生理鹽水中,除去小腦、嗅球和低位腦干,稱取腦濕重。將腦組織在-20℃條件下冷凍10 min,取出后用手術刀片將腦組織切成5片。然后將腦片放入含有1%的TTC的磷酸緩沖溶液中,37℃避光30 min,達15 min時翻到另外一面。經染色后,腦組織梗死區顯白色,正常區域顯玫瑰紅色,界限分明。分離梗死區和非梗死區腦組織,稱重,計算梗死百分比。
1.4.5 考察SXD對MCAO再灌注大鼠血小板聚集率的影響 大鼠MCAO再灌注22 h后,麻醉后固定大鼠,腹主動脈取血,用3.8%枸椽酸鈉溶液(1∶9)抗凝,低速離心機1 000 r·min-1離心10 min,所取上清液為富血小板血漿(PRP),余下部分3 000 r·min-1離心10 min,所取上清液為貧血小板血漿(PPP),用PPP調整PRP吸光度值在300~400之間。取PRP 290 μL,37℃孵育5 min,加入誘導劑二磷酸腺苷(ADP)溶液10 μL,利用比濁法測定5 min血小板最大聚集率。
1.4.6 考察SXD對MCAO再灌注大鼠腦含水量和腦指數的影響 大鼠斷頭后快速取腦,用電子天平稱取腦組織標本濕重。按照公式:腦指數=腦濕重×100/體重計算腦指數。將腦組織放入恒溫干燥箱(105℃)烤24 h以上,稱取腦組織干重,按公式:腦含水量(%)=(濕重-干重)/濕重×100%計算腦含水量。
1.4.7 考察SXD對MCAO再灌注大鼠腦組織生化指標的影響 取一批大鼠,MCAO 2 h再灌注22 h后斷頭處死大鼠,快速取腦后將其置于冰臺上切為兩部分,一部分固定后做病理組織學檢測。分離另外一部分腦皮質,加入冰NS后在冰浴條件下制成10%的腦組織勻漿,將勻漿在4℃下離心(3 500 r·min-1)15 min,分離上清液后用試劑盒測定SOD和LDH活性,MDA含量,考馬斯亮藍法測定蛋白含量。
1.4.8 考察SXD對MCAO再灌注大鼠腦組織形態學的影響 將腦組織放入10%甲醛溶液中固定。石蠟包埋、切片后作HE染色,主要對大腦皮質神經元部位進行病理組織學檢查。
1.5 統計學分析 采用SPSS17.0軟件進行統計學分析,觀察資料均為計量資料,以(±s)表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。大鼠神經功能評分為多時點重復測量資料,采用兩因素重復測量方差分析,以P<0.05代表有統計學意義。
2 結果
2.1 SXD對MCAO再灌注大鼠神經功能損傷評分的影響 各組結果如表1所示,該資料為5組4個時點重復測量資料,經球形檢驗后,進行兩因素重復測量方差分析。發現組間和時間點之間交互作用有統計學意義。再行精細比較,再灌(0,4 h)結果無統計學意義。再灌8 h后SXJ和SXD(0.42,0.84 g·kg-1)組對大鼠神經功能損傷有所減輕。再灌24 h后SXD(0.84 g·kg-1)組對神經功能損傷評分有所降低,具有統計學意義。
表1 SXD對MCAO再灌注大鼠神經功能損傷評分的影響(±s,n=8)
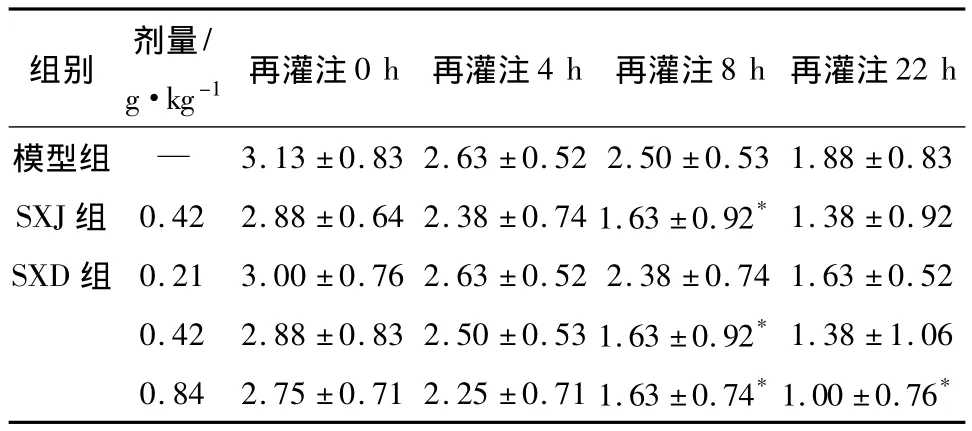
表1 SXD對MCAO再灌注大鼠神經功能損傷評分的影響(±s,n=8)
注:與模型組比較:*P <0.05。
組別 劑量/g·kg-1再灌注0 h 再灌注4 h 再灌注8 h再灌注22 h模型組 —3.13 ±0.83 2.63 ±0.52 2.50 ±0.53 1.88 ±0.83 SXJ組 0.42 2.88 ±0.64 2.38 ±0.74 1.63 ±0.92*1.38 ±0.92 SXD 組 0.21 3.00 ±0.76 2.63 ±0.52 2.38 ±0.74 1.63 ±0.52 0.42 2.88 ±0.83 2.50 ±0.53 1.63 ±0.92*1.38 ±1.06 0.84 2.75 ±0.71 2.25 ±0.71 1.63 ±0.74*1.00 ±0.76*
2.2 SXD對MCAO再灌注大鼠腦梗死百分比的影響 與模型組比較,SXD(0.42,0.84 g·kg-1)和陽性藥SXJ能夠減小MCAO再灌注22 h大鼠的腦梗死百分比。差異有統計學意義(P<0.05),結果見表2。
表2 SXD對MCAO再灌注大鼠腦梗死百分比的影響(±s,n=8)
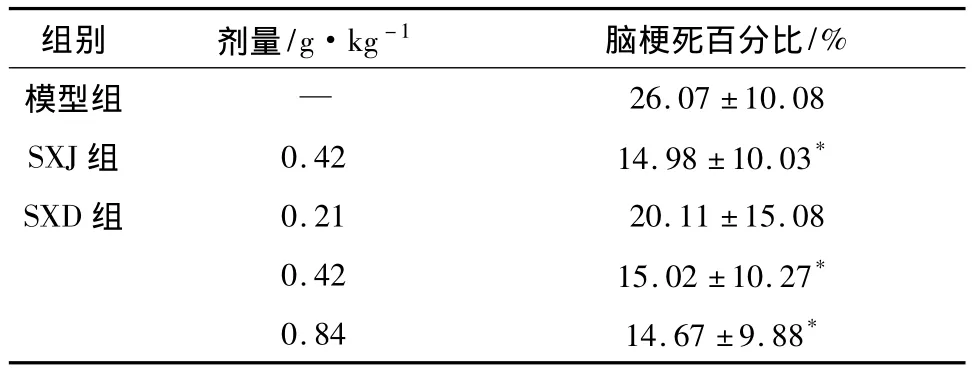
表2 SXD對MCAO再灌注大鼠腦梗死百分比的影響(±s,n=8)
注:與模型對照組比較:*P<0.05。
組別 劑量/g·kg-1 腦梗死百分比/%模型組 —26.07 ±10.08 SXJ組 0.42 14.98 ±10.03*SXD 組 0.21 20.11 ±15.08 0.42 15.02 ±10.27*0.84 14.67 ±9.88*
2.3 SXD對MCAO再灌注大鼠血小板聚集率的影響 結果表明,模型組大鼠血小板聚集率相對于假手術組明顯增加,SXD(0.42,0.84 g·kg-1)組大鼠血小板聚集率相對于模型組比較有一定的降低。陽性藥SXJ組大鼠血小板聚集率有降低趨勢,但無顯著性差異,結果見表3。
表3 SXD對MCAO再灌注大鼠血小板聚集率的影響(±s,n=8)
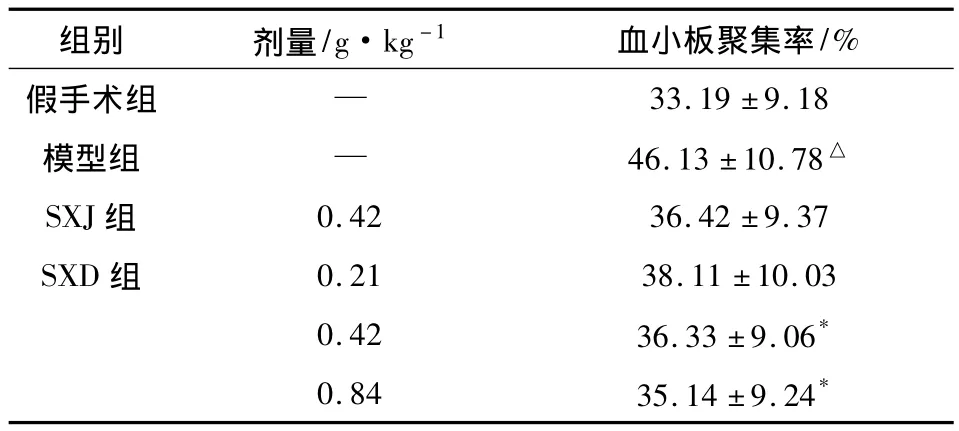
表3 SXD對MCAO再灌注大鼠血小板聚集率的影響(±s,n=8)
注:與假手術組比較:△P <0.05;與模型組比較:*P <0.05。
組別 劑量/g·kg-1 血小板聚集率/%假手術組 —33.19 ±9.18模型組 — 46.13±10.78△SXJ組 0.42 36.42 ±9.37 SXD 組 0.21 38.11 ±10.03 0.42 36.33 ±9.06*0.84 35.14 ±9.24*
2.4 SXD對MCAO再灌注大鼠腦含水量和腦指數的影響 結果顯示,模型組腦含水量和腦指數明顯高于假手術組;SXD(0.42、0.84 g·kg-1)和陽性藥SXJ對腦缺血再灌注22 h大鼠腦指數都低于模型組。SXD(0.84 g·kg-1)和陽性藥SXJ組腦含水量低于模型組且有統計學差異,結果見表4。
表4 SXD對MCAO再灌注大鼠腦含水量和腦指數的影響(±s,n=8)
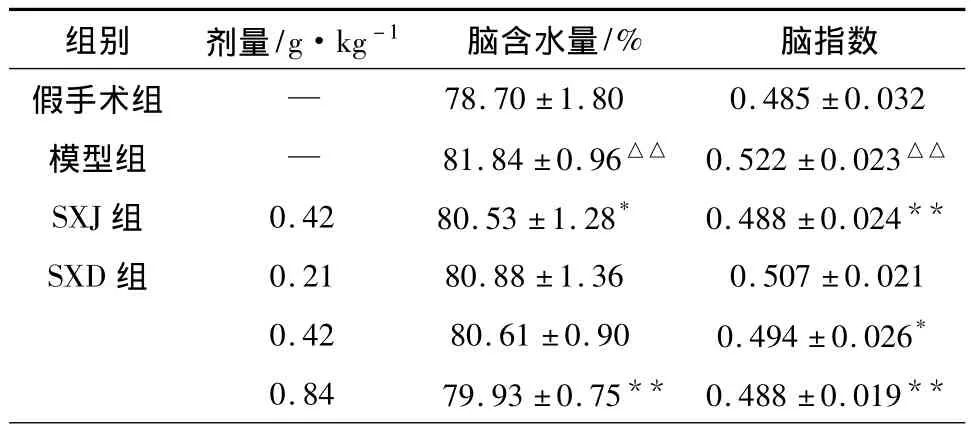
表4 SXD對MCAO再灌注大鼠腦含水量和腦指數的影響(±s,n=8)
注:與假手術組比較:△△P<0.01;與模型組比較:*P<0.05,**P <0.01。
組別 劑量/g·kg-1 腦含水量/%腦指數假手術組 —78.70 ±1.80 0.485 ±0.032模型組 — 81.84±0.96△△ 0.522±0.023△△SXJ組 0.42 80.53 ±1.28* 0.488 ±0.024**SXD 組 0.21 80.88 ±1.36 0.507 ±0.021 0.42 80.61 ±0.90 0.494 ±0.026*0.84 79.93 ±0.75** 0.488 ±0.019**
2.5 SXD對MCAO再灌注大鼠腦組織生化指標的影響 與假手術組相比,模型組大鼠腦組織中SOD及LDH活性顯著降低,MDA含量顯著增加;與模型組比較,SXD(0.42、0.84 g·kg-1)和陽性藥SXJ能夠提高MCAO再灌注大鼠腦組織SOD活性,降低 MDA 含量;SXD(0.42、0.84 g·kg-1)和陽性藥SXJ對LDH活性明顯提高,結果見表5。
表5 SXD對MCAO再灌注大鼠腦組織SOD、LDH、MDA的影響(±s,n=8)
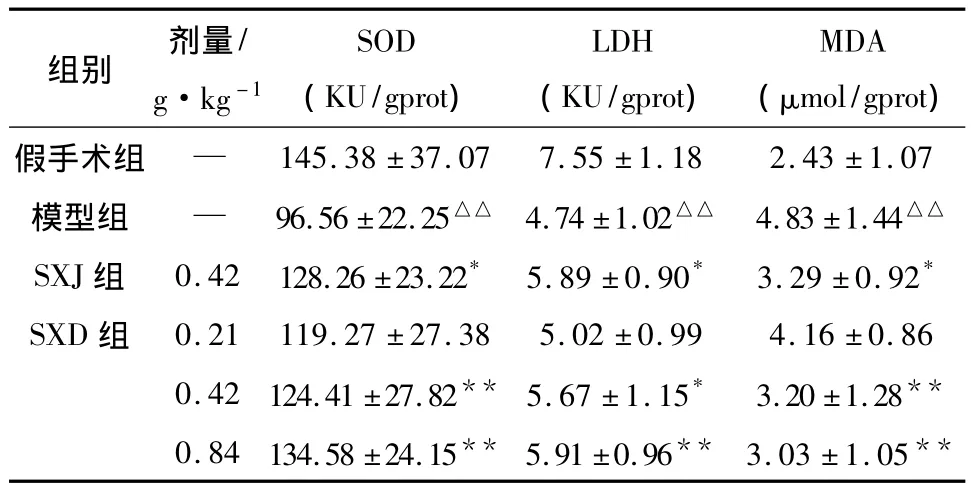
表5 SXD對MCAO再灌注大鼠腦組織SOD、LDH、MDA的影響(±s,n=8)
注:與假手術組比較:△△P<0.01;與模型組比較:*P<0.05,**P <0.01。
組別 劑量/g·kg-1 SOD(KU/gprot)LDH(KU/gprot)MDA(μmol/gprot)假手術組 —145.38 ±37.07 7.55 ±1.18 2.43 ±1.07模型組 — 96.56 ±22.25△△ 4.74 ±1.02△△ 4.83 ±1.44△△SXJ組 0.42 128.26 ±23.22* 5.89 ±0.90* 3.29 ±0.92*SXD 組 0.21 119.27 ±27.38 5.02 ±0.99 4.16 ±0.86 0.42 124.41 ±27.82** 5.67 ±1.15* 3.20 ±1.28**0.84 134.58 ±24.15** 5.91 ±0.96** 3.03 ±1.05**
2.6 SXD對MCAO再灌注大鼠腦組織形態學的影響 假手術組腦組織神經元及細胞形態正常,核仁清晰,未觀察到神經細胞變性壞死等明顯的病理變化。模型組腦組織細胞排列不規則,有一定程度的核固縮、核染色較深,神經元結構模糊、較多胞體腫脹。SXD(0.42、0.84 g·kg-1)和 SXJ組腦組織軟化灶都有一定程度的減少,神經元細胞核固縮程度明顯降低,僅有少量細胞出現腫脹,表明SXD和SXJ對MCAO再灌注大鼠腦組織損傷均具有一定的作用保護,結果見圖1。
3 討論
缺血性腦血管病是一類由腦血流供應障礙導致的腦組織缺血、缺氧,是引發局灶性腦組織缺血性損傷或壞死的多發中樞神經系統病變[7]。缺血性腦血管疾病的病理生理機制主要是由腦缺血再灌注損傷引起,首先需要建立穩定、可靠的實驗動物模型。目前常用的造模方法為大腦中動脈阻斷再灌注損傷模型,該模型具有操作簡單、損害較小、死亡率較低等特點,基本模擬了缺血性腦血管疾病的病理生理狀態。
腦缺血后模型成功和MCAO再灌注損傷程度的評價主要是依據腦梗死百分比的測定和神經功能學的評分[8]。本實驗采用TTC染色法檢測腦缺血再灌注損傷后腦組織梗死狀況,采用Bederson的評分方法對MCAO再灌注0、4、8、22 h大鼠的神經功能進行評分。實驗結果表明SXD對MCAO再灌注后8 h和22 h神經功能損傷評分有一定的降低作用,對MCAO再灌注22 h大鼠腦組織梗死百分比具有一定的減小作用;病理組織學結果也顯示SXD能明顯改善MCAO再灌注大鼠腦組織神經元結構的形態變化。腦水腫是腦缺血再灌注損傷進程中的一個顯著的變化,也是作為評價抗缺血性腦損傷藥物的重要指標之一[9]。本實驗結果顯示SXD可以減輕腦缺血再灌注22 h大鼠腦水腫程度,降低其腦含水量和腦指數。
目前認為腦缺血再灌注損傷是由多種復雜因素相互作用而導致的結果,其中氧自由基脂質過氧化損傷是腦缺血再灌注損傷的主要機制[10]。腦缺血再灌注后腦中氧自由基顯著增加,自由基連鎖反應的激化可造成腦缺血損傷和遲發性神經功能損害的加重[11]。本實驗結果顯示,MCAO再灌注后腦組織中MDA含量顯著升高,SOD和LDH活性下降,表明MCAO再灌注后出現脂質和氧自由基過氧化損傷。而SXD能降低缺血腦組織中MDA的含量,并提高SOD、LDH的活性,表明SXD能夠減輕氧自由基介導的脂質過氧化反應,清除過氧自由基,減輕大鼠缺血性腦組織病變程度。另外,腦缺血時由于無氧糖酵解增加,導致生成大量自由基以及酸中毒,使血小板發生大量聚集繼而加速血栓的形成[12]。實驗結果表明,SXD能夠一定程度降低局灶性腦缺血大鼠血小板聚集率,表明其具有抑制血栓形成的作用。
綜上所述,SXD對大鼠腦缺血再灌注損傷具有一定的保護作用,其作用機制可能與抗脂質過氧化損傷、清除氧自由基,減少血小板聚集等因素有關。
[1]Thrift AG,Dewey HM,Macdonell RA,et al.Incidence of the major stroke subtypes:initial findings from the North East Melbourne stroke incidence study(NEMESIS)[J].Stroke,2001,32(8):1732-1738.
[2]Appelros P,Stegmayr B,Terént A.Sex differences in stroke epidemiology:A systematic review[J].Stroke,2009,40(4):1082-1090.
[3]尹士敏,王士賢.麝香的藥理作用及臨床研究近況[J].天津藥學,2002,14(3):42-44.
[4]李鳳文,張立石,劉 紅,等.水蛭、丹參及其復方對血瘀大鼠血管內皮細胞保護作用的研究[J].中國中藥雜志,2001,26(10):703-706
[5]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472-476.
[7]Hallenbeck JM,Dutka AJ.Background review and current concepts of reperfusion injury[J].Arch Neurol,1990,47(11):1245-1254.
[8]Menzies SA,Hoff JT,Betz AL.Middle cerebral artery occlusion in rats:a neurological and pathological evaluation of a reproducible model[J].Neurosurgery,1992,31(1):100-107.
[9]汪 洋,李維祖,尹艷艷,等.麝香醒腦寧對大鼠全腦缺血/再灌注損傷的保護作用[J].安徽醫科大學學報,2009,44(4):475-479.
[10]Homi HM,Freitas JJ,Curi R,et al.Changes in superoxide dismutase and catalase activities of rat brain regions during early global transient ischemia/reperfusion[J].Neurosci Lett,2002,333(1):37-40.
[11]Hayashi T,Sakurai M,Itoyama Y,et al.Oxidative damage and breakage of DNA in rat brain after transient MCA occlusion [J].Brain Res,1999,832(1/2):159-163.
[12]魏 菲,紀鳳蘭,溫富春,等.注射用通栓欣粉針對大鼠腦缺血損傷的保護作用及其機制[J].中國老年學雜志,2010,30(4):500-501.

