酪蛋白降解對牦牛乳硬質干酪苦味的影響
王 玲,梁 琪,宋雪梅,張 炎
(甘肅農業大學食品科學與工程學院,甘肅省功能乳品工程實驗室,甘肅 蘭州 730070)
酪蛋白降解對牦牛乳硬質干酪苦味的影響
王 玲,梁 琪*,宋雪梅,張 炎
(甘肅農業大學食品科學與工程學院,甘肅省功能乳品工程實驗室,甘肅 蘭州 730070)
針對牦牛乳硬質干酪的苦味缺陷,分別以小牛皺胃酶、微生物凝乳酶和木瓜蛋白酶制作的牦牛乳硬質干酪為研究對象,利用尿素聚丙烯酰胺凝膠電泳,研究牦牛乳硬質干酪pH 4.6水不溶性酪蛋白的降解程度,且對成熟過程中的牦牛乳硬質干酪苦味進行感官評價,探究牦牛乳硬質干酪pH 4.6水不溶性酪蛋白降解對其苦味的影響。結果表明:牦牛乳硬質干酪在成熟期間酪蛋白發生了明顯的降解,且αs-酪蛋白均比β-酪蛋白降解速率快。經尿素聚丙烯酰胺凝膠電泳分離后,發現木瓜蛋白酶制作的牦牛乳硬質干酪pH 4.6水不溶性酪蛋白在Pre-αs-酪蛋白區域有較強的蛋白帶。木瓜蛋白酶制作的牦牛乳硬質干酪pH 4.6水不溶性酪蛋白中αs-酪蛋白和β-酪蛋白降解程度均顯著或極顯著高于微生物凝乳酶和小牛皺胃酶制作的牦牛乳硬質干酪(P<0.05或P<0.01),木瓜蛋白酶制作的牦牛乳硬質干酪的苦味值極顯著高于微生物凝乳酶和小牛皺胃酶制作的牦牛乳硬質干酪的苦味值(P<0.01),通過主成分分析得出3 種凝乳酶制作牦牛乳硬質干酪的苦味值和未降解β-酪蛋白和αs-酪蛋白含量成極顯著負相關。這為控制牦牛乳硬質干酪品質提供了理論參考。
牦牛乳硬質干酪;酪蛋白降解;尿素聚丙烯酰胺凝膠電泳;苦味;主成分分析
牦牛乳是中國青藏高原地區的特色資源,蛋白質含量為5.6%,比荷斯坦牛乳高100.7%,而乳蛋白的組成以酪蛋白(casein,CN)為主,含量為84%[1],且主要是αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白。酪蛋白的降解不僅影響干酪的產量和質地,一定程度上對干酪的風味也有較大的影響。大多數干酪成熟過程中,殘留的凝乳酶促使酪蛋白降解,凝乳酶過度水解酪蛋白會產生苦味[2-4],苦味是蛋白質水解不平衡產生苦味肽的積累結果。已有大量從凝乳酶降解酪蛋白的產物αs1-酪蛋白和β-酪蛋白中分離出苦味肽的報道[5]。Lowrie等[6]研究發現切達干酪中的苦味是由酪蛋白降解產生的部分寡肽引起的,因為它們含有大量的疏水性殘基。酪蛋白降解產物αs-酪蛋白和β-酪蛋白這兩種酪蛋白含有較高的疏水性氨基酸,因此,這兩種酪蛋白是苦味肽可能的來源。不同凝乳酶對牦牛乳硬質干酪酪蛋白降解程度不同。與動物凝乳酶相比,植物和微生物凝乳酶對β-酪蛋白降解影響更大[7-11]。許多研究發現同種凝乳酶水解αs-酪蛋白比β-酪蛋白降解程度更大。國外就動物凝乳酶制作干酪的酪蛋白降解研究報道較多,但對動物凝乳酶、微生物凝乳酶和植物凝乳酶分別制作干酪的酪蛋白降解研究甚少。
近些年研究發現尿素聚丙烯酰胺凝膠電泳(urea polyacrylamide gel electrophoresis,urea-PAGE)能夠分析干酪酪蛋白降解程度,且能定量測定干酪成熟過程中酪蛋白的降解程度[12]。與傳統的分析手段(高效液相色譜和聚丙烯酰胺凝膠電泳)相比,尿素聚丙烯酰胺凝膠電泳能在較低的凝膠濃度下達到很好的分離效果,能夠很好地分析干酪成熟過程中酪蛋白降解的小分子多肽物質。我國正處于干酪發展的起步階段,利用尿素聚丙烯酰胺凝膠電泳對不同凝乳酶制作干酪中酪蛋白降解產生苦味的研究尚未見報道,尤其是針對牦牛乳硬質干酪酪蛋白降解的相關研究還處于空白階段。因此,本實驗利用尿素聚丙烯酰胺凝膠電泳研究不同凝乳酶(動物、微生物和植物凝乳酶)分別制作牦牛乳硬質干酪酪蛋白降解程度對干酪苦味的影響,旨在對牦牛乳硬質干酪酪蛋白的降解規律有較為明確的認識,以期為今后指導牦牛乳干酪生產和控制干酪質量提供一定的科學依據。
1 材料與方法
1.1 材料與試劑
小牛皺胃酶(酶活力10 000 U/g) 蘭州百靈生物技術有限公司;微生物凝乳酶(酶活力20 000 U/g) 甘肅華羚生物技術研究中心;木瓜蛋白酶(酶活力80 000 U/g)上海源葉生物科技有限公司;嗜熱發酵劑:保加利亞乳桿菌、嗜熱鏈球菌 丹麥丹尼斯克公司;αs-酪蛋白、β-酪蛋白 美國Sigma-Aldrich公司。
三羥基氨基甲烷、丙烯酰胺、N,N’-甲叉雙丙烯酰胺、過硫酸銨、四甲基乙二胺、考馬斯亮藍G-250、溴酚藍、鹽酸、甲醇、冰乙酸等其他常用試劑均為分析純。
1.2 儀器與設備
125L干酪壓榨槽 上海翰強儀器設備廠;E-201-9 pH計 上海儀電科學儀器公司;TGL-20臺式高速冷凍離心機 中國長沙湘儀離心機儀器有限公司;HWS26型電熱恒溫水浴鍋 上海一恒科技有限公司;真空冷凍干燥機 上海姚氏儀器設備廠;電泳儀和電泳槽 美國Bio-Rad公司;Tanon Gis2010凝膠圖像分析系統 上海天能科技有限公司。
1.3 方法
分別制作3 種酶活力相當的凝乳酶(小牛皺胃酶、微生物凝乳酶、木瓜蛋白酶)牦牛乳硬質干酪,用尿素聚丙烯酰胺凝膠電泳分別測定貯藏在10 ℃條件下的6 個成熟階段(30、60、90、120、150、180 d)中3 種凝乳酶牦牛乳硬質干酪的pH 4.6水不溶性酪蛋白的降解程度,并對成熟過程中的干酪苦味進行感官評價。
1.3.1 牦牛乳硬質干酪制作工藝
原料乳→過濾→檢驗→巴氏殺菌(63 ℃,30 min)→冷卻(35 ℃)→添加發酵劑(0.062 5 g/100 mL)→添加CaCl2(0.03 g/100 mL)→添加凝乳酶→凝乳→切割→二次加熱→排乳清→攪拌、加鹽(凝塊的2%)→堆釀(30 min)→壓榨成型(4~5 h)→真空包裝→成熟
1.3.2 干酪pH 4.6水不溶性酪蛋白的制備
分別稱取5 g干酪,加入15 mL去離子水均質。混合物于40 ℃條件下放置1 h,室溫條件下放置15 min。在磁力攪拌的作用下,用1 mol/L鹽酸調混合物至pH 4.6。混合物在4 ℃、4 000×g條件下離心20 min。沉淀用1 mmol/L醋酸銨(pH 4.6)沖洗一次,在4 ℃、3 000×g條件下離心10 min,收集沉淀進行真空冷凍干燥,干燥的粉末稱質量,樣品冷凍保存備用[13]。
1.3.3 尿素聚丙烯酰胺凝膠電泳[14-15]
分離膠:T 12.5%,C 4%;分離膠緩沖溶液:4.6 g三羥基氨基甲烷和26 g尿素,加入0.4 mL的濃鹽酸,調節pH值至8.9,定容至100 mL。12 g丙烯酰胺、0.5 g N,N’-甲叉雙丙烯酰胺、50 μL四甲基乙二胺和40 mg過硫酸銨溶于100 mL pH 8.9的分離膠緩沖溶液。
濃縮膠:T 4.2%,C 5%;濃縮膠緩沖溶液:0.75 g三羥基氨基甲烷和26 g尿素,加入0.4 mL的濃鹽酸,調節pH值至7.6,定容至100 mL。2 g丙烯酰胺、0.1 g N,N’-甲叉雙丙烯酰胺、25 μL四甲基乙二胺和20 mg過硫酸銨溶于100 mL pH 8.9的濃縮膠緩沖溶液。
電泳緩沖液:15 g三羥基氨基甲烷和73 g甘氨酸溶解在5 L的水中,預電泳電壓為80 V,樣品進入分離膠后調到120 V。
樣品溶解液:0.75 g三羥基氨基甲烷和28 g尿素,加入0.4 mL的濃鹽酸定容至100 mL。樣品處理:分別取5 mg凍干樣品溶解到3 mL的樣品溶解液中,滴入2 滴溴酚藍溶液,充分混勻,樣品在沸水中煮沸5 min,待冷卻后上樣。電泳結束后用考馬斯亮藍染色,甲醇冰醋酸溶液脫色。用天能圖像分析系統對電泳圖片進行掃描分析,得譜帶的積分光密度值和樣品中各蛋白的百分含量。
1.3.4 牦牛乳硬質干酪苦味值的測定
感官評定小組由經過篩選的9 人組成(男女比例為4∶5,均為不吸煙者),品嘗時,評價員用蒸餾水漱口,取1.5 cm×1.5 cm×1.5 cm大小的干酪置于口中,5~10 s后吐出。根據品嘗的情況,然后按照表1的評分標準對每種干酪打分,評分值就是苦味值,得出的平均值表示干酪的苦味[16]。
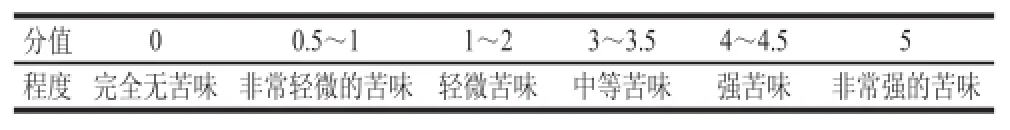
表1 苦味值的評分標準Table 1 Evaluation standards of bitterness
感官評價之前,分別取干酪樣品在4 ℃過夜解凍,然后21 ℃放置1 h。以不同質量濃度的硫酸奎寧溶液為參比(0.002 3、0.004 6、0.009 4、0.018 8 g/L),對干酪的苦味進行感官評價。
1.4 數據處理
實驗所得數據均用SPSS17.0統計分析軟件進行處理,分別對凝乳酶種類和成熟時間進行單因素方差分析,LSD法進行差異顯著性分析。對牦牛乳硬質干酪酪蛋白降解指標和干酪苦味值做了相關性分析,且對凝乳酶種類和成熟時間進行主成分分析。
2 結果與分析
2.1 尿素聚丙烯酰胺凝膠電泳結果

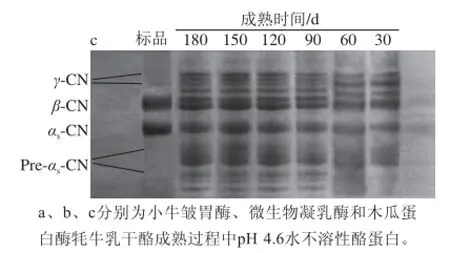
圖1 3 種凝乳酶牦牛乳干酪成熟過程中pH 4.6水不溶性酪蛋白變化的尿素聚丙烯酰胺凝膠電泳圖Fig.1 Urea-PAGE of pH 4.6-insoluble casein from yak milk hard cheeses prepared w ith calf rennet, microbial rennet and papain throughout ripening
由圖1可知,干酪pH 4.6水不溶性酪蛋白分子質量由大到小劃分為4 個條帶:γ-CN、β-CN、αs-CN、Pre-αs-CN。3 種凝乳酶制作的牦牛乳硬質干酪pH 4.6水不溶性酪蛋白降解的電泳條帶不一致,原因是3 種凝乳酶對酪蛋白特定的酶切位點不同引起的[17]。木瓜蛋白酶牦牛乳硬質干酪的αs-CN和β-CN降解高于微生物和小牛皺胃酶,這與Sanjuán等[18]的研究結果一致。3 種凝乳酶制作的牦牛乳硬質干酪pH 4.6水不溶性酪蛋白中αs-CN均比β-CN降解強烈,這主要是因為αs-CN的降解是由凝乳酶的作用引起的,β-CN的降解是由血纖維素蛋白溶酶引起的,也受到凝乳酶小幅度的降解,而排乳清時把纖維素蛋白溶酶的激活劑和抑制劑排除了,使得β-CN的降解程度較弱[18]。木瓜蛋白酶制作的牦牛乳硬質干酪pH 4.6水不溶性酪蛋白在Pre-αs-CN區域有較強的蛋白帶,這說明木瓜蛋白酶制作的牦牛乳硬質干酪中Pre-αs-CN區域的電泳遷移率最高,其次是微生物凝乳酶,小牛皺胃酶牦牛乳硬質干酪較弱。這是由于木瓜蛋白酶對αs-CN的降解比小牛皺胃酶和微生物凝乳酶更強烈。另外,木瓜蛋白酶和微生物凝乳酶牦牛乳硬質干酪中,Pre-αs-CN和γ-CN區域條帶的顏色隨著干酪的成熟逐漸加深。
2.2 牦牛乳硬質干酪未降解β-酪蛋白水平的變化

圖2 3 種凝乳酶干酪成熟過程中未水解β-酪蛋白水平的變化Fig.2 Changes in residual β-CN of hard yak milk cheeses prepared with calf rennet, microbial rennet and papain during ri pening
由圖2可知,牦牛乳硬質干酪成熟過程中,隨成熟的進行,3 種凝乳酶對β-CN的降解速率趨于平緩。成熟終點時,小牛皺胃酶、微生物凝乳酶和木瓜蛋白酶制作的牦牛乳硬質干酪未水解β-CN含量分別是31.14%、25.74% 和19.78%。由方差分析可知,同一成熟時間,3 種凝乳酶對牦牛乳硬質干酪未水解β-CN含量影響極顯著(P<0.01);同一凝乳酶,不同成熟時間對牦牛乳硬質干酪未水解β-CN的含量影響極顯著(P<0.01)。牦牛乳硬質干酪整個成熟過程中,木瓜蛋白酶對β-CN降解極顯著高于微生物凝乳酶和小牛皺胃酶(P<0.01),這與Galán等[19]研究荊棘薊制作的羊乳干酪β-CN降解極顯著高于小牛皺胃酶制作干酪的結果一致,這可能與引起木瓜蛋白酶牦牛乳硬質干酪的苦味較強的有關。微生物凝乳酶使β-CN的降解顯著高于小牛皺胃酶(P<0.01),這和Lawrence等[17]研究米黑毛霉切達干酪β-CN的降解比小牛皺胃酶制作干酪強烈的結果吻合。牦牛乳硬質干酪成熟過程中,β-CN主要由受血纖溶蛋白酶影響,血纖溶蛋白酶首先使β-CN降解,然后被微生物蛋白酶緩慢水解為γ1[β-CN(f29~209)]、γ2[β-CN(f106~209)]、γ3[β-CN(f108~209)]。隨成熟時間的延長,β-CN逐漸降解,γ-CN含量增加,干酪中殘留的凝乳酶也會導致β-CN的微小降解。
2.3 牦牛乳硬質干酪未降解αs-酪蛋白水平的變化
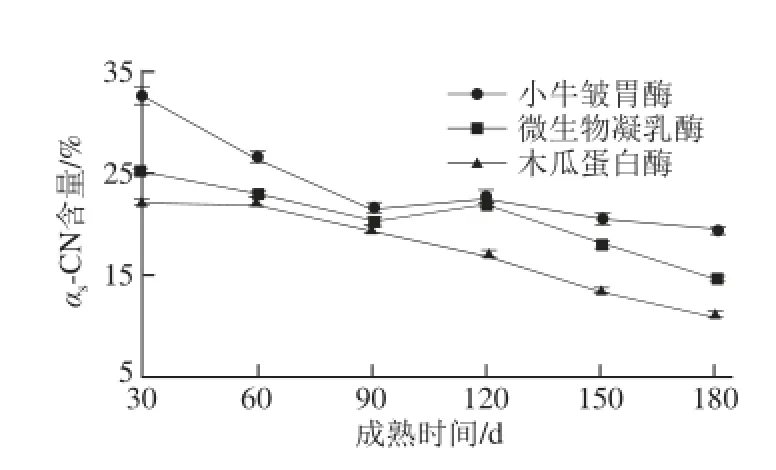
圖3 3 種凝乳酶干酪成熟過程中未水解αs-酪蛋白的變化Fig.3 Changes in residual αs-CN of hard yak milk cheeses prepared with calf rennet, microbial rennet and papain during ripening
由圖3可知,3 種凝乳酶牦牛乳硬質干酪成熟過程中,凝乳酶種類對牦牛乳硬質干酪的αs-CN降解有顯著影響(P<0.05),成熟時間對其也有極顯著影響(P<0.01 )。成熟30 d之后,木瓜蛋白酶牦牛乳硬質干酪αs-CN含量顯著低于其他兩種凝乳酶干酪(P<0.05)。血纖維素蛋白酶、植物凝乳酶和動物凝乳酶依次使αs-CN降解,這就使得木瓜蛋白酶牦牛乳硬質干酪的αs-CN降解程度顯著高于小牛皺胃酶干酪[19]。αs-CN在Phe23-Phe24處斷裂,形成αs1-CN(f1~23)和αs2-CN(f24~199)[20-25]小片段。在成熟180 d時,小牛皺胃酶、微生物凝乳酶和木瓜蛋白酶制作的牦牛乳硬質干酪未被水解的αs-CN含量分別為19.34%、14.43%和10.89%。3 種凝乳酶制作的牦牛乳硬質干酪成熟過程中,αs-CN和β-CN的降解程度并不相同,αs-CN的總體降解程度要大于β-CN。Visser[25]研究表明,在干酪Urea-PAGE電泳中,酪蛋白的降解速率主要是凝乳酶和乳中纖溶酶作用的結果。一般認為,酪蛋白的初級降解主要是凝乳酶的作用。
2.4 牦牛乳硬質干酪未降解αs-CN/β-CN值的變化
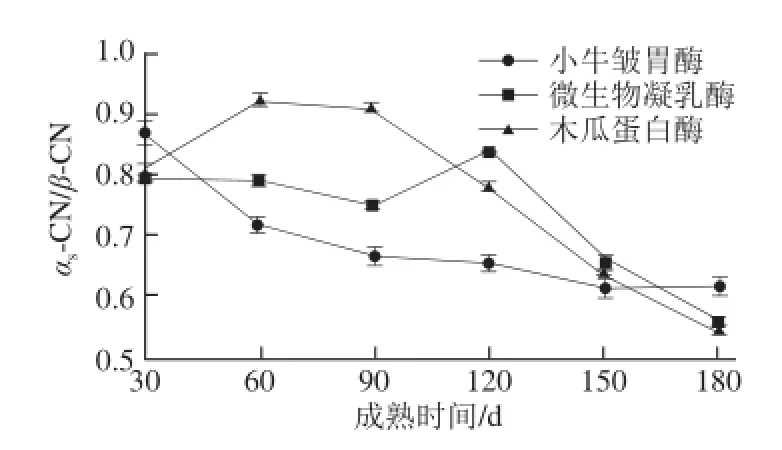
圖4 3 種凝乳酶牦牛乳硬質干酪成熟過程中未水解αs--CCNN//β-CCNN值變化Fig.4 Changes in residual αs-C N/β-CN of yak milk hard cheeses prepared with calf rennet, microbial rennet and papain during ripening
由圖4可知,成熟至180 d時,小牛皺胃酶、微生物凝乳酶和木瓜蛋白酶牦牛乳硬質干酪αs-CN/β-CN值分別從0.87、0.79和0.81降低到0.62、0.56和0.55。木瓜蛋白酶牦牛乳硬質干酪αs-CN/β-CN值最低,這與Fernández-Salguero等[26]研究動物凝乳酶和植物凝乳酶羊乳干酪報道的αs-CN/β-CN值從0.9%降低到0.5%一致。由方差分析可知,同一成熟時間,3 種凝乳酶牦牛乳硬質干酪未水解αs-CN/β-CN值差異顯著(P<0.05)。成熟90 d之前,小牛皺胃酶牦牛乳硬質干酪未水解αs-CN/β-CN值差異顯著(P<0.05),之后不顯著(P>0.05)。成熟前90 d,微生物凝乳酶牦牛乳硬質干酪未水解αs-CN/β-CN值差異不顯著(P>0.05),后期差異顯著(P<0.05)。由此可以看出成熟時間和凝乳酶種類對牦牛乳硬質干酪未水解αs-CN/β-CN值有顯著的影響。
2.5 牦牛乳硬質干酪苦味感官評價

圖5 3 種凝乳酶牦牛乳硬質干酪苦味感官評價Fig.5 Sensory evaluation of the bitterness of hard yak milk cheeses prepared with calf rennet, microbial rennet and papain
由圖5可知,隨成熟時間的延長,3 種凝乳酶牦牛乳硬質干酪的苦味均呈緩慢加重趨勢。成熟前90 d,同一種凝乳酶牦牛乳硬質干酪的苦味值差異不顯著(P>0.05),成熟90 d之后,差異顯著(P<0.05)。整個成熟過程中,凝乳酶種類對牦牛乳硬質干酪苦味值影響差異極顯著(P<0.01)。牦牛乳硬質干酪成熟180 d時,小牛皺胃酶、微生物凝乳酶和木瓜蛋白酶牦牛乳硬質干酪苦味值分別從1.5、2和3升高到3、4和5。
2.6 牦牛乳硬質干酪酪蛋白降解片段與苦味值的相關性分析
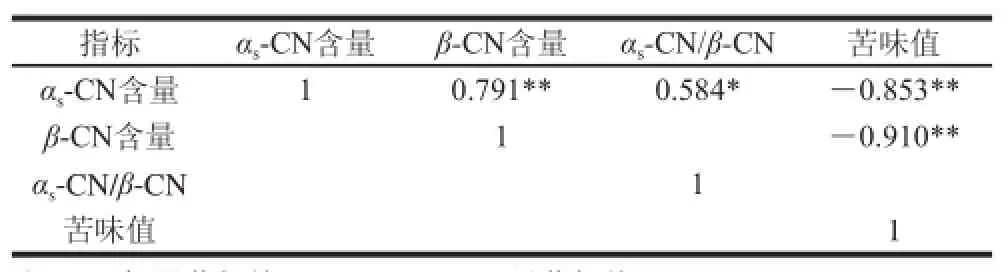
表2 牦牛乳硬質干酪酪蛋白降解指標與苦味值的相關性Table 2 Correlation between bitterness and casein degradation indices of hard yak milk cheese
由表2可知,牦牛乳硬質干酪未降解的αs-CN含量和β-CN含量成極顯著正相關(r=0.791)、苦味值成極顯著負相關(r=-0.853),且與αs-CN/β-CN值成顯著正相關(r=0.584)。牦牛乳硬質干酪未降解的β-CN含量與苦味值成極顯著負相關(r=-0.910)。未降解的β-CN含量對牦牛乳硬質干酪的苦味值的影響最大,其次是αs-CN含量,未降解酪蛋白αs-CN/β-CN值和牦牛乳硬質干酪的苦味值無相關性。
2.7 牦牛乳硬質干酪酪蛋白片段的主成分分析

圖6 3 種凝乳酶牦牛乳硬質干酪成熟過程中酪蛋白片段的主成分得分圖Fig.6 Score plots obtained from principal component analysis for casein fractions from hard yak milk cheeses prepared with calf rennet, microbial rennet and papain
由圖6可知,第一主成分占累計貢獻率的65.79%,反映了凝乳酶種類對未降解αs-CN含量差異的顯著性有極大的貢獻,但凝乳酶種類對未降解β-CN含量差異的顯著性也有貢獻。第二主成分占累計貢獻率的33.95%,反映了成熟時間對牦牛乳硬質干酪β-CN含量的影響。在牦牛乳硬質干酪成熟180 d時,小牛皺胃酶牦牛乳硬質干酪中未降解β-CN的含量最高。同理,成熟時間對未降解αs-CN含量和αs-CN/β-CN值的差異顯著性有極大的貢獻。小牛皺胃酶牦牛乳硬質干酪pH 4.6水不溶性酪蛋白部分主要分布在PC 1的評分正值附近、PC 2的評分負值附近,而微生物凝乳酶和木瓜蛋白酶制作的牦牛乳硬質干酪pH 4.6水不溶性酪蛋白部分主要分布在PC 1的評分正值附近、PC 2的評分正值附近。說明木瓜蛋白酶和微生物凝乳酶對牦牛乳硬質干酪αs-CN和β-CN降解速率更大。
3 結 論
苦味缺陷是牦牛乳硬質干酪優質資源開發的制約因素。干酪成熟過程中,殘留凝乳酶影響干酪酪蛋白的降解,其降解程度直接關系著干酪的苦味。通過研究不同凝乳酶制作的牦牛乳硬質干酪成熟期間酪蛋白的降解規律,發現不同凝乳酶牦牛乳硬質干酪酪蛋白中未降解的αs-CN、β-CN含量以及干酪苦味值差異均極顯著(P<0.01),且牦牛乳硬質干酪酪蛋白中αs-CN均比β-CN降解強烈。木瓜凝乳酶制作的牦牛乳硬質干酪酪蛋白中的αs-CN和β-CN降解程度顯著或極顯著高于微生物凝乳酶和小牛皺胃酶牦牛乳硬質干酪(P<0.05或P<0.01),且β-CN的降解對牦牛乳硬質干酪的苦味值的影響最大,其次是αs-CN,αs-CN/β-CN值與干酪的苦味無關,表明干酪中殘留的凝乳酶降解酪蛋白中的β-CN產生苦味肽,使干酪產生苦味。本實驗為調控牦牛乳硬質干酪風味缺陷提供了一定的理論依據,在干酪生產中應選擇蛋白酶活力較小而凝乳能力較強的凝乳酶和能夠降解苦味肽的外肽酶。由于引起干酪苦味肽形成的原因極其復雜,導致引起干酪苦味的物質仍然不是非常清楚,因此,干酪中苦味的產生機理及苦味成分的組成還有待進一步研究。
[1] 楊楠, 梁琪, 楊敏, 等. 牦牛脫脂乳中酪蛋白受熱處理溫度及時間影響的研究[J]. 食品工業科技, 2013, 34(5): 121-125.
[2] VICENTE M S, IBANEZ F C, BARCINA Y, et al. Casein breakdown during ripening of Idiazabal cheese: influence of starter and rennet type[J]. Journal of the Science of Food and Agriculture, 2001, 81(2): 210-215.
[3] PINO A, PRADOS F, GALAN E, et al. Proteolysis during the ripening of goats’ milk cheese made with p lant coagulant or calf rennet[J]. Food Research International, 2009, 42(3): 324-330.
[4] IRIGOYEN A, IZCO J M, IBANEZ F C, et al. Evaluation of the effect of rennet type on casein proteolysis in an ovine milk cheese by means of capillary electrophoresis[J]. Journal of Chromatography A, 2000, 881(1): 59-67.
[5] VALéRIE G, STEFANIA C, CONCETTA P, et al. Uncommonly thorough hydrolysis of peptides during ripening of Ragusano cheese revealed by tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2011, 59(23): 12443-12452.
[6] LOWRIE R J, LAWRENCE R C. Cheddar cheese flavour. IV. A new hypothesis to account for the development of bitterness[J]. International Journal of Dairy Technology, 1972, 37(3): 113-125.
[7] TEJADA L, ABELLáN A, CAYUELA J M, et al. Proteolysis in goats’milk cheese made with calf rennet and plant coagulant[J]. International Dairy Journal, 2008, 18(2): 139-146.
[8] ?ENGüL M, ERKAYA T, DERVI?O?LU M, et al. Compositional, biochemical and textural changes during ripening of Tulum cheese made with different coagulants[J]. International Journal of Dairy Technology, 2014, 67(3): 373-383.
[9] YA SAR K, GUZELER N. Effects of coagulant type on the physicochemical and organoleptic properties of Kashar cheese[J]. International Journal of Dairy Technology, 2011, 64(3): 372-379.
[10] SOUSA M J, MALCATA F X. Advances in the role of a plant coagulant (Cynara cardunculus) in vitro and during ripening of cheeses from several milk species[J]. Le Lait, 2002, 82(2): 151-170.
[11] HAYALOGLU A A, BRECHANY E Y, DEEGAN K C, et al. Characterization of the chemistry, bi ochemistry and volatile profile of Kufl u cheese, a mou ld-ripened variety[J]. LWT-Food Science and Technology, 2008, 41(7): 1323-1334.
[12] MCSWEENEY P L H, FOX P F. Chemical methods for the characterization of proteolysis in cheese during ripening[J]. Le Lait, 1997, 77(1): 41-76.
[13] HAYALOGLU A A, GUVEN M, FOX P F. Proteolysis in Turkish White-brined cheese ma de with defined strains of Lactococcus[J]. International Dairy Journal, 2004, 14(7): 599-610.
[14] ANDREWS A T. Proteinases in normal bovine milk and their action on caseins[J]. Journal of Dairy Research, 1983, 50(2): 45-55.
[15] SHALABI S I, FOX P F. Electrophoretic analysis of cheese, comparison of methods[J]. Irish Journal of Food Science and Technology, 1987, 11(3): 135-151.
[16] KUKMAN I L, ZELENIK-BLATNIK M, ABRAM V. Isolation of low-molecular-mass hydrophobic bitter peptides in soybean protein hydrolysates by reversed-phase high-performance liquid chromatography[J]. Journal of Chromatography A, 1995, 704(1): 113-120.
[17] LAWRENCE R C, CREAMER L K, GILLES J. Texture development during cheese ripening[J]. Journal of Dairy Science, 1987, 70(8): 1748-1760.
[18] SANJUáN E, MILLáN R, SAAVEDRA P, et al. Infl uence of anim al and vegetable rennet on the physicochemical characteristics of Los Pedroches cheese during ripening[J]. Food Chemistry, 2002, 78(3): 281-289.
[19] GALáN E, PRADOS F, PINO A, et al. Infl uence of different amounts of vegetable coagulant from cardoon Cynara cardunculus and calf rennet on the proteolysis and sensory characteristics of cheeses made with sheep milk[J]. International Dairy Journal, 2008, 18(1): 93-98.
[20] GARCíA V, ROVIRA S, TERUEL R, et al. Effect of vegetable coagulant, microbial coagulant and calf rennet on physicochemical, proteolysis, sensory and texture profi les of fresh goats cheese[J]. Dairy Science and Technology, 2012, 92(6): 691-707.
[21] LARSEN M D, KRISTIANSEN K R, HANSEN T K. Characterization of the proteolytic activity of starter cultures of Penicillium roqueforti for production of blue veined cheeses[J]. International Journal of Food Microbiology, 1998, 43(3): 215-221.
[22] 張娜, 郭慶啟, 黃文秀, 等. 微膠囊化蛋白酶在干酪制備中的應用及干酪成熟過程中電泳分析[J]. 食品科學, 2014, 35(5): 134-138. doi: 10.7506/spkx1002-6630-201405027.
[23] BARA? M B, SMILJANI? M, PE?I? M B, et al. Primary proteolysis of white brined goat cheese monitored by high molarity Tris buffer SDS-PAGE system[J]. Mljekarstvo, 2013, 63(3): 122-131.
[24] O’MAHONY J A, SOUSA M J, MCSWEENEY P L H. Proteolysis in miniature Cheddar-type cheeses made using blends of chymosin and Cynara cardunculus proteinases as coagulant[J]. International Journal of Dairy Technology, 2003, 56(1): 52-58.
[25] VISSER S. Proteolytic enzymes and their relation to cheese ripening and flavor: an overview[J]. Journal of Dairy Science, 1993, 76(1): 329-350.
[26] FERNáNDEZ-SALGUERO J, SANJUáN E. Infl uence of vegetable and animal rennet on proteolysis during ripening in ewes’ milk cheese[J]. Food Chemistry, 1999, 64(2): 177-183.
Effect of Casein Degradation on Bitterness of Hard Yak Milk Cheese
WANG Ling, LIANG Qi*, SONG Xuemei, ZHANG Yan (Functional Dairy Product Engineering Laboratory of Gansu, College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China)
In view of the bitter taste defect in hard yak milk cheese, calf rennet, microbial rennet and papain were used to prepare yak milk hard cheese in the present study to explore the degradation degree of pH 4.6 water-insoluble casein of hard yak milk cheese, as evaluated by urea-polyacrylamide gel electrophoresis (urea-PAGE) and sensory evaluation of bitterness during the ripening period, as well as explore the effect of degradation degree of pH 4.6 water-insoluble casein on bitterness of hard yak milk cheese. The results indicated that hard yak milk cheese casein revealed signifi cant degradation during the ripening period; moreover, αs-casein underwent much more extensive and faster degradation than β-casein. The pH 4.6 water-insoluble casein of hard yak milk cheese made with papain showed higher i ntensity ban ds in the Pre-αs-casein region as shown by urea-PAGE, while the degradation degree of αs-casein and β-casein was signifi cantly higher than that of pH 4.6 water-insoluble casein from hard yak milk cheeses pre pared with microbial rennet and calf rennet (P < 0.05). The bitterness of hard yak milk cheese prepared with papain was signifi cantly higher than that obtained from microbial rennet and calf rennet (P < 0.01). These results suggested that the contents of residual αs-casein and β-casein showed a highly signifi cant negative correlation with bitterness for three yak milk hard cheeses by principal component analysis. This investigation can provided a theor etical basis for the quality control of hard yak milk cheese.
hard yak milk cheese; casein degradation; urea-polyacrylamide gel electrophoresis (urea-PAGE); bitterness; principal component analysis
TS252.53
A
1002-6630(2015)19-0001-06
10.7506/spkx1002-6630-201519001
2014-12-19
國家自然科學基金地區科學基金項目(31260383)
王玲(1988-),女,碩士研究生,研究方向為乳制品加工。E-mail:1041842191@qq.com
*通信作者:梁琪(1969-),女,教授,博士,研究方向為食品品質、乳品科學。E-mail:liangqi@gsau.edu.cn

