GM1治療新生兒缺氧缺血性腦病血漿BDNF及NSE的動態變化
鹿向東
山東萊蕪市人民醫院 萊蕪 271199
GM1治療新生兒缺氧缺血性腦病血漿BDNF及NSE的動態變化
鹿向東
山東萊蕪市人民醫院 萊蕪 271199
目的 探討單唾液酸四己糖神經節苷脂(monosialotetrahexosyl ganglioside,GM1)的作用機制及與血漿中腦源性神經營養因子(brain derived neuotrophic factor,BDNF)和神經元特異烯醇化酶(neuron specific enolase,NSE)的關系。方法 選擇本院新生兒科住院治療的新生兒缺氧缺血性腦病(hypoxic-ischemic encephalopathy,HIE)病例128例,隨機分為對照組和實驗組,分別于新生兒出生后第1、3、7、10、14天檢測血漿中腦源性神經營養因子和神經元特異烯醇化酶的濃度。結果 不同程度的HIE患兒,臨床分度越重,NSE水平越高;GM1治療組,NSE濃度降低較對照組明顯(P<0.01),BDNF濃度升高較對照組明顯(P<0.01),且血漿中BDNF濃度先升高后降低。結論 GM1治療HIE效果較好,能減輕臨床癥狀,縮短病程,值得在臨床推廣應用。
新生兒缺氧缺血性腦病;腦源性神經營養因子;神經元特異性烯醇化酶
單唾液酸四己糖神經節苷脂(GM1)是最重要的神經節苷脂之一,在中樞神經系統病變的治療中起重要作用,具有促進神經重構的功能,可以加速神經細胞修復、最大程度恢復原有的神經功能[1]。本文測定患兒血漿中腦神經營養因子(BDNF)和神經元特異烯醇化酶(NSE)的濃度變化,并與對照組相比,從而探討GM1的作用機制及與血漿中BDNF 和NSE的關系。
1 資料及方法
1.1 一般資料 收集2008-09—2009-09到我院新生兒科住院的HIE患者128例,男72例,女54例,胎齡(38.3±1.5)周,出生體質量(3.50±0.16)kg,均經頭顱CT檢查。HIE的臨床表現:(1)胎兒宮內窒息史,嚴重的胎兒宮內窘迫表現[胎心<100次,持續5min以上;和(或)羊水III度污染];(2)出生時有重度窒息:Apgar評分1min≤3分,至5min時仍≤5分;或出生時臍動脈血氣pH≤7.00;(3)出生后24h內出現神經系統表現;(4)排除低鈣血癥、低糖血癥、感染、產傷和顱內出血等引起的抽搐,以及遺傳代謝性疾病和其他先天性疾病所引起的神經系統疾患。同時具備以上4條者可確診,第4條暫時不能確定者作為擬診病例。其中輕度35例,中度64例,重度29例。合并蛛網膜下腔出血12例,室管膜下腔出血5例,腦實質出血2例。HIE的分度和診斷符合中華醫學會兒科學會新生兒學組2004-11修訂于長沙的標準:輕度:興奮,肌張力正常,擁抱反射活躍,吸吮反射正常,呼吸平穩,無驚厥。癥狀多在3d內逐漸消失,預后良好。中度:抑制,肌張力降低,吸吮反射和擁抱反射減弱,出現驚厥。癥狀持續7~10d,可能有后遺癥。重度:昏迷狀態,驚厥頻繁,呼吸不規則或暫停,甚至出現呼吸衰竭。重度患兒病死率高,存活者常留神經系統后遺癥。隨機分為對照組和治療組,治療組中男30例,女32例,輕度20例,中度24例,重度15例;對照組中男42例,女22例,輕度15例,中度40例,重度14例;經統計學分析,2組胎兒的性別、年齡、分度差異無統計學意義(P>0.05)。
1.2 治療方法 全部患兒給予常規治療,主要包括:(1)控制腦水腫,入院后3d內嚴格限制液體的入量在60mL/(kg·d)同時給呋塞米1mg/kg,地塞米松0.5mg/kg,甘露醇0.25g~0.5g/(kg·次),3~4次/d,3~5d后減量停用。(2)迅速控制驚厥:苯巴比妥鈉,首劑20mg/kg靜推。(3)及時糾正酸中毒、低血壓、低血糖。治療組在上述基礎上加GM1 20mg靜滴,1次/d,7~10d為一療程。
1.3 標本采集 分別于HIE新生兒出生后第1、3、7、10、14天抽靜脈血2mL,靜置20min后,3 000r/min離心10min,分離血清,并分別置于Eppendof管中,—20℃冰箱保存。
2 結果
2.1 BDNF不同時間的平均變化水平 采用酶聯免疫吸附法(ELISA)分析HIE新生兒出生后第1、3、7、10、14天靜脈血中BDNF濃度,見表1。
表1 BDNF不同時間的平均變化水平(±s,pg/mL)
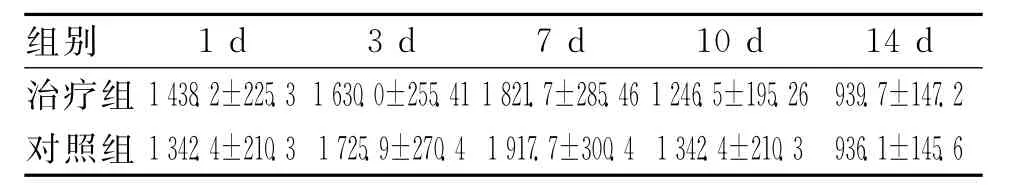
表1 BDNF不同時間的平均變化水平(±s,pg/mL)
組別1d 3d 7d 10d 14d治療組1 438.2±225.3 1 630.0±255.41 1 821.7±285.46 1246.5±195.26 939.7±147.2對照組1 342.4±210.3 1 725.9±270.4 1 917.7±300.4 1 342.4±210.3 936.1±145.6
2.2 HIE不同時間血漿NSE值的變化 見表2。輕、中、重患兒血漿中NSE的表達水平有顯著差異,GM1治療后,第3天中重度患兒血漿NSE下降具有顯著差異,第7天差異更加明顯,10d后血漿NSE變化差異無統計學意義。血清NSE水平與HIE的病情嚴重程度相關,不同程度的HIE患兒,臨床分度越重,NSE水平越高[2]。用GM1治療后,NES濃度降低比對照組明顯。腦缺血后機體提高BDNFmRNA表達的水平是機體保護性機制之一,缺血后產生的大量興奮性毒性物質最終刺激神經元提高BDNF mRNA表達的水平,因此血漿中BDNF濃度先升高后降低[3]。GM1可加強營養因子對神經細胞的作用,促進神經再生,GM1與BDNF 對HIE患者的腦細胞都有一定的保護作用。
表2 HIE不同時間血漿NSE值的變化(±s,ng/L)
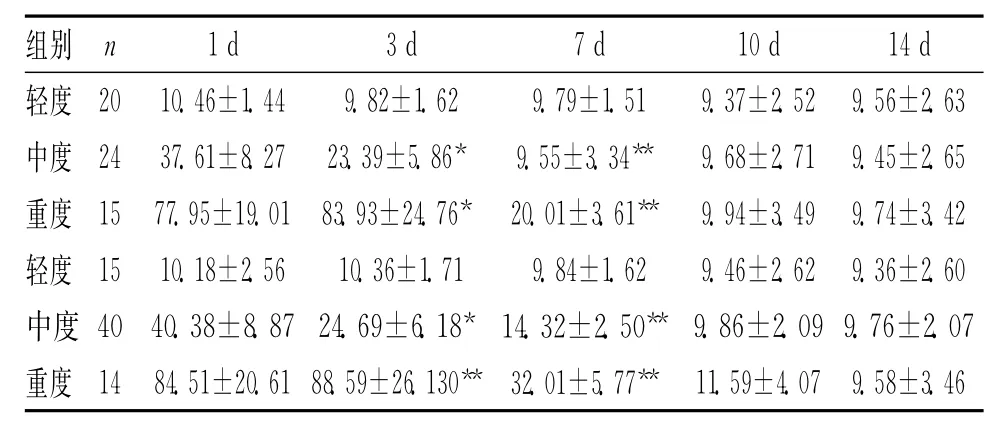
表2 HIE不同時間血漿NSE值的變化(±s,ng/L)
注:與對照組相比,*P<0.05,**P<0.01
組別n 1d 3d 7d 10d 14d輕度20 10.46±1.44 9.82±1.62 9.79±1.51 9.37±2.529.56±2.63中度24 37.61±8.27 23.39±5.86* 9.55±3.34** 9.68±2.71 9.45±2.65重度15 77.95±19.01 83.93±24.76*20.01±3.61**9.94±3.49 9.74±3.42輕度15 10.18±2.56 10.36±1.71 9.84±1.62 9.46±2.62 9.36±2.60中度40 40.38±8.87 24.69±6.18*14.32±2.50**9.86±2.09 9.76±2.07重度14 84.51±20.61 88.59±26.130**32.01±5.77**11.59±4.07 9.58±3.46
3 討論
神經節苷脂是動物細胞膜的組成部分,在中樞神經系統含量尤為豐富。神經節苷脂分子的親脂性基團嵌入神經細胞的雙脂層中,親水性基團突出于細胞外液中,有助于最大程度上維持細胞表面負電荷。而細胞膜表面呈負電性又是細胞興奮的基礎。神經節苷脂還參與組織識別和信號傳遞,保護缺氧缺血性神經損害。除此之外,中樞神經細胞膜上的Na+-K+-ATP酶及Ca2+-Mg2+-ATP酶的活性也依賴于神經節苷脂,它可以維持細胞內外離子平衡,從而可以減輕神經細胞的水腫,另外也可以減輕自由基對神經細胞的損害,防止細胞內Ca2+積聚等。胞漿Ca2+對神經元的生物學行為、可塑性和存活起著決定性作用。因此,GM1具有促進神經重構作用,即通過促進各種生化途徑、細胞途徑、神經生理途徑改善修復神經組織,最大程度地恢復原有的神經功能。陳志剛等[4]在大鼠顱腦液壓損傷后早期給予GM1(30mg/kg,傷后5min和60 min各1次)或等量的生理鹽水進行治療,觀察GM1在傷后6 h對大鼠平均動脈壓(MAP)、腦水腫、損傷側腦組織內乳酸和脂質過氧化物(LPO)的影響,實驗結果顯示,損傷組平均動脈壓(MAP)降低、損傷側腦組織含水量、乳酸和LPO含量增加;GM1治療組MAP維持在傷前水平,損傷側腦組織含水量、乳酸和LPO含量較損傷組顯著下降(P<0.05或P<0.01)。結果表明,GM1能有效阻斷繼發性腦損傷的病理生理過程中對腦損傷有明顯的早期腦保護作用。
單唾液酸四己糖神經節苷在神經系統中含量尤其豐富,廣泛存在于哺乳動物神經細胞中,也是神經細胞膜的重要組成部分,神經節苷脂可以結合到朗飛結間和朗飛結旁區的髓質,在朗飛結區結合最緊密。對于神經的發生、生長、分化過程、神經修復都具有非常重要的作用。它能促進神經軸突生長和突觸形成、促進神經再生、恢復神經功能;還有它能保護細胞膜,穩定細胞膜,促進細胞膜功能活性恢復,改善神經傳導、促進腦電活動及其他神經電生理功能[5]。據報道GM1能在培養的神經細胞中傳遞與神經生長因子相似的神經營養效應,能促進神經再生,具有神經保護作用[6]。GM1可加強營養因子對神經細胞的作用,促進神經再生,減少病灶周圍細胞的死亡,GM1本身還具有神經營養作用與神經營養因子類似也參與信息由細胞外向細胞內的傳遞,參與細胞的生長、分化的功能[7]。GM1的作用機制是可以通過改善細胞膜酶的活性而有效地減輕缺氧缺血所致的腦細胞水腫,抑制氧自由基和興奮性氨基酸的生成,穩定細胞膜,減少鈣內流,降低毒性物質對腦細胞的損傷,阻止神經細胞凋亡,減少缺氧缺血所致的繼發性損害,使受損神經細胞修復,恢復神經細胞功能。GM1可促進“神經重構”,包括神經細胞生存、軸突生長和突觸生長,因此,對HIE有明顯的療效。輕、中、重患兒血漿中NSE的表達水平有顯著差異,GM1治療以后,第3天中重度患兒血漿NSE下降具有顯著差異,第7天差異更加明顯,10d后血漿NSE變化無明顯差異。新生兒HIE,血漿NSE水平與病情輕重呈正相關。BDNF是神經營養因子家族中的一員,廣泛分布于大腦中,具有促進受損傷神經元再生并分化成熟等生物效應,在中樞神經系統(CNS)的損傷修復中具有重要的作用,可減少病灶周圍細胞的死亡,促進神經再生,有利于HIE患者的康復,減少HIE患兒的病死率和致殘率。
[1]周榮娟,周偉.單唾液酸四己糖神經節苷脂對重度窒息新生兒腦損傷程度的影響[J].中國婦幼保健,2005,(20)(13):1 606-1 607.
[2]李紅英,于萍 .單唾液酸四己糖神經節苷脂藥代動力學研究[J].山東醫藥工業,2003,20:(6):24.
[3]鄒文舟,郭曉軍,余放青.血清NSE和Ca2+的變化在早期評估中、重HIE預后的價值[J].齊齊哈爾醫學院學報,2009,30(11):1 283-1 284.
[4]陳志剛,盧亦成,朱誠,等.神經節苷脂GM1在顱腦損傷早期的腦保護作用[J].第二軍醫大學學報,2002,23(4):420.
[5]Rodden FA,Wiegandt H,Bauer BL.Cangliosides:the relevance of current research to neurosurgry[J].Crit Rev Clin Neurosurg,1991,74(4):606-619.
[6]Choi JS,Kim JA,Joo CK.Activation of MAPK and CREB by GM 1induces survival of RGCs in the retina with axotomized nerve[J].Invest Ophthalmal Vis Sci,2003,44(4):1 747-1 752.
[7]黃海英,劉家浩.神經節苷脂GM1防治缺氧缺血性腦損傷的研究進展[J].實用兒科臨床雜志,2006,21(12):789-791.
(收稿2014-11-14)
Dynamic changes of serum BDNF and NSE in neonates with hypoxic-ischemic encephalopathy treated with monosialotetrahexosyl ganglioside
Lu Xiangdong
Department of Neurosurgery,the People's Hospital of Laiwu,Laiwu271199,China
Objective To explore the mechanism of monosialotetrahexosyl ganglioside(GM1)as well as the relationship between plasma brain-derived neurotrophic factor(BDNF),neuron-specific enolase(NSE)and GM1.Methods 128neonates with hypoxic-ischemic encephalopathy(HIE)in our hospital were randomly divided into control group and experimental group.We examined the concentration changes of BDNF and NSE on 1st,3rd,7th,10th,14th day after birth.Results Neonates with HIE in different grade of severity,the more severity the clinical grade had,the higher NSE level was.Compared with the control group,the concentration of NSE decreased significantly and the concentration of BDNF increased remarkably in the experimental group(P<0.01).In addition,BDNF levels in plasma increased at first and then decreased.Conclusion GM1treatment has a better effect on neonates with HIE.It can reduce symptoms and shorten the course of the disease,which should be worthy of popularization and application in clinical practice.
Neonatal hypoxic-ischemic encephalopathy;Brain-derived neurotrophic factor;Neuron-specific enolase
R722.1
A
1673-5110(2015)21-0015-02

