膽道閉鎖肝纖維化研究進展
丁美云,詹江華
膽道閉鎖肝纖維化研究進展
丁美云1,詹江華2△
膽道閉鎖(BA)是嚴重危及嬰幼兒生命健康的消化系統疾病之一,晚期肝臟纖維化是導致患兒死亡的主要原因。在膽道閉鎖發病過程中,病毒感染可誘導一系列免疫和炎癥反應,導致調節性T細胞(Treg細胞)減少,CD14表達增高,多種炎癥通路以及轉化生長因子-β(TGF-β)/Smad2/3促纖維化通路被激活。激活的通路產生大量炎性介質損傷肝細胞和膽管細胞,釋放各種促炎因子、氧代謝產物和細胞因子,進一步加重肝、膽系統損傷造成肝細胞內環境失衡,失衡的內環境伴隨肝實質細胞、肝巨噬細胞、肝內聚集的炎性細胞等發生適應性變性、壞死、增生,導致肝星形細胞(HSCs)激活,HSCs轉化為成纖維細胞,促進肝纖維化進程。免疫、炎癥損傷、促纖維化通路是導致膽道閉鎖肝纖維化肝硬化的三大重要因素。
膽道閉鎖;肝硬化;T淋巴細胞,調節性;轉化生長因子β;抗原,CD14;Smad蛋白質類
膽道閉鎖(biliary atresia,BA)目前仍然是小兒外科中最嚴重的肝膽系統疾病之一,具體發病原因尚不十分清晰。目前認為,在胚胎發育期機體內先天發育異常可以誘發BA;而另外一種病因是在圍生期,患兒肝膽系統受到病毒等多種因素損傷后發生一系列固有和適應性免疫反應以及炎癥反應,導致促炎因子、CD14等大量炎性因子聚集;同時發生調節性T細胞(Treg細胞)增殖失衡以及轉化生長因子(TGF)-β促纖維化通路激活,它們共同作用逐漸破壞肝膽系統、肝實質,形成促進BA肝纖維化發展的特殊內環境,導致肝實質及肝內外膽管損傷進行性加重并促進肝硬化形成[1]。不可逆轉的肝纖維化、肝硬化是BA疾病進展最嚴重的結局,是影響BA預后的重要因素,本文擬對BA肝臟纖維化研究綜述如下。
1 免疫炎性損傷與促進肝纖維化
目前大多認為BA是由于機體感染病毒引發固有或適應性免疫反應,導致炎癥介質增多、Treg細胞減少,同時CD14高表達,使膽管結構受到破壞或發育停滯,引起免疫和炎癥反應損傷膽管上皮細胞、肝細胞等,并促進肝細胞釋放各種促炎因子、細胞因子。各種促炎性因子、免疫產物促進BA肝纖維化發展[2]。
1.1 炎癥介質激活肝星形細胞(HSCs)誘導肝纖維化病毒感染激活由核因子(NF)-κB介導的炎癥反應引起膽管上皮脫落,脫落的膽管上皮被肝巨噬細胞吞噬提呈至T細胞受體,激活T細胞使之分化成細胞毒性T細胞,細胞毒性T細胞通過分泌炎性介質如促炎因子白介素(IL)-2、干擾素(IFN)、細胞因子[3]以及激活Fas/FasL系統兩個方面攻擊BA膽管上皮細胞。進而機體發生炎癥反應,炎性細胞如淋巴細胞、自然殺傷細胞等浸潤進一步造成膽管損傷、膽汁淤積,同時肝內鵝去氧膽酸(CDC)增多損傷肝細胞導致肝細胞壞死、調亡。損傷的肝細胞和各種細胞因子可以刺激HSCs活化,激活的HSCs增生并遷移至門管區產生大量基質成分,增生的HSCs同時經歷表型轉化形成肌成纖維細胞[4],肌成纖維細胞分化促進膽道纖維化、肝纖維化、肝硬化形成[2]。
與此同時,病毒抗原通過生成IFN-γ激活特異性T細胞,引發膽道上皮組織炎性反應并刺激巨噬細胞釋放一氧化氮、腫瘤壞死因子(TNF)等多種細胞因子,這些細胞因子、病毒和壞死產物共同作用繼續加重膽管上皮細胞、肝細胞壞死、凋亡,致使肝細胞內環境嚴重失衡,這種失衡狀態反過來進一步活化HSCs,加重肌成纖維細胞以及基質成分的形成,促進肝臟膽管纖維化發生[5]。
各種炎癥通路被病毒激活后產生多種炎性介質,炎性介質損傷肝臟和膽管引發炎癥反應,炎癥反應又繼續加重肝臟和膽管損傷促進炎性介質生成,它們作用于HSCs形成肌纖維細胞等,促進肝組織纖維化。因此,炎性損傷在肝纖維化進程中產生巨大作用,炎性介質以及各種細胞因子、壞死物質形成對肝纖維化發展起重要推進作用。
1.2 Treg細胞減少促進肝纖維化發展Treg細胞對于維持免疫內環境穩定性非常重要,它與效應性輔助性T細胞新亞群Th17細胞密切相關,都是從最初的CD4+T細胞前體分化而來。Treg細胞在感染性疾病和自身免疫性疾病中扮演著重要角色,其通過產生調節性細胞因子,接觸抑制及競爭必需細胞因子產生作用,具有廣泛的免疫抑制作用。Th17細胞與炎癥反應性疾病,自身免疫性疾病有關。它主要通過分泌IL-17α發揮功能,調節組織炎性因子浸潤以及激活NF-κB介導的炎癥反應,同時IL-17α誘導促炎細胞因子如IL-6、TNF、單核細胞趨化蛋白(MCP)-1、巨噬細胞炎性蛋白(MIP)-2等的表達,導致肝組織和膽管組織損傷。然而促進Th17細胞增殖的炎性通路干擾Treg細胞發揮免疫抑制功能,即Treg細胞阻止炎性反應的功能會被Th17細胞增殖破壞。在BA實驗和臨床研究中都有文獻證實Treg細胞數量缺失,其數量缺失使免疫抑制作用降低或消失進而抑制炎癥反應能力減弱,從而導致促炎性反應迅速放大,以至形成無法控制的炎性反應[6]。研究發現,BA患兒外周血Th17細胞顯著增加而Treg細胞數量明顯減少,伴隨BA肝纖維化加重,Treg/Th17細胞比率進一步降低[6]。Treg和Th17細胞之間平衡的紊亂見于原發性膽汁性肝硬化、自身免疫性硬化性膽管炎,這說明在BA中Treg/Th17細胞比率降低可能是免疫炎癥性紊亂導致肝纖維化發展潛在的病理機制。
對BA肝臟細胞因子的研究發現IL-1β、IL-6、IL-32和TGF-β1在BA患兒外周血表達增加,這些因子能夠促進Th17細胞和其他效應細胞增多,提示在BA患兒肝實質內存在一個促炎癥微環境[7]。BA動物模型已經證明TGF-β1影響Treg和Th17細胞的發展,低水平TGF-β1、IL-6和IL-21聯合作用促進Th17細胞分化,而分化的Th17細胞分泌大量IL-17α[8]。據此推測BA患兒體內可能存在TGF-β1介導Th17細胞分化,它們共同作用加重免疫炎癥損傷從而促進肝纖維化,同時TGF-β自身也是介導肝纖維化發展的重要因子。
2 膽道閉鎖肝組織TGF-β促纖維化通路及作用
2.1 TGF-β在膽道閉鎖肝纖維化形成中的作用TGF-β在BA患兒大部分由肝內膽管上皮細胞產生,與BA的肝臟纖維化關系密切[9]。TGF-β促纖維化在BA肝纖維化進程中起重要作用,主要通過Smad家族蛋白調節,Smad蛋白家族是TGF-βs超家族重要的細胞因子,由8種不同的蛋白Smad1~8構成,通過可逆磷酸化對多種信號傳導通路的功能起著關鍵的調節作用[10]。
在促纖維化過程中,TGF-β通過整合素蛋白αvβ6等因素啟動,基于與其受體的聯系誘導Smad2/3磷酸化,磷酸化后形成與Smad4的絡合物。這個絡合物向細胞核移動,啟動包括細胞外基質(ECM)蛋白的基因轉錄,增加ECM蛋白的表達,同時也抑制了抗纖維化蛋白酶抑制劑[11]。TGF-β下游基質金屬蛋白酶1組織抑制因子(TIMP)-1和人纖溶酶原激活物抑制因子(PAI)-1過度表達加速肝臟纖維化進程[12],見圖1。目前研究證實其作用機制主要通過以下兩方面來完成:一是通過抑制各種基質金屬蛋白酶減少ECM降解,同時刺激HSC/ECM絡合物,激活HSCs等,促進肝纖維化進程;另一方面通過抑制抗纖維化蛋白酶抑制劑促進組織纖維化。研究證實,在嚙齒動物中阻斷Smad2/3信號通路可以阻止肝臟纖維化,提示阻止這一信號通路是治療膽道閉鎖肝纖維化的可能方法[9,13]。研究發現Smad相關蛋白(SIP)-1是一個通過綁定激活Smads 1、2、3、5、8與TGF-β路徑相互作用的轉錄因子[14];Smad-3和SIP-1相伴隨增加,SIP-1綁定激活的Smads家族和Smad絡合物引起靶基因轉錄激活物減少[15]。因此SIP-1伴隨TGF-β路徑而產生并且與其作用相反。TGF-β/Smad2/3通路在BA肝纖維化中起重要作用,與ECM以及纖維細胞的合成、增殖作用有關,但TGF-β通路對BA肝膽炎癥有何作用有待進一步研究。
2.2 TGF-β1加速肝纖維化并導致肝功能衰竭TGF-β有6種不同的亞型TGF-β1~6,其中TGF-β1是肝纖維化發生過程中起關鍵作用的細胞因子。TGF-β1來源于Kuffer細胞,顯著刺激HSC/ECM絡合物,它作為潛在纖維化細胞因子以廣泛調節作用包括HSC激活、ECM蛋白化合物誘導和基質金屬蛋白酶抑制作用為大家熟知[16]。HSCs被TGF-β1激活后在肝損傷部位增生并遷移至門管區產生大量基質成分,HSCs又可以分泌TGF-β1、上調TGF-β1受體,形成自分泌循環。TGF-β1能夠刺激纖維細胞合成與增殖,以及一些細胞外基質成分諸如膠原蛋白Ⅰ、Ⅲ、Ⅳ和纖維黏連蛋白(fibronectin)分泌。TGF-β1在小葉中心部的表達明顯高于肝門區域[14],它在BA晚期過度表達,在啟動復雜的纖維化進程中起到重要作用,并加速肝臟纖維化進程。有研究指出存在TGF-β1/Smad2/3促纖維化路徑,且TGF-β1通路是引起BA肝臟纖維化的重要通路之一[13]。
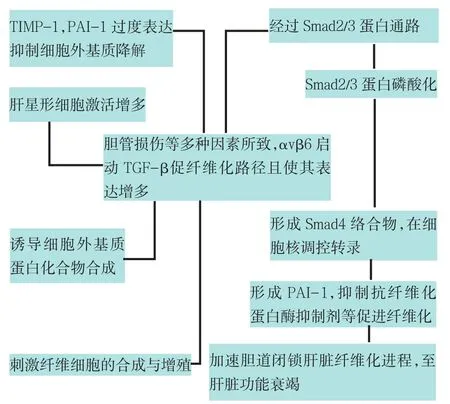
Fig.1 The pathway of fibrosis induced by TGF-β圖1 TGF-β促纖維化路徑
3 CD14加速BA肝纖維化發展
3.1 CD14結構CD14主要結構特征為N-末端富含亮氨酸的重復單位,人類CD14氨基酸序列中39~44位區段是結合脂多糖(LPS)的必須區段,該結構可能在識別LPS中發揮關鍵作用,CD14分子以膜CD14(mCD14)和可溶CD14(sCD14)2種形式存在[17]。mCD14是一個50~55 ku的受體,通過糖基磷酸化肌醇(glycosyl-phosphatidyl inositol,GPI)固定于細胞表面,主要在巨噬細胞、樹突狀細胞、單核細胞和中性粒細胞的表面表達,sCD14是一種糖蛋白,由單核細胞產生,但血漿中sCD14的主要來源是肝實質細胞。
3.2 CD14在BA的雙重性在BA肝內炎細胞表面檢測到mCD14,說明mCD14在炎細胞表面表達并且參與炎性反應,而它在肝內Kuffer細胞和肝竇內皮細胞的表達顯示:CD14高表達促進炎癥反應,促進NF-κB表達,造成機體免疫反應激活和全身炎癥反應綜合征,導致膽汁淤積、肝臟損傷[18]。LPS對肝臟具有損傷作用,在BA肝損害中作用尤為明顯。通過LPS方式誘導的Kuffer細胞、中性粒細胞、肝實質細胞和膽道上皮細胞中都有CD14表達,而Kuffer細胞可以修飾已經內吞的LPS,然后將其傳遞到肝實質細胞繼而分泌到膽汁中[18]。這說明CD14在吸收和清除LPS的循環途徑中有一定的作用。高水平CD14通過炎癥反應損傷肝臟甚至增加LPS誘導的死亡率,同時CD14也具有協同Kuffer細胞共同轉運LPS從而減輕肝臟損害的作用,因此BA中CD14在不同水平具有雙重性。
肝細胞直接分泌sCD14,這可以增加對內毒素的清除,在BA早期膽汁淤積時血漿中sCD14含量增加,提示sCD14在肝臟能夠阻止由于膽汁淤積導致的內毒素增加,減輕肝臟損傷[17,19]。相反,BA晚期sCD14減少卻沒有伴隨肝臟和血中內毒素減少,據此推測Kuffer細胞內缺少保障CD14傳遞LPS作用持續進行的機制,而導致炎癥反應傳遞,造成不可逆轉的肝損傷和晚期BA患者肝組織纖維增生、肝硬化的結局[20]。
3.3 CD14促肝纖維化通路CD14在BA肝細胞內激活信號傳導機制可能有蛋白酪氨酸激酶(protein tyrosine kinase, PTK)和磷脂酰肌醇(phosphatidyl inositol,PI)2個途徑。PI途徑通過產生第二信使來實現信號轉導并且發揮細胞內生物學效應。PTK途徑是CD14受體細胞內信號傳遞中的另一重要通路。當LPS直接激活肝細胞,損傷膽管上皮細胞時,在LPS刺激的數分鐘內,一些特定的靶蛋白被酪氨酸磷酸化,從而激活促分裂原活化蛋白激酶途徑,催化轉錄因子發生磷酸化修飾,調控相關基因的表達,導致CD14在肝細胞內表達上調。同時細菌毒素和LPS激活大量肝巨噬細胞,肝內產生大量活化CD14陽性巨噬細胞,CD14陽性巨噬細胞產生大量細胞因子如TGF、血小板源性生長因子(PDGF)、TNF等,這些細胞因子繼續激活HSCs生成大量基質以及促肝纖維化因子,導致肝纖維化形成[21]。
內毒素等損傷因素導致CD14在BA肝臟中高表達,引起膽汁淤積、肝臟損傷,加大促炎癥反應,CD14本身也可能作為炎性因子刺激機體免疫反應活化HSCs,并且促進TGF-β1分泌及其受體上調[21]。因此,CD14作為一種炎性介質不僅介導免疫反應和炎性損傷,而且CD14損傷膽管細胞、促進大量細胞因子釋放的作用也可激活TGF-β促纖維化通路。因此,CD14在BA肝臟纖維化發展中起著重要的介導作用。
綜上,圍生期病毒等眾多因素損傷機體引發炎癥、免疫反應生成CD14、TGF-β等多種細胞因子,同時激活TGF-β促纖維化通路加重免疫和炎癥反應,促進BA肝纖維化進程。免疫、炎癥、促肝纖維化通路相互作用,是BA肝纖維化發展三大重要因素。除此之外BA肝纖維化發展是否還有其他路徑,以及TGF-β促纖維化通路如何調節免疫和炎癥反應,如果打斷以上通路是否可以減輕BA肝膽纖維化程度仍需進一步研究。
[1]Zhan JH,Guan ZW,Zhang H.Attention to neonatal cholestasis:Enhance the early diagnostic rate of Biliary atresia[J].Chinese Journal of Applied Clinical Pediatrics,2014,29(11):803-806.[詹江華,管志偉,張輝.重視新生兒膽汁淤積:提高膽道閉鎖的早診率[J].中華實用兒科臨床雜志,2014,29(11):803-806].doi:10.3760/cma.j. issn.2095-428X.2014.11.002.
[2]Antoniades CG,Khamri W,Abeles RD,et al.Secretory leukocyte protease inhibitor:a pivotal mediator of anti-inflammatory responses in acetaminophen-induced acute liver failure[J].Hepatology,2014,59 (4):1564-1576.doi:10.1002/hep.26933.
[3]Moore SW,Zabiegaj-Zwick C,Nel E.Problems related to CMV infection and biliary atresia[J].S Afr Med J,2012,102(11):890-892.doi: 10.7196/samj.6163.
[4]Kisseleva T,Cong M,Paik Y,et al.Myofibroblasts revert to an inactive phenotype during regression of liver fibrosis[J].Proc Natl Acad Sci USA,2012,109(24):9448-9453.doi:10.1073/pnas.1201840109.
[5]Vejchapipat P,Poomsawat S,Chongsrisawat V,et al.Elevated serum IL-18 and interferon-gamma in medium-term survivors of biliary atresia[J].Eur J Pediatr Surg,2012,22(1):29-33.doi:10.1055/s-0032-1306260.
[6]Brindley SM,Lanham AM,Karrer FM,et al.Cytomegalovirus-specific T-cell reactivity in biliary atresia at the time of diagnosis is associated with deficits in regulatory T cells[J].Hepatology,2012,55(4): 1130-1138.doi:10.1002/hep.24807.
[7]Okamura A,Harada K,Nio M,et al.Interleukin-32 production associated with biliary innate immunity and proinflammatory cytokines contributes to the pathogenesis of cholangitis in biliary atresia[J]. Clin Exp Immunol,2013,173(2):268-275.doi:10.1111/cei.12103.
[8]Zhou L,Lopes JE,Chong MM,et al.TGF-beta-induced Foxp3 inhibits T(H)17 cell differentiation by antagonizing ROR gammat function [J].Nature,2008,453(7192):236-240.doi:10.1038/nature06878.
[9]Massague J.TGF signalling in context.Nat Rev Mol Cell Biol,2012, 13(10):616-630.doi:10.1038/nrm3434.
[10]Cheng X,Alborzinia H,Merz KH,et al.Indirubin derivatives modulate TGFβ/BMP signaling at different levels and trigger ubiquitinmediated depletion of nonactivated R-Smads[J].Chem.Biol,2012,19 (11):1423-1436.doi:10.1016/j.chembiol.2012.09.008.
[11]Markovics JA,Araya J,Cambier S,et al.Interleukin-1beta induces increased transcriptional activation of the transforming growth factorbeta-activating integrin subunit beta8 through altering chromatin architecture[J].JBiolChem,2011,286(42):36864-36874.doi: 10.1074/jbc.M111.276790.
[12]Burch ML,Zheng W,Little PJ.Smad linker region phosphorylation in the regulation of extracellular matrix synthesis[J].Cell Mol Life Sci,2011,68(1):97-107.doi:10.1007/s00018-010-0514-4.
[13]Lee JH,Lee H,Joung YK,et al.The use of low molecular weight heparin-pluronic nanogels to impede liver fibrosis by inhibition the TGF-β/Smad signaling pathway[J].Biomaterials,2011,32(5):1438-1445.doi:10.1016/j.biomaterials.2010.10.023.
[14]Iordanskaia T,Hubal MJ,Koeck E,et al.Dysregulation of upstream and downstream transforming growth factor-β transcripts in livers of children with biliary atresia and fibrogenic gene signatures[J].J PediatrSurg,2013,48(10):2047-2053.doi:10.1016/j.jpedsurg.2013.03.047.
[15]Conidi A.Few Smad proteins and many Smad-interacting proteins yield multiple functions and action modes in TGF-β/BMP signaling in vivo[J].Cytokine Growth Factor Rev,2011,22(5-6):287-300.doi: 10.1016/j.cytogfr.2011.11.006.
[16]Kamato D,Burch ML,Piva TJ,et al.Transforming growth factor-β signalling:role and consequences of Smad linker region phosphorylation[J].Cell Signal,2013,25(10):2017-2024.doi:10.1016/j.cellsig.2013.06.001.
[17]Kim D,Kim JY.Anti-CD14 antibody reduces LPS responsiveness via TLR4 internalization in human monocytes[J].Mol Immunol,2014, 57(2):210-215.doi:10.1016/j.molimm.2013.09.009.
[18]Chou MH,Chuang JH,Eng HL,et al.Endotoxin and CD14 in the progression of biliary atresia[J].J Transl Med,2010,8:138.doi:10.1186/ 1479-5876-8-138.
[19]Berenger BM,Hamill J,Stack D,et al.Membrane CD14,but not soluble CD14,is used by exoenzyme S from P.aeruginosa to signal proinflammatory cytokine production[J].J Leukoc Biol,2011,90(1):189-198.doi:10.1189/jlb.0510265.
[20]Litzman J,Nechvatalova J,Xu J,et al.Chronic immune activation in common variable immunodeficiency(CVID)is associated with elevated serum levels of soluble CD14 and CD25 but not endotoxaemia [J].Clin Exp Immunol,2012,170(3):321-332.doi:10.1111/j.1365-2249.2012.04655.x.
[21]Liu HH,Hu Y,Zheng M,et al.CD14 SNPs regulate the innate immune response[J].Mol Immunol,2012,51(2):112-117.doi:10.1016/ j.molimm.2012.02.112.
(2014-08-01收稿2014-11-14修回)
(本文編輯李國琪)
Advances in the research of liver fibrosis in biliary atresia
DING Meiyun1,ZHAN Jianghua2△
1The Graduate School of Tianjin Medical University,Tianjin 300070,China;2 Tianjin Children’s Hospital△
Biliary atresia(BA)is one of the most serious digestive system diseases,which threatens the health of infants. Liver fibrosis is a major cause of death in children with BA.In the process of the pathogenesis of BA,virus infection can induce a series of immune and inflammatory reaction,result in a decrease of regulatory T cells(Treg cells)and high expression of CD14,activating a variety of inflammatory pathways and TGF-β/Smad2/3 pro-fibrogenic pathway,which produces a large number of medium damage of liver cells and bile duct cells,releases proinflammatory factor,oxygen metabolism matter and cytokines.These changes further aggravate damage of hepatobiliary system and cause the internal environment imbalance of liver parenchyma cells.The imbalance of internal environment with adaptive degeneration and necrosis in liver parenchyma cells,hepatic macrophages and gathered inflammatory cells leads to the activation of hepatic stellate cells(HSCs).HSCs can be converted into fibroblast cells,and promote the process of liver fibrosis.Immune and inflammatory lesions,pro-fibrogenic pathway are the important factors in contributing to liver fibrosis and cirrhosis of biliary atresia.
biliary atresia;liver cirrhosis;T-lymphocytes,regulatory;transforming growth factor beta;antigens,CD14; Smad proteins
R726.574
A
10.3969/j.issn.0253-9896.2015.01.002
天津市衛計委重點攻關項目(14KG129)
1天津醫科大學研究生院(郵編300070);2天津市兒童醫院外科
丁美云(1988),女,碩士在讀,主要從事小兒普通外科、膽道閉鎖方面研究
△通訊作者及審校者zhanjianghuatj@163.com

