青蒿琥酯對高糖誘導的腎小管上皮細胞凋亡及TNF-α、IL-8表達的影響
蔣姍姍,龍艷,蘇珂,聶寒,黃漓莉,楊帆,李爭明,荀靖瓊
青蒿琥酯對高糖誘導的腎小管上皮細胞凋亡及TNF-α、IL-8表達的影響
蔣姍姍,龍艷△,蘇珂,聶寒,黃漓莉,楊帆,李爭明,荀靖瓊
目的探討青蒿琥酯(Art)對高糖誘導的大鼠腎小管上皮細胞(NRK-52E)的凋亡及腫瘤壞死因子-α(TNF-α)、白細胞介素-8(IL-8)表達的影響。方法傳代培養(yǎng)大鼠腎小管上皮細胞,分為正常對照組、高糖組、高糖+不同濃度青蒿琥酯組(10、20、30 mg/L)、高糖+依那普利對照組(5 mg/L)。四甲基偶氮唑鹽微量比色(MTT)法觀察細胞增殖能力的改變;流式細胞儀AnnexinV-FITC/PI雙染法檢測細胞凋亡指數(shù);酶聯(lián)免疫吸附(ELISA)法檢測細胞培養(yǎng)上清液中TNF-α和IL-8蛋白含量。結果(1)經(jīng)高糖處理48 h后,NRK-52E細胞增殖抑制,細胞凋亡率增高,細胞上清液中TNF-α、IL-8蛋白濃度升高。(2)經(jīng)青蒿琥酯干預后,與高糖組比較,NRK-52細胞增殖明顯,細胞凋亡率減低,細胞上清液中TNF-α、IL-8蛋白濃度降低,其干預作用呈現(xiàn)劑量依賴性。結論青蒿琥酯可抑制高糖誘導的NRK-52E細胞凋亡及細胞上清液中炎癥因子TNF-α、IL-8的表達。青蒿琥酯的抗炎和免疫調(diào)節(jié)作用可能有助于糖尿病腎病的治療。
糖尿病腎病;細胞凋亡;腫瘤壞死因子α;白細胞介素8;青蒿琥酯;腎小管上皮細胞
糖尿病腎病(diabetic nephropathy,DN)是糖尿病最常見的微血管并發(fā)癥之一,目前已成為糖尿病患者的主要死亡原因之一。DN發(fā)病機制復雜,腎內(nèi)炎癥反應的激活為其主要病理損傷機制之一,炎癥因子及促炎癥細胞因子在DN的發(fā)展中起著重要作用,腫瘤壞死因子(TNF)-α和白細胞介素(IL)-8就是其中兩個啟動炎癥反應的關鍵細胞因子[1]。青蒿琥酯(artesunate,Art)是從傳統(tǒng)中藥菊科植物黃花蒿中提取的倍半萜內(nèi)酯類化合物青蒿素的水溶性衍生物,為治療瘧疾的經(jīng)典藥物[2]。近年來研究發(fā)現(xiàn),青蒿琥酯還具有抗炎[3]、抗腫瘤[4]、抗纖維化[5]、抗新生血管生成[6]等作用,已證實其可減輕腎間質(zhì)炎性損傷[7],但目前國內(nèi)外尚鮮見其應用于防治DN的研究報道。本實驗以體外培養(yǎng)的大鼠腎小管上皮細胞(NRK-52E)為實驗對象,觀察青蒿琥酯對高糖誘導的炎癥反應和腎小管細胞凋亡的抑制作用,為其臨床應用于DN的防治提供初步的理論依據(jù)。
1 材料與方法
1.1 材料大鼠近端腎小管上皮細胞株(NRK-52E)購于上海復祥生物科技有限公司(源于ATCC,貨號CRL-1571)。高糖、低糖DMEM培養(yǎng)基為美國GIBCO公司產(chǎn)品;胎牛血清為美國Hyclone公司產(chǎn)品。噻唑蘭(MTT)粉末、二甲基亞砜(DMSO)、青鏈霉素混合液(×100)、胰蛋白酶消化液(0.25%)均為北京索萊寶科技有限公司產(chǎn)品。AnnexinV-FITC/PI凋亡檢測試劑盒購于北京嘉美紐諾生物科技有限公司。IL-8 ELISA試劑盒購于武漢華美生物工程有限公司;TNF-α ELISA試劑盒購于欣博盛生物科技有限公司。注射用青蒿琥酯(批號LA130613,規(guī)格60 mg/支)由桂林南藥股份有限公司生產(chǎn),用1 mL 5%NaHCO3注射液助溶,配成60 g/L濃度的儲存液保存于4℃,實驗時用無血清培養(yǎng)基稀釋成不同濃度的工作液。馬來酸依那普利(Ena)原料藥由武漢勝天宇生物科技有限公司生產(chǎn),用PBS溶液(pH 7.4)配成1 mmol/L儲存液,過濾除菌后保存于4℃,實驗時用無血清培養(yǎng)基稀釋成不同濃度的工作液。
1.2 細胞培養(yǎng)大鼠近端腎小管上皮細胞(NRK-52E)在含10%胎牛血清、100 U/mL青霉素、100 U/mL鏈霉素的低糖DMEM培養(yǎng)基(D-葡萄糖濃度5.6 mmol/L)于37℃、5%CO2無菌培養(yǎng)箱中孵育。細胞呈單層貼壁鋪路石樣生長,長至80%左右用0.25%胰蛋白酶消化,1∶3傳代培養(yǎng),每2~3 d傳代1次。取第5~10代細胞用于實驗。
1.3 實驗分組與處理細胞穩(wěn)定傳代生長至亞融合狀態(tài)時加入無血清低糖DMEM培養(yǎng)基同步化24 h,根據(jù)預實驗摸索的藥物濃度,將NRK-52E細胞隨機分為6組。(1)正常對照組(A組):低糖DMEM培養(yǎng)基(D-葡萄糖終濃度為5.6 mmol/L);(2)高糖組(B組):高糖DMEM培養(yǎng)基(D-葡萄糖終濃度25 mmol/L);(3)高糖+青蒿琥酯小劑量組(C組):高糖DMEM培養(yǎng)基+青蒿琥酯(終濃度10 mg/L);(4)高糖+青蒿琥酯中劑量組(D組):高糖DMEM培養(yǎng)基+青蒿琥酯(終濃度為20 mg/L);(5)高糖+青蒿琥酯大劑量組(E組):高糖DMEM培養(yǎng)基+青蒿琥酯(終濃度30 mg/L);(6)高糖+依那普利陽性藥物對照組(F組):高糖DMEM培養(yǎng)基+依那普利(終濃度5 mg/L)。
1.4 四甲基偶氮唑鹽微量比色(MTT)法檢測細胞增殖情況MTT粉劑用高壓滅菌處理的PBS溶液(pH7.4)配成濃度為5 g/L的儲存液,過濾除菌,4℃保存。收集對數(shù)生長期的細胞,計數(shù)后調(diào)整細胞懸液濃度,將細胞以5×103個/孔接種至96孔培養(yǎng)板中,每孔200 μL培養(yǎng)基。細胞貼壁后,用無血清低糖DMEM培養(yǎng)基同步化24 h,細胞進入靜止期后吸棄孔中的培養(yǎng)基,按以上實驗分組每孔加入180 μL相應的含藥物培養(yǎng)基,每組設6個復孔,并設置調(diào)零孔。將96孔板放回培養(yǎng)箱繼續(xù)培養(yǎng),等藥物作用48 h后,避光條件下每孔加入20 μL MTT溶液,繼續(xù)培養(yǎng)4 h后小心吸去上清液,每孔加入150 μL DMSO,置于搖床上避光低速振蕩10 min,使結晶物充分溶解。用酶聯(lián)免疫檢測儀在490 nm波長下測量各孔的光密度值(OD490)。根據(jù)OD值推測出活細胞的數(shù)目,了解細胞的增殖能力。
1.5 AnnexinV-FITC/PI雙標記流式細胞儀檢測細胞凋亡率待細胞在6孔板中培養(yǎng)至對數(shù)生長期,換無血清低糖DMEM培養(yǎng)基培養(yǎng)24 h使細胞周期同步化,再按上述分組加藥處理48 h后,收集各組細胞培養(yǎng)液中懸浮細胞和用胰酶消化的細胞,2 000 r/min離心5 min。用PBS洗滌細胞1次,收集并調(diào)整細胞濃度為1×106個/mL,取1 mL單細胞懸液,1 000 r/min離心5 min,棄上清。用400 μL緩沖液重懸細胞后,加入5 μL AnnexinV-FIFC,混勻后室溫避光孵育15 min。再加入10 μL PI染色液,混勻后冰浴避光放置5 min。篩網(wǎng)過濾后,用流式細胞儀檢測細胞凋亡率,計算各組細胞AnnexinV-FIFC和PI染色細胞百分含量。
1.6 酶聯(lián)免疫吸附(ELISA)法檢測TNF-α及IL-8水平細胞經(jīng)上述分組加藥處理培養(yǎng)48 h后收集各組上清液,同一標本設立復管。按ELISA試劑盒說明書操作,在操作前先進行預實驗以建立最佳稀釋倍數(shù)。用酶聯(lián)免疫檢測儀在450 nm處測定OD值。根據(jù)標準品的測量值繪制標準曲線,計算標本中TNF-α、IL-8的相應濃度。
1.7 統(tǒng)計學方法用SPSS 16.0軟件進行統(tǒng)計分析,所有實驗均重復3次,計量結果數(shù)據(jù)以表示,多個樣本之間的比較采用單因素方差分析,組間多重比較采用SNK-q檢驗。P<0.05表示差異有統(tǒng)計學意義。
2 結果
2.1 高糖和青蒿琥酯對NRK-52E細胞增殖能力的影響MTT結果顯示,與低糖組(A組)比較,高糖組(B組)培養(yǎng)48 h后細胞OD490明顯減低,提示高糖可抑制腎小管上皮細胞增殖。與B組比較,藥物干預(C、D、E、F)組細胞OD490明顯升高,但仍低于A組,提示用不同濃度青蒿琥酯和依那普利干預后細胞增殖能力較高糖組明顯升高,且青蒿琥酯濃度越高,細胞增殖能力升高越明顯(均P<0.05)。青蒿琥酯中劑量組(D組)與依那普利組(F組)比較差異無統(tǒng)計學意義(P>0.05),但青蒿琥酯小、大劑量組(C、E組)與依那普利組(F組)比較,差異有統(tǒng)計學意義(P<0.05),見表1。
2.2 高糖和青蒿琥酯對NRK-52E細胞凋亡的影響流式細胞儀檢測結果顯示,各組加藥處理48 h后,與A組比較,B組細胞凋亡率(早期凋亡率+晚期凋亡率)明顯增高,提示高糖可誘導NRK-52E細胞凋亡;與B組比較,C、D、E、F組細胞凋亡率均降低,但仍高于A組,提示用不同濃度青蒿琥酯和依那普利干預后均可抑制高糖誘導的NRK-52E細胞的凋亡,且D組和E組較C組抑制凋亡效應更加顯著(均P<0.05)。C組與F組比較差異無統(tǒng)計學意義,但D、E組均低于F組(P<0.05),見圖1、表1。
Tab.1The cell proliferations and apoptotic rates of in different groups of NRK-52E cells表1 各組NRK-52E細胞生長增殖及凋亡情況(n=6,)
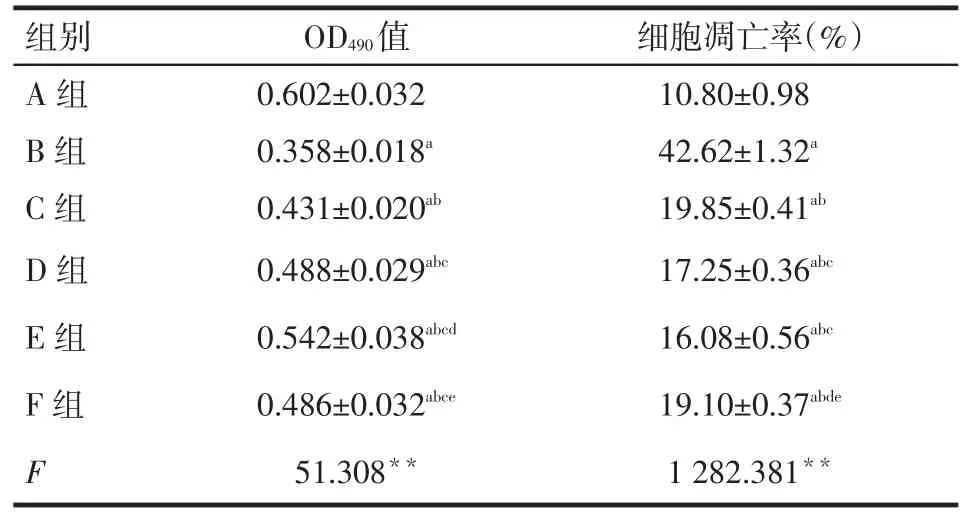
Tab.1The cell proliferations and apoptotic rates of in different groups of NRK-52E cells表1 各組NRK-52E細胞生長增殖及凋亡情況(n=6,)
**P<0.01;a與A組比較,b與B組比較,c與C組比較,d與D組比較,e與E組比較,P<0.05;表2同
OD490值0.602±0.032 0.358±0.018a 0.431±0.020ab 0.488±0.029abc 0.542±0.038abcd 0.486±0.032abce 51.308**組別A組B組C組D組E組F組F細胞凋亡率(%)10.80±0.98 42.62±1.32a 19.85±0.41ab 17.25±0.36abc 16.08±0.56abc 19.10±0.37abde 1 282.381**
2.3 高糖和青蒿琥酯對NRK-52E細胞上清液中TNF-α、IL-8水平的影響ELISA結果顯示,各組培養(yǎng)48 h后,A組上清中TNF-α、IL-8呈較低水平,B組水平明顯升高;而C、D、E、F組水平明顯低于B組,但仍高于A組(P<0.05)。提示用不同濃度青蒿琥酯和依那普利干預后均可抑制高糖誘導的NRK-52E炎癥因子TNF-α、IL-8的分泌,且青蒿琥酯濃度越高,抑制作用越明顯。C、D、E組與F組TNF-α水平比較差異均有統(tǒng)計學意義(P<0.05)。C、D組與F組IL-8水平比較差異無統(tǒng)計學意義(P>0.05),E組IL-8水平低于F組(P<0.05),見表2。
Tab.2Expressions of TNF-α and IL-8 in different NRK-52E supernatant groups表2 各組NRK-52E上清液中TNF-α、IL-8表達水平(n=6,mg/L,)
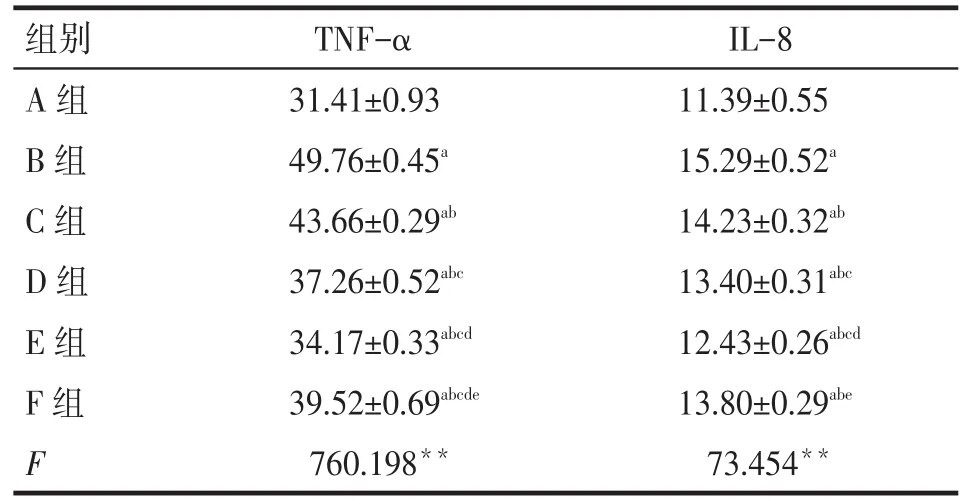
Tab.2Expressions of TNF-α and IL-8 in different NRK-52E supernatant groups表2 各組NRK-52E上清液中TNF-α、IL-8表達水平(n=6,mg/L,)
TNF-α 31.41±0.93 49.76±0.45a 43.66±0.29ab 37.26±0.52abc 34.17±0.33abcd 39.52±0.69abcde 760.198**組別A組B組C組D組E組F組F IL-8 11.39±0.55 15.29±0.52a 14.23±0.32ab 13.40±0.31abc 12.43±0.26abcd 13.80±0.29abe 73.454**
3 討論
目前DN在臨床治療上尚無有效方法,主要以對癥支持治療延緩腎功能的損害為主。長時間的藥物治療,不僅影響患者的生活質(zhì)量,其治療費用也給患者及社會帶來巨大的經(jīng)濟負擔,因此如何在DN早期進行防治干預仍是當前及未來研究的熱點。以往認為DN早期階段主要是腎小球病變,但近年研究發(fā)現(xiàn),在DN早期腎小管的損害可能早于腎小球的損害,因為臨床中在尚無尿微量白蛋白時尿中已有多種腎小管蛋白存在[8]。因此近年來研究者越來越重視腎小管上皮細胞損傷和凋亡在DN發(fā)病機制中的作用。
3.1 高糖誘導與腎小管細胞的凋亡研究表明,高糖環(huán)境可通過多種途徑誘導腎小管上皮細胞凋亡,如Toll樣受體(Toll like receptor,TLR)途徑[9]、細胞外信號調(diào)節(jié)激酶(extracellular regular protein kinase,ERK)途徑[10]、c-Jun氨基末端激酶(C-jun N-terminal kinase,JNK)途徑[11]、p38絲裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38MARK)[12]途徑等,導致腎小管再吸收和分泌功能異常,促進腎臟小管間質(zhì)纖維化改變,是DN進展為終末期腎病(End stage renal disease,ESRD)的重要因素。因此,腎小管上皮細胞凋亡在糖尿病腎損傷中具有重要的意義。本實驗結果也證實,高糖培養(yǎng)可促進腎小管上皮細胞凋亡并抑制細胞增殖。
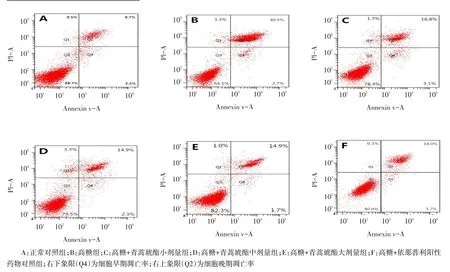
Fig.1The apoptotic rates in different groups of NRK-52E cells圖1 各組NRK-52E細胞凋亡情況
3.2 高糖誘導與腎小管細胞的炎性細胞因子表達炎癥反應是DN持續(xù)發(fā)展的重要因素,炎癥反應越強烈,腎臟損傷越嚴重。本研究表明,高糖刺激下NRK-52E細胞上清液中TNF-α、IL-8濃度明顯高于低糖組,說明高糖可激活腎小管上皮細胞分泌炎性分子。TNF-α和IL-8是2個在炎癥反應中釋放較早的內(nèi)源性介質(zhì),在細胞分化和凋亡等過程中起著重要作用[1]。TNF-α可由腎小球系膜細胞、腎小管上皮細胞以及浸潤的單核巨噬細胞產(chǎn)生,可誘導IL-1、IL-6、白三烯、前列腺素和血小板活化因子等炎癥介質(zhì)的合成,促進免疫炎癥反應進展[13]。IL-8主要由單核-巨噬細胞產(chǎn)生,可使中性粒細胞趨化、脫顆粒并釋放溶酶,加強炎癥反應。炎癥刺激腎小管上皮細胞分泌釋放更多的免疫介質(zhì)和細胞因子,使腎間質(zhì)單核-巨噬細胞聚集,經(jīng)上皮間葉轉(zhuǎn)化來的肌纖維細胞和原基質(zhì)成纖維細胞增殖,導致間質(zhì)纖維化,促使腎病進入終末期[14]。同時,炎癥反應并不是孤立的,它與其他機制如氧化應激、內(nèi)質(zhì)網(wǎng)應激、腎素-血管緊張素系統(tǒng)(renin-angiotensin system,RAS)過度激活、血流動力學改變等一起加快了腎病的進展[15]。因此目前治療DN的藥物很多都是通過抗炎治療的,如他汀類、血管緊張素轉(zhuǎn)換酶抑制劑(ACEI)類、醛固酮拮抗劑及麥考酚酸莫酯等。
3.3 青蒿琥酯對高糖誘導下腎小管細胞的影響青蒿琥酯作為經(jīng)典抗瘧疾中藥,近年來研究顯示其還具有抗炎和免疫調(diào)節(jié)作用[3]。眾所周知,ACEI是目前在DN治療中應用時間最長的藥物,有很好的腎臟保護作用,其可通過多種機制,抑制DN炎癥反應,故該研究采用依那普利作為陽性對照藥物。本研究顯示,高糖誘導后腎小管細胞凋亡率及培養(yǎng)上清液中TNF-α、IL-8濃度均升高,經(jīng)青蒿琥酯及依那普利干預后細胞凋亡及TNF-α、IL-8濃度均出現(xiàn)不同程度的抑制;且青蒿琥酯大、中劑量的抑制程度強于小劑量濃度,呈現(xiàn)出劑量依賴性。由于本實驗只觀察了各組細胞加藥誘導后48 h的變化,是否存在時間依賴性仍需進一步觀察。此外,本實驗發(fā)現(xiàn)青蒿琥酯小劑量對高糖誘導的細胞凋亡率升高及青蒿琥酯小、中劑量對高糖誘導后細胞上清液中IL-8濃度升高所呈現(xiàn)出的抑制程度與依那普利比較差異無統(tǒng)計學意義,說明青蒿琥酯在減少炎性因子的釋放和抑制細胞凋亡方面可與ACEI類藥物依那普利達到同樣的效果。由此推測,青蒿琥酯可能是通過抑制高糖誘導的炎癥反應,減少某些炎性因子的釋放,阻斷高糖的促凋亡作用,從而減輕腎小管上皮細胞損傷,進而防止腎損害的發(fā)生。
綜上所述,青蒿琥酯可以抑制高糖誘導的炎癥反應和腎小管細胞凋亡,提示腎小管上皮細胞是青蒿琥酯的抗炎作用靶點,也為防治DN提供了新的思路。青蒿琥酯極可能成為防治DN的新藥物,但作用機制有待進一步探討。另外,體外實驗不能完全模擬復雜的體內(nèi)環(huán)境,因此青蒿琥酯對DN的腎臟保護作用還有待于大量的動物實驗和臨床試驗證實。
[1]Navarro-González JF,Mora-Fernández C,Muros de Fuentes M,et al.Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J].Nat Rev Nephrol,2011,7(6):327-340.doi: 10.1038/nrneph.2011.51.
[2]Nzila A,Al-Zahrani I.Drugs for the treatment of malaria in the Kingdom of Saudi Arabia[J].Saudi Med J,2013,34(6):569-578.
[3]Mo HY,Wang LF,Zhang LH.Effects of artesunate on tumor necrosis factor α and chemotactic factors in the serum and the synoviocyte culture supernate of collagen-induced arthritis rats[J].Chin J Integr Tradit West Med,2012,32(2):253-256.[莫漢有,王麗芳,張麗華.青蒿琥酯對佐劑性關節(jié)炎大鼠血清及滑膜細胞培養(yǎng)上清液中腫瘤壞死因子α及趨化因子的影響[J].中國中西醫(yī)結合雜志,2012,32(2):253-256].
[4]Liu L,Zuo LF,Wang J.Effects of artesunate on membrane potential of mitochondria and cell apoptosis of Ec9706 cells[J].Med J Chin PLA, 2014,39(1):25-29.[劉亮,左連富,王靜.青蒿琥酯對食管癌Ec9706細胞線粒體膜電位及凋亡的影響[J].解放軍醫(yī)學雜志,2014,39(1): 25-29].doi:10.11855/j.issn.0577-7402.2014.01.06.
[5]Wang CM,Chen J,Jiang M,et al.Relationship between artesunate influence on the process of TGF-β1 induced alveolar epithelial cells transform into mesenchymal cells and on idiopathic pulmonary fibrosis[J].Acta Pharm Sin,2014,49(1):142-147.[王昌明,陳娟,蔣明,等.青蒿琥酯干預TGF-β1誘導的肺泡上皮-間質(zhì)細胞轉(zhuǎn)分化與肺纖維化的關系[J].藥學學報,2014,49(1):142-147].
[6]Liu Y,Peng HC,Tang H.Effects of artesunate on proliferation and expression of VEGF in human retinal capillary endothelial cells treated with high glucose[J].Int Eye Sci,2013,13(2):252-255.[劉逸,彭輝燦,唐虹.青蒿琥酯對高糖環(huán)境下人視網(wǎng)膜微血管內(nèi)皮細胞增殖及VEGF表達的影響[J].國際眼科雜志,2013,13(2): 252-255].doi:10.3980/j.issn.1672-5123.2013.02.08.
[7]Ma XY,Wu WH,Zeng Y,et al.The anti-inflammatory effect and its mechanism of Artemisia on the renal of UUO rats[J].Chongqing Med, 2010,39(12):1514-1516.[馬行一,吳蔚樺,曾燕,等.青蒿琥酯對UUO模型大鼠腎臟的抗炎作用及其機制研究[J].重慶醫(yī)學,2010,39(12): 1514-151].doi:10.3969/j.issn.1671-8348.2010.12.013.
[8]Abdel Aziz MT,Wassef MA,Ahmed HH,et al.The role of bone marrow derived-mesenchymal stem cells in attenuation of kidney function in rats with diabetic nephropathy[J].Diabetol Metab Syndr, 2014,6(1):34.doi:10.1186/1758-5996-6-34.
[9]Allam R,Scherbaum CR,Darisipudi MN,et al.Histones from dying renal cells aggravate kidney injury via TLR2 and TLR4[J].J Am Soc Nephrol,2012,23(8):1375-1388.doi:10.1681/ASN.2011111077.
[10]Mohamed R,Jayakumar C,Ranganathan PV,et al.Kidney proximal tubular epithelial-specific overexpression of netrin-1 suppresses inflammation and albuminuria through suppression of COX-2-mediated PGE2 production in streptozotocin-induced diabetic mice[J].Am J Pathol,2012,181(6):1991-2002.doi:10.1016/j.ajpath.2012.08.014.
[11]Benedetti G,Fredriksson L,Herpers B,et al.TNF-α-mediated NF-κB survival signaling impairment by cisplatin enhances JNK activation allowing synergistic apoptosis of renal proximal tubular cells[J].BiochemPharmacol,2013,85(2):274-286.doi:10.1016/j. bcp.2012.10.012.
[12]Gong X,Wang Q,Tang X,et al.Tetramethylpyrazine prevents contrast-induced nephropathy by inhibiting p38 MAPK and FoxO1 signaling pathways[J].Am J Nephrol,2013,37(3):199-207.doi: 10.1159/000347033.
[13]Fernández-Real JM,Vendrell J,García I,et al.Structural damage in diabetic nephropathy is associated with TNF-α system activity [J].Acta Diabetol,2012,49(4):301-305.doi:10.1007/s00592-011-0349-y.
[14]Lima SM,Grisi DC,Kogawa EM,et al.Diabetes mellitus and inflammatory pulpal and periapical disease:a review[J].Int Endod J, 2013,46(8):700-709.doi:10.1111/iej.12072.
[15]Yang SM,Ka SM,Wu HL,et al.Thrombomodulin domain 1 ameliorates diabetic nephropathy in mice via anti-NF-κB/NLRP3 inflammasome-mediated inflammation,enhancement of NRF2 antioxidant activity and inhibition of apoptosis[J].Diabetologia,2014,57(2): 424-434.doi:10.1007/s00125-013-3115-6.
(2014-05-26收稿2014-08-29修回)
(本文編輯李鵬)
Effects of artesunate on high glucose-induced cell apoptosis,TNF-α and IL-8 expression in renal tubular epithelial cells
JIANG Shanshan,LONG Yan△,SU Ke,NIE Han,HUANG Lili,YANG Fan,LI Zhengming,XUN Jingqiong
Department of Endocrinology,Affiliated Hospital of Guilin Medical College,Guangxi 541004,China△
ObjectiveTo investigate the effects of artesunate(Art)on cell apoptosis,tumor necrosis factor-alpha(TNF-α)and interleukin-8(IL-8)expression induced by high glucose in rat renal tubular epithelial cells(NRK-52E).Methods NRK-52E cells were cultured and divided into normal control group,high glucose group,high glucose with different concentrations of Art(10 mg/L,20 mg/L and 30 mg/L)groups,and high glucose with Ena(5 mg/L)group.MTT assay was used to detect the cell proliferation.The apoptotic rate was evaluated by flow cytometry with AnnexinV-FITC/PI double stains.The protein levels of TNF-α and IL-8 in the cell culture supernatant were determined using ELISA.ResultsHigh glucose inhibited NRK-52E proliferation,induced its apoptosis,and the expressions of TNF-α and IL-8 in the supernatant.Application of Art obviously abolished the effects of high glucose,and the effects of Art were showed in dose-dependent manner.ConclusionArt can suppress high glucose-stimulated cell apoptosis,enhance TNF-α and IL-8 expression in NRK-52E cells. The anti-inflammatory action and immune regulation of Art could be a novel approach of treating diabetic nephropathy.
diabetic nephropathies;apoptosis;tumor necrosis factor-alpha;interleukin-8;artesunate;renal tubular epithelial cells
R587.24
A
10.3969/j.issn.0253-9896.2015.01.006
廣西醫(yī)療衛(wèi)生適宜技術研究與開發(fā)項目(S201316-07);廣西自然科學基金項目(2012GXNSFAA053085);廣西高等學校計劃科研項目(201204LX246)
桂林醫(yī)學院附屬醫(yī)院內(nèi)分泌科(郵編541004)
蔣珊珊(1986),女,碩士在讀,主要從事糖尿病及其并發(fā)癥研究
△通訊作者E-mail:ly136988@163.com

