人肝癌細胞Hep-G2的低溫保存研究
姚嵐 梁瑋 劉寶林
(上海理工大學生物系統熱科學研究所 上海 200093)
人肝癌細胞Hep-G2的低溫保存研究
姚嵐 梁瑋 劉寶林
(上海理工大學生物系統熱科學研究所 上海 200093)
在細胞的低溫保存中,低溫保護劑的種類與濃度對復溫后的存活率有著重要影響。本文以人肝癌細胞Hep-G2為研究對象,利用慢速冷凍法,篩選最佳的凍存液配方。通過配比不同濃度的甘油、Me2SO以及在Me2SO中添加一定濃度的蔗糖、海藻糖,一周后復溫細胞,對臺盼藍染色存活率、MTT存活率以及24 h貼壁率三種檢測結果進行比較分析,結果表明:以Me2SO作為低溫保護劑時,凍存液濃度為10%(v/v)的Me2SO復溫后細胞的三種檢測指標最優;以甘油作為低溫保護劑時,凍存液濃度為20%(v/v)的甘油復溫后細胞的三種檢測指標最優;再將以上分別得到的最佳濃度(即體積濃度20%甘油、10%Me2SO)與5% Me2SO(v/v)+0.3 mol/L蔗糖、5%Me2SO(v/v)+0.3 mol/L海藻糖這四種低溫保護劑進行凍存與比較,5%Me2SO(v/v)+0.3 mol/L海藻糖檢測指標高于其他實驗組,并且差異顯著(P<0.05)。最終得到5%Me2SO(v/v)+0.3 mol/L海藻糖為慢速冷凍保存Hep-G2細胞的最優保護劑配方。
低溫保存;低溫保護劑;糖類;存活率
隨著人類生活環境的惡化,惡性腫瘤的發病率越來越高,腫瘤的早期診斷和治療是目前研究的熱點。而臨床樣本作為研究腫瘤不可再生的寶貴資源,不僅對于探索新的治療方法,發現新的診斷工具提供保障,對于制定新的診斷指標以及新藥的研發也具有重要意義,所以建立腫瘤樣本組織庫勢在必行。保持樣本庫中腫瘤細胞的活性,可以更加有效地保護細胞中蛋白、DNA、RNA等生物信息免受損傷,從而使后續的腫瘤基礎研究結果可信、準確。但是,目前絕大多數的生物樣本庫均不能保持細胞的活性,所以,針對樣本庫中各種各樣的細胞類型,研究其細胞及組織活體的低溫保存方法,具有十分重要的意義。
細胞的低溫保存有兩種方法:慢速冷卻法與玻璃化保存法[1],這兩種方法都需要添加低溫保護劑[2]。而低溫保護劑的種類以及濃度對細胞復溫后的存活率是至關重要的。自從1949年Polge C等[3]利用甘油成功的凍存精子后,至今低溫保護劑的種類已達上百種。由于甘油的局限性,人們繼續在尋找低溫保護劑的路上進行探索;直到1959年,Lovelock等人發現了二甲基亞砜(Me2SO)后,人們對低溫保護劑的種類有了更多的發現。Jolanta K等[4]利用甘油和羥乙基淀粉來凍存人體紅細胞,發現羥乙基淀粉比甘油能更有效地保存紅細胞的血紅蛋白。Chesne C等[5]通過比較得到,Me2SO較甘油有更好的保護作用。然而有研究表明Me2SO對細胞膜有一定毒副作用,而利用非滲透性保護劑(如蔗糖,海藻糖等)與滲透性保護劑Me2SO聯合應用,不僅減小Me2SO的濃度,又能達到理想的低溫保存效果。Mohammed S等[6]在凍存人體原代肝細胞時添加Me2SO與Me2SO+葡萄糖這兩種保護劑,兩者對于復溫后的存活率沒有顯著性差異,但通過檢測相關指標得出利用后者保存后的肝功能更佳。目前,腫瘤細胞的低溫保存也有較多的報導,Sui L等[7]通過以人類卵巢癌細胞以及宮頸癌細胞為研究目標,得到海藻糖+Me2SO的最優保護劑配方。李慧等[8]探討季德勝蛇藥含藥血清對人肝癌細胞Hep-G2增殖和凋亡的影響。陳光等[9]利用10% Me2SO+高濃度血清的凍存液凍存胃腸道腫瘤組織原代細胞,成功率達到100%。由以上可以看出,對于不同種類的細胞,選擇合適的低溫保護劑,可以更好的保護細胞及其功能。
建立肝癌組織樣本庫,從中篩選肝腫瘤生物標志物,利用各種組學方法來早期診斷、預測肝癌,具有重要意義[10]。因此,本文以人肝癌細胞Hep-G2為研究對象,以不同濃度的甘油、Me2SO以及Me2SO聯合蔗糖、海藻糖作為低溫保護劑,通過對復溫后細胞的臺盼藍染色存活率、MTT存活率以及24 h貼壁率三種監測指標進行對比、顯著性分析等,探討了不同保護劑對Hep-G2細胞的保存效果,優化保護劑配方,從而進一步提高低溫保存Hep-G2細胞的存活率。
1 材料與方法
1·1 材料與試劑
實驗材料:人肝癌細胞Hep-G2(購于中科院)。
實驗試劑:HyClone胎牛血清(賽默飛世爾生物化學制品北京有限公司);Dulbecco’s Modified Eagle Medium培養基(DMEM)(GIBCO公司);臺盼藍染色液(2X),四唑鹽(MTT)(碧云天生物技術公司);二甲亞砜(Me2SO)(德國APPLICHEM公司);甘油(丙三醇)(BIOSHARP公司);蔗糖、海藻糖(中國醫藥集團上海化學試劑公司)。
1·2 儀器與設備
實驗儀器:二氧化碳培養箱(上海博訊實業有限公司);超低溫冰箱(青島海爾特種電器有限公司);低速臺式離心機(上海安亭科學儀器廠);程序降溫盒(賽默飛世爾生物化學制品北京有限公司)。
1·3 方法
1·3·1 細胞培養
吸除細胞培養瓶中的培養基(10%(v/v)胎牛血清+90%(v/v)DMEM培養基),加入5 mL的 DHanks液,沖洗細胞兩次,再加入2 mL的0.25%胰蛋白酶消化,之后于顯微鏡下觀察,當細胞呈現圓粒狀將要分離時,吸掉胰蛋白酶溶液,加4mL培養基終止消化。反復吹打瓶壁上殘留的細胞,并將已消化下來的細胞吹打均勻,然后吸入離心管中,1000 r/min離心10 min,吸除上清液,備用。
1·3·2 實驗分組
根據保護劑配方種類,實驗分為三組,第一組為Me2SO組,對應表1中編號1~3;第二組為甘油組,保護劑配方對應表1中編號4~6,第三組為不同保護劑組,對應表1中編號7~10。其中第三組的保護劑配方是根據第一、二組實驗結果,選擇Me2SO和丙三醇濃度,再配以蔗糖和海藻糖。將上述配好的凍存液各取3 mL,分別逐滴加入到處理好的細胞中,輕輕振搖混勻,在室溫下平衡5 min后,再將3 mL細胞懸液均分三份滴入3支凍存管中,并在各凍存管中標注細胞的組號。表1中編號0為對照組,未加入任何保護劑。
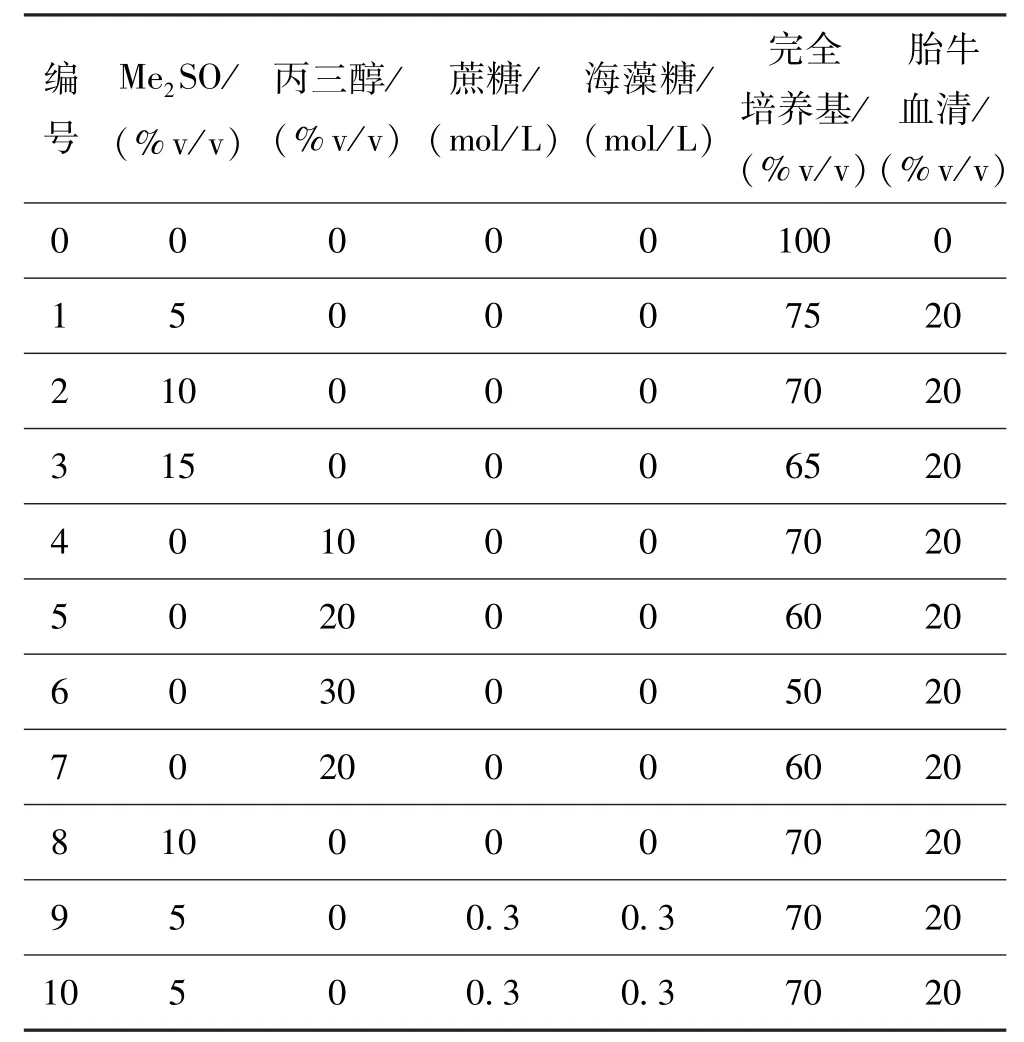
表1 保護劑分組Tab·1 The grouPof cryoprotectants
1·3·3 細胞凍存
將凍存管放入程序降溫盒中,再放入-80℃低溫冰箱中,根據程序降溫盒的參數,能實現的降溫速率為1℃/min。細胞在-80℃凍存7天。
1·3·4 細胞復蘇
一周后從低溫冰箱中取出凍存管,于37℃水浴中快速震蕩復溫,1000 r/min離心10 min并去除上清液,然后分別加入1mL培養基吹打均勻,制備成細胞懸液。
1·3·5 細胞檢測
1)臺盼藍染色檢測細胞存活率[11]
凍存前以及復溫后的細胞吹打混勻后,取100 uL 于2 mL離心管中,再加入100 uL臺盼藍染液染色,混勻后靜止3~5 min,吸取10 uL于血球計數板計數,分別記錄凍存前以及復溫后活細胞和死細胞數量。按以下公式計算細胞存活率:
細胞存活率(%)=

2)MTT檢測細胞活性[11]
每組實驗中,取復溫后的細胞懸液置于96孔培養板中,每種保護劑配方有三個平行,另加一組新鮮對照組(新鮮細胞且濃度接近于復蘇后細胞),一組完全培養基組;每孔加入100 uL,每組對應4個復孔,即第一、二組實驗共4×14孔,第三組實驗共4×17孔。待細胞鋪滿孔底后,每孔加入20 uL MTT,于37℃、5%CO2培養箱中避光孵育4 h,4000 r/min離心10 min,吸掉上清,每孔加入150 uLMe2SO,于37℃、5%CO2培養箱中孵育4 h后,置搖床上低速振蕩10 min,待結晶物充分溶解后,在酶聯免疫檢測儀OD490 nm處測量各孔的吸光值。按以下公式計算細胞存活率:
細胞存活率(%)=

3)24 h貼壁率
復溫后的細胞接種于細胞培養瓶中(500 uL),加入4.5 mL培養基后置于37℃、5%CO2培養箱中培養,24 h后換液并用D-Hanks液(2.5 mL)清洗兩次,收集上清液,計數未貼壁細胞;接著用胰酶消化后加入培養基,1000 r/min離心10 min,計數貼壁細胞。同時觀察培養肝細胞的生長情況及形態變化,按以下公式計算細胞貼壁率:
24 h貼壁率(%)=

1·4 數據分析
應用SPSS軟件對數據進行處理、統計以及顯著性分析。
2 結果與分析
2·1 me2SO組的細胞存活率、mTT存活率以及24 h貼壁率
凍存前,用臺盼藍染色得到細胞的存活率為(95.74±3)%。
對照組以及保護劑濃度(v/v)為5%、10%、15% 的Me2SO的細胞復溫后,存活率、MTT存活率以及24 h貼壁率結果如表2所示。
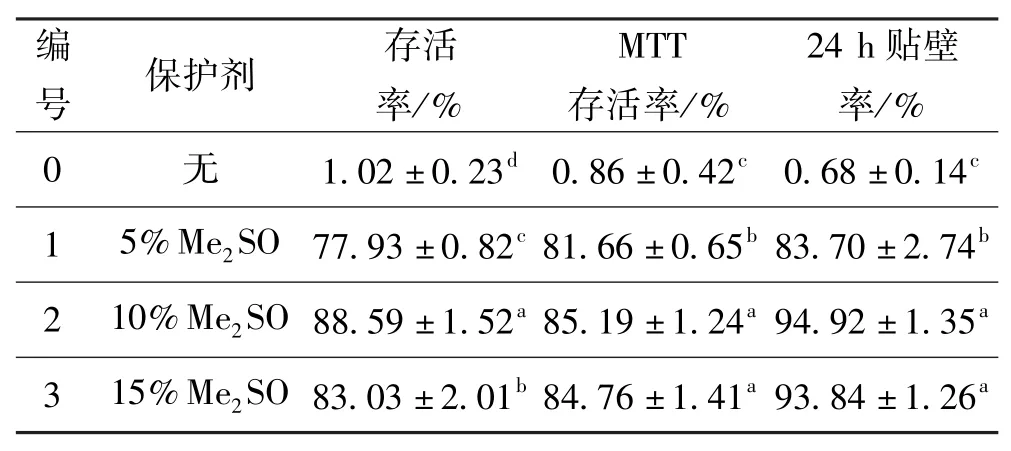
表2 保護劑為me2SO組的細胞復溫后存活率、MTT存活率以及24 h貼壁率Tab·2 Trypan blue dye exclusion test,MTT assay and the attached rations after 24 h of cellwith me2SO(cryoprotectant)
從表2中可以得出,三個實驗組的細胞存活率,MTT存活率以及24 h貼壁率與對照組(編號0)相比,均有顯著性差異(P<0.05),說明加入5%~15%(v/ v)Me2SO的低溫保護劑能夠顯著提高細胞的存活率。10%(v/v)Me2SO(編號2)組的細胞存活率,MTT存活率以及24 h貼壁率都較5%組高,且均具有顯著性(P<0.05);而10%(v/v)Me2SO的MTT存活率以及24 h貼壁率與15%組相比,略高但無顯著性差異(P>0.05),而細胞存活率差異有顯著性(P<0.05)。綜上所述:添加10%(v/v)Me2SO的低溫保護劑,對人肝癌細胞Hep-G2能產生較好的保護作用。
2·2 甘油組的細胞存活率、MTT存活率以及24 h貼壁率
凍存前,用臺盼藍染色得到細胞的存活率為(96.66±2)%。對照組及保護劑濃度(v/v)為10%、20%、30%的甘油的細胞復溫后,細胞存活率、MTT存活率以及24 h貼壁率結果如表3所示。
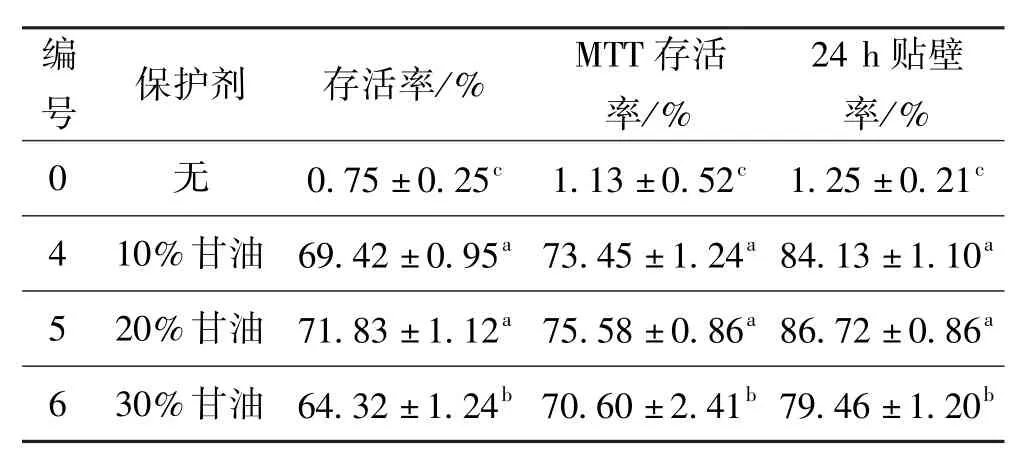
表3 保護劑為甘油組的細胞復溫后存活率、MTT存活率以及24 h貼壁率Tab·3 Trypan blue dye exclusion test,mTT assay and the attached rations after 24 h of cell with glycerol(cryoprotectant)
從表3中可以得出,三個實驗組的細胞存活率,MTT存活率以及24 h貼壁率與對照組(編號0)相比均有顯著性差異(P<0.05),這說明加入10%~30% (v/v)甘油的低溫保護劑能夠顯著提高細胞的存活率。20%(v/v)甘油(編號5)組的細胞存活率,MTT存活率以及24 h貼壁率都較30%(v/v)高,且均具有顯著性(P<0.05);而略高于10%組,且無顯著性差異(P>0.05)。綜上所述:添加20%(v/v)甘油的低溫保護劑的凍存效果與10%(v/v)甘油相近但稍好,對人肝癌細胞Hep-G2能產生較好的保護作用。
2·3 復方保護劑組的細胞存活率、MTT存活率以及24 h貼壁率
從前兩組實驗中分別選擇最優保護劑,從而進行第三組復方保護機組實驗。
凍存前,用臺盼藍染色得到細胞的存活率為(95.06±2)%對照組及實驗組(保護劑分別為20% (v/v)甘油、10%(v/v)Me2SO、5%(v/v)Me2SO+0.3 mol/L蔗糖、5%(v/v)Me2SO+0.3 mol/L海藻糖)的細胞復溫后,存活率、MTT存活率以及24 h貼壁率結果如表4所示。
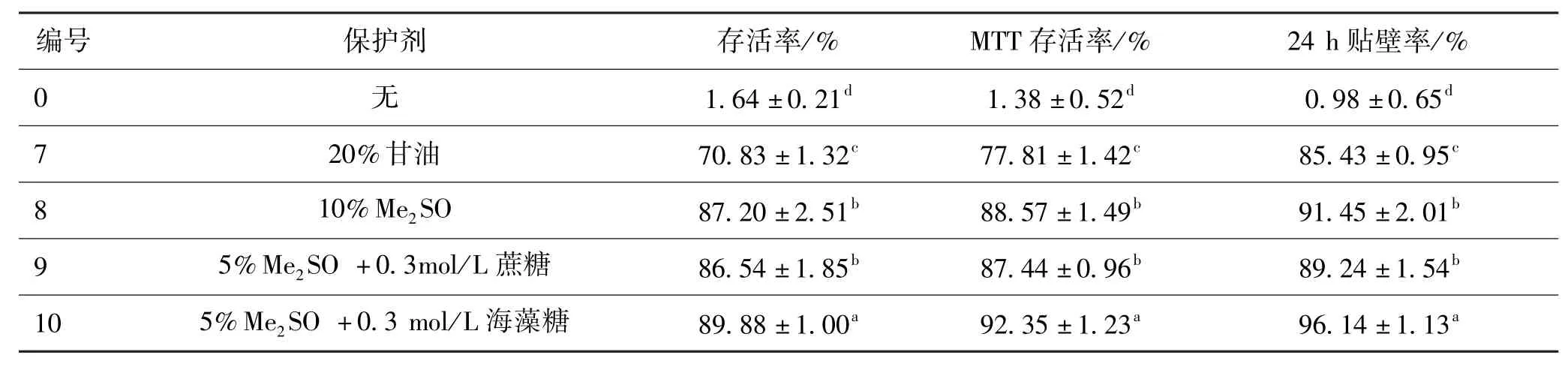
表4 不同保護劑的細胞復溫后存活率、MTT存活率以及24 h貼壁率Tab·4 Trypan blue dye exclusion test,MTT assay and the attached rations after 24 h of cellwith different cryoprotectant
從表4中可以得出,四個實驗組的細胞存活率,MTT存活率以及24 h貼壁率與對照組(編號0)相比,均有顯著性差異(P<0.05),這說明低溫保護劑對細胞的低溫保存有一定作用。
20%(v/v)甘油組(編號7)無論是細胞存活率,MTT存活率以及24 h貼壁率都低于其他三組實驗組,這說明在這四種保護劑凍存細胞中,20%(v/v)甘油組的凍存效果最差。10%(v/v)Me2SO組(編號8),無論是細胞存活率,MTT存活率以及24 h貼壁率,都略高于Me2SO+蔗糖(編號9)但差異不顯著(P>0.05),這說明兩組實驗凍存效果接近,但10% (v/v)Me2SO的凍存效果略好于Me2SO+蔗糖;由此得出:通過降低Me2SO濃度(v/v)加入蔗糖的低溫保護劑起到一定的保護作用,但保護效果并不如10% (v/v)Me2SO。而10%(v/v)Me2SO(編號8),無論是細胞存活率,MTT存活率以及24 h貼壁率,都低于Me2SO+海藻糖(編號10),這說明Me2SO+海藻糖的凍存效果優于10%(v/v)Me2SO,即Me2SO與海藻糖的聯合保護作用優于Me2SO的單獨作用。
3 討論
目前,臺盼藍染色法做為最常用的檢測細胞死活的方法之一,其原理是喪失活性或是細胞膜不完整的細胞由于膜的通透性增加,可被臺盼藍染成藍色;通常認為細胞膜完整性喪失,即可認為細胞已經死亡[11]。四唑鹽比色法(MTT)是利用活細胞線粒體中的琥珀酸脫氫酶可將噻唑藍(MTT)還原成紫藍色(Formazan)顆粒的原理,而二甲基亞砜(DMSO)能溶解細胞中的紫色結晶物,用酶聯免疫檢測儀在490 nm波長處測定其光吸收值,從而間接反映活細胞數量[11]。然而,在MTT染色的過程中有的細胞雖有細胞膜的損害,但仍有酶的活性,仍屬于“活細胞”,不能存活下去;并且臺盼藍染色法的誤差偏大。所以這兩種方法聯合應用能更全面地反映細胞活性[12]。24 h貼壁率是檢測細胞復溫后,在24 h內的存活以及貼壁能力的一種方法;與前面兩種方法不同的是,它著重于細胞復溫培養后的存活能力。
細胞在降溫過程中,胞外溶液會先結冰,由于冰晶的形成使細胞外的溶液濃度增大,導致細胞脫水收縮,引起細胞內原生質和細胞器的損傷。添加滲透性保護劑(如甘油、Me2SO等)后,通過結合溶液中的水分子從而弱化了水的結晶過程,達到了保護細胞的目的。保護劑濃度的不同以及細胞膜滲透能力的差異等,都會影響著細胞的凍存效果。所以本文通過前人的實驗總結,針對Hep-G2細胞,篩選出最優的低溫保護劑。
甘油作為最早發現以及使用的低溫保護劑[1],60多年來仍然被應用在細胞的低溫保存中,而甘油的濃度對低溫保存效果有著重要的影響。華澤釗等[13]利用濃度為15%(v/v)的甘油凍存表皮細胞,得到92%的存活率;郝愛玲等[14]利用濃度為4%(v/ v)的甘油對鮮精低溫保存的效果達到最好,由此可見不同的細胞在低溫保存中對甘油的濃度要求并不相同。本文選用10%、20%、30%三種常用的甘油低溫保護劑濃度,研究得到20%(v/v)甘油濃度對Hep-G2細胞低溫保存效果最佳。
Me2SO作為滲透型保護劑,是凍存肝細胞最常用的保護劑[15],常用濃度(v/v)為5%~20%。楊波等[16]利用濃度為10%(v/v)的Me2SO凍存人肝細胞,存活率達到89.95%;Andre Guillouzo等[17]通過配比不同濃度的Me2SO得出:凍存老鼠肝細胞的Me2SO最佳濃度(v/v)為16%,其他動物為14%,而人肝細胞的Me2SO濃度(v/v)為10%~12%。本文基于前人對于肝細胞的研究基礎,選用的Me2SO濃度(v/v)為5%~20%,得到10%(v/v)Me2SO的凍存效果最優。
糖類作為非滲透型保護劑,近些年越來越廣泛的應用于低溫保存中。當滲透性保護劑滲入細胞后,與細胞內的水分子結合,通過控制結晶過程而達到保護作用;而非滲透型低溫保護劑雖然不能進入細胞內,但可形成細胞外的高滲,減少胞內冰的形成,雖然兩者機制不同,合用可以產生協同效應,因此目前一致認為,非滲透型和滲透型保護劑混合使用的保護效果最好。并且有文獻顯示,糖類添加到低溫保護劑中,會產生更好的保存效果。阿洛糖作為一種罕見的單糖,在某些人類細胞的保存連同Me2SO加入后,復溫后的存活率有所提高[7];Me2SO中加入一定濃度的海藻糖可以提高胰島細胞的存活率[18];在人肝細胞的低溫保存中,在保護劑Me2SO中添加不同濃度的蔗糖與海藻糖,分別得到Me2SO+蔗糖、Me2SO+海藻糖的最佳濃度配比[16]。而本文選用蔗糖、海藻糖這兩種常用的糖類作為保護劑添加到Me2SO中,一方面可以通過降低Me2SO的濃度來減小對細胞的毒性[19],另一方面利用糖類對細胞膜的保護性。與蔗糖相比,海藻糖具有較高的玻璃化溫度、更低的引濕性、并不具有還原性,所以在低溫保護劑中應用更好。因而實驗數據得出濃度為 5%(v/v)Me2SO+0.3 mol/L海藻糖的凍存效果最佳;雖然濃度為5% (v/v)Me2SO+0.3 mol/L蔗糖的凍存效果不如濃度為10%(v/v)Me2SO,但兩者差異并不顯著,這說明蔗糖仍起到一定的保護作用。實際上,海藻糖的濃度將影響保存效果,濃度過高會抑制細胞表面分子(酶等)活性、減少Me2SO(滲透型保護劑)進入胞內、引起滲透性胞內脫水;而濃度過低起到的作用效果不夠明顯,所以選擇最優的海藻糖濃度還有待更多的探討。
4 結論
本文以人肝癌細胞Hep-G2為研究對象,利用慢速冷凍的低溫保存程序,選取了不同濃度的Me2SO、甘油以及一定濃度的Me2SO聯合蔗糖、海藻糖作為低溫保護劑,對比復溫后細胞的存活率和24 h貼壁率,結果表明:添加濃度為5%(v/v)Me2SO+0.3 mol/L海藻糖的細胞,復溫后臺盼藍染色存活率、MTT存活率以及24 h貼壁率分別達到89.88%、92.35%、96.14%,高于其他保護劑組,并且差異顯著。所以濃度為5%(v/v)Me2SO+0.3 mol/L海藻糖的保護劑凍存效果最佳。
[1] 華澤釗,任禾盛.低溫生物醫學技術[M].北京:科學出版社,1995:150-152.
[2] Watts P,Grant mH.Cryopreservation of rat hepatocyte monolayer cultures[J].Human&Experimental Toxicology,1996,15(1):30-37.
[3] Polge C,SmithAU,ParkesAS.Revival of spermatozoaafter vitrification and dehydration at low temprature[J]. Nature,1949,164:666.
[4] Jolanta K,Agnieszka G,Agnieszka R,etal.Evaluation of two distinct cryoprotectants for cryopreservation of human red blood cell concentrates[J].Cryoletters,2014,35 (1):15-21.
[5] Chesne C,Guillouzo A.Cryopreservation of isolated rat hepatocytes:A critical evaluation of freezing and thawing conditions[J].Cryobiology,1988,25(4):323-330.
[6] Mohammed S,Frida H,BergstromT R,et al.Improved cryopreservation of human hepatocytes usingAnew xenofree cryoprotectant solution[J].World Journal of Hepatology,2012,4(5):176-183.
[7] Sui L,Nomura R,Dong Y,etal.Cryoprotective effects of d-allose on mammalian cells[J].Cryobiology,2007,55 (2):87-92.
[8] 李慧,姚建華,田芝奧,等.季德勝蛇藥含藥血清對人肝癌細胞Hep-G2增殖和凋亡的影響[J].中西醫結合肝病雜志,2012,22(1):32-37.(Li Hui,Yao Jianhua,Tian Zhi’ao,et al.Effects of Jidesheng Sheyaomedicated serumon proliferation and apoptosis of human hepatocellular carcinoma cell Hep-G2[J].Combine Traditional Chineseand Western Medicine Liver Disease,2012,22(1): 32-37.)
[9] 陳光,蔡慧云,魏曉軍,等.胃腸道腫瘤凍存組織原代細胞培養的實驗研究[J].臨床軍醫雜志,2011,39 (4):605-607.(Chen Guang,Cai Huiyun,Wei Xiaojun,et al.Study on primary cell culture of gastroenteriCcancer tissues after cryopreservation[J].Clinical Journal of Medical Officer,2011,39(4):605-607.)
[10]王晨,衛建平,李育民.建立標準化規范化腫瘤生物樣本庫是轉化醫學的重要保障[J].中國藥物與臨床,2013,13(9):1176-1178.(Wang Chen,Wei Jianping,Li Yumin.EstablishAstandardized tumor biological sample library is the important guarantee of translationalmedicine [J].Chinese Remedies&Clinics,2013,13(9):1176-1178.)
[11]司徒鎮強.細胞培養[M].北京:世界圖書出版社,2004:3.
[12]成惠林,王袆芳,史繼新,等.用四甲基偶氮唑鹽比色法測定5種冷凍保存液對大鼠垂體細胞的保存效果[J].江蘇醫藥,1998,24(5):329-330.(Cheng Huilin,Wang Huifang,Shi Jixin,et al.With tetramethyl azo azole salt colorimetry determination of five kinds of cryopreservation on the preservation effectof the rat pituitary cells [J].Jiangsu Medical Journal,1998,24(5):329-330.)
[13]華澤釗,馮世杰.皮膚低溫保存的方法和工藝研究[J].中國生物醫學工程學報,1991,10(2):118-126. (Hua Zezhao,Feng Shijie.Skin cryopreservation method and technology of the research[J].Chinese Journal of Biomedical Engineering,1991,10(2):118-126.)
[14]郝愛玲,阿淑艷,鄭偉.不同甘油濃度對牛鮮精低溫保存的影響[J].中國奶牛,2007(10):33-34.(Hao Ailing,A Shuyan,Zheng Wei.The influence of different glycerol concentration of NiuXian spermcryopreservation [J].China Dairy Cattle,2007(10):33-34.)
[15]Naik S,Santangini H A,Trenkler D M,et al.Functional recovery of porcine hepatocytes after hypothermiCor cryogeniCpreservation for liver support systems[J].Cell Transplantation,1997,6(5):447-454.
[16]楊波,周燕,劉寶林,等.肝細胞低溫保存的實驗研究[J].中國生物醫學工程學報,2011,30(2):308-311. (Yang Bo,Zhou Yan,Liu Baolin,et al.Studies on cryopreservation of cryopreservation of human hepatocytes[J]. Chinese Journal of Biomedical Engineering,2011,30(2): 308-311.)
[17]Andre G,Laure R,Alain F.Survival and function of isolated hepatocytes after cryopreservation[J].Chemico-Biological Interactions,1999,121(1):7-16.
[18]Beattie G M,Crowe JH,LopezAD,et al.Trehalose:A cryoprotectant that enhances recovery and preserves function of human pancreatiCislets after long-termstorage[J]. Diabetes,1997,46(3):519-23.
[19]Li Y,Lu R H,Luo G F,et al.Effects of different cryoprotectants on the viability and biological characteristics of porcine preadipocyte[J].Cryobiology,2006,53(2): 240-247.
Study on Cryopreservation of Human Hepatoma Hep-G2 Cell
Yao Lan Liang Wei Liu Baolin
(Institute of Biothermal and Technology,University of Shanghai for Science and Technology,Shanghai,200093,China)
It iswell known that the type and concentration of cryoprotectant(CPAs)exertsAsignificant influence on the survival rate of cells following cryopreservation.The optimal cryoprotectant for human hepatoma Hep-G2 cell with slow coolingmethod was determined in the study.The Cells were frozen in Me2SO,glycerol,sucrose and trehalose at different concentration and combination,then stored inA-80℃ freezer for one week.The survival rate was assessed by trypan blue dye exclusion test,MTT assay and 24 h attachment assay. The results suggested that10%(v/v)Me2SO provide effective protection among Me2SO groups;20%(v/v)glycerol provide effective protection among glycerol groups;when sugars were added,5%Me2SO(v/v)+0.3 mol/L trehalose provide effective protection than the other groups(P<0.05).In conclusion,5%Me2SO(v/v)+0.3 mol/L trehalose was the presumptive optimal cryoprotectant for human hepatoma Hep-G2 cell during slow freezing.
cryopreservation;cryoprotectants;sugar;viability
TK124;R318.52
A
0253-4339(2015)02-0095-06
10.3969/j.issn.0253-4339.2015.02.095
簡介
劉寶林,男,教授,博士,上海理工大學醫療器械與食品學院,13636524955,E-mail:blliuk@163.com。研究方向:低溫生物。About the corresponding author
國家自然科學基金(51076108)資助項目。(The projectwas supported by the National Natural Science Foundation of China(No. 51076108).)
2014年7月7日
Liu Baolin,male,Ph.D./professor,College of Medical Equipment and Food,University of Shanghai for Science and Technology, +86 13636524955,E-mail:blliuk@163.com.Research fields:cryobiology.

