IVF-ET 前使用脫氫表雄酮對卵巢儲備功能低下患者妊娠結局影響的系統評估
董娟,徐望明,董蘭,解美婷,陳明明
(武漢大學人民醫院生殖中心,武漢 430000)
卵巢儲備功能是指卵巢皮質形成可受精的卵母細胞的能力,主要由卵巢內的竇卵泡數目及其質量決定。隨著當今社會及就業壓力的加大,女性的生育年齡不斷推后,卵巢儲備功能低下(DOR)成為影響女性成功妊娠的一個重要因素。同樣DOR 患者在進行IVF助孕時,其臨床妊娠率不高也是目前一大難題。研究表明,DOR 患者在體外受精中占9%~24%[1]。近年來,隨著脫氫表雄酮(DHEA)在生殖領域應用的研究不斷增多。在輔助生殖技術中,聯合應用DHEA 對改善DOR 患者妊娠結局的研究也不斷增多,Yeung等[2]通過一項隨機雙盲安慰劑對照試驗,指出DHEA 能夠顯著增加基礎竇卵泡數(AFC),改善卵巢儲備功能。另有眾多學者[3-4]認為口服DHEA 能提高卵巢對促性腺激素(Gn)的敏感性,可以改善卵巢的反應性,臨床妊娠率也高于不服用者。也有學者[5-6]提出不同的意見,即:卵巢低反應患者口服DHEA 預治療不能提高臨床妊娠率及活產率。為探討DHEA 能否有效的改善DOR患者的妊娠結局,本文采用Meta分析對目前已經發表并且質量相對較高的文獻進行分析,比較在進入IVF周期前,DOR 患者聯合口服DHEA 與不服用或者服用安慰劑患者在妊娠結局上的差異性,進而來評價DHEA 的預處理,對改善DOR 患者妊娠結局的有效性。
資料與方法
一、檢索策略
計算機檢索中國知網、萬方、維普等中文數據庫及PUBMED、CBMDISC、MEDLINE、Elsevier等英文數據庫中的文獻。檢索截止時間2014年10月,中文檢索詞為:脫氫表雄酮;體外受精,卵巢低反應,隨機,對照;英文檢索詞為:dehydroepiandrosterone(DHEA),Diminished ovarian reserve,IVF,randomization,control。文獻檢索策略采用計算機網絡檢索系統進行關鍵詞檢索。
二、文獻篩選和資料提取及質量評價
1.文獻篩選和資料提取:由2名評價者獨立瀏覽文獻題目及摘要、選擇相關文獻、提取資料并交叉核對,意見不一致時通過討論或征求第3名評價者意見解決。提取的資料包括一般資料、方法學、基線情況、干預措施、分析方法及研究結果。
2.文獻質量評價:質量評價標準參考Cochrane library有關質量評價的要求標準,包括以下6 條:(1)隨機方法是否正確;(2)分配是否做到隱藏;(3)是否采用盲法;(4)基線是否具有均衡性;(5)有無失訪、退出,失訪率是否超過20%;(6)如有失訪和退出,兩組失訪人數是否均衡,是否采用ITT(intention to treat)分析。將納入的文獻按以上標準分為A、B、C 三級,其中完全滿足以上標準,發生各種偏倚的可能性最小,為A 級;部分滿足上述標準,發生偏倚的可能性為中度,為B 級;完全不滿足以上標準,發生各種偏倚的可能性為高度,為C級。
三、納入標準
1.研究類型:納入2014年10月之前已經完成并已經發表的有關DHEA 在輔助生殖技術中改善DOR 患者妊娠結局的臨床隨機對照試驗(RCT)及回顧性研究,文種限制在中文及英文。
2.研究對象:因DOR 行IVF-ET 的不孕女性,納入女性的年齡,不孕年限無顯著性差異。
3.干預措施:研究組在促排卵進入周期前先口服DHEA,治療劑量及療程不限,對照組不予以處理或者口服安慰劑。所有入選患者采用標準長方案、短方案或者拮抗劑方案,達到降調標準后給予Gn,當主 導 卵 泡>18 mm 時,給 予HCG 5 000-10 000IU/L 刺激,24~36h取卵,根據男方的精液情況,選擇IVF/ICSI受精方式,取卵后第2~3 天進行胚胎移植,后期繼續黃體支持,在移植后第12天左右檢測血β-HCG≥10IU/L即為生化妊娠,移植后第30天超聲提示可見孕囊、胚芽及胎心搏動則為臨床妊娠。
四、排除標準
1.數據無法利用的文獻
2.會議報告、綜述、指南
3.重復報道及重復發表的文獻
4.曾接受雄激素或DHEA 治療
(2)堅持先有實踐,后有立法規范。堅持問題導向和有效實用原則,出臺有關法律法規應有針對性,避免大而全、空而不實。在立法條件尚不成熟的情況下,可以考慮通過政府部門發布具體行業指南加以引導,規范發展,為立法積累經驗和依據。積極學習借鑒發達國家人工智能立法經驗,但決不能照抄照搬。各國國情不同、文化傳統不同,對待人工智能態度并不相同,采取的法律實踐不同。對此,應結合我國實情,制定相關法律規范,指導和規范人工智能技術的發展和應用。
5.男性重度少、弱、畸精子癥
6.子宮內膜異位癥、生殖器畸形、高泌乳素血癥和多囊卵巢綜合征及其他內分泌疾病
五、測量指標
1.主要指標:臨床妊娠率
2.次要指標:HCG 日E2值、HCG 日子宮內膜厚度、Gn總用量、獲卵數、移植胚胎數、周期取消率
六、統計分析
本研究采用RevMan 5.1軟件。所有評價指標都給出95%CI,檢驗水準取α=0.05。文獻間異質性檢驗用卡方檢驗,以P<0.05表示差異具有統計學意義。同時采用I2判斷異質性,當I2>50% 時,認為納入研究間存在較大異質性。對無異質性的數據采用固定效應模型;有異質性者,分析異質性產生的原因,并用亞組分析和敏感性分析處理,對無法消除異質性的文獻用隨機效應模型合并分析或僅作描述性分析。
結 果
一、檢索結果及方法學質量評價結果
計算機檢索中英文相關文獻共250篇,經閱讀題目及摘要,初篩出31篇文獻,然后查找全文及閱讀全文,排除26篇文獻,其中不符合納入標準的有16篇,自身對照研究的有5篇,重復發表的有1篇,數據不可用的有2篇,回顧性對照研究2篇,最后共納入RCT 5篇,共532名患者。納入研究的一般情況及方法學質量評價結果見表1和表2。
二、統計分析主要指標
臨床妊娠率:4項研究報道了臨床妊娠率,各項研究間經檢驗不存在異質性(P=0.25;I2=26%),采用固定效應模型進行分析,其結果為:口服DHEA 組患者與未服用組患者臨床妊娠率有差異,但差異沒有統計學意義[RR=1.32,95%CI(0.91,1.90),P=0.14](圖1),口服DHEA 不能提高臨床妊娠率,同時分析漏斗圖不對稱,存在發表偏移(圖2)。
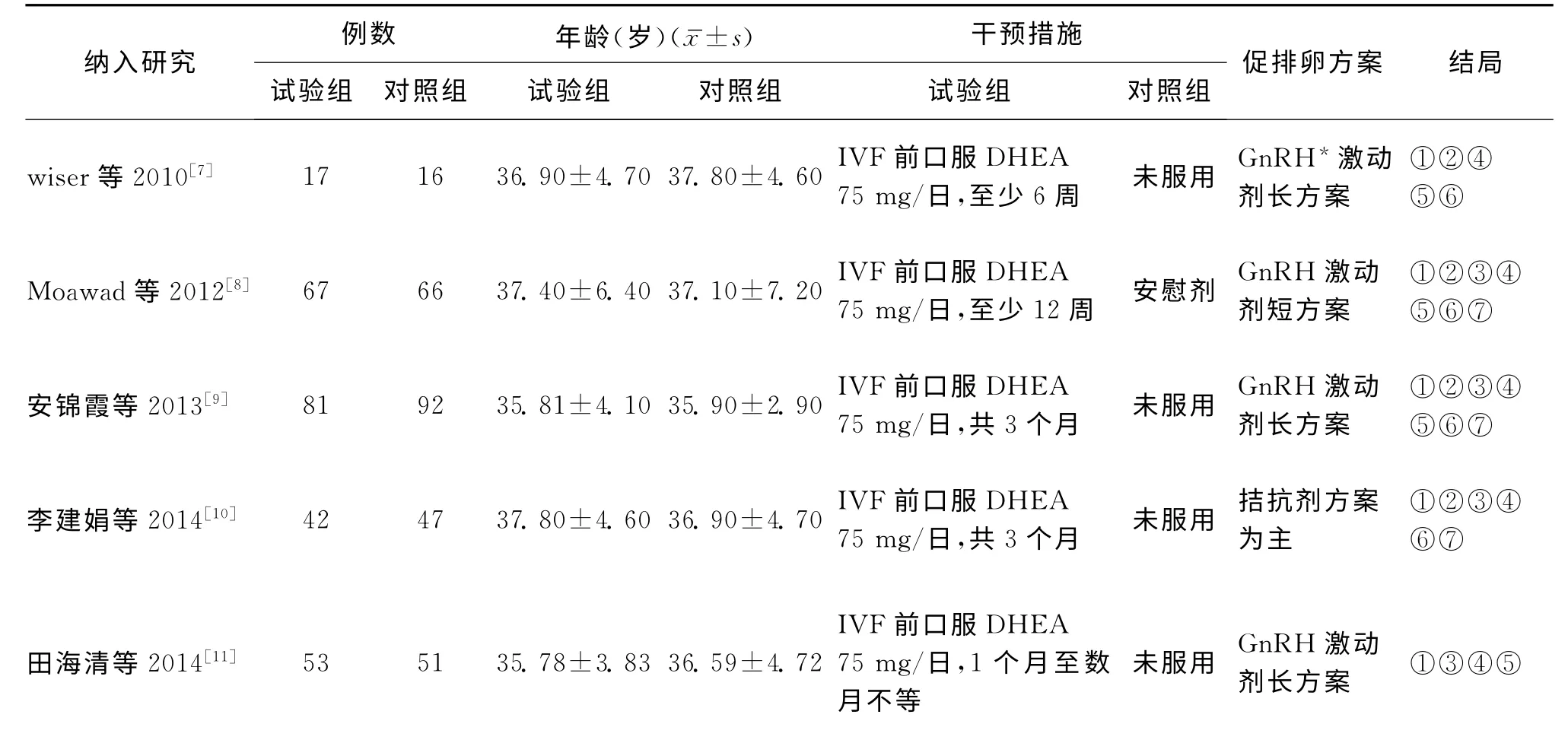
表1 納入研究基本情況比較

表2 納入研究的質量評價
三、統計分析次要指標
2.HCG 日子宮內膜厚度(mm):4 項研究報道了HCG 日子宮內膜厚度,各項研究間經檢驗存在異質性(P<0.0001;I2=87%,采用隨機效應模型進行分析,其結果為:口服DHEA 組患者與未服用組患者HCG 日內膜厚度差異不具有統計學意義[MD=0.77,95%CI(-0.35,1.89),P=0.18](圖5)。研究間的異質性可能與納入樣本量少有關,并且漏斗圖分析存在發表偏倚。
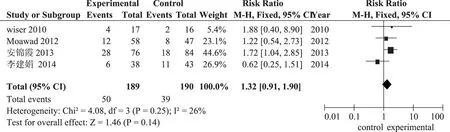
圖1 口服DHEA 組與對照組臨床妊娠率的比較
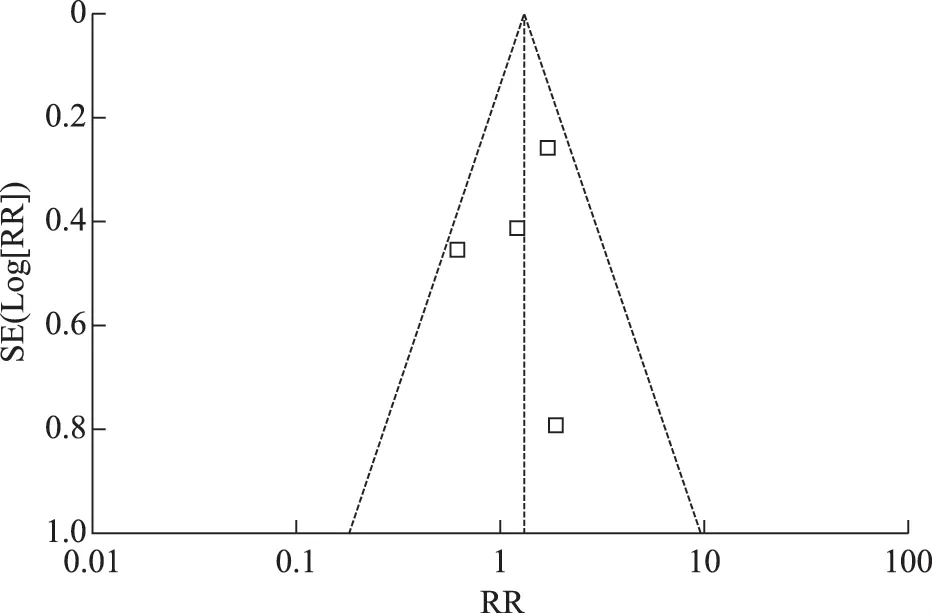
圖2 口服DHEA 組與對照組臨床妊娠率漏斗圖
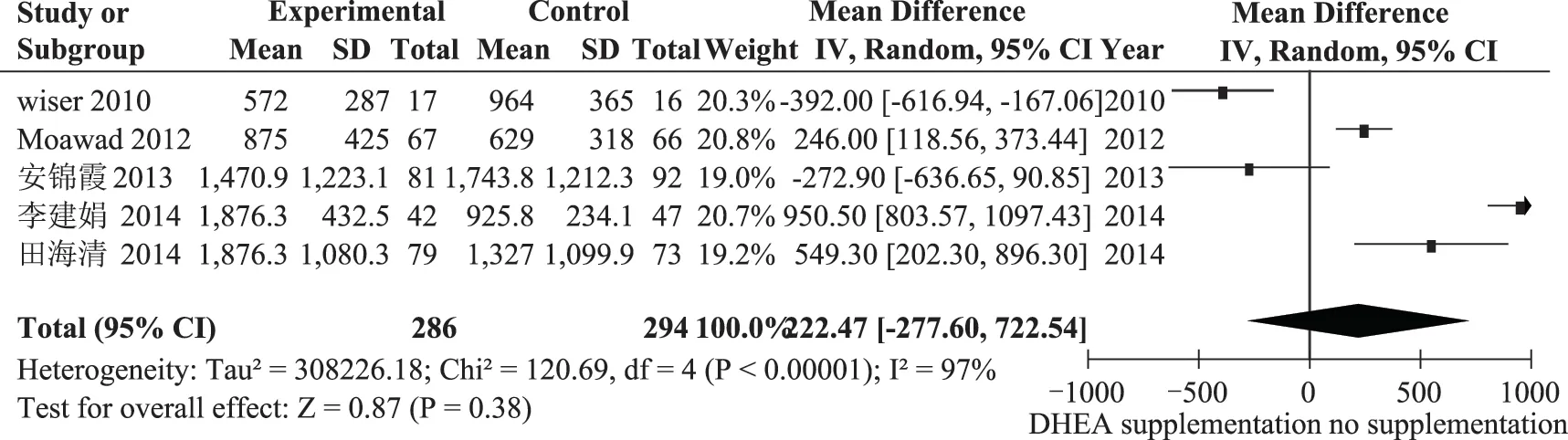
圖3 口服DHEA組與對照組HCG日E2值的比較
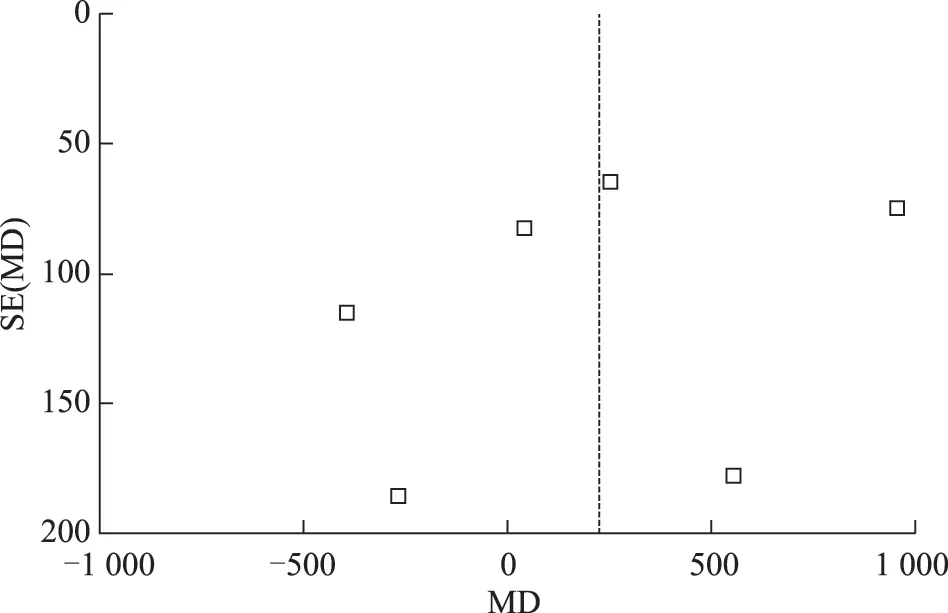
圖4 口服DHEA組與對照組HCG日E2 值漏斗圖
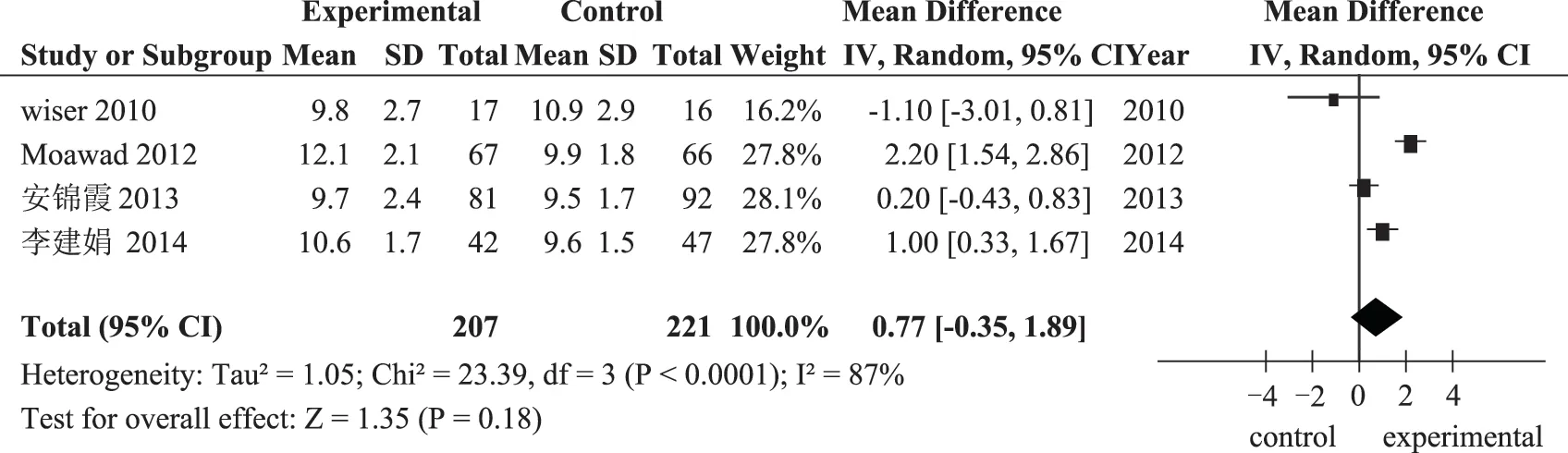
圖5 口服DHEA組與對照組HCG日子宮內膜厚度的比較
3.Gn總用量:4項研究均報道了Gn總用量,各項研究間經檢驗存在異質性(P<0.00001;I2=93%),采用隨機效應模型進行分析,其結果為:口服DHEA 組患者與未服用組患者Gn總用量差異具有統計學意義[MD=-528.58,95%CI(-992.59,-64.56),P=0.03](圖6),口服DHEA 組Gn 總用量明顯低于對照組。各項研究間異質性較大的原因可能是超促排卵方案存在差異。
4.獲卵數:5項研究均報道了獲卵數,各項研究間經檢驗存在異質性(P=0.001;I2=78%),采用隨機效應模型進行分析,其結果為:口服DHEA 組患者與未服用組患者獲卵數差異具有統計學意義[MD=1.27,95%CI(0.26,2.29),P=0.01](圖7),口服DHEA 組獲卵數明顯高于對照組。異質性的原因可能與納入文獻質量有關,偏倚分析漏斗圖表現不對稱,存在發表偏倚(圖8)。
5.移植胚胎數:4項研究報道了移植胚胎數,各項 研 究 間 經 檢 驗 存 在 異 質 性(P <0.00001;I2=89%),采用隨機效應模型進行分析,其結果為:口服DHEA 組患者與未服用組患者移植胚胎數差 異 不 具 有 統 計 學 意 義[MD =0.32,95%CI(-0.23,0.87),P=0.26](圖9)。各項研究間的異質性可能是種族人群的差異,對超促排卵藥物反應的差異性,漏斗圖表現不對稱,存在發表偏倚。
6.周期取消率:3項研究報道了周期取消率,各項 研 究 間 經 檢 驗 不 存 在 異 質 性(P =0.32;I2=13%),采用固定效應模型進行分析,其結果為:口服DHEA 組患者與未服用組患者周期取消率有差異,但差 異 不 具 有 統 計 學 意 義[RR =0.64,95%CI(0.38,1.09),P=0.10](圖10),漏斗圖分析表現不 對稱,存在發表偏倚。
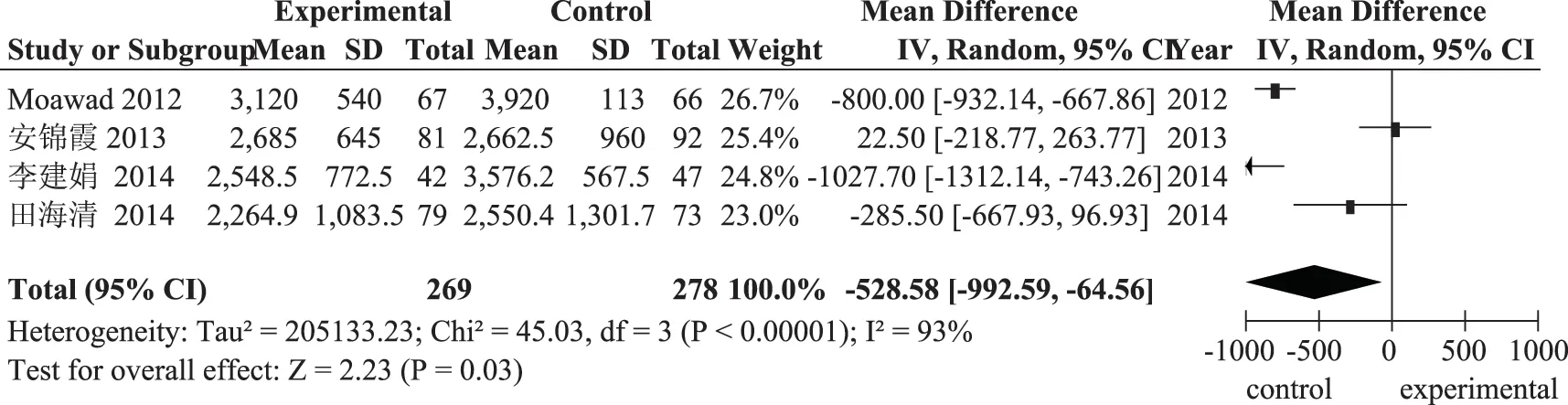
圖6 口服DHEA 組與對照組Gn總用量的比較

圖7 口服DHEA 組與對照組獲卵數的比較
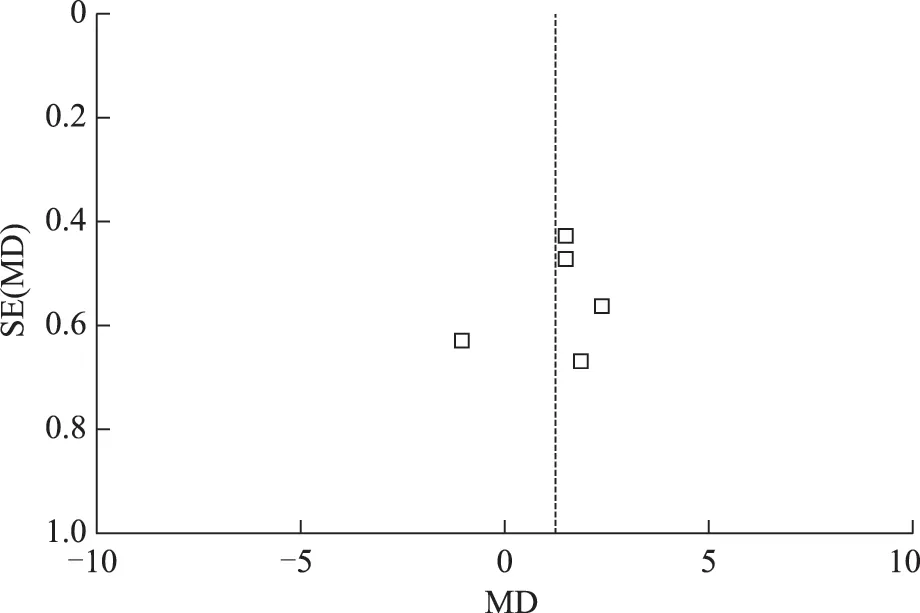
圖8 口服DHEA 組與對照組獲卵數比較

圖9 口服DHEA 組與對照組移植胚胎數的比較

圖10 口服DHEA 組與對照組周期取消率的比較
討 論
本研究結果顯示,DOR 患者進入IVF 周期前口服一定劑量的DHEA 較不服用或者服用安慰劑者周期獲卵數增加,Gn 總用量減少并且差異具有統計學意義(P<0.05),但是臨床妊娠率沒有提高(P=0.14)。DHEA 是人體血循環中含量最豐富的甾體物質,具有弱雄激素作用,在外周組織主要轉化為睪酮和雌二醇發揮間接生物效應。DHEA 在血循環中的含量隨年齡的增長不斷下降,20~30歲其濃度達到最高值,30歲以后不斷下降,到80歲時達到最低值[12]。DHEA 是卵泡內類固醇激素合成的重要前體激素,在中樞神經系統以及代謝、免疫、血管、血脂等方面也有作用,賈悅等[13]總結出DHEA也可能具有改善骨質代謝、預防骨質疏松的作用。但是其具體的生理作用及在卵巢中的作用機制到目前為止還未闡明。Casson等[3]首次將DHEA 應用到生殖領域,創新性地開展了在輔助生殖技術中聯合 應 用DHEA。隨 后Barad 等[14]連 續 幾 年 對DHEA 在生殖領域的作用進行研究,認為DHEA能提高受精卵母細胞數及胚胎數,并且能夠提高卵母細胞和胚胎的質量。之后進行的一項大樣本的病例對照研究[15]結果顯示:在DOR 患者中聯合應用DHEA 組的臨床妊娠率較對照組顯著升高(P<0.05),周期取消率及流產率較對照組降低(P>0.05)。王雅琴等[16]也提出對卵巢反應不良行試管助孕患者額外補充雄激素或其調節劑能夠提高臨床妊娠率、減少Gn 用量,有益于妊娠結局。然而,Bosdou等[5]對雄激素及其調節劑在卵巢低反應患者中的應用進行了系統性評價并指出,睪酮透皮貼劑可以提高卵巢低反應患者的妊娠結局,但是DHEA 預處理與妊娠結局無關。本研究納入的文獻均為近幾年的報道,獲得的結果與Bosdou 等[5]的研究結果基本一致。DHEA 不能提高DOR 患者的臨床妊娠率,但是在一定程度上可以提高DOR患者的卵巢反應性,相比對照組表現為促排卵藥物使用總量減少(P=0.03),獲卵數增多(P=0.01)。
目前一項對全球45個國家的196個IVF 中心的調查指出,有超過四分之一(25.8%)的生殖中心在進入IVF周期前聯合使用DHEA 并且有一定的效果[17]。在國外DHEA 作為絕經后婦女激素替代治療輔助用藥已廣泛用于臨床,在美國DHEA 已經作為保健品進入食品市場[18]。目前有關服用DHEA 的副反應報道比較少,主要表現為痤瘡、面部毛發生長、聲音低沉等體征[19]。另外有文獻指出DHEA 作為類固醇激素的前體,其可能增加雌激素或者雄激素依賴的惡性腫瘤的風險[20],但迄今缺少此類報道。在服用DHEA 的時間上,美國紐約的人類生殖中心建議[21],DOR 患者應至少服用DHEA 6周,年輕者可適當延長。但是目前仍缺乏相關RCT 數據來確定臨床上使用DHEA 的劑量及持續時間。本項研究所納入的文獻中,DHEA 使用劑量均為75mg/d,無不良反應,用藥持續時間上有差異,但均超過6周。雖然本研究指出,口服一定劑量的DHEA 較不服用或者服用安慰劑者臨床妊娠率沒有統計學差異,但由于納入的研究比較少、樣本量不大、未控制混雜因素對結局的影響,所以需要進一步的研究來證實結論。在本項研究所納入的文獻中,有多個次要指標出現很大的異質性,其原因可能是納入樣本之間存在差異,如:種族人群的差異;另外在促排卵方案的選擇及DHEA 預處理的時間上也存在差異,從而導致本系統性評價結論的合理性存在質疑。考慮到相關的隨機對照研究甚少,再進行臨床異質性的調查意義也將不大。另外就目前獲得的一些文獻數據分析,部分文獻[3-4]提示DOR 患者服用DHEA 有一定的療效,部分文獻[5-6]提示DOR 患者服用DHEA 沒有改善妊娠結局,本Meta分析研究結果提示DHEA 輔助治療可以改善卵巢儲備功能,提高DOR 患者的卵巢反應性,但是沒有改善IVF-ET 的臨床妊娠率。通過一些分析,我們發現本研究存在發表偏倚,所以DHEA 輔助治療能否改善IVF-ET 的妊娠結局有待進一步研究。因此,建議可以在一定程度上鼓勵DOR 患者服用DHEA,并且進行大樣本、高質量的、多中心的隨機化前瞻性對照研究,進而不斷補充有關DHEA 在DOR 患者應用中的妊娠結局、成本效益、不良反應及安全性的RCT 數據,來解答DHEA 最終能否提高IVF-ET 的妊娠結局這個疑問。
[1] Kyrou D,Kolibianakis EM,Venetis CA,et al.How to improve the probability of pregnancy in poor responders undergoing in vitro fertilization:a systematic review and metaanalysis[J].Fertil Steril,2009,1:749-766.
[2] Yeung WY,Li HW,Lee CY,et al.A randomized doubleblind placebo-controlled trial on the effect of dehydroepiandrosterone for 16 weeks on ovarian response markers in women with primary ovarian insufficiency[J].J Clin Endocrinol Metab,2013,98:1-9.
[3] Casson PR, Lindsay MS, Pisarska MD, et al.Dehydroepiandrosterone supplementation augments ovarian stimulation in poor responders:a case series [J].Hum Reprod,2000,15:2129-2132.
[4] Barad D,Brill H,Gleicher N.Update on the use of dehydroepiandrosterone supplementation among women with diminished ovarian function [J].J Assist Reprod Genet,2007,24:629-634.
[5] Bosdou JK,Venetis CA,Kolibianakis EM,et al.The use of androgens or androgen-modulating agents in poor responders undergoing in vitro fertilization:a systematic review and metaanalysis[J].Hum Reprod Update,2012,18:127-145.
[6] Yeung TW,Chai J,Li RH,et al.A randomized,controlled,pilot trial on the effect of dehydroepiandrosterone on ovarian response markers,ovarian response,and in vitro fertilization outcomes in poor responders[J].Fertil Steril,2014,102:108-115.
[7] Wiser A,Gonen O,Ghetler Y,et al.Addition of dehydroepiandrosterone(DHEA)for poor-responder patients before and during IVF treatment improves the pregnancy rate:a randomized prospective study [J].Hum Reprod,2010,25:2496-2500.
[8] Moawad A,Shaeer M.Long-term androgen priming by use of dehydroepiandrosterone(DHEA)improves IVF outcome in poor-responder patients.A randomized controlled study[J].Middle East Fertil Soc J,2012,7:268-274.
[9] 安錦霞,王琰,倪亞莉,等.脫氫表雄酮(DHEA)預治療在體外受精-胚胎移植周期中的應用[J].生殖與避孕,2013,33:89-92.
[10] 李建娟,任春娥,張安清,等.補充DHEA 對卵巢儲備功能降低患者IVF-ET 的影響[J].遼寧醫學院學報,2014,35:51-53.
[11] 田海清,王青麗,鞏曉蕓,等.卵巢功能低下者添加DHEA 獲卵數隨機對照研究[J].新疆醫科大學學報,2014,36:603-605.
[12] Walker ML,Anderson DC,Herndon JG,et al.Ovarian aging in squirrel monkeys(Saimiri sciureus)[J].Reproduction,2009,138:793-799.
[13] 賈悅,潘芹芹,崔毓桂,等.脫氫表雄酮在骨質代謝中的作用[J].生殖醫學雜志,2004,13:183-185.
[14] Barad D,Gleicher N.Effect of dehydroepiandrosterone on oocyte and embryo yields,embryo grade and cell number in IVF[J].Hum Reprod,2006,21:2845-2849.
[15] Barad D,Brill H,Gleicher N.Update on the use of dehydroepiandrosterone supplementation among women with diminished ovarian function [J].J Assist Reprod Genet,2007,24:629-634.
[16] 王雅琴,楊菁,徐望明,等.雄激素及其調節劑對卵巢反應不良患者體外助孕妊娠結局影響的Meta分析[J].生殖醫學雜志,2013,22:588-595.
[17] Artini PG,Simi G, Ruggiero M,et al. DHEA supplementation improves follicular micro enviroment in poor responder patients [J].Gynecol Endocrinol,2012,28:669-673.
[18] Traish AM,Kang HP,Saad F,et al.Dehydroepiandrosterone(DHEA)-aprecursor steroid or an active hormone in human physiology[J].J Sex Med,2011,8:2960-2982.
[19] Panjari M,Davis S.DHEA therapy for women:effect on sexual function and wellbeing[J].Hum Reprod,2007,13:239-248.
[20] Kaaks R,Berrino F,Key T,et al.Serum sex steroids in premenopausal women and breast cancer risk within the European Prospective Investigation into Cancer and Nutrition(EPIC)[J].J Natl Cancer Inst,2005,97:755-765.
[21] Gleicher N,Barad DH.Dehydroepiandrosterone(DHEA)supplementation in diminished ovarian reserve(DOR)[J].Reprod Biol Endocrinol,2011,9:67.

