沉默G250基因對腎癌786-0細胞移植瘤Skp2表達的影響
沉默G250基因對腎癌786-0細胞移植瘤Skp2表達的影響
趙俊峰肖耀軍1姜耀東2趙善超2楊旭凱3鄭少斌2
(河南省中醫院河南中醫學院第二附屬醫院泌尿外科,河南鄭州450002)
摘要〔〕目的探討沉默G250基因對腎癌786-0細胞移植瘤S期激酶相關蛋白2(Skp2)表達的影響。方法構建靶向G250的siRNA表達質粒pshRNA-G250并轉染腎癌786-0細胞,12只BALB/c裸鼠分為陰性對照組和干擾成瘤組,干擾成瘤組每只裸鼠皮下接種5×106個G250基因沉默后的腎癌786-0細胞(786-0/si-G250-b),以轉染空質粒的細胞(786-0/si-G250-0)為對照。成瘤3 w后,處死裸鼠后切取瘤塊,采用組織芯片技術及免疫組化SP法檢測Skp2的表達。結果5×106個細胞皮下接種BALB/c裸鼠3 w后均成瘤,Skp2在陰性對照組和干擾成瘤組裸鼠的腫瘤組織中表達率分別為83.33%(5/6)和16.67%(1/6),兩者有顯著性差異(P=0.04)。結論G250基因表達沉默抑制了腎癌細胞移植瘤Skp2的表達。
關鍵詞〔〕G250基因;S期激酶相關蛋白2;腫瘤相關抗原;RNA干擾;腎細胞癌;體內
中圖分類號〔〕R737.11〔
基金項目:鄭州市科技攻關項目(No.109TGS486-9)
通訊作者:楊旭凱(1970-),男,副主任醫師,主要從事腎癌的基礎及臨床研究。
1廣東省武警醫院泌尿外科
2南方醫科大學附屬南方醫院泌尿外科
3蘭州軍區總醫院泌尿外科
第一作者:趙俊峰(1966-),男,主任醫師,主要從事腎臟腫瘤的RNA干擾以及臨床方面的研究。
腎癌是老年人常見的惡性腫瘤,其發生發展的分子生物學機制至今不清,多數研究顯示G250(又稱MN/CAⅨ)基因可誘導細胞惡性表型〔1〕,并參與了腎臟腫瘤細胞的生長與轉移。也有研究顯示S期激酶相關蛋白2(Skp2)對腎臟腫瘤的形成有一定影響〔2〕。本研究在成功構建腎癌相關抗原G250 siRNA表達載體〔3〕和完成G250基因沉默后裸鼠成瘤體內實驗〔4〕的基礎上,利用RNA干擾(RNAi)技術阻斷G250基因表達,觀察了G250基因沉默對腎癌786-0細胞體內成瘤及生長的影響。
1材料和方法
1.1材料與試劑人腎透明細胞癌786-0細胞株(以下稱腎癌786-0細胞)及大腸桿菌(DH5α)由南方醫科大學南方醫院泌尿外科保存。4~6 w的12只BALB/c裸鼠為SPF級,體重15~20 g,雌雄各半,購自南方醫科大學實驗動物中心,在南方醫院SPF實驗動物中心飼養。OPTI-MEMⅠ培養基及RPMI 1640培養基、胎牛血清(GIBCO公司),lipofectamineTM2000(Invitrogen 公司),G418及DEPC(Sigma公司),空質粒pRNAT-U6.1/Neo (GenScript公司),限制性內切酶BamHⅠ、Hind Ⅲ、KpnⅠ、T4 DNA連接酶、T4磷酸化酶、質粒提取試劑盒、磷酸鹽緩沖液(PBS)(Promega公司)、鼠抗人Skp2 mAb、SP試劑盒及二氨基聯苯胺(DAB)顯色劑(中杉金橋生物技術有限公司)。
1.2方法
1.2.1siRNA靶序列的設計和質粒的構建G250 mRNA的全長序列從NCBI基因庫(Genebank登錄號:AJ010588)檢索得出。應用Primer express軟件按照siRNA的設計原則尋找含21個堿基的特異性序列。在前期實驗的基礎上,選擇最有效的G250的siRNA片段,靶位點293~313,根據pRNAT-U6.1/Neo質粒的結構,設計出特異性干擾片段的核苷酸序列:5′-GGATCCCATTTAGGCTTAACTTCAGGTATTGATATCCGTACCTGAAGTT AAGCCTAAATTTTTTTCCAAAAGCTT-3′,5′-AAGCTTTTGGAAA AAAATTTAGGCTTAACTTCAGGTACGGATATCAATACCTGAAGT TAAGCCTAAATGGGATCC-3′。序列送由南京金思特公司合成。將退火后shRNA寡核酸雙鏈和pRNAT-U6.1/Neo酶切產物按3∶1混合,T4DNA連接酶27℃連接過夜,轉化感受態DH5α。然后提取待測的重組質粒。酶切鑒定正確后取1 ml轉化菌液,送金思特公司測序。
1.2.2siRNA轉染及建立穩定干擾G250基因抗性單克隆腎癌786-0細胞培養時,培養基為含10%胎牛血清的RPMI1640。轉染前24 h,傳代至24孔板,每孔1.5×105個細胞。用LipofectamineTM2000進行轉染。轉染后6 h換成完全培養基,繼續培養72 h,加入選擇性培養基進行篩選,根據G418對腎癌786-0細胞在14 d內的殺滅效果,選擇600 μg/ml作為篩選濃度。篩選培養2 w后可見抗性克隆長出,挑取單克隆轉入24孔板逐漸擴大培養,4 w左右可獲得穩定干擾抗性單克隆。
1.2.3實驗分組和建立腫瘤動物模型將皮下注射轉染空質粒的腎癌細胞的(786-0/si-G250-0)裸鼠作為對照組,轉染RNA干擾片斷細胞(786-0/si-G250-b)的為實驗組,每組6只。對數生長期的786-0/si-G250-0和786-0/si-G250-b細胞經胰酶消化,離心收集,計數后分別重懸于無血清RPMI 1640培養基中,配制成每0.1 ml含5×106個腫瘤細胞的懸液,用1 ml注射器將0.1 ml細胞懸液皮下注射于BALB/c裸鼠背部皮下,每一個部位注射5×106個細胞的懸液。
1.2.4腫瘤生長情況監測自腫瘤細胞注射第10日起,每天觀察裸鼠成瘤情況,待腫瘤出現后每3 d用毫米游標卡尺測量腫瘤的長、寬、高最大垂直直徑(mm),分別以a、b、c表示,依據腫瘤體積計算公式:V(mm3)=a×b×c/2〔5〕。在成瘤后的第3周處死裸鼠,切取腫瘤組織備用。
1.2.5組織芯片的制作
1.2.5.1制作組織蠟塊切取腫瘤組織,約1.0 cm×1.0 cm×0.5 cm。用10%中性甲醛固定,常規脫水石蠟包埋。對所有標本組織蠟塊常規切片、蘇木素-伊紅HE染色并作形態學觀察,選擇有代表性的腫瘤區域,在相應位置進行標記。
1.2.5.2制作包含120個點的組織芯片使用組織微陣列儀(MTA-1)制作受體空白蠟塊。大小2.0 cm×2.0 cm×1.0 cm,設計12×10點組織陣列。每個微陣列蠟塊包含120個標本。根據各標本HE染色切片標記的部位。用直徑為0.6 mm的供體針在蠟塊相應部位取樣。每例標本選定2個不同取樣位點,將供體組織芯放入受體蠟塊,組織芯間距0.4 mm。在組織樣本填入蠟孔時記錄每個樣本在二維陣列中的具體位置。并在一定位置上標記出組織微陣列的方位。置入烤箱低溫烘烤約1 h,封蠟,冷卻,制成兩個組織微陣列蠟塊。再以4 μm厚切片,裱于載玻片,制成組織芯片備用。
1.2.6免疫組化檢測SP免疫組化染色方法嚴格按SP試劑盒說明書操作。DAB溶液顯色。用已知乳腺癌標本作陽性對照,用TBS代替一抗作陰性對照。
1.2.7結果判定參考Langner等〔6〕的經驗制定判定標準:Skp2在胞核或胞核胞質中均表達為陽性,僅在胞質中表達為陰性。隨機取5個高倍視野,計算每個高倍視野中陽性細胞數占腫瘤細胞總數的百分比,最后計算5個高倍視野的平均百分比。Skp2陽性細胞數<10%為陰性(-),>10%為陽性(+)。結果判定由兩人共同完成,取二者平均值。
1.3統計學方法應用SPSS18.0統計學軟件進行χ2檢驗及方差分析。
2結果
2.1G250基因表達沉默對腎癌786-0細胞體內成瘤的影響將786-0/si-G250-0和786-0/si-G250-b細胞接種6只裸鼠均成瘤,成瘤率分別為100%。實驗組的成瘤時間(15±2.4)d較對照組延長〔(11±1.5)d〕(t=3.381,P=0.007),說明G250基因表達水平降低后腎癌786-0細胞在動物體內的成瘤能力受到抑制。
2.2兩組腎細胞癌組織中Skp2的表達成瘤3 w后,處死裸鼠,切取腫塊用組織芯片技術及免疫組化SP法檢測Skp2的表達,Skp2主要在細胞核中表達,在細胞質中也有部分表達。陽性染色呈現粗大棕黃色顆粒,見圖1。Skp2在對照和實驗組裸鼠的腫瘤組織中表達率分別為83.33%(5/6)和16.67%(1/6)差異顯著(P=0.04)。
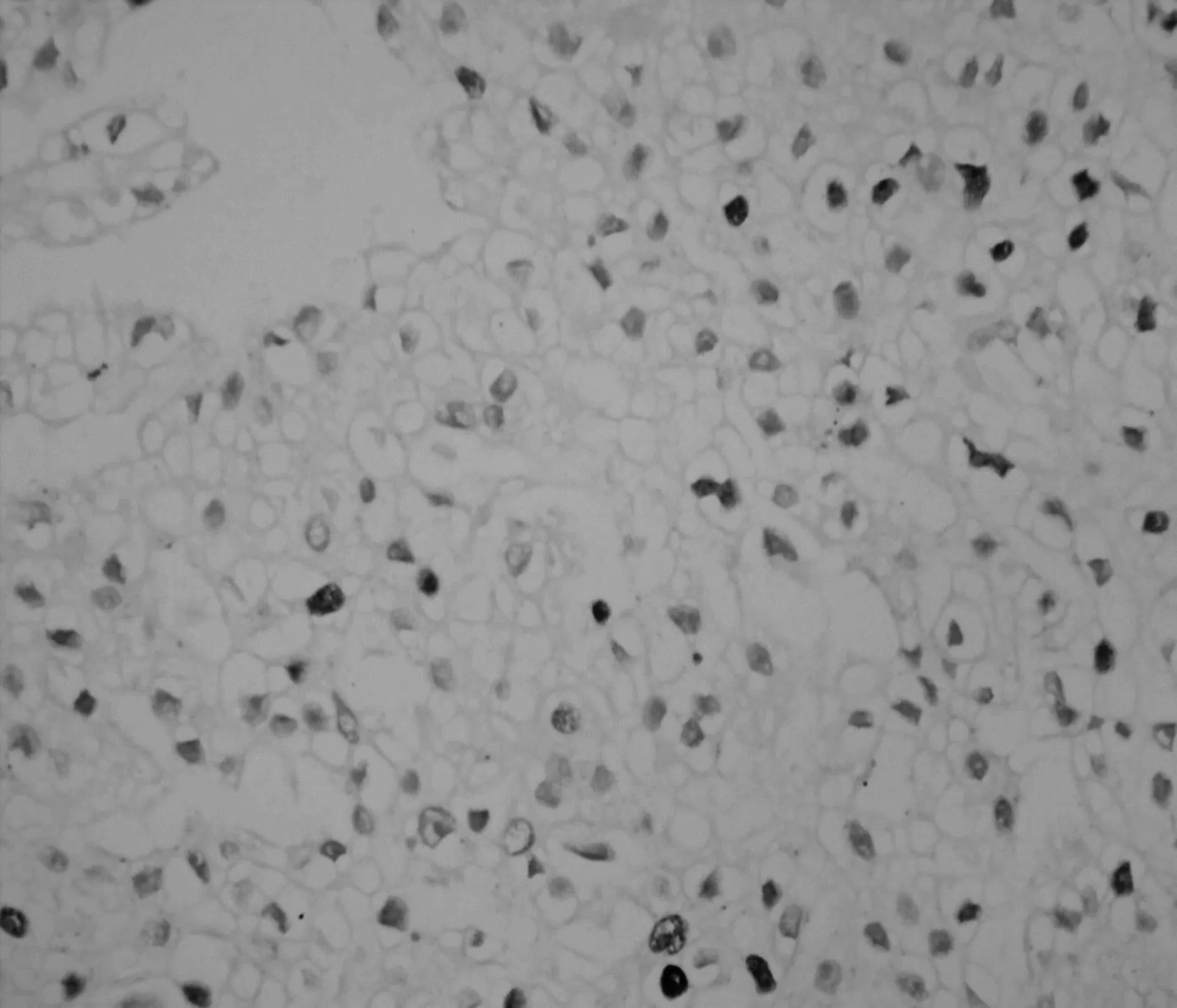
實驗組
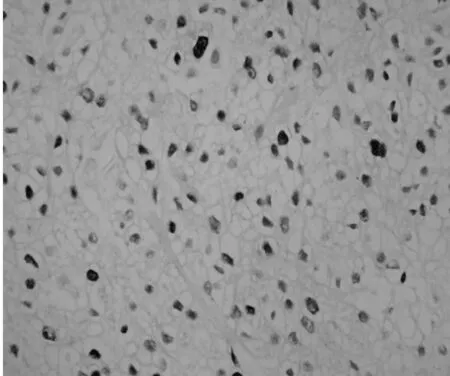
對照組
圖1兩組裸鼠腫瘤組織中Skp2表達(DAB,×400)3討論
腎腫瘤是泌尿系最常見的惡性腫瘤,死亡率高〔7〕。2013年美國統計新發腎腫瘤占所有新發實體腫瘤的3%〔8〕。腎癌的發生發展與多種癌基因及抑癌基因的異常激活、表達有關。G250基因表達在腎透明細胞癌發病中的作用尚不明確,研究顯示G250基因可能是一種癌基因,而且對腫瘤轉移有促進作用〔9〕。為進一步了解該基因在腎癌發生、發展中的作用,在成功設計構建、篩選及鑒定G250基因有效siRNA干擾序列基礎上,通過人工誘導RNA干擾(RNAi)技術實現了對G250基因持續穩定的抑制,觀察到G250基因表達沉默后,腎癌786-0細胞成瘤時間較對照組明顯延長,同一時期腫瘤體積較對照組明顯減小,說明G250基因沉默能有效抑制腎癌786-0細胞裸鼠皮下移植瘤的生長,不僅進一步證實G250基因在促進細胞增殖、轉化方面有重要的作用〔10〕,也提示該基因的作用可能比目前了解的要多,需要進一步探討。
惡性腫瘤的發生也與細胞周期調控機制出現紊亂從而導致細胞的失控性生長有關。而細胞周期主要由正負調控因子調控。其中細胞周期負性調控因子能夠抑制多種G1期cyclin-CDK激酶活性,使細胞不能通過G1期,從而防止細胞過度增殖形成腫瘤,其缺失與腫瘤的發生及發展有關。Skp2是一種泛素-蛋白酶體途徑的底物識別序列。能特異作用于磷酸化的細胞周期負性調控因子,可使其通過泛素-蛋白酶體途徑降解〔2〕。本研究提示在腎細胞癌的發生發展過程中,Skp2的高表達可能提示細胞周期負性調控因子的降解減少,這時細胞異常增殖不能得到有效抑制〔11〕,從而促進了腎細胞癌的發生和發展。因此,Skp2蛋白表達水平對判斷腎細胞癌的發展和預后也可能具有重要意義。
由于觀察到G250基因表達沉默后,體內腫瘤細胞成瘤能力明顯下降,造成腫瘤生長速度減慢,說明本文設計的小分子干擾RNA在體內穩定的發揮了作用,導致G250基因沉默,同時Skp2也出現表達降低,不僅證實了siRNA技術的持久、高度特異和高效的抑制靶基因表達的優勢〔12〕,也提示G250和Skp2在腎腫瘤的發生發展中可能有更多的作用。
4參考文獻
1Li G,Feng G,Gentil-Perret A,etal.CA9 gene expression in conventional renal cell carcinoma:a potential marker for prediction of early metastasis after nephrectomy〔J〕.Clin Exp Metastasis,2007;24(3):149-55.
2Langner C,von Wasielewski R,Ratschek M,etal.Biological significance of p27 and Skp2 expresion in renal cell carcinoma〔J〕.Virchows Arch,2004;445(6):631-6.
3趙俊峰,鄭少斌,姜耀東,等.G250基因siRNA表達載體的構建與鑒定〔J〕.山東醫藥,2008;48(6):23-5.
4趙俊峰,鄭少斌,姜耀東,等.沉默G250基因對腎癌786-0細胞體內成瘤及生長的影響〔J〕.中國老年學雜志,2012;32(19):3775-7.
5Agrawal N,Dasaradhi PV,Mohmmed A,etal.RNA interference: biology,mechanism,and applications〔J〕.Microbiol Mol Biol Rev,2003;67(4):657-85.
6Langner C,von Wasielewski K,Ratschek M,etal.Expression of p27 and its ubiquitin ligase subunit Skp2 in upper urinary tract transitional cell carcinoma〔J〕.Urology,2004;64(3):611-6.
7Mulders P,Figlin R,deKernion JB,etal.Renal cell carcinoma: recent progress and future directions〔J〕.Cancer Res,1997;57(22):5189-95.
8Siegel R,Ma J,Zou Z,etal.Cancer statistics,2014〔J〕.CA Cancer J Clin,2014;64(1):9-29.
9Ivanov S,Liao SY,Ivanova A,etal.Expression of hypoxia-inducible cell-surface transmem-brane carbonic anhydrases in human cancer〔J〕.Am J Pathol.2001;158(3):905-19.
10Zavada J,Zavadova Z,Pastorek J,etal.Human tumor-associated cell adhension protein MN/CA IX:identification of M75 eptope and of the region mediating cell adhension〔J〕.Br J Cancer,2000;82(11):1808-13.
11Sui L,Dong Y,Watanabe Y,etal.Clinical significance of skp2 expression,alone and combined with Jab l and p27 in epithelial ovarian tumors〔J〕.Oncol Rep,2006;15(4):765-71.
12Wullner U,Neef I,Tur MK,etal.Targeted delivery of short interfering RNAs-strategies for in vivo delivery〔J〕.Recent Pat Anticancer Drug Discov,2009;4(1):1-8.
〔2013-11-15修回〕
(編輯袁左鳴)

