吡咯列酮通過內質網應激致凋亡途徑促進大鼠血管平滑肌細胞鈣化
馬 琦邊云飛白 瑞魯 燕肖傳實*
(1 山西醫科大學第一臨床醫學院心內科,山西 太原 030001;2 山西醫科大學第二臨床醫學院心內科,山西 太原 030001)
吡咯列酮通過內質網應激致凋亡途徑促進大鼠血管平滑肌細胞鈣化
馬 琦1邊云飛2白 瑞2魯 燕1肖傳實1*
(1 山西醫科大學第一臨床醫學院心內科,山西 太原 030001;2 山西醫科大學第二臨床醫學院心內科,山西 太原 030001)
目的探討吡咯列酮通過內質網應激致凋亡途徑對大鼠血管平滑肌細胞鈣化影響。方法利用β-甘油磷酸鈉聯合丙酮酸鈉制備鈣化血管平滑肌細胞模型,予不同濃度(10、50、100 μmol/L)吡咯咧酮干預。用Von Kossa染色及茜素紅S染色觀察細胞鈣化程度,用甲基百里香酚藍法測定各組細胞中鈣含量,磷酸苯二鈉法測定細胞中堿性磷酸酶(ALP)活性。采用流式細胞術及TUNEL法檢測細胞凋亡率,實時熒光定量RT-PCR檢測各組細胞PPAR-γ、GRP78和caspased-12表達。觀察吡咯列酮通過內質網應激致凋亡對大鼠血管平滑肌細胞鈣化影響及其可能的分子機制。結果鈣化血管平滑肌細胞其鈣含量、ALP活性較普通細胞增多(P<0.01),而吡格列酮呈劑量依賴性地促進鈣化大鼠血管平滑肌細胞的鈣含量、ALP活性,以及PPAR-γ、GRP78、caspase-12mRNA表達(P<0.05)。結論吡咯列酮通過內質網應激致凋亡途徑作用可促進β-磷酸甘油誘導的血管平滑肌細胞鈣化,其作用可能與PPAR-γ及GRP78、caspase-12表達上調有關。
血管鈣化;內質網應激;血管平滑肌細胞;吡咯列酮
血管鈣化(vascular calcification,VC)是動脈粥樣硬化、高血壓、糖尿病血管病變、血管損傷、慢性腎病和衰老等普遍存在的病理表現,主要表現為血管壁僵硬性增加,順應性降低,進而導致心肌缺血、左心室肥大和心力衰竭,引發血栓形成,斑塊破裂,是心腦血管疾病高發病率和高病死率的重要因素之一,80%血管損傷和90%冠心病患者伴有VC[1]。新近研究表明凋亡在血管平滑肌細胞鈣化過程中發揮了重要作用,可能與內質網應激介導的凋亡有關[2-3]。研究發現吡格列酮(Pioglitazone,PIO)對血管平滑肌細胞凋亡具有促進作用,但吡格列酮是否通過促進內質網應激所致的細胞凋亡來促進血管鈣化的發生鮮有報道。本研究在體外血管平滑肌細胞(vascular smooth muscle cells,VSMCs)鈣化模型[4]基礎上,探討吡格列酮通過內質網應激致凋亡途徑對血管鈣化的影響。
1 材料與方法
1.1 實驗動物和試劑:SD大鼠由山西醫科大學動物實驗中心提供。吡格列酮(沈陽施德),GW9662(sigma公司),DMEM高糖型培養基(Gibco),胎牛血清(杭州四季青公司),特異性小鼠抗大鼠α-平滑肌肌動蛋白(武漢博士德)DAB顯色試劑盒(武漢博士德),鈣離子定量檢測試劑盒和堿性磷酸酶(ALP)檢測試劑盒(南京建成生物工程研究所),TUNEL試劑盒(羅氏公司)SP免疫組化試劑盒(北京博奧森),余為市售分析純。
1.2 實驗方法
1.2.1 VSMCs培養及鑒定:采用無菌方法取160 g左右Sprague-Dawley雄性大鼠胸主動脈中膜,將中膜剪成約1 mm×1 mm大小,貼培養皿底部,放入含20%胎牛血清的DMEM培養基,置于37 ℃、5% CO2的孵箱中培養,用0.125%胰蛋白酶消化傳代。實驗選用第5~10代細胞。經SMα-actin免疫細胞化學染色確定為平滑肌細胞。
1.2.2 分組及處理:取上述平滑肌細胞生長至融合狀態后,分別置于六孔板中進行試驗。本實驗分6組:①空白對照組(加入10%DMEM細胞培養液);②鈣化組(加入鈣化培養基,鈣化培養基是在常規培養基中加入10 mmol/Lβ-甘油磷酸(β-GP)和10 mmol/L丙酮酸鈉);③鈣化+PPAR-γ抑制劑(加入鈣化培養基、25 mmol/L GW9662);④鈣化+PIO(10、50、100 μmol/L)組(加入鈣化培養基中以及加入不同濃度(10、50、100 μmol/L吡格列酮)。每組設3個復孔,細胞每隔兩天換液1次,連續培養15 d[4]。
1.2.3 VSMCs鈣化的染色鑒定:取1.5 cm×0.5 cm的蓋玻片數枚放入6孔板內,以1.2×105接種密度進行細胞爬片。分別制作實驗組和對照組的細胞爬片。取出蓋玻片先用預冷4 ℃的PBS緩沖液洗滌2次,浸入冰丙酮中固定20 min。①將細胞玻片放入1%茜素紅S溶液內染色30 min,用0.2%醋酸溶液快速沖洗l次,濾紙吸干。系列酒精脫水,二甲苯固定、封片。顯微鏡下鈣鹽沉積處被染為橘紅色。②Von Kossa染色:將細胞玻片放入5%硝酸銀溶液避光孵育15 min,紫外燈照射10 min,洗滌后浸入1%硫代硫酸銨溶液1 min,洗滌后堿性品紅復染。顯微鏡下觀察鈣鹽沉積處為黑色。
1.2.4 VSMCs的鈣含量測定:棄上層培養基,用PBS緩沖液沖洗細胞2次,加入適量0.6 N鹽酸,37 ℃去鈣化作用24 h。采用鈣離子定量檢測試劑盒測定。剩余細胞用PBS洗3次,加入0.05 mol/L NaOH/0.1% SDS細胞裂解液,30 min后提取胞質蛋白,用BCA法蛋白分析試劑盒測定總蛋白,鈣含量用蛋白含量標準化。
1.2.5 VSMCs的堿性磷酸酶活性測定:棄上層培養基,用PBS緩沖液沖洗細胞2次,加入適量含1%TritonX-100的生理鹽水,置于4 ℃冰箱24 h。用超聲波處理25 s后反復吹打,使細胞充分破裂(倒置顯微鏡下觀察到細胞破碎、無完整的細胞結構),離心后取上清用堿性磷酸酶(ALP)檢測試劑盒測定ALP活性。測量時提取胞質蛋白并測定總蛋白含量,用其校正細胞層ALP活性。
1.2.6 流式細胞術檢測VSMCs凋亡率:各組細胞用0.25%胰酶(無EDTA)消化,血清終止消化后轉移至離心管,1000 rpm離心10 min,棄上清,用PBS沖洗2~3次,棄上清,每管500 μL buffer重懸,分別加入AnnexinV-FITC,PI染液各5 μL,避光反應15 min,流式細胞儀檢測細胞凋亡百分率。
1.2.7 TUNEL法檢測VSMCs凋亡率:棄上層培養基,收集細胞,采用細胞凋亡原位檢測試劑盒,即TUNEL法進行檢測,之后用DAPI染液染色封片,熒光倒置顯微鏡下觀察。TUNEL陽性呈綠色熒光,DAPI呈藍色熒光。每個細胞爬片觀察4個獨立視野,計算每100個細胞的凋亡個數,計算凋亡率。
1.2.8 RT-PCR測定GRP-78,caspase-12和PPAR-γ mRNA的表達:見表1。應用RNA提取試劑盒提取RNA,并用微量分光光度計進行檢測其吸光度在1.8~2.0,其后取5 μL RNA按照反轉錄試劑盒制備cDNA后,進行PCR擴增。

表1 GRP78、caspase-12、PPAR-γ、β-actin引物序列
2 結 果
2.1 血管平滑肌鑒定:倒置顯微鏡下觀察,可見原代平滑肌細胞從組織塊邊緣游出(圖1A)血管平滑肌細胞呈梭型,逐漸呈現束狀排列,出現典型的“峰谷樣”樣生長。經特異性免疫組化SMα-actin染色,可見胞質內SMα-actin表達豐富,細絲狀排列,符合血管平滑肌細胞特征。
2.2 鈣化的血管平滑肌細胞鑒定:倒置顯微鏡下觀察,可見血管平滑肌細胞透明度下降,表現為多層生長狀態,部分細胞脫死亡。空白對照組與單純鈣化組相比:茜素紅S染色時,鈣化組(A2)與對照組(A1)比較可見橘紅色區域,散裝分布,證實有鈣鹽沉積;Von Kassa染色時,鈣化組(B2)與對照組(B1)比較可見黑色沉積區域,證實有鈣鹽沉積。

圖1 原代培養大鼠VSMCs及鑒定(×200)A,B為原代大鼠VSMCs,C為大鼠VSMCs SMα-actin免疫細胞化學染色
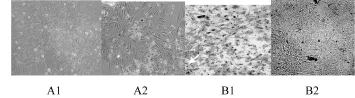
圖2 茜素紅S染色細胞結節處可見橘紅色沉積;Von Kossa染色細胞結節處可見黑色顆粒沉積
2.3 吡格列酮對VSMCs鈣含量、堿性磷酸酶活性:見表2。與對照組相比,鈣化組的鈣含量、ALP活性含量均升高(P<0.01);不同濃度吡格列酮組的鈣含量、ALP活性與鈣化組相比較均明顯升高(P<0.05),且呈劑量依賴。
表2 各組細胞鈣沉積含量、ALP活性比較(,n=4)
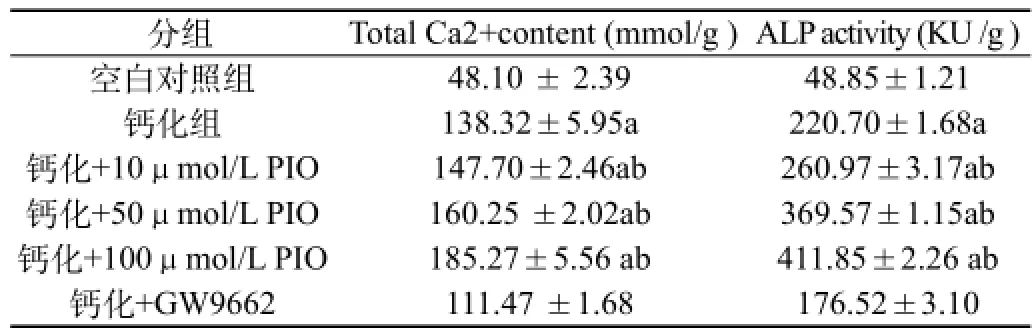
表2 各組細胞鈣沉積含量、ALP活性比較(,n=4)
注:a為P<0.01,與空白對照組相比;b為P<0.05,與鈣化組相比
分組 Total Ca2+content (mmol/g )ALP activity (KU /g )空白對照組 48.10 ± 2.39 48.85±1.21鈣化組 138.32±5.95a 220.70±1.68a鈣化+10μmol/L PIO 147.70±2.46ab 260.97±3.17ab鈣化+50μmol/L PIO 160.25 ±2.02ab 369.57±1.15ab鈣化+100μmol/L PIO 185.27±5.56 ab 411.85±2.26 ab鈣化+GW9662 111.47 ±1.68 176.52±3.10
2.4 吡咯咧酮對VSMCs凋亡的影響:鈣化組與對照組相比,出現大量細胞凋亡,差異顯著(P<0.01);不同濃度吡咯列酮處理后在流式圖中B4區和B2區的細胞分布均明顯增多,即促進了細胞鈣化造成的凋亡和壞死,凋亡率均較鈣化組明顯減低(P<0.05),且吡咯列酮的作用呈現劑量依賴關系(表3和圖3)。
表3 各組心肌細胞凋亡率比較(,n=4)

表3 各組心肌細胞凋亡率比較(,n=4)
注:a為P<0.01,與對照組比較;b為P<0.05,與鈣化組比較
分組 凋亡率(%)空白對照組 4.35±3.04鈣化組 14.40±3.11a鈣化+10μmol/L PIO 17.49±9.45ab鈣化+50μmol/L PIO 18.75±2.19ab鈣化+100μmol/L PIO 25.4±4.10ab鈣化+GW9662 11.0±1.20
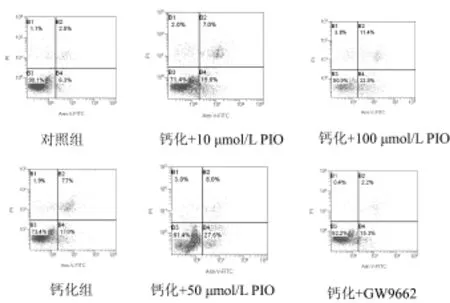
圖3 各組VSMCs凋亡率的比較
2.5 TUNEL法檢測各組VSMCs凋亡率:倒置熒光顯微鏡下觀察,可見TUNEL陽性信號呈綠色熒光,而所有細胞核經DAPI熒光染料復染后,呈藍色。與對照組相比,鈣化組和鈣化+PIO處理組凋亡細胞增多,差異顯著(P<0.01);PIO處理組與鈣化組相比,細胞凋亡率顯著增高(P<0.05)。見圖4。

圖4 各組血管平滑肌細胞細胞凋亡率
2.6 GRP-78、caspase-12及PPAR-γ mRNA的表達:與空白組比較,鈣化組和鈣化組+PIO處理組,GRP-78、caspase-12及PPAR-γ mRNA表達增高,差異顯著(P<0.01);與鈣化組比較,鈣化+PIO處理組GRP-78、caspase-12及PPAR-γmRNA表達顯著增高(P<0.05),且呈劑量依賴。見圖5。
3 討 論

圖5 各組VSMCs mRNA表達的比較a為P<0.01,與空白對照組相比;b為P<0.05,與鈣化組相比。
血管鈣化與冠心病、心肌梗死、腦卒中等多種疾病相關,是發生心、腦血管急癥的重要危險因子。以往認為VC是鈣鹽在細胞內和細胞外基質的被動沉積,近年來研究發現VC是一種與骨發育類似的主動的、可調控的生物學過程,類似于骨和軟骨形成過程中的骨化,主要特征是血管細胞尤其是血管平滑肌細胞成骨樣表型轉換[5-6]。隨血管平滑肌細胞組織鈣化的進展,原有的細胞功能發生改變,具備了骨細胞的特征和功能,呈現出骨細胞特異性蛋白及基因表達。
內質網應激是內質網內環境在外界環境影響下,內質網折疊蛋白質發生未折疊或者異常蛋白蓄積,導致“未折疊蛋白反應。”已有研究證實內質網應激參與細胞凋亡的過程,通過上調GRP78來發揮作用[7],同時GRP78被公認為內質網應激的標志。caspase-12的激活是促發內質網凋亡的重要途徑。Proudfoot等[8]實驗發現:人體VSMC在鈣化發生前就出現細胞凋亡特征,其培養l周后出現來源于VSMC凋亡小體的基質囊泡(基質囊泡是正常軟骨內骨鈣化的生發中心);進而說明了凋亡小體的功能類似骨基質囊泡,其能夠蓄積鈣,促進VSMC骨相分化。
吡格列酮作為PPAR-γ激活劑已廣泛應用于臨床糖尿病的治療,除此之外,有報道稱該類藥物可減輕動脈粥樣硬化和促進血管平滑肌細胞凋亡的作用,其機制可能是通過快速激活TGFβ1,進而引起細胞凋亡[9]。研究發現,PPAR-γ激活時,凋亡相關基因p53和bal-2出現異常表達,促進平滑肌細胞凋亡[10]。但吡咯咧酮是否通過激活PPAR-γ,進而影響血管平滑肌細胞凋亡,促進血管平滑肌細胞鈣化鮮有報道。因此,本實驗采用體外BGP誘導血管平滑肌細胞鈣化,觀察比格咧酮對血管平滑肌細胞鈣化的影響及機制。結果發現離體的血管平滑肌細胞可以形成明顯的礦化結節,鈣含量及ALP活性較對照組明顯增加,標志著局部細胞已發生成骨細胞樣化。血管平滑肌細胞鈣化后,凋亡率明顯增加,內質網應激指標GRP78及caspase-12mRNA水平明顯增加;同時比格咧酮處理后,上述改變加重。結果證實比格咧酮可以促進PPAR-γ的表達,促進血管平滑肌細胞鈣化,促使血管平滑肌細胞向成骨樣細胞表型轉化,其機制可能是作用于內質網,通過上調GRP78及caspase-12,促使內質網應激狀態加重,引起過度內質網應激,加重細胞鈣化。但抑制PPAR-γ活性作為很有前途的抗血管鈣化手段,還需對其在VC中的作用做進一步研究。
[1]Parhami F,Tintut Y,Patel JK,et al.Regulation of vascular calcificationin in atherosclerosis[J].Zkaradiol,2001,90(1):27-30.
[2]Shroff R,Long DA,Shanahan C.Mechanistic Insights into Vascular Calcification in CKD[J].J Am Soc Nephrol,2013,24(2):179-189..
[3]Kapustin AN,Davies JD,Reynolds JL,et al.Calcium regulates key components of vasculμLar smooth muscle cell-derived matrix vesicles to enhance mineralization[J].Circ Res,2011,109(1):e1-12.
[4]Bear M,Butcher M,Shaughnessy SG.Oxidized low-densitylipoprotein acts synergistically with beta -glycerophosphate to induce osteoblast differentiation in primary cultures of vascular smooth muscle cells [J].Cell Biochem,2008,105(1):185-193.
[5]Sasaki T,Nakamura K,Sasada K,et al.Matrix metalloproteinase-2 deficiency impairs aortic atherosclerotic calcification in ApoE-deficient mice[J].Atherosclerosis,2013,227(1):43-50.
[6]Shimizu T,Tanaka T,Iso T,et al.Azelnidipine inhibits msx2-dependent osteogenic differentiation and matrix mineralization of vascular smooth muscle cells[J].Int Heart J,2012,53(5):331-335.
[7]Proudfoot D,Skepper JN,Hegyi L,et al.The role of apoptosis in the initiation of vascular caleification[J].Z Kardiol,2001,90(3):43-46.
[8]Xin W,Li X,Niu K,et al.Involvement of endoplasmic reticulum stress-associated apoptosis in a heart failure model induced by chronic myocardial ischemia[J].Int J Mol Med,2011, 27(4): 503-509.
[9]劉廠輝,李建平,陽輝.羅格列酮對高脂血癥大鼠平滑肌細胞凋亡的影響及機制探討[J].中國動脈硬化雜志,2012,20(3):199.
[10]王朝輝,甘瓊.過氧化物酶體增生物激活物受體γ誘導的平滑肌細胞凋亡凋亡中相關基因p53和bcl-2表達的變化[J].中國病理生理雜志,2004,20(4):590-594.
Pioglitazone Increases Calcification of Rat Vascular Smooth Muscle Cells by Endoplasmic Reticulum Stress Apoptotic Pathway
MA Qi1, BIAN Yun-Fei2, BAI Rui2, LU Yan1, XIAO Chuan-Shi1*
(1 Department of Cardiology, The First Affiliated Hospital of Shanxi Medical University, Taiyuan 030001, China; 2 Department of Cardiology, The Second Affiliated Hospital of Shanxi Medical University, Taiyuan 030001, China)
ObjectiveTo explore the impact of pioglitazone by endoplasmic reticulum stress apoptotic pathway on calcification of rat vascular smooth muscle cells in vitro, and its signal transduction and molecular mechanisms.MethodsCalcification of cultured rat vascular smooth muscle cells(VSMCs)was produced by with β-glycerophosphate(β-GP) and sodium pyruvate. The vascular smooth muscle cells cells (VSMCs) were treat with (10, 50, 100 μmol/ L) pioglitazone. Von kossa staining and alizarin red staining, calcium content, alkaline phosphatase activity were analyzed to estimate the extent of calcification. The apoptoticrate was analyzed by flowcy tometry and TUNEL. The mRNA expression of peroxisome proliferator-activated receptor(PPAR-γ), glucose regulated protein 78 (GRP78)and cysteine-containing aspartate-specific proteases-12 (caspase-12) were detected by quantitative real-time RT-PCR.ResultsCompared with the normal VSMCs, the calcium content and, ALP activity of the cells of the calcified VSMCs were significantly higher (P<0.05), pioglitazone in a dose-dependent manner to promote calcified rat vascular the calcium content of the smooth muscle cells (VSMCs) ALP activity, the cell apoptotic rate and the mRNA expression of PPAR-γ, GRP78 and caspase-12.ConclusionPioglitazone can promote β-glycerophosphate-induced calcification of vascular smooth muscle cells, pioglitazone promote calcification of vascular smooth muscle cells may be though by endoplasmic reticulum stress apoptotic pathway.
Vascular calcification; Endoplasmic reticulum stress; Vascular smooth muscle cells; Pioglitazone
R54
B
1671-8194(2015)07-0013-04
*通訊作者:E-mail: ganxibaozhongxin@sina.com

