多不飽和脂肪酸對大腦功能影響研究進展
劉志國,王麗梅,王華林,劉烈炬
(武漢輕工大學生物與制藥工程學院,湖北 武漢 430023)
多不飽和脂肪酸對大腦功能影響研究進展
劉志國,王麗梅,王華林,劉烈炬*
(武漢輕工大學生物與制藥工程學院,湖北 武漢 430023)
多不飽和脂肪酸(polysaturated fatty acid,PUFA)是一類重要的脂肪酸族營養素,廣泛參與細胞代謝和細胞膜脂的構成。在腦組織中,PUFA含量豐富,對促進大腦發育、增強學習記憶能力有重要作用,因而廣受關注。本文綜述PUFA的膳食來源及其與腦組織中磷脂構成的關系,以及PUFA參與大腦發育、影響大腦功能的作用機制,為確定膳食中ω-6/ω-3 PUFA的合理配比,科學添加源于深海魚油和水藻的二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)或相關替代品,改善我國居民膳食中ω-3 PUFA的攝入不足,維持大腦健康功能提供理論依據。
多不飽和脂肪酸;磷脂;大腦發育;大腦功能
多不飽和脂肪酸是油脂中的一類重要的營養成分,其含量和種類決定了油脂的營養特性,對維護人類健康有重要作用,因而倍受人們的關注。大量研究證實,多不飽和脂肪酸(polysaturated fatty acid,PUFA)對維護細胞膜正常結構功能、參與細胞代謝調控、維持機體正常功能具有重要作用。其對神經系統的影響更是營養學與神經生物學共同關注的焦點。本文結合本課題組的研究[1-4]與有關文獻,針對PUFA對大腦功能的調節作用及機理做一綜述,希望對引導合理健康飲食及油脂營養有所幫助。
1 PUFA的膳食來源與結構平衡
根據雙鍵的位置不同,PUFA可分為ω-3和ω-6兩種類型,又根據脂肪鏈的長度,超過18碳的被稱為長鏈多不飽和脂肪酸(long-chain polyunsaturated fatty acid,LC-PUFA)。重要的ω-3 PUFA有α-亞麻酸(α-linolenic acid,ALA)、二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),ω-6 PUFA有亞油酸(linoleic acid,LA)、花生四烯酸(arachidonic acid,AA)等(表1)。近幾十年,伴隨著工業的快速發展和人們生活方式的改變,我國居民的膳食PUFA構成發生了很大變化。人們日常廣泛使用含有高比例ω-6 PUFA,而缺乏ω-3 PUFA的大豆油、玉米油、花生油和葵花油等植物油(表2),導致食物中ω-6 PUFA含量明顯增加,ω-3 PUFA含量相對降低[5-6]。另外,肉類食品和奶類制品消費量的增加也是導致ω-6 PUFA攝入量增加的另一個重要原因。而ω-3 LC-PUFA,例如DHA和EPA的攝入則主要依賴于魚類食品,特別是來自深海的鱈魚、沙丁魚和鮭魚等魚類產品[7],少量來自植物源ALA轉化生成的DHA、EPA,但轉化率極低,通常約2%~10%,甚至更低[8],因而導致我國居民ω-3 PUFA攝取普遍不足。而在美國,每個成年人平均的EPA和DHA攝入量大約也只有100 mg/d[9]。
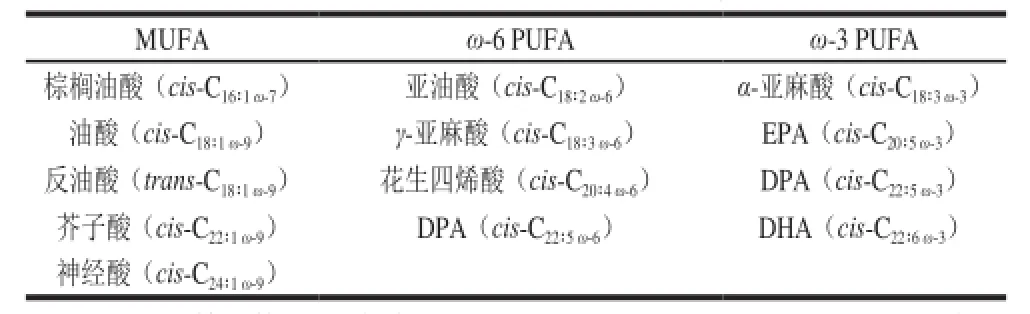
表1 常見的不飽和脂肪酸種類Table 1 Common unsaturated fatty acids
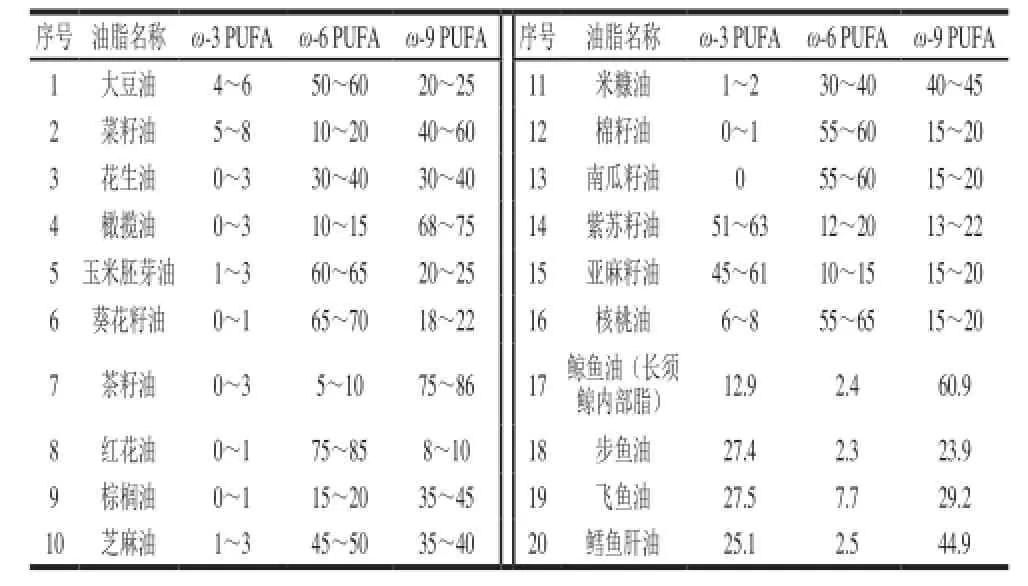
表2 主要食用植物油中不飽和脂肪酸的構成Table 2 Unsaturated fatty acid composition of edible vegetables oils %
飲食結構改變所致的ω-6/ω-3攝入比例失衡已成為現代社會人們重要的飲食特征。近幾十年來,西方國家居民ω-6 LC-PUFA的攝入量(主要是AA)增加了1 倍多,ω-6/ω-3攝入比例隨之升高。在法國,飲食中的LA/ALA比例增加了4 倍,達到10∶1~15∶1,遠高于膳食營養指南推薦的小于5∶1的要求[10-11]。LA和ALA是LC-PUFA合成的前體,由于人和哺乳動物自身不能合成LA和ALA,食物中的LA/ALA比例決定了人體ω-6/ω-3 PUFA的比例。雖然ω-6與ω-3 PUFA在體內不能相互轉化,然而ω-6和ω-3 LC-PUFA的體內合成卻使用共同的延長酶和去飽和酶,使ω-6和ω-3 LC-PUFA的合成具有競爭關系(圖1)。研究發現,飲食中限制ω-6 PUFA的攝入量,能使ALA至DHA轉換率增加25%[12]。值得注意的是,由于食物中ω-3 LC-PUFA相對缺乏,EPA和DHA合成效率極低,飲食中高比例的ω-6 PUFA可對ω-3 LC-PUFA的合成造成顯著的競爭性抑制效應,導致體內ω-3 LC-PUFA含量進一步降低。飲食中ω-3 PUFA攝入量過低以及ω-6/ω-3比例過高可影響血液、紅細胞、乳汁、脂肪組織以及大腦中ω-6和ω-3 PUFA的含量[13],增加多種疾病發生的風險。
研究顯示,較高的ω-6/ω-3 PUFA攝入比例或ω-3 PUFA缺乏可導致代謝紊亂,是誘發神經系統疾病、心血管疾病、癌癥等慢性疾病的重要原因之一[14-17]。流行病學研究顯示,飲食中ω-6/ω-3 PUFA比例過高與智力發育遲緩、老年癡呆等疾病的高發生率密切相關[18]。此外,高ω-6/ω-3 PUFA比例可促進人類前列腺腫瘤細胞的生長[19],并增加乳腺癌和胰腺癌發病風險[20],并對精子有顯著損傷作用,降低精子的數量和質量[21-22]。因此,在現代飲食中攝入足夠量的ω-3 PUFA,并保持ω-6/ω-3 PUFA攝入量的平衡顯得尤為重要。
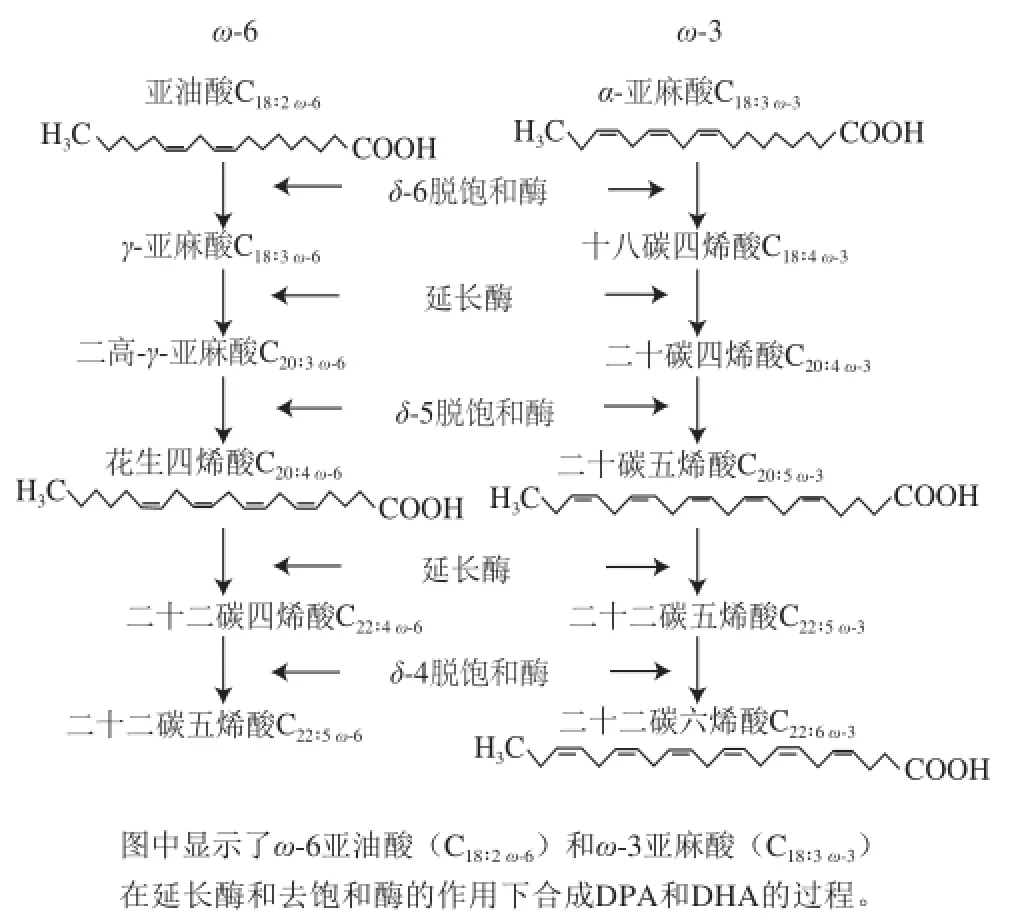
圖1 長鏈不飽和脂肪酸的合成途徑[14]Fig.1 Synthesis pathway of long-chain polyunsaturated fatty acids[14]
2 腦組織PUFA的構成
2.1 腦組織PUFA的分布特點
ω-3和ω-6 PUFA占腦組織脂肪酸總量的30%~35%,并主要以與磷脂結合的形式存在。在哺乳動物中,磷脂占腦組織干質量的50%~60%。PUFA在腦組織具有不對稱分布的特點,表現為不同種類的PUFA在腦組織中含量不同:高含量的DHA和AA,低含量的EPA、ALA和LA[23](圖2)。PUFA構成的磷脂在細胞膜脂質雙層結構中也呈不對稱分布。在哺乳動物的細胞膜上,磷脂酰膽堿(phosphatidylcholine,PC)多集中在脂質雙分子層的外側小葉,而磷脂酰絲氨酸(phosphatidylserine,PS)、磷脂酰乙醇胺(phosphatidylethanolamine,PE)和磷脂酰肌醇(phosphatidylinositol,PI)更集中于內側小葉[24]。雖然對這些PUFA不對稱分布的生理意義目前尚缺乏充分研究,但很顯然,這與細胞膜脂質雙層結構的流動性、可塑性以及脂筏的形成有關,同時也可能影響到脂質雙層結構中蛋白質(例如酶、受體和通道蛋白等)的功能[25]。
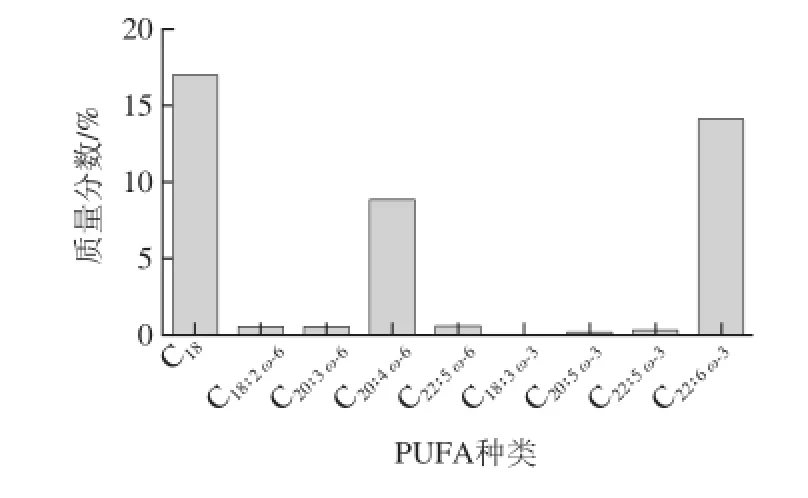
圖2 腦磷脂中不同脂肪酸的含量Fig.2 Contents of different fatty acids in brain phospholipids
為了保持細胞膜PUFA水平的相對穩定,大腦需要不斷從血液攝取來自飲食和肝臟合成的脂肪酸。過去對PUFA通過血腦屏障的方式一直存有爭議。曾經有觀點認為PUFA通過血腦屏障需要脂蛋白或血漿蛋白等轉運機制的參與。但最近的研究采用原位腦灌注技術發現EPA和DHA可以脂溶性的方式迅速通過血腦屏障[26-27]。然而實驗發現大腦磷脂中DHA的含量是EPA的300 倍[28]。如何解釋脂肪酸在大腦中的不均勻分布?最近的研究發現:在給成年大鼠飼喂富含DHA和ALA的飼料后,雖然ALA可以迅速從血漿擴散到大鼠的大腦,但大部分ALA通過β-氧化而降解,只剩下10%用于磷脂的合成,2%用于合成甘油三酯,僅≤0.2%用以合成新的DHA[29]。其他研究發現,86%以上從血漿攝取的LA在大腦中被β-氧化,只有<1%的部分用于合成AA。給大鼠側腦室注入放射性元素標記的EPA,4 d之后,發現只有9%完整的EPA,剩余的均被β-氧化或去酯化降解[28]。這些研究表明,脂肪酸在腦中的不均勻分布可能與其差異化的降解和酯化過程有關。
在大鼠飼料缺乏DHA的情況下,肝臟ALA轉化為DHA的速率加快,以維持大腦正常的需要。因此在肝功能損傷的情況下或老年性肝臟功能衰退時,需要從膳食中直接攝取更多的DHA,以維持大腦中DHA的水平。實驗發現神經細胞膜ω-3 PUFA含量會隨著年齡增長和神經變性疾病而減少[30]。盡管神經細胞質膜的成分能在一定范圍可通過自身的調節機制保持相對穩定,但在很大程度上仍受到飲食的影響。例如在為小鼠補充EPA 6~8 周后,可以顯著增加其神經細胞膜EPA和代謝物DPA含量[31]。長期補充DHA可增加大腦的DHA含量,相應降低大腦ω-6 PUFA的含量。相反,在飲食中長期缺乏ω-3 PUFA,將耗盡帕金森模型小鼠大腦中的DHA,伴隨大腦ω-6 PUFA的含量相應的增加[32]。ω-6/ω-3 PUFA比例嚴重失調可造成大腦功能損傷的潛在風險[33]。
2.2 PUFA在膜磷脂中的特異性分布
磷脂是構成神經和膠質細胞膜脂質雙層結構的主體。進入腦組織的PUFA(包括DHA和AA)在酰基輔酶A合成酶的作用下轉化為酰基輔酶A,然后通過酰基輔酶A轉移酶形成甘油磷脂。
在人類的大腦灰質、白質和髓鞘中,不同的甘油磷脂所占干質量的百分比不同。整體而言,膽堿甘油磷脂(choline glycerophosphates,CGP)和乙醇胺甘油磷脂(ethanolamine glycerophosphates,EGP)含量較高,而絲氨酸甘油磷脂(serine glycerophosphates,SGP)含量較低。有實驗研究了不同的脂肪酸在甘油磷脂中的分布,發現最大比例的PUFA(40%~60%)存在于大腦灰質的EGP和SGP中,只微量存在于CGP中;不同于甘油磷酸酯,棕櫚酸在CGP中含量最高,而在SGP中含量極低。在鞘磷脂中,PUFA的含量最低(特別是在CGP和SGP中),而油酸的含量最高[34]。研究發現脂肪酸在磷脂中的特異性分布具有重要的生理意義。例如SGP中DHA的含量與神經細胞的生存能力密切相關,可能成為判斷神經細胞生存能力的一個指標。當大腦DHA含量不足時,DPA(ω-6)即可取代PS中的DHA,造成神經細胞的損傷[35-36]。此外,盡管CGP中DHA的含量很低,但隨著年齡的增長,大腦灰質CGP中的DHA的含量卻迅速增加,與老年大腦的衰老過程密切相關[37]。目前已有許多研究對飲食中EPA和DHA與血漿以及紅細胞胞膜中EPA和DHA的關聯性進行了探討[38],然而迄今還沒有任何直接的數據揭示膳食中脂肪酸與大腦中脂肪酸的相關性[14]。脂肪酸在磷脂中的特異性分布及其生理意義將是今后研究探討的重要方向。
磷脂的合成需要多種前體,包括尿苷、脂肪酸和膽堿(圖3)。實驗發現,沙鼠單獨攝入尿嘧啶不能增加磷脂的含量(PC、PE、PS和PI)。沙鼠單獨攝入DHA在某種程度上可以增加一些磷脂(PE、PS和PI)的水平,但不能增加PC水平。然而,沙鼠尿嘧啶和DHA聯用,可以增加28%的PC含量。單獨攝入DHA僅可增加26%的PE含量,結合尿苷使用則可增加59%的含量。單獨使用DHA僅增加75%的PS含量,結合尿苷使用可達到160%。單獨使用DHA僅增加了29%的PI含量,結合尿苷的使用可增加到100%[39]。上述結果表明,DHA和尿苷對增加磷脂的合成具有協同作用,同時也提示了兩者聯合干預的可行性和必要性。值得注意的是,在大腦脂肪酸的積累過程中存在一種層級結構,例如進入大腦的DHA總是優先結合在大腦灰質的EGP和SGP中,而不是CGP中[34]。DHA對不同的磷脂合成也具有優先的層級結構,即最高的層級是PS、其后是PI、然后是PE和PC。采用神經嗜鉻細胞瘤細胞培養方法,發現DHA可被細胞攝取,并可激活酰基輔酶A合成酶,合成富含DHA的磷脂[40]。磷脂合成的增加可促進神經突起的生長,增加突觸和樹突棘的數量,促進大腦的學習記憶功能[41]。
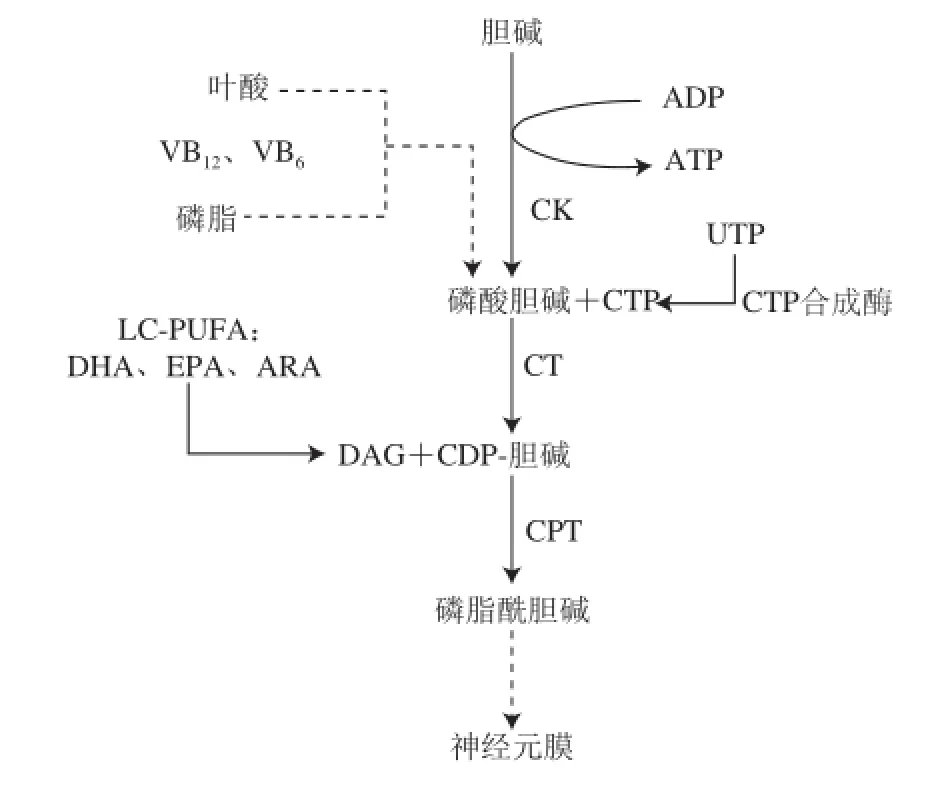
圖3 神經細胞膜的形成Fig.3 Formation of the nerve cell membrane
總之PUFA和磷脂的關系越來越受到關注。首先磷脂是PUFA的重要載體,在磷脂中PUFA呈特異性分布,具有重要的生理意義。另外飲食中的PUFA和尿苷不僅可以協同增加各自在大腦中的含量,同時對促進大腦磷脂的合成具有協同作用,提示了一種PUFA聯合干預的新途徑。
3 PUFA對大腦功能的影響及機制
除脂肪組織外,大腦是PUFA(特別是DHA)含量的最高器官。PUFA對維持大腦正常的結構和功能起著重要作用。PUFA在嬰幼兒期可以促進大腦的生長發育;在老年期可延緩大腦的衰老。雖然對PUFA的作用目前仍有爭論[42-43],但研究者普遍認為ω-3 PUFA的缺乏有礙于大腦正常功能;相反,適當地補充ω-3 PUFA則有益于大腦正常的結構和功能的維護[44]。越來越多證據表明:飲食中ω-3 PUFA的攝入量還與多種神經和精神性疾病有關,包括嬰幼兒時期神經發育障礙,如多動癥等[45]以及中老年期的阿爾茨海默病和帕金森病等[46-47]。目前全球精神和神經系統疾病的發病率已經超過了心血管疾病和癌癥的發病率,迫切需要有一種新的、安全有效的防治方法,PUFA提供了這樣一種潛在的可能性[48]。我國目前已進入了老年化的社會,伴隨而來的老年人學習記憶或認知能力的衰退已日益成為嚴重的社會問題[49]。因此,PUFA增強大腦學習記憶的作用以及作用機理是目前營養生物學和食品科學探討的重要課題[50]。
3.1 PUFA與大腦發育
人類大腦快速生長期開始于妊娠晚期,在此期間胎兒大腦的DHA開始大量集聚。快速生長期一直延續到出生后的第24個月,出生后的嬰兒期DHA仍在快速聚集,但相比妊娠晚期,聚集速率開始有所下降[51]。LC-PUFA是維持大腦和視覺系統生長發育的必需營養素[52]。胎盤中脂肪酸的含量取決于母親血液中脂肪酸的含量[53];出生后嬰兒的PUFA來源于母乳,支持嬰兒期大腦的快速生長發育。雖然大腦可以合成少量的LC-PUFA,但AA和DHA主要來源于血液,肝臟是人體合成AA和DHA的主要器官。大多數AA和DHA進入大腦是在胎兒發育晚期和產后早期,這是補充ω-6和ω-3 PUFA的最關鍵時期。針對人和動物的研究均表明圍產期母體飲食中ω-3 PUFA的缺乏可導致胎兒大腦DHA含量的下降。在懷孕期間雌性大鼠ω-3 PUFA攝入量的不足,可導致幼鼠大腦DHA的含量與正常大鼠相比下降50%[54]。大量研究表明嬰兒期是攝取ω-3 PUFA的重要時期,尤其是DHA。研究發現,與母乳喂養的嬰兒相比,缺乏ω-3 PUFA的攝入可使一些嬰兒大腦DHA的含量下降35%[55],因此在嬰兒配方奶粉中對PUFA的補充應引起人們的高度重視[56]。
3.2 PUFA與大腦功能
對成年人而言,大腦的DHA含量可直接影響細胞膜的特性、突觸的生成和可塑性,從而影響大腦學習記憶的功能[44,57]。在磷脂酶A2(phospholipase A2,PLA2)的作用下,大腦質膜,包括神經和神經膠質細胞的細胞膜不斷釋放非酯化的AA和DHA。這些被釋放的PUFA有以下主要的代謝途徑:1)轉化為重要的生物活性分子,如花生四烯酸、白細胞三烯、凝血惡烷和前列腺素等;2)通過β-氧化,進入能量代謝途徑或重新酯化形成新的膜磷脂;3)擴散到血液,在大腦和血漿之間進行交換。實驗表明大鼠每天PUFA的交換率大約為5%~8%。人類AA交換率為18 mg/d,DHA交換率為4~5 mg/d[58-59]。可見,為了維持大腦正常的結構和功能,每天必須要消耗一定數量的DHA,被消耗的DHA需要由飲食中的ω-3 PUFA來補充。在飼料中限制ω-3 PUFA攝入量,4 個月后成年大鼠大腦中DHA的含量低于正常大腦的37%[60]。因此根據我國居民目前的飲食習慣,飲食中ω-3 PUFA的缺乏可能會導致一些個體大腦DHA含量的不足,從而影響大腦的結構和功能。當DHA缺乏時,大腦可啟動有效的反饋機制,減少DHA的消耗量。實驗發現,當飼料中ω-3 PUFA不足時,DHA在成年大鼠的腦和血漿之間的交換率可延長至4 個月,交換率低于正常對照組的4 倍[60]。大腦DHA的缺乏可觸發一系列的信號級聯反應,并導致DHA和AA之間的代謝失衡。AA及其代謝產物過剩可促進大腦的炎性反應。實驗證明膳食中ω-3 PUFA的攝入量可以影響體內PLA2/COX axis和脂質信號轉導系統的活動[61]。在大腦衰老和神經系統炎性反應過程中,神經細胞、小膠質細胞和星形膠質細胞膜上的PLA2/COX axis是維持大腦內環境穩定的重要因素[62]。因此在成年期飲食中ω-3 PUFA攝入量不足不僅可導致大腦DHA的含量逐漸減少,影響大腦的功能;同時也可能為老年期大腦慢性炎癥的發生埋下隱患[63]。
隨著年齡的增長,大腦逐漸衰老,腦內的DHA含量開始下降。實驗顯示老年大鼠細胞膜的DHA含量明顯低于年輕大鼠[64]。DHA在不同膜磷脂中的含量降幅在5%~20%之間[65]。膳食中ω-3 PUFA的不足會加速大腦的老年化過程,大腦的老年化過程又進一步導致大腦DHA的流失。最新的一些研究發現,由年齡導致的大腦DHA的流失可能與一些酶類活性下降有關,例如長鏈酰基輔酶A合成酶,該酶可選擇性地催化DHA與大腦膜磷脂結合[66]。實驗證明大腦DHA缺乏不僅是衰老導致大腦學習記憶功能下降重要原因;同時與多種和學習記憶相關的老年性疾病有關[46-47]。
總之,PUFA在大腦的生長發育、功能成熟和衰老進程中起著重要的作用。在嬰幼兒期,PUFA促進大腦的生長發育;在成年期,PUFA維持大腦的正常功能;在老年期,PUFA可延緩大腦的衰老。
3.3 PUFA影響大腦功能的可能機制
PUFA對大腦的作用,除了以磷脂為載體,構成細胞膜脂質雙層結構,影響細胞膜的流動性和可塑性以外,還可通過調節局部游離脂肪酸以及磷脂信號分子的濃度而發揮生理效應。如前文所述,大腦中的PUFA主要來源于食物,體內最大的PUFA合成器官是肝臟。但局部游離脂肪酸和脂質信號分子的濃度除了取決于整體的PUFA濃度外,還依賴于局部質膜的釋放。細胞膜的構成和局部游離脂酸的濃度是影響細胞信號轉導系統的兩個重要因素。人們通常把細胞質膜形容為動態游離脂肪酸和脂質信號分子的儲庫[25]。細胞膜脂質的構成和磷脂中脂肪酸的特性可直接影響質膜結構和脂質信號轉導系統[26]。脂肪酸的長度和飽和度可直接影響脂質雙層的側向擴散運動和蛋白質在脂質雙層結構中的流動性[67]。不飽和脂肪酸的雙鍵結構在質膜的流動性和可塑性中扮演著重要角色[68]。在神經遞質、神經營養因子和細胞因子的作用下,細胞膜可通過酶解反應釋放出多種脂質信號分子,提高大腦脂質的可用度,如磷酯酰肌醇二磷酸、脂肪酸酯輔酶A、溶血磷脂酸和游離的脂肪酸等可改善細胞的功能。長期不良飲食、疾病、生長發育障礙和衰老均可引起神經細胞膜結構的改變和脂質可用度的降低。
細胞質膜釋放游離脂肪酸的過程可能與炎性作用有關,本文僅以AA為例來說明細胞質膜PUFA的釋放過程和對PUFA可用度調節。激活某些G蛋白偶聯代謝型受體,可引起細胞膜磷脂的酶解反應,釋放出游離脂肪酸。參與這些酶解反應的有3 個重要的磷脂酶,即磷脂酶A2(PLA2)、磷脂酶C(phospholipase C,PLC)和磷脂酶D(phospholipase D,PLD)。上述3 種磷脂酶分別作用于磷脂中的不同基團,產生不同的酶解產物。在哺乳動物細胞中包含多種PLA2的同工酶。PLA2可直接催化磷脂質sn-2脂酰鍵的水解,產生AA、DHA和溶血磷脂[69]。PLC和PLD的激活不能直接產生AA,但可以通過AA的前體——二脂酰甘油或磷脂酸釋放AA。釋放出的AA可能成為逆行信使(retrograde messenger)[70],或進一步通過各種代謝酶(如環氧酶、脂氧合酶和加雙氧酶等)生成多種類花生酸物質,如前列腺素、白細胞三烯、凝血惡烷等。類花生酸在機體炎性反應中起著重要的作用。不同的是,類花生酸主要產生的是促炎因子,而DHA主要產生抗炎因子[71-72]。
因此,大腦中游離脂肪酸的濃度,特別局部游離脂肪酸的濃度,不僅僅取決于食物中ω-3 PUFA的含量,還取決于細胞質膜對游離脂肪酸的釋放。PUFA對調節大腦的功能具有重要作用。在此過程中,PLA2、PLC和PLD是關鍵酶,是PUFA作用的靶點。
4 結 語
綜上所述,PUFA與人體健康和大腦功能有著密切的關系。大量攝取富含ω-3 PUFA的飲食既可以降低缺血性心臟病的風險,又有助于大腦的健康[73-74]。目前我國居民的膳食中并不缺乏ω-6 PUFA,而ω-3 PUFA的攝入量相對不足。與西方國家相比,我國居民的魚類食品,特別是海洋魚類食品攝入量較少,表現為ω-3 LC-PUFA攝入量更加匱乏。這些膳食特點應該對油脂工業和食品科學研究領域有所啟示。世界衛生組織下設的油脂委員會和中國營養學會提出了食用油中飽和脂肪酸、單不飽和脂肪酸、多不飽和脂肪酸的組成比例應為1∶1∶1的建議[75]。此外,最新的一系列研究發現食用油中ω-3 LC-PUFA的含量以及ω-6/ω-3 PUFA的比例對食用油的營養價值具有同樣重要的意義。對我國的消費者和生產者而言,重視食用油中添加來源于深海魚油和水藻的EPA和DHA,以及尋找和挖掘EPA的DHA的替代品對維護健康具有重要意義。
參考文獻:
[1] PAN J P, ZHANG H Q, WEI W, et al. Some subtypes of endocannabinoid/endovanilloid receptors mediate docosahexaenoic acid-induced enhanced spatial memory in rats[J]. Brain Research, 2011, 1412: 18-27.
[2] 王麗梅, 葉誠, 郭艷芬, 等. DHA油與其他4種油脂對大鼠空間學習記憶、脂質過氧化及其血脂水平的影響[J]. 中國油脂, 2013, 38(3): 34-38.
[3] 馬琳, 王麗梅, 樊永波, 等. DHA提高大鼠學習記憶的分子機制研究[J]. 食品科學, 2013, 34(17): 246-249. doi: 10.7506/spkx1002-6630-201317052.
[4] 郭艷芬, 王麗梅, 肖娜, 等. 發育期補充DHA對大鼠空間學習記憶能力的影響[J]. 中國油脂, 2011, 36(9): 43-47.
[5] LEAF A, WEBER P C. A new era for science in nutrition[J]. American Journal of Clinical Nutrition, 1987, 45(Suppl 5): 1048-1053.
[6] BILTON R. Averting comfortable lifestyle crises[J]. Science Progress, 2013, 96(4): 319-368.
[7] STONE N J. Fish consumption, fish oil, lipids, and coronary heart disease[J]. Circulation, 1996, 94(9): 2337-2340.
[8] KELLY L, GREHAN B, CHIESA A D, et al. The polyunsaturated fatty acids, EPA and DPA exert a protective effect in the hippocampus of the aged rat[J]. Neurobiology of Aging, 2011, 32(12): 2318.e1-2318.e15. doi: 10.1016/j.neurobiolaging.2010.04.001.
[9] ERVIN R B, WRIGHT J D, WANG C Y, et al. Dietary intake of fats and fatty acids for the United States population: 1999-2000[J]. Advance Data, 2004, 348: 1-6.
[10] AILHAUD G, MASSIERA F, WEILL P, et al. Temporal changes in dietary fats: role of n-6 polyunsaturated fatty acids in excessive adipose tissue development and relationship to obesity[J]. Progress in Lipid Research, 2006, 45(3): 203-236.
[11] LEGRAND P, SCHMITT B, MOUROT J, et al. The consumption of food products from linseed-fed animals maintains erythrocyte omega-3 fatty acids in obese humans[J]. Lipids, 2010, 45(1): 11-19.
[12] BAZINET R P, DOUGLAS H, CUNNANE S C. Whole-body utilization of n-3 PUFA in n-6 PUFA-deficient rats[J]. Lipids, 2003, 38(2): 187-189.
[13] POTTALA J V, YAFFE K, ROBINSON J G, et al. Higher RBC EPA + DHA corresponds with larger total brain and hippocampal volumes: WHIMS-MRI study[J]. Neurology, 2014, 82(5): 435-442.
[14] LUCHTMAN D W, SONG C. Cognitive enhancement by omega-3 fatty acids from child-hood to old age: findings from animal and clinical studies[J]. Neuropharmacology, 2013, 64: 550-565.
[15] JANSSEN C I, KILIAAN A J. Long-chain polyunsaturated fatty acids (LCPUFA) from genesis to senescence: the influence of LCPUFA on neural development, aging, and neurodegeneration[J]. Progress in Lipid Research, 2014, 53: 1-17.
[16] MONTEIRO J, LESLIE M, MOGHADASIAN M H, et al. The role of n-6 and n-3 polyunsaturated fatty acids in the manifestation of the metabolic syndrome in cardiovascular disease and non-alcoholic fatty liver disease[J]. Food & Function, 2014, 5(3): 426-435.
[17] YANG B, REN X L, FU Y Q, et al. Ratio of n-3/n-6 PUFAs and risk of breast cancer: a meta-analysis of 274135 adult females from 11 independent prospective studies[J]. BMC Cancer, 2014, 14(2): 105. doi: 10.1186/1471-2407-14-105.
[18] DULLEMEIJER C, DURGA J, BROUWER I A, et al. n-3 fatty acid proportions in plasma and cognitive performance in older adults[J]. American Journal of Clinical Nutrition, 2007, 86(5): 1479-1485.
[19] ROSE D P, CONNOLLY J M. Omega-3 fatty acids as cancer chemopreventive agents[J]. Pharmacology & Therapeutics, 1999, 83(3): 217-244.
[20] FUNAHASHI H, SATAKE M, HASAN S, et al. Opposing Effects of n-6 and n-3 polyunsaturated fatty acids on pancreatic cancer growth[J]. Pancreas, 2008, 36(4): 353-362.
[21] FAIR S, DOYLE D N, DISKIN M G, et al. The effect of dietary n-3 polyunsaturated fatty acids supplementation of rams on semen quality and subsequent quality of liquid stored semen[J]. Theriogenology, 2014, 81(2): 210-219.
[22] YAN L, BAI X L, FANG Z F, et al. Effect of different dietary omega-3/ omega-6 fatty acid ratios on reproduction in male rats[J]. Lipids in Health and Disease, 2013, 12: 33. doi: 10.1186/1476-511X-12-33.
[23] PALSDOTTIR V, MANSSON J E, BLOMQVIST M, et al. Long-term effects of perinatal essential fatty acid deficiency on anxiety-related behavior in mice[J]. Behavioral Neuroscience, 2012, 126(2): 361-369. [24] DEVAUX P F. Protein involvement in transmembrane lipid asymmetry[J]. Annual Review of Biophysics and Biomolecular Structure, 1992, 21: 417-439.
[25] BOLAND L M, DRZEWIECKI M M. Polyunsaturated fatty acid modulation of voltage-gated ion channels[J]. Cell Biochemistry and Biophysics, 2008, 52(2): 59-84.
[26] OUELLET M, EMOND V, CHEN C T, et al. Diffusion of docosahexaenoic and eicosapentaenoic acids through the bloodbrain barrier: an in situ cerebral perfusion study [J]. Neurochemistry International, 2009, 55(7): 476-482.
[27] GREEN J T, LIU Z, BAZINET R P. Brain phospholipid arachidonic acid half-lives are not altered following 15 weeks of n-3 polyunsaturated fatty acid adequate or deprived diet[J]. Journal of Lipid Research, 2010, 51(3): 535-543.
[28] CHEN C T, LIU Z, BAZINET R P. Rapid de-esterification and loss of eicosapentaenoic acid from rat brain phospholipids: an intracerebroventricular study[J]. Journal of Neurochemistry, 2011, 116(3): 363-373.
[29] DEMAR J C, MA K, CHANG L, et al. α-Linolenic acid does not contribute appreciably to docosahexaenoic acid within brain phospholipids of adult rats fed a diet enriched in docosahexaenoic acid[J]. Journal of Neurochemistry, 2005, 94(4): 1063-1076.
[30] YEHUDA S, RABINOVITZ S, CARASSO R L, et al. The role of polyunsaturated fatty acids in restoring the aging neuronal membrane[J]. Neurobiology of Aging, 2002, 23(5): 843-853.
[31] LUCHTMAN D W, MENG Q, SONG C. Ethyl-eicosapentaenoate (E-EPA) attenuates motor impairments and inflammation in the MPTP-probenecid mouse model of Parkinson’s disease[J]. Behavioural Brain Research, 2012, 226(2): 386-396.
[32] BOUSQUET M, SAINT-PIERRE M, JULIEN C, et al. Beneficial effects of dietary omega-3 polyunsaturated fatty acid on toxin-induced neuronal degeneration in an animal model of Parkinson’s disease[J]. FASEB Journal, 2008, 22(4): 1213-1225.
[33] SIMOPOULOS A P. The importance of the ratio of omega-6/omega-3 essential fatty acids[J]. Biomedicine & Pharmacotherapy, 2002, 56(8): 365-379.
[34] PARLETTA N, MILTE C M, MEYER B J. Nutritional modulation of cognitive function and mental health[J]. Journal of Nutritional Biochemistry, 2013, 24(5): 725-743.
[35] KIM H Y, BIGELOW J, KEVALA J H. Substrate preference in phosphatidylserine biosynthesis for docosahexaenoic acid containing species[J]. Biochemistry, 2004, 43(4): 1030-1036.
[36] KIM H Y. Novel metabolism of docosahexaenoic acid in neural cells[J]. Journal of Biological Chemistry, 2007, 282(26): 18661-18665.
[37] SCHAEFER E J, BONGARD V, BEISER A S, et al. Plasma phosphatidylcholine docosahexaenoic acid content and risk of dementia and Alzheimer disease: the framingham heart study[J]. Archives of Neurology, 2006, 63(11): 1545-1550.
[38] KROGER E, VERREAULT R, CARMICHAEL P H, et al. Omega-3 fatty acids and risk of dementia: the Canadian study of health and aging[J]. American Journal of Clinical Nutrition, 2009, 90(1): 184-192.
[39] SAKAMOTO T, CANSEV M, WURTMAN R J. Oral supplementation with docosahexaenoic acid and uridine-5’-monophosphate increases dendritic spine density in adult gerbil hippocampus[J]. Brain Research, 2007, 1182: 50-59.
[40] MARSZALEK J R, KITIDIS C, DIRUSSO C C, et al. Long-chain acyl-CoA synthetase 6 preferentially promotes DHA metabolism[J]. Journal of Biological Chemistry, 2005, 280(11): 10817-10826.
[41] WURTMAN R J, ULUS I H, CANSEV M, et al. Synaptic proteins and phospholipids are increased in gerbil brain by administering uridine plus docosahexaenoic acid orally[J]. Brain Research, 2006, 1088(1): 83-92.
[42] GOULD J F, MAKRIDES M, COLOMBO J, et al. Randomized controlled trial of maternal omega-3 long-chain PUFA supplementation during pregnancy and early childhood development of attention, working memory, and inhibitory control[J]. American Journal of Clinical Nutrition, 2014, 99(4): 851-859.
[43] DANTHIIR V, HOSKING D, BURNS N R, et al. Cognitive performance in older adults is inversely associated with fish consumption but not erythrocyte membrane n-3 fatty acids[J]. Journal of Nutrition, 2014, 144(3): 311-320.
[44] STONEHOUSE W, CONLON C A, PODD J, et al. DHA supplementation improved both memory and reaction time in healthy young adults: a randomized controlled trial[J]. American Journal of Clinical Nutrition, 2013, 97(5): 1134-1143.
[45] KURATKO C N, BARRETT E C, NELSON E B, et al. The relationship of docosahexaenoic acid (DHA) with learning and behavior in healthy children: a review[J]. Nutrients, 2013, 5(7): 2777-2810.
[46] DACKS P A, SHINEMAN D W, FILLIT H M. Current evidence for the clinical use of long-chain polyunsaturated n-3 fatty acids to prevent age-related cognitive decline and Alzheimer’s disease[J]. Journal of Nutrition, Health & Aging, 2013, 17(3): 240-251.
[47] CEDERHOLM T, SALEM N, PALMBLAD J. Omega-3 fatty acids in the prevention of cognitive decline in humans[J]. Advances in Nutrition, 2013, 4(6): 672-676.
[48] COLLINS P Y, PATEL V, JOESTL S S, et al. Grand challenges in global mental health[J]. Nature, 2011, 475: 27-30.
[49] SIERRA S, ALFARO J M, SANCHEZ S, et al. Administration of docosahexaenoic acid before birth and until aging decreases kainateinduced seizures in adult zebrafish[J]. Brain Research Bulletin, 2012, 88(5): 467-470.
[50] CRUPI R, MARINO A, CUZZOCREA S. n-3 Fatty acids: role in neurogenesis and neuroplasticity[J]. Current Medicinal Chemistry, 2013, 20(24): 2953-2963.
[51] DAGAI L, PERI-NAOR R, BIRK R Z. Docosahexaenoic acid significantly stimulates immediate early response genes and neurite outgrowth[J]. Neurochemical Research, 2009, 34(5): 867-875.
[52] KOLETZKO B, LIEN E, AGOSTONI C, et al. The roles of long-chain polyunsaturated fatty acids in pregnancy, lactation and infancy: review of current knowledge and consensus recommendations[J]. Journal of Perinatal Medicine, 2008, 36(1): 5-14.
[53] LO A, SIENNA J, MAMAK E, et al. The effects of maternal supplementation of polyunsaturated fatty acids on visual, neurobehavioural, and developmental outcomes of the child: a systematic review of the randomized trials[J]. Obstetrics and Gynecology International, 2012. doi: 10.1155/2012/591531.
[54] CHAMPEIL-POTOKAR G, CHAUMONTET C, GUESNET P, et al. Docosahexaenoic acid (22:6 n-3) enrichment of membrane phospholipids increases gap junction coupling capacity in cultured astrocytes[J]. European Journal of Neuroscience, 2006, 24(11): 3084-3090.
[55] FARQUHARSON J, JAMIESON E C, ABBASI K A, et al. Effect of diet on the fatty acid composition of the major phospholipids of infant cerebral cortex[J]. Archives of Disease in Childhood, 1995, 72(3): 198-203.
[56] TAI E K, WANG X B, CHEN Z Y. An update on adding docosahexaenoic acid (DHA) and arachidonic acid (AA) to baby formula[J]. Food & Function, 2013, 4(12): 1767-1775.
[57] HENNEBELLE M, CHAMPEIL-POTOKAR G, LAVIALLE M, et al. Omega-3 polyunsaturated fatty acids and chronic stressinduced modulations of glutamatergic neurotransmission in the hippocampus[J]. Nutrition Reviews, 2014, 72(2): 99-112.
[58] RAPOPORT S I, RAO J S, IGARASHI M. Brain metabolism of nutritionally essential polyunsaturated fatty acids depends on both the diet and the liver[J]. Prostaglandins, Leukotrienes, and Essential Fatty Acids, 2007, 77(5/6): 251-261.
[59] RAPOPORT S I. Arachidonic acid and the brain[J]. Journal of Nutrition, 2008, 138(12): 2515-2520.
[60] DEMAR J C, MA K, BELL J M, et al. Half-lives of docosahexaenoic acid in rat brain phospholipids are prolonged by 15 weeks of nutritional deprivation of n-3 polyunsaturated fatty acids[J]. Journal of Neurochemistry, 2004, 91(5): 1125-1137.
[61] BAZAN N G. Omega-3 fatty acids, pro-inflammatory signaling and neuroprotection[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2007, 10(2): 136-141.
[62] SUN G Y, XU J, JENSEN M D, et al. Phospholipase A2 in the central nervous system: implications for neurodegenerative diseases[J]. Journal of Lipid Research, 2004, 45(2): 205-213.
[63] PIZZA V, AGRESTA A, D’ACUNTO C W, et al. Neuroinflammation and ageing: current theories and an overview of the data[J]. Reviews on Recent Clinical Trials, 2011, 6(3): 189-203.
[64] LITTLE S J, LYNCH M A, MANKU M, et al. Docosahexaenoic acidinduced changes in phospholipids in cortex of young and aged rats: a lipidomic analysis[J]. Prostaglandins, Leukotrienes, and Essential Fatty Acids, 2007, 77(3/4): 155-162.
[65] LATOUR A, GRINTAL B, CHAMPEIL-POTOKAR G, et al. Omega-3 fatty acids deficiency aggravates glutamatergic synapse and astroglial aging in the rat hippocampal CA1[J]. Aging Cell, 2013, 12(1): 76-84.
[66] CHEN C T, GREEN J T, ORR S K, et al. Regulation of brain polyunsaturated fatty acid uptake and turnover[J]. Prostaglandins, Leukotrienes, and Essential Fatty Acids, 2008, 79(3/5): 85-91.
[67] LEE A G. How lipids affect the activities of integral membrane proteins[J]. Biochimica et Biophysica Acta, 2004, 1666(1/2): 62-87.
[68] ZIMMERBERG J, GAWRISCH K. The physical chemistry of biological membranes[J]. Nature Chemical Biology, 2006, 2(11): 564-567.
[69] FAROOQUI A A, HORROCKS L A. Brain phospholipases A2: a perspective on the history[J]. Prostaglandins, Leukotrienes, and Essential Fatty Acids, 2004, 71(3): 161-169.
[70] BAZAN N G. Synaptic signaling by lipids in the life and death of neurons[J]. Molecular Neurobiology, 2005, 31(1/2/3): 219-230.
[71] ULU A, HARRIS T R, MORISSEAU C, et al. Anti-inflammatory effects of omega-3 polyunsaturated fatty acids and soluble epoxide hydrolase inhibitors in angiotensin-II-dependent hypertension[J]. Journal of Cardiovascular Pharmacology, 2013, 62(3): 285-297.
[72] DEPNER C M, TORRES-GONZALEZ M, TRIPATHY S, et al. Menhaden oil decreases high-fat diet-induced markers of hepatic damage, steatosis, inflammation, and fibrosis in obese Ldlr-/-mice[J]. Journal of Nutrition, 2012, 142(8): 1495-1503.
[73] BANG H O, DYERBERG J, SINCLAIR H M. The composition of the Eskimo food in north western Greenland[J]. American Journal of Clinical Nutrition, 1980, 33(12): 2657-2661.
[74] HOEVENAAR-BLOM M P, NOOYENS A C, KROMHOUT D, et al. Mediterranean style diet and 12-year incidence of cardiovascular diseases: the EPIC-NL cohort study[J]. PLoS ONE, 2012, 7(9): e45458. doi: 10.1371/journal.pone.0045458.
[75] 中國營養學會. 中國居民膳食營養素參考攝入量[J]. 營養學報, 2001, 23(3): 193-196.
Recent Advances in Undersanding the Effects of Polyunsaturated Fatty Acids on Brain Function
LIU Zhiguo, WANG Limei, WANG Hualin, LIU Lieju*
(School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Polyunsaturated fatty acids (PUFAs) are a group of important nutritional fatty acids which are involved in cell metabolism and plasma membrane constitution. PUFAs have attracted tremendous attention as an abundant component of brain tissue which plays a crucial role in brain development and improvement of learning and memory abilities. Herein, we summarize the relationship between dietary sources of PUFAs and brain phospholipid composition. Furthermore, the mechanisms of PUFAs on brain development and function are reviewed, which will provide a theoretical basis for the modification of dietary ω-6/ω-3 PUFA ratio in China via adding docosahexaenoic acid (DHA), eicosapentaenoic acid (EPA) or related substitutes from deep-sea fish oil and algae.
polyunsaturated fatty acid; phospholipid; brain development; brain function
TS201.4
A
1002-6630(2015)21-0284-07
10.7506/spkx1002-6630-201521053
2014-12-03
國家自然科學基金面上項目(31271855);國家自然科學基金青年科學基金項目(31000772;81402669);
湖北省自然科學基金項目(2014CFB887);湖北省教育廳科學技術研究項目(D20141705)
劉志國(1963—),男,教授,博士,研究方向為營養與食品安全。E-mail:zhiguo_l@126.com
*通信作者:劉烈炬(1952—),男,教授,碩士,研究方向為營養生物學。E-mail:liulieju@qq.com

