高溫液態水預處理木質纖維素
趙孟姣,李國民,徐 剛,徐琴琴,張 昱,3,銀建中
(1.大連理工大學化工機械學院,遼寧大連116024;2.遼寧石油化工大學機械工程學院,遼寧撫順113001;3.內蒙古工業大學化工學院,內蒙古呼和浩特010051)
在燃料乙醇生產過程中可發酵糖(木糖與葡萄糖)的制取很關鍵。自然狀態下,木質纖維素細胞壁的結構很復雜,既含結晶聚合物又含無定型聚合物,而且半纖維素與木質素緊緊包裹著纖維素,阻礙了酶與纖維素的接觸,糖收率低。采用預處理可增大纖維素與酶的接觸面積(可及度),提高糖收率及酶解效率。預處理方法包括化學法和物理法。化學法是采用酸、堿、高溫液態水[1]以及有機溶劑等進行預處理;物理法是采用氣爆與球磨等進行預處理。酸、堿預處理效率高,但腐蝕設備,產物中含有對發酵起抑制作用的物質;有機溶劑價格昂貴,有毒。與其它預處理方法相比,高溫液態水在預處理過程中既是溶劑又是反應劑,無需添加其它物質,且價格低,綠色環保,因此成為研究熱點。
作者在此總結了高溫液態水的物化性質,在此基礎上,從木質纖維素預處理時的溶解情況以及半纖維素水解影響因素、機理、強化等方面,詳細敘述了木質纖維素高溫液態水預處理工藝的研究進展。
1 高溫液態水的物化性質
高溫液態水是指溫度在180~350 ℃(Tc=374 ℃,Pc=22 MPa)、壓力高于飽和壓力的液態水。隨著溫度升高,水的物理化學性質會發生改變,如圖1所示。
由圖1可看出,水的介電常數、黏度及密度均隨溫度的升高而降低,在近臨界點處迅速下降,進入超臨界區后緩慢下降。
在25 ℃、0.1 MPa下,水的介電常數與密度分別為78.46F·m-1、1.0g·cm-3;當溫度升至350 ℃、20 MPa時,其值分別降至14.07F·m-1和0.60g·cm-3[2-3];繼續升溫至400 ℃、25 MPa時,其介電常數與密度已降至5.9F·m-1和0.17g·cm-3。
較低的介電常數使高溫液態水在一定條件下表現出類似于極性有機溶劑的性質,能夠大量地溶解氣體和有機小分子,并且在超臨界態下還可以與某些有機物以任意比例互溶[4-5]。應用這種溶解性質可以從植物中提取抗氧化劑[6],去除固體中的有機污染物[7]及金屬[8]。另一方面,高溫液態水使某些鹽(如二類鹽Na2CO3、K2SO4等)的溶解性下降,致使析出的鹽造成管路堵塞[9]。高溫液態水較低的密度提高了水本身的擴散性能,較低的黏度減小了擴散阻力。較低的介電常數、黏度和密度共同促進了有機物在高溫液態水中迅速、大量地溶解[4]。
高溫液態水最獨特的性質是它的離子積(Kw)。標準狀態下水的離子積是10-14[10],溫度升高,Kw增大(圖1b)。在250 ℃時,Kw達到最大值10-11,比標準狀態下水的離子積大了3 個數量級,當溫度升至374 ℃時,Kw陡降,在超臨界區域緩慢降低。高溫液態水可提供較多的H+和OH-,表現出酸堿催化的性能,用于催化(促進)反應。高溫液態水既支持自由基反應又支持離子基反應:當Kw<10-14時,以自由基反應為主;當Kw>10-14時,以離子基反應為主[11]。水中H+的濃度不足以促進某些反應時,較高的溫度則進行了彌補。
在上覆壩體壓力及廊道自身重力作用下,廊道出現豎直向下的撓曲變形,在防滲墻的帶動下發生向下游撓曲變形。兩種變形組合后在廊道軸線方向產生較大的拉壓應力,廊道兩端上游受拉,下游受壓,河床中部上游面受壓、下游面受拉。因壩基巖體的約束,基巖面處出現了明顯的應力集中現象,左右岸1/4跨位置上游面壓應力較大,下游面拉應力較大。表1列出了靜力條件下廊道沿各方向的變形和正應力極值。
高溫液態水較大的離子積與較高的溫度共同促進有機物的水解,反應條件較溫和;而在超臨界水中,有機物高效、快速地水解,反應可在幾秒鐘內完成[12]。相對于超臨界水而言,高溫液態水水解木質纖維素所需溫度低,時間長,較容易控制。
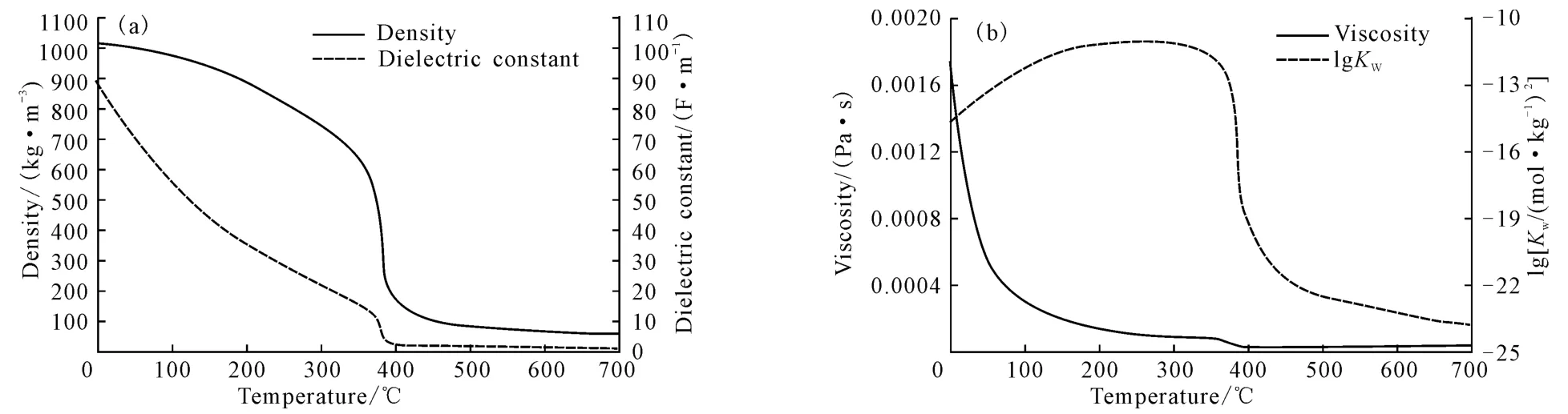
圖1 25 MPa下,水的密度、介電常數(a)與黏度、離子積(b)隨溫度的變化曲線[9]Fig.1 Density and dielectric constant(a),viscosity and ion product(b)of water versus temperature at pressure of 25 MPa[9]
2 木質纖維素水解反應
木質纖維素在一定溫度下可溶于高溫液態水,其中半纖維素、纖維素在溶解狀態下水解生成糖。它們水解的起始溫度分別為180 ℃、230 ℃[13-14]。Mok等[15]指出熱液解可作為酶解纖維素前的預處理。與爆破預處理破壞木質纖維素細胞壁不同[16],高溫液態水預處理的實質是利用熱量和自身酸催化能力使全部半纖維素及少量木質素溶解并發生水解反應,重新定位大部分木質素分布,增大纖維素與酶的接觸面積[17-18],提高酶解效率和糖收率,同時回收70%~90%半纖維素衍生糖。
2.1 半纖維素、木質素的溶解
半纖維素在纖維素的表面通過氫鍵纖維絲交聯。半纖維素去除越多,纖維素酶解效果越好[19-21]。高溫液態水可溶解全部半纖維素[22-23]。Mok等[15]采用不同種類的木本和草本植物在200~230 ℃的高溫液態水中處理0~15min,半纖維素100%溶解,經后續處理得到90%的單糖。
在木質纖維素水解還原糖的研究中,對木質素單獨的研究較少。當高溫液態水的溫度升至木質素熔溶溫度后,它透過細胞壁并在細胞壁表面沉降下來[24],重新分布,同時少量木質素脫落,最后生成木質素衍生物[25],木質纖維素溶解越多,酶解糖收率越大[26-27]。
木質纖維素溶解最多的條件未必是最佳預處理條件。評價預處理的效果有兩方面,即半纖維素糖收率與纖維素的可及度。目前,利用高溫液態水預處理木質纖維素以獲得最大總還原糖收率,預處理工藝及半纖維素水解機理是主要的研究方向。表1為不同木質纖維素原料在高溫液態水中不同反應條件下的糖收率。
2.2 半纖維素水解的影響因素
2.2.1 木質纖維素種類
半纖維素是植物細胞壁中除纖維素以外的雜聚多糖的總稱。不同種類木質纖維素中的半纖維素含量與組成不同,因此預處理效果也不同[35-36]。采用6種農業廢物制取低聚木糖,其產量與半纖維素含量及半纖維素支鏈上的乙酰基有關,可能是因為乙酰基脫落生成的乙酸促進了半纖維素水解[37]。但有實驗證明其無影響[38-39],甚至在去乙酰基的木質纖維素中加入過量乙酸(使用量超過脫掉的乙酰基量),其水解效果不如自然進料[40]。乙酰基脫落生成的乙酸對半纖維素的水解是否具有催化作用與木質纖維素的種類相關,需要進一步探討半纖維素水解機理才能得出定論。
2.2.2 工藝條件
在反應溫度、反應時間及反應壓力3個參數中,反應溫度對半纖維素水解影響最大[41];反應時間依賴于反應溫度;反應壓力不僅能使水在預處理溫度下保持液態,而且能使木質纖維素的結構發生變化[26]。在高溫液態水預處理木質纖維素過程中,通常采用Overend與Chornet推導的反應強度系數[42],即R0=t×描述反應溫度與反應時間對半纖維素水解的共同影響[19]:半纖維素衍生糖收率是反應溫度與反應時間共同作用的結果。反應溫度升高,半纖維素水解速率加快;在同一反應溫度下,隨反應時間的延長,糖收率先升高后降低,即半纖維素首先水解生成寡糖,寡糖再生成單糖,單糖進一步降解成副產物[43],當半纖維素水解速率大于單糖降解速率時,糖收率升高,反之則降低。反應溫度越高,反應時間越長,單糖降解的副產物越多[44]。在200~220 ℃的高溫液態水中預處理某些草本及木本生物質0~10 min,即可得到最高半纖維素衍生糖收率[45]。固液比(1.0%~10.0%)對半纖維素水解糖收率沒有影響[46];原料顆粒越小,與水接觸的面積越大,半纖維素水解越容易,效果越好[47],但原料顆粒小到一定程度時,其粉碎作用相當于球磨,將減少半纖維素的含量[48]。
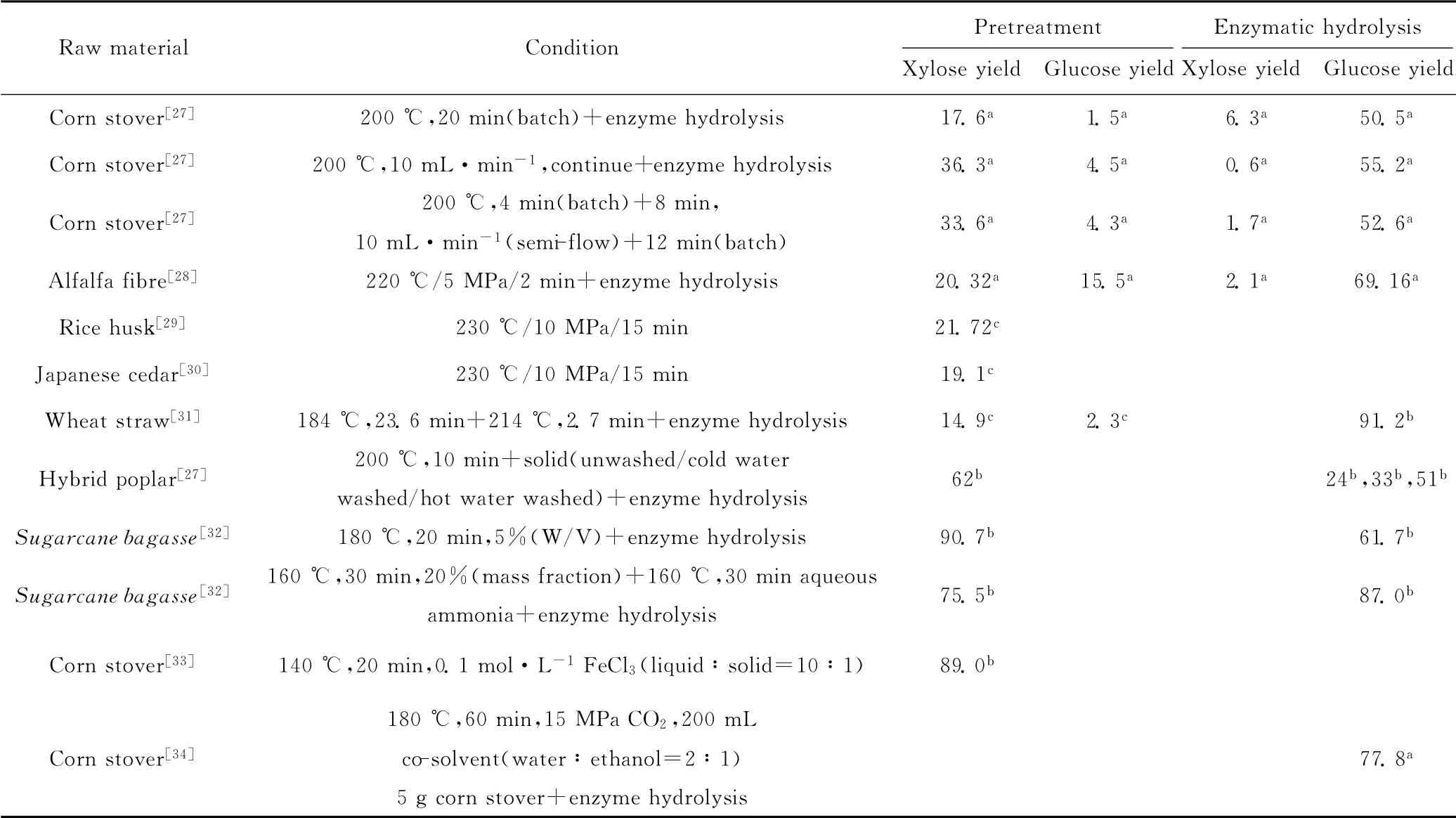
表1 不同木質纖維素原料在高溫液態水中不同反應條件下的糖收率/%Tab.1 Sugar yields for different types of lignocellulose materials in hot liquid water under different reaction conditions/%
預處理常用設備有間歇釜式反應器與半連續釜式反應器。在間歇釜式反應器中,水解產物單糖在反應器內停留時間較長,降解副產物多,但水解液糖濃度高,可實現較大的固液比;在半連續釜式反應器中,流水的沖刷使水解液中木質纖維素表面的長鏈聚合物與水分子形成的“冰層”變薄,有利于水滲入到木質纖維素內部,加速水解反應進行,并且生成的寡糖與溶出的木質素被水帶出反應器,減少單糖的降解,提高半纖維素衍生糖收率與酶解糖收率,但水解液糖濃度較小,用水量大,能耗高[39,49]。近年來,有學者采用半連續固定床反應器提高了原料固液比,有效地抑制水解產物的降解,降低能耗,且不需要對原料進行粉碎[50]。因此,研制出高效、節能的反應器型式是提高預處理效果、降低用水量及能耗的重要途徑。
在半連續操作中,水的高速流動對半纖維素水解的促進作用只在反應初期有效而末期效果卻不明顯,因而Liu等[51]提出部分流動工藝:先在200 ℃下間歇反應4min,然后在連續流動中反應8min,最后再進行間歇反應12min。木糖收率84%~89%,纖維素的酶消化性88%~90%,木質素去除了40%~45%,總糖收率達到了90%~92%,比單純采用連續流動操作節省了60%的用水量。在間歇操作過程中,最高半纖維素衍生糖收率與最高纖維素酶解糖收率的預處理條件不一致,因此采用兩步法預處理:第一步水解獲取最高半纖維素衍生糖收率,第二步使纖維素可及度最大,此時,所得木質纖維素總糖收率最高[25,31]。此外,將水pH 值控制在4~7 之間[26],可使半纖維素水解生成的糖以寡糖的形式存在,減少單糖的生成與降解,提高半纖維素衍生糖收率[52]。
2.2.3 水解過程強化
采用CO2加壓的方式使水保持液相的同時形成碳酸,Savage等根據CO2-H2O 二元系統的熱力學性質建立了預測富含CO2高溫液態水的pH 值的模型。計算證明,添加的CO2可以使高溫液態水的pH 值降低幾個單位[53]。CO2可催化某些木質纖維素中半纖維素水解,顯著提高木糖和呋喃的濃度,抑制水解液中有機酸的累積,泄壓之后,CO2逸出,水的pH 值又可恢復正常[53-54]。采用富含高壓CO2的液態水在較低溫度下(105~110 ℃)預處理甘蔗渣,酶解糖收率與經高溫預處理后的酶解糖收率相似[55];但是,CO2對山楊[56]和黑麥稻稈的水解[54]卻沒有效果,木糖的收率也未提高。此外,向富含CO2的高溫液態水中加入少量乙醇,可溶解更多的木質素,酶解糖收率提高[34]。
木質纖維素的灰分中含有少量的Ca2+、K+、Mg2+、Na+、Al3+、Fe3+,含有這些陽離子的無機鹽對木質纖維素的氣化過程[57]及半纖維素水解有催化作用,對水解液產品具有選擇性[33,58-59]。高溫液態水聯合其它預處理不僅可以處理高固液比原料[32],還可以減少后續水解纖維素的酶用量[60]。
2.3 半纖維素水解機理
半纖維素水解產物受反應器、工藝參數、添加劑以及木質纖維素本身的影響,而且水解產物復雜,除木(單)糖之外還有不同聚合度的低聚糖、有機酸及糠醛等[61]。高溫液態水中的H+由水提供,并表現出稀酸催化作用,因此,通常把稀酸催化半纖維素水解的一階連串動力學模型應用于高溫液態水中,并采用阿倫尼烏斯方程預測動力學參數。最初的半纖維素動力學模型是以纖維素動力學模型為基礎而建立的,如模型(1):
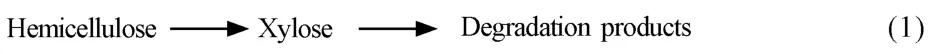
Kobayashi等[62]用稀酸水解硬木,發現半纖維素可以分為兩部分水解:快速水解部分和慢速水解部分,快速水解部分約占30%。研究發現,在半纖維素向單糖轉變過程中還存在寡糖,如模型(2)[46]:
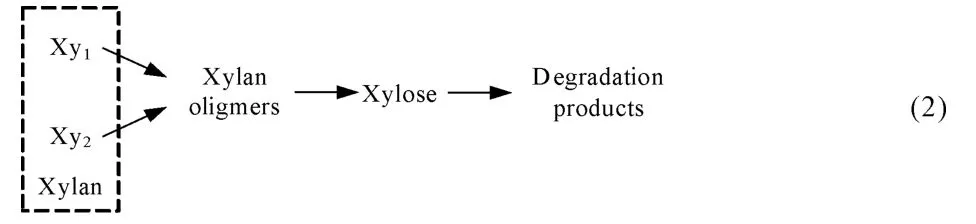
Nabarlatz等[63]將寡糖水解產物細化成3 種單體,即乙酸、木糖和阿拉伯糖,而后單糖再降解成糠醛等副產物,3種單體收率的理論計算值與實驗值相符,但寡糖構成隨時間與溫度變化的理論計算值與實驗值存在偏差,如模型(3):
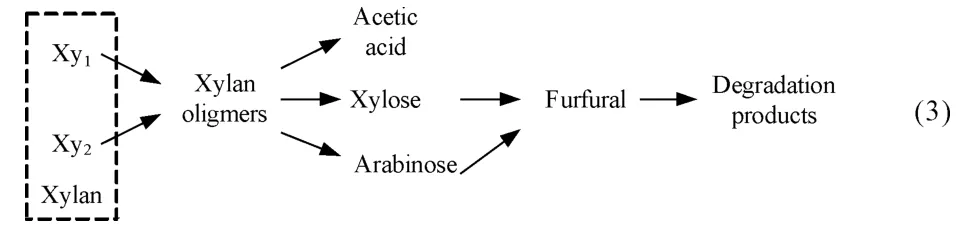
余強等[64]認為半纖維素主要發生鏈間的斷裂,產物以木聚糖為主,支鏈上的基團會脫落生成阿拉伯糖、乙酸和葡萄糖醛酸等,低聚木糖會進一步水解為木糖、小分子酸類,如甲酸是糠醛和乙醇酸的進一步降解產物,并將木聚糖和單糖放在一起考慮,如模型(4):
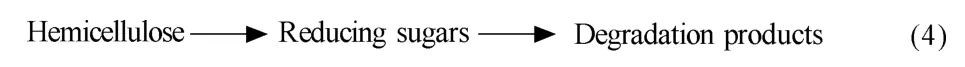
應用該模型預測水稻稈與棕櫚稈的水解,糖產率的實驗值與理論計算值較吻合[45]。不同原料、不同反應條件、不同模型的水解反應動力學參數如表2所示。

表2 不同木質纖維素原料半纖維素高溫液態水水解反應動力學參數Tab.2 Kinetic parameters for hydrolysis of hemicellulose in hot liquid water with different lignocellulose materials
3 纖維素水解反應
在半纖維素水解的同時還有一部分纖維素——無定型纖維素與半纖維素、木質素同時水解[14,66]。研究表明,無定型纖維素在180℃開始水解,結晶纖維素則在>230 ℃水解[67-68]。在240~290 ℃時,纖維素分解成低聚物、單糖和降解產物[69]。在320~350 ℃時,纖維素的水解率與寡糖的降解率隨溫度升高而增大,纖維素水解速率小于葡萄糖和纖維二糖的分解速率,產品主要是葡萄糖降解產物;在350~400 ℃時,反應速率更快,400 ℃時反應速率比320~350 ℃時快兩個數量級,此時,纖維素水解速率大于葡萄糖與纖維二糖的分解速率,產品是單糖與低聚糖[70]。
預處理的主要目標是溶解半纖維素和木質素,保留纖維素并最大限度地將其暴露出來。因此,預處理溫度應低于結晶纖維素的水解溫度(<230 ℃)。
4 結語
高溫液態水預處理是一種高效、綠色的方法,增大了木質纖維素中纖維素與酶的接觸面積,提高了酶水解效率及還原糖收率,且預處理過程中無需添加其它化學制劑。目前,預處理工藝存在水解液糖濃度較低、進料液固比較高、水解產物復雜、糖收率不高等問題。因此,應根據木質纖維素種類并結合酶水解效果共同研究合理的預處理工藝及反應器,提高預處理效果,并進一步研究半纖維素的水解機理,建立準確的動力學模型,從而指導和控制水解過程。
[1]趙巖,王洪濤,陸文靜,等.秸稈超(亞)臨界水預處理與水解技術[J].化學進展,2007,19(11):1832-1838.
[2]UEMATSU M,FRANK E U.Static dielectric constant of water and steam[J].Journal of Physical and Chemical Reference Data,1980,9(4):1291.
[3]TOOR S S,ROSENDAHL L,RUDOLF A.Hydrothermal liquefaction of biomass:A review of subcritical water technologies[J].Energy,2011,36(5):2328-2342.
[4]KRUSE A,DINJUS E.Hot compressed water as reaction medium and reactant[J].The Journal of Supercritical Fluids,2006,41(3):361-379.
[5]AKIYA N,SAVAGE P E.Roles of water for chemical reactions in high-temperature water[J].Chemical Reviews,2002,102(8):2725-2750.
[6]HERRERO M,CIFUENTES A,IBANEZ E.Sub-and supercritical fluid extraction of functional ingredients from different natural sources:Plants,food-by-products,algae and microalgae[J].Food Chemistry,2006,98(1):136-148.
[7]HAWTHORNE S B,YANG Y,MILLER D J.Extraction of organic pollutants from environmental solids with sub-and supercritical water[J].Analytical Chemistry,1994,66(18):2912-2920.
[8]BRUNNER G,MISCH B,FIRUS A,et al.Supercritical Water and Supercritical Carbon Dioxide for Cleaning of Soil Material[M]//Treatment of Contaminated Soil,Berlin:Springer-Veerlag:491-517.
[9]HODES M,MARRONE P A,HONG G T,et al.Salt precipitation and scale control in supercritical water oxidation—Part A:Fundamentals and research[J].The Journal of Supercritical Fluids,2004,29(3):265-288.
[10]MARSHALL W L,FRANCK E U.Ion product of water substance,0~1000 ℃,1~10000bars:New international formulation and its background[J].J Phys Chem Ref Data,1981,10(2):295-340.
[11]SAVAGE P E.Organic chemical reactions in supercritical water[J].Chemical Reviews,1999,99(2):603-621.
[12]劉慧屏,銀建中,徐剛.超/亞臨界水兩步法水解玉米秸稈制備還原糖[J].化學與生物工程,2010,27(11):47-50.
[13]ANDO H,SAKARI T,KOBUSHO T,et al.Decomposition behavior of plant biomass in hot-compressed water[J].Industrial&Engineering Chemistry Research,2000,39(10):3688-3693.
[14]HASHAIKEH R,FANG Z,BUTLER I S,et al.Hydrothermal dissolution of willow in hot compressed water as a model for biomass conversion[J].Fuel,2006,86(10):1614-1622.
[15]MOK W S L,ANTAL M J.Uncatalyzed solvolysis of whole biomass hemicellulose by hot compressed liquid water[J].Industrial&Engineering Chemistry Research,1992,31(4):1157-1161.
[16]YIN J Z,HAO L D,YU W,et al.Enzymatic hydrolysis enhancement of corn lignocellulose by supercritical CO2combined with ultrasound pretreatment[J].Chinese Journal of Catalysis,2014,35:763-769.
[17]KRISTENSEN J B,THYGESEN L G,FELBY C,et al.Cell-wall structural changes in wheat straw pretreated for bioethanol production[J].Biotechnol Biofuels,2008,1(1):5.
[18]HANSEN M A T,KRISTENSEN J B,FELBY C,et al.Pretreatment and enzymatic hydrolysis of wheat straw(TriticumaestivumL.)—The impact of lignin relocation and plant tissues on enzymatic accessibility[J].Bioresource Technology,2010,102(3):2804-2811.
[19]YANG B,WYMAN C E.Effect of xylan and lignin removal by batch and flow through pretreatment on the enzymatic digestibility of corn stover cellulose[J].Biotechnology and Bioengineering,2004,86(1):88-98.
[20]ZENG M J,MOSIER N S,HUANG C P,et al.Microscopic examination of changes of plant cell structure in corn stover due to hot water pretreatment and enzymatic hydrolysis[J].Biotechnology and Bioengineering,2007,97(2):265-278.
[21]XIAO X,BIAN J,LI M F,et al.Enhanced enzymatic hydrolysis of bamboo(DendrocalamusgiganteusMunro)culm by hydrothermal pretreatment[J].Bioresource Technology,2014,159:41-47.
[22]LASER M,SCHULMAN D,ALLEN S G,et al.A comparison of liquid hot water and steam pretreatments of sugar cane bagasse for bioconversion to ethanol[J].Bioresource Technology,2002,81(1):33-44.
[23]SASAKI M,ADSCHIRI T,ARAI K.Fractionation of sugarcane bagasse by hydrothermal treatment[J].Bioresource Technology,2002,86(3):301-304.
[24]DONOHOE B S,DECKER S R,TUCKER M P,et al.Visualizing lignin coalescence and migration through maize cell walls following thermochemical pretreatment[J].Biotechnology and Bioengineering,2008,101(5):913-925.
[25]YU Q,ZHUANG X S,YUAN Z H,et al.Two-step liquid hot water pretreatment ofEucalyptusgrandisto enhance sugar recovery and enzymatic digestibility of cellulose[J].Bioresource Technology,2009,101(13):4895-4899.
[26]ALVIRA P,TOMAS-PEJO E,BALLESTEROS M,et al.Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis:A review[J].Bioresource Technology,2009,101(13):4851-4861.
[27]KIM Y,MOSIER N S,LADISCH M R.Enzymatic digestion of liquid hot water pretreated hybrid poplar[J].Biotechnology Progress,2009,25(2):340-348.
[28]SREENATH H K,KOEGEL R G,MOLDES A B,et al.Enzymic saccharification of alfalfa fibre after liquid hot water pretreatment[J].Process Biochem,1999,35(1-2):33-41.
[29]PHAIBOONSILPA N,OGURA M,YAMAUCHI K,et al.Twostep hydrolysis of rice(Oryzasativa)husk as treated by semiflow hot-compressed water[J].Industrial Crops and Products,2013,49:484-491.
[30]PHAIBOONSILPA N,YAMAUCHI K,LU X,et al.Two-step hydrolysis of Japanese cedar as treated by semi-flow hot-compressed water[J].Journal of Wood Science,2010,56(4):331-338.
[31]PEREZ J A,BALLESTEROS I,BALLESTEROS M,et al.Optimizing liquid hot water pretreatment conditions to enhance sugar recovery from wheat straw for fuel-ethanol production[J].Fuel,2008,87(17):3640-3647.
[32]YU Q,ZHUANG X S,YUAN Z H,et al.Pretreatment of sugarcane bagasse with liquid hot water and aqueous ammonia[J].Bioresource Technology,2013,144:210-215.
[33]LIU L,SUN J S,CAI C Y,et al.Corn stover pretreatment by inorganic salts and its effects on hemicellulose and cellulose degradation[J].Bioresource Technology,2009,100(23):5865-5871.
[34]Lü H S,REN M M,ZHANG M H,et al.Pretreatment of corn stover using supercritical CO2with water-ethanol as co-solvent[J].Chinese Journal of Chemical Engineering,2013,21(5):551-557.
[35]PHAIBOONSILPA N,SAKA S.Hydrolysis behaviors of lignocellulosics as treated by two-step semi-flow hot-compressed water[J].Cellulose,2012,48(44.8):p.31.3.
[36]IMMAN S,ARNTHONG J,BURAPATANA V,et al.Autohydrolysis of tropical agricultural residues by compressed liquid hot water pretreatment[J].Applied Biochemistry and Biotechnology,2013,170(8):1982-1995.
[37]NABARLATZ D,EBRINGEROVA A,MONTANE D.Autohydrolysis of agricultural by-products for the production of xylooligosaccharides[J].Carbohydrate Polymers,2006,69(1):20-28.
[38]LIU C,WYMAN C E.The effect of flow rate of compressed hot water on xylan,lignin,and total mass removal from corn stover[J].Industrial & Engineering Chemistry Research,2003,42(21):5409-5416.
[39]BOBLETER O,BONN G,PRUTSCH W.Steam explosion-hydro-thermolysis-organosolv.A comparison[C]//Steam Explosion Techniques.Gordon and Breach,Philadelphia,1991:59-82.
[40]STUHLER S L.Effects of solids concentration,acetylation,and transient heat transfer on uncatalyzed batch pretreatment of corn stover[D].Dartmouth College,2002.
[41]PEREZ J A,GONZALEZ A,OLIVA J M,et al.Effect of process variables on liquid hot water pretreatment of wheat straw for bioconversion to fuel-ethanol in a batch reactor[J].Journal of Chemical Technology and Biotechnology,2007,82(10):929-938.
[42]OVEREND R P,CHOMET E,GASCOIGNE J A.Fractionation of lignocellulosics by steam-aqueous pretreatments[J].Philosophical Transactions of the Royal Society of London A,1987,321(1561):523-536.
[43]LI X,CONVERSE A O,WYMAN C E.Characterization of molecular weight distribution of oligomers from autocatalyzed batch hydrolysis of xylan[J].Applied Biochemistry and Biotechnology,2003,107(1):515-522.
[44]ROGALINSKI T,INGRAM T,BRUNNER G.Hydrolysis of lignocellulosic biomass in water under elevated temperatures and pressures[J].The Journal of Supercritical Fluids,2008,47(1):54-63.
[45]ZHUANG X S,YUAN A H,MA L L,et al.Kinetic study of hydrolysis of xylan and agricultural wastes with hot liquid water[J].Biotechnology Advances,2009,27(5):578-582.
[46]JACOBSEN S E,WYMAN C E.Xylose monomer and oligomer yields for uncatalyzed hydrolysis of sugarcane bagasse hemicellulose at varying solids concentration[J].Industrial &Engineering Chemistry Research,2002,41(6):1454-1461.
[47]KROGELL J,KOROTKOVA E,ERANEN K,et al.Intensification of hemicellulose hot-water extraction from spruce wood in a batch extractor—Effects of wood particle size[J].Bioresource Technology,2013,143:212-220.
[48]TILLMAN L M,LEE Y Y,TORGET R.Effect of transient acid diffusion on pretreatment/hydrolysis of hardwood hemicellulose[J].Applied Biochemistry and Biotechnology,1990,24(1):103-113.
[49]LU X,YAMAUCHI K,PHAIBOONSILPA N,et al.Two-step hydrolysis of Japanese beech as treated by semi-flow hot-compressed water[J].Journal of Wood Science,2009,55(5):367-375.
[50]INGRAM T,ROGALINSKI T,BOCKEMUHL V,et al.Semicontinuous liquid hot water pretreatment of rye straw[J].The Journal of Supercritical Fluids,2008,48(3):238-246.
[51]LIU C G,WYMAN C E.Partial flow of compressed-hot water through corn stover to enhance hemicellulose sugar recovery and enzymatic digestibility of cellulose[J].Bioresource Technology,2005,96(18):1978-1985.
[52]MOSIER N,HENDRICKSON R,HO N,et al.Optimization of pH controlled liquid hot water pretreatment of corn stover[J].Bioresource Technology,2005,96(18):1986-1993.
[53]HUNTER S E,SAVAGE P.Quantifying rate enhancements for acid catalysis in CO2-enriched high-temperature water[J].AIChE Journal,2008,54(2)516-528.
[54]van WALSUM G P,SHI H.Carbonic acid enhancement of hydrolysis in aqueous pretreatment of corn stover[J].Bioresource Technology,2004,93(3):217-226.
[55]GURGEL L V A,PIMENTA M T B,da SILVA CURVELO A A.Enhancing liquid hot water(LHW)pretreatment of sugarcane bagasse by high pressure carbon dioxide(HP-CO2)[J].Industrial Crops and Products,2014,57:141-149.
[56]McWILLIAMS R C,van WALSUM G P.Comparison of aspen wood hydrolysates produced by pretreatment with liquid hot water and carbonic acid[J].Applied Biochemistry and Biotechnology,2002,98-100:109-121.
[57]VARHEGYI G,ANTAL M J,SZEKELY T,et al.Simultaneous thermogravimetric-mass spectrometric studies of the thermal decomposition of biopolymers.1.Avicel cellulose in the presence and absence of catalysts[J].Energy & Fuels,1988,2(3):267-272.
[58]LIU C G,WYMAN C E.The enhancement of xylose monomer and xylotriose degradation by inorganic salts in aqueous solutions at 180 ℃[J].Carbohydrate Research,2006,341(15):2550-2556.
[59]YU Q,ZHUANG X S,YUAN Z H,et al.The effect of metal salts on the decomposition of sweet sorghum bagasse in flowthrough liquid hot water[J].Bioresource Technology,2011,102(3):3445-3450.
[60]INOUE H,YANO S,ENDO T,et al.Combining hot-compressed water and ball milling pretreatments to improve the efficiency of the enzymatic hydrolysis of eucalyptus[J].Biotechnology Biofuels,2008,1(1):2.
[61]金強,張紅漫,嚴立石,等.生物質半纖維素稀酸水解反應[J].化學進展,2010,22(4):654-662.
[62]KOBAYASHI T,SAKAI Y B.Hydrolysis rate of pentosan of hardwood in dilute sulfuric acid[J].Agr Chem Soc Japan,1956,20(1):1-7.
[63]NABARLATZ D,FARRIOL X,MONTANE D.Kinetic modeling of the autohydrolysis of lignocellulosic biomass for the production of hemicellulose-derived oligosaccharides[J].Industrial&Engineering Chemistry Research,2004,43(15):4124-4131.
[64]余強,莊新姝,袁振宏,等.高溫液態水中甜高粱渣半纖維素水解及其機理[J].化工學報,2012,63(2):599-605.
[65]徐明忠,莊新姝,袁振宏,等.農業廢棄物高溫液態水水解動力學[J].過程工程學報,2008,8(5):941-944.
[66]ALLEN S G,KAM L C,ZEMANN A J,et al.Fractionation of sugar cane with hot,compressed,liquid water[J].Industrial &Engineering Chemistry Research,1996,35(8):2709-2715.
[67]YU Y,WU H.Significant differences in the hydrolysis behavior of amorphous and crystalline portions within microcrystalline cellulose in hot-compressed water[J].Industrial & Engineering Chemistry Research,2010,49(8):3902-3909.
[68]YU Y,WU H.Evolution of primary liquid products and evidence of in situ structural changes in cellulose with conversion during hydrolysis in hot-compressed water[J].Industrial &Engineering Chemistry Research,2010,49(8):3919-3925.
[69]KAMIO E,SATO H,TAKAHASHI S,et al.Liquefaction of cellulose in hot compressed water under variable temperatures[J].Industrial & Engineering Chemistry Research,2006,45(14):4944-4953.
[70]SASAKI M,FANG Z,FUKUSHIMA Y,et al.Dissolution and hydrolysis of cellulose in subcritical and supercritical water[J].Industrial & Engineering Chemistry Research,2000,39(8):2883-2890.

