紅皮土豆純生清酒釀造工藝研究
劉林明,王 燕,楊平平,張海濤,孫自頂(齊魯工業大學 食品與生物工程學院,山東 濟南 250300)
紅皮土豆純生清酒釀造工藝研究
劉林明,王 燕,楊平平,張海濤,孫自頂
(齊魯工業大學 食品與生物工程學院,山東 濟南 250300)
以西藏紅皮土豆為原料,通過單因素實驗和正交試驗,釀制純生清酒,以膜過濾濾除菌體,得出土豆純生清酒最佳釀造工藝條件為:酵母添加量0.2%,主發酵溫度28℃,主發酵時間4 d,后發酵溫度11~15℃,后發酵時間14 d。實驗結果為紅皮土豆進一步工業化生產提供了理論依據。
紅皮土豆;純生清酒;發酵工藝
隨著健康消費觀念的提高,低度酒在酒市場所占的份額逐年提高,開發研制新型低度保健酒成為釀酒行業的一個研究熱點[1]。紅皮土豆含淀粉和花青素,且富含多種微量元素,具有抗氧化作用,防癌抗癌、美容養顏、護心降血壓、食療效果極佳。西藏獨特的氣候地質條件,適合紅皮土豆生長,每年產量很高,且紅皮土豆鈣、鐵含量高,對人體補充鈣、鐵元素有很好的作用。目前國內外尚沒有關于用紅皮土豆做飲料酒的研究報道。本研究以西藏紅皮土豆為原料,采用新型清酒工藝釀造紅皮土豆清酒,研制的土豆清酒具有保健功能,營養豐富、色澤鮮亮、酒性醇和。
1 材料與方法
1.1 材料與儀器
1.1.1 材料
紅皮土豆:西藏合作企業提供;釀酒酵母 Y1、Y2、Y3:實驗室保藏;耐高溫 α-淀粉酶:諾維信公司;糖化酶:諾維信公司;其他試劑均為分析純。
1.1.2 儀器
QUINTIX124-1CN電子天平:賽多利斯科學儀器(北京)有限公司;DZKW-C電子恒溫水浴鍋:黃驊市卸甲綜合電器廠;SHP-150生化培養箱:上海精宏實驗設備有限公司;LDZX-50KBS立式高壓蒸汽滅菌鍋:上海申安醫療器械廠;PB-10標準型 pH計:德國賽多利斯集團;TR501VATC酒精濃度計:深圳市同奧科技有限公司;SW-CJ-1FD潔凈工作臺:蘇州安泰空氣技術有限公司;L1523發酵罐:瑞士比歐生物工程公司;UV-5100B紫外可見分光光度計:上海精密儀器有限公司。
1.2 工藝流程及操作要點
1.2.1 工藝流程
土豆清酒釀造工藝流程見圖1。
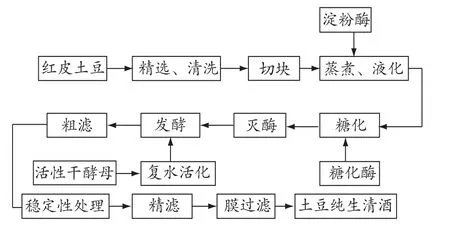
圖1 發酵工藝流程
1.2.2 操作要點
蒸煮、液化:土豆和水的比例為1∶3,煮熟,采用邊煮邊液化方式,蒸煮 10 min后,調節pH值到6.0,加入耐高溫 α-淀粉酶,繼續蒸煮同時注意攪拌打碎成漿。
糖化:漿液冷卻到60℃,調節pH值至4~5,加入糖化酶,每克土豆添加 100 U酶,60℃恒溫處理2 h。
滅酶:漿液加熱沸騰,維持10 min。
發酵:發酵分為主發酵和后發酵。
粗濾:6層紗布過濾除渣。
穩定性處理:混合添加單寧、明膠去除蛋白質,添加PVPP(交聯聚乙烯吡咯烷酮)和硅藻土吸附酒中多酚物質[2]。
精濾:濾膜孔徑0.8 μm。
膜過濾:濾膜的孔徑最大不超過0.45 μm。
1.3 分析方法
土豆淀粉含量的測定參照國家標準GB/T 5514—2008《糧油檢驗 糧食、油料中淀粉含量測定》[3];發酵過程中定期取樣檢測,理化指標測定參照國家標準 GB/T 13662—2008[4];成品酒中甲醇含量測定參照國家標準 GB/T 5009.48—2003[5]。
2 結果與討論
2.1 紅皮土豆淀粉含量的測定
按照國標方法測定土豆淀粉含量X,平行測定4次,得到的數值分別為33.20%、33.61%、33.27%、33.51%,依次取兩組數據 Xa和 Xb。 Xa-Xb/[(X1+X2)/2]×100%<5%數據有效,所以所測土豆淀粉含量:X=(X1+X2+X3+X4)/4≈33.40%。
2.2 液化工藝參數的確定
由于 α-淀粉酶添加量(每克土豆添加量)、液化時間、溫度和 pH值四個因素共同影響土豆液化,實驗本著節約能源、縮短周期的原則,采用邊糊化邊液化的方式,所用的酶為耐高溫 α-淀粉酶,因此溫度不在優化考慮范圍,為全面考慮其他三個因素的影響,在預實驗基礎上,以酸堿調節 pH值,以水解度為指標設計 L9(33)正交試驗,正交試驗設計見表1,正交試驗分析結果見表2。
由極差分析可知,各因素對液化效果的影響程度順序為:pH值 >α-淀粉酶添加量 >溫度,糖化的最優方案是 A2B3C2,即每克土豆原料添加 α-淀粉酶8 U,pH值控制在6,酶作用時間為0.5 h。
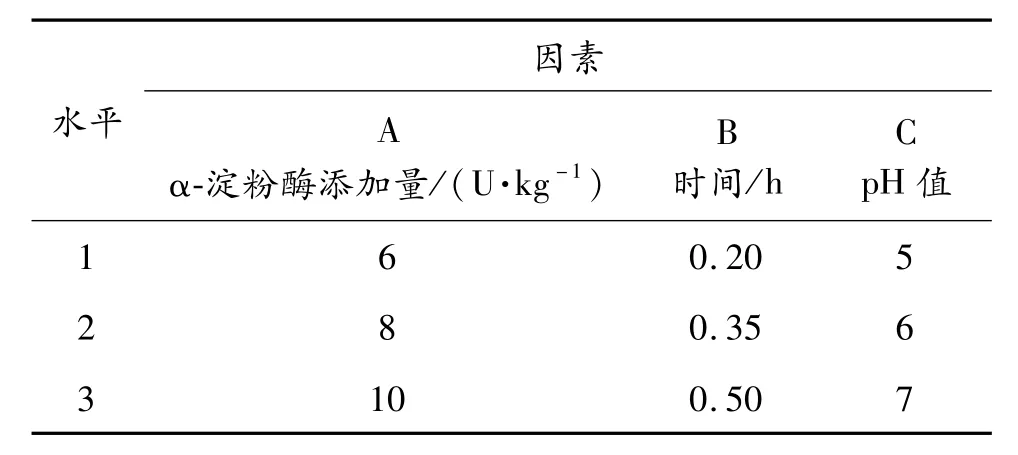
表1 α-淀粉酶液化條件正交試驗設計
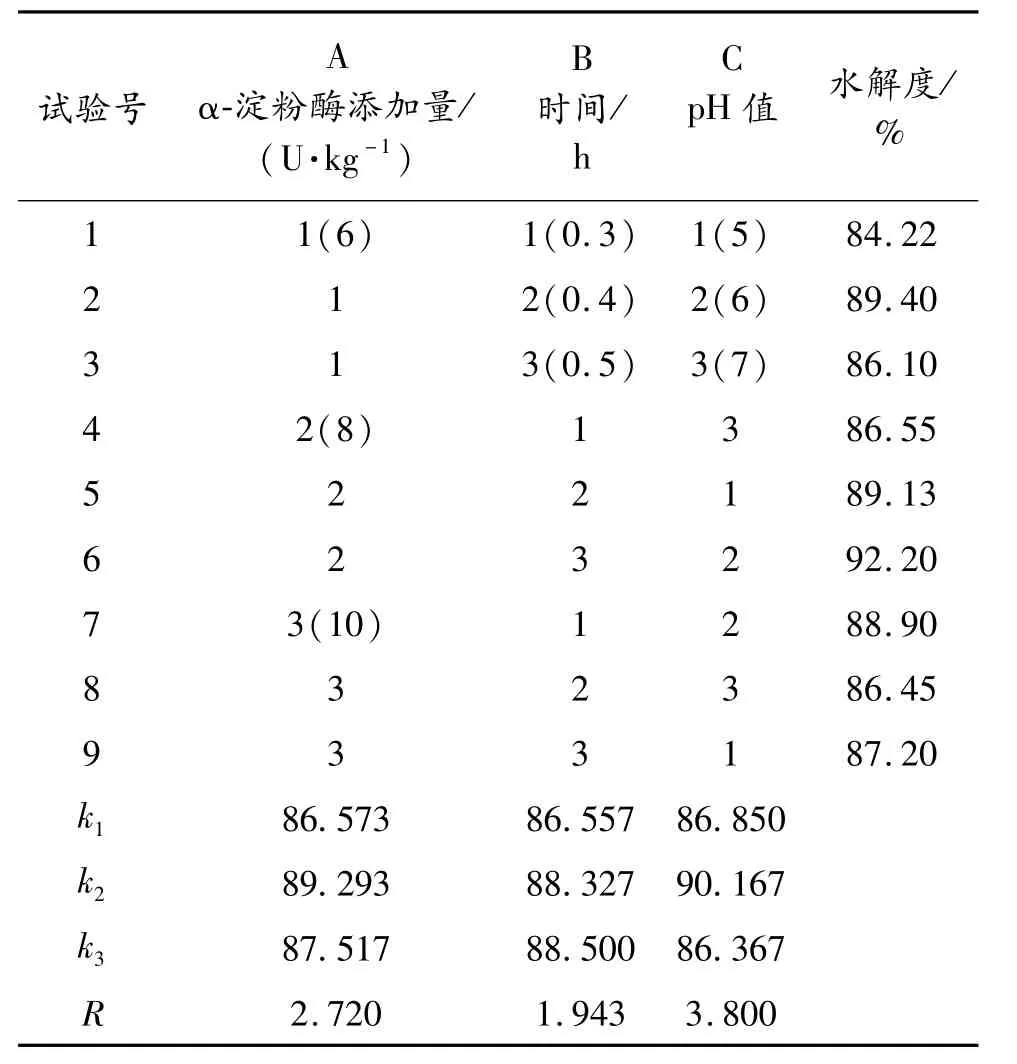
表2 α-淀粉酶液化條件正交試驗結果
2.3 糖化工藝參數的確定
用糖化酶將液化充分的土豆漿液糖化,以糖化酶添加量、時間、pH值、溫度為影響因素,3次實驗取平均值作為實驗數據,還原糖含量作為指標設計L9(34)正交試驗,正交試驗設計方案及結果見表3。
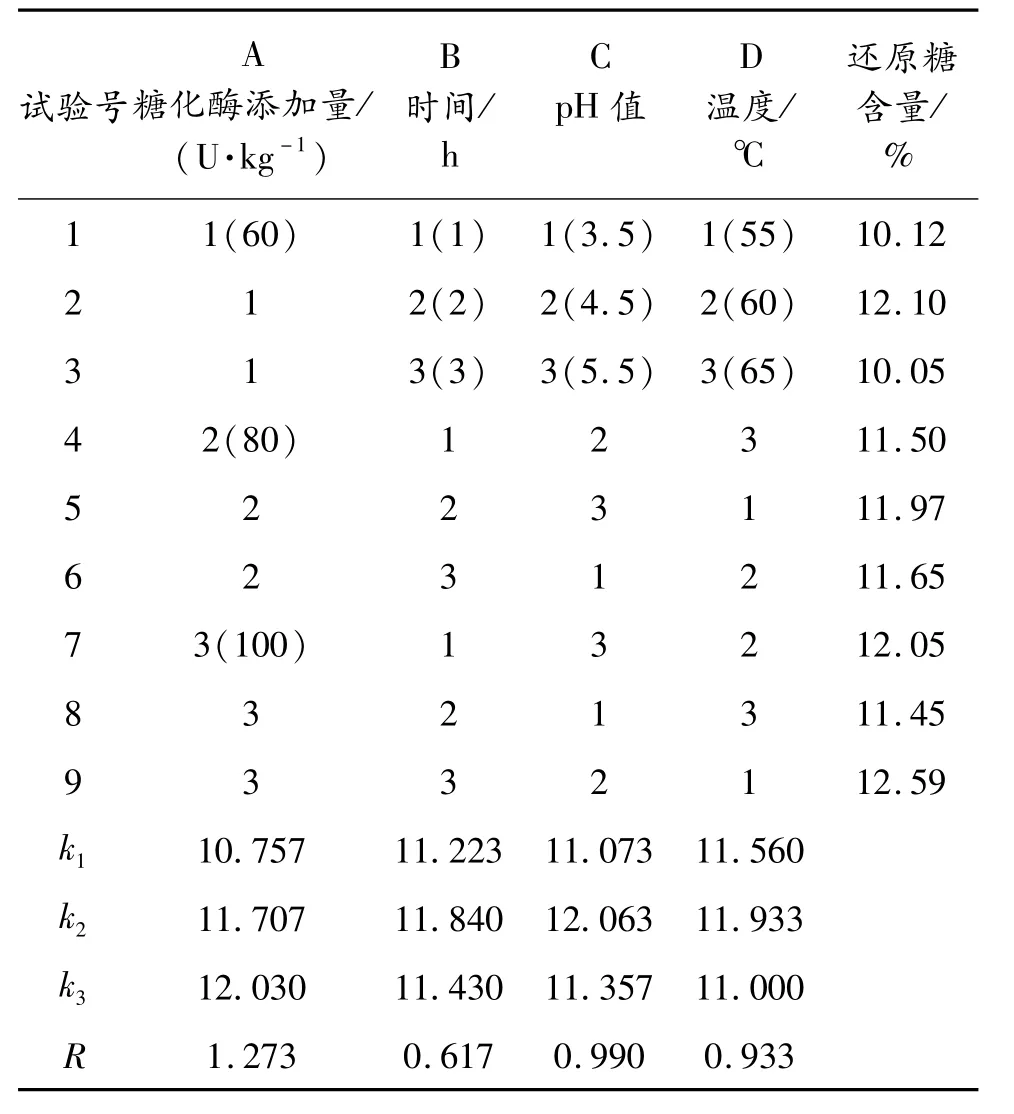
表3 糖化酶糖化條件的正交試驗設計及結果
由表3中極差 R分析可知,糖化酶添加量對糖化影響效果最大,其次是溫度和pH值,影響最小的是酶作用時間。比較 k值可以得出最優的組合方式是A3B2C2D2,在此條件下實驗測得還原糖含量為13.25%,高于其他所有組次,所以最優的糖化條件為:每克土豆添加糖化酶量100 U,pH值4.5,60℃保溫處理2 h。
2.4 發酵工藝參數的確定
發酵是整個生產過程中最重要的一環,直接影響成品酒的質量[6]。在研究中,將對發酵結果可能產生較大影響的酵母菌種類、接種量、初始 pH值、溫度、發酵時間作為考察因子,以成品酒的理化指標作為指標設計單因素實驗和正交試驗,最終確定最優的發酵工藝參數。
2.4.1 單因素實驗設計
2.4.1.1 酵母菌的選擇對酒的影響
將糖化好的土豆漿液分別接種釀酒酵母 Y1、Y2、Y3,接種量均為0.2%,28℃發酵 4 d,后轉移到11~15℃下發酵14 d,比較成品酒的感官特性和理化特性。比較三種酵母發酵的成品酒:均為清亮透明的淡黃色,有特有的土豆香氣。Y1條件下的酒口感略酸,酒味重,口感較單一,其余兩種條件下的酒口感柔和,酸甜適口。比較酒度和 pH值,結果如圖2所示。
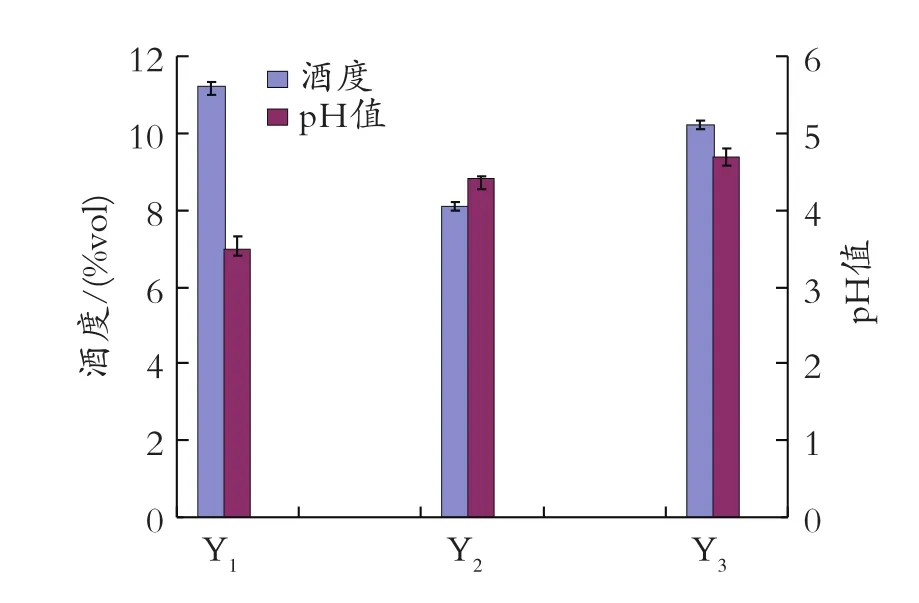
圖2 不同酵母菌對酒度和 pH值的影響
由圖 2可知,Y1和 Y3條件的清酒酒度高,Y2條件的酒度偏低,殘糖高,結合感官特性結果,Y3條件下釀造的紅皮土豆清酒最好。
2.4.1.2 酵母菌接種量對酒的影響
接種酵母 Y3,改變接種量,28℃發酵4 d,后轉移到11~15℃下發酵14 d,比較成品酒的感官特性和理化特性,結果見表4。
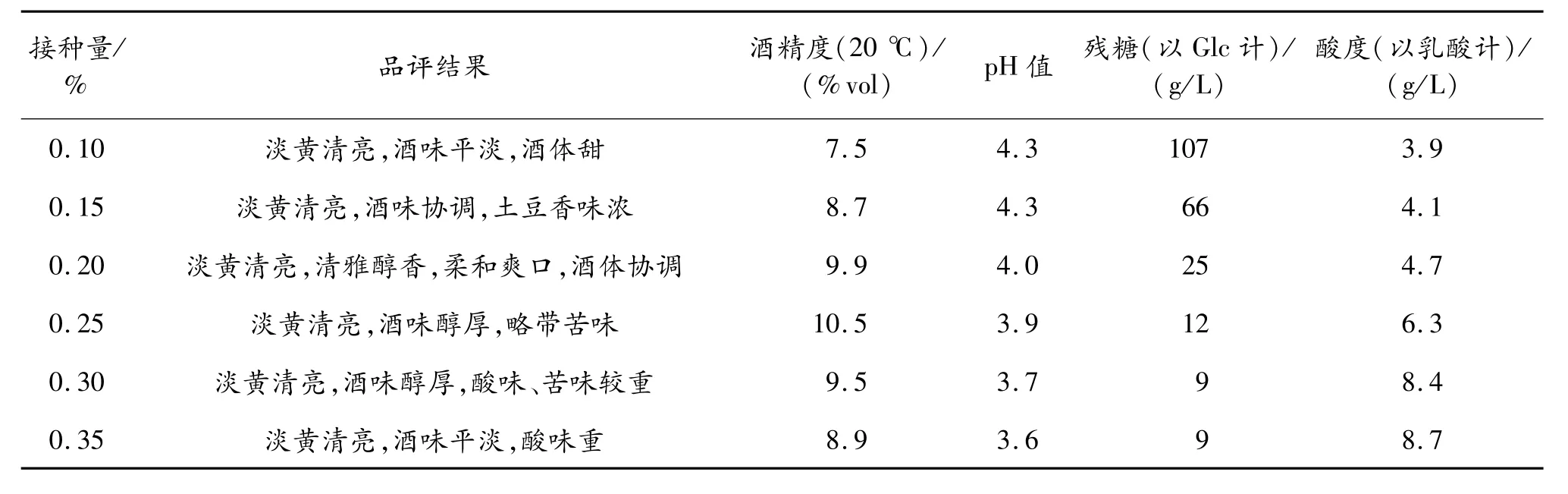
表4 酵母菌接種量對酒的影響
從表4可以看出,當接種量小于0.15%時,發酵緩慢,酒度較低;當接種量大于0.25%時,酒體發酸,原因可能是過高的接種量導致發酵過快,發酵后期殘糖較少,酵母開始大量死亡;當接種量控制在0.15%~0.25%時,酒的品質較高,其中接種量為0.2%時最好。
2.4.1.3 初始pH值對酒的影響
接種酵母 Y3,改變 pH值,28℃發酵4 d,后轉移到11~15℃下發酵14 d,比較成品酒的品質發現pH值在3.5~6.5時,酒的感官特性和理化指標變化不大,這個范圍內的初始 pH值對成品酒的影響不大,按照簡化原則,初始 pH值不再調整。
2.4.1.4 主發酵溫度對酒的影響
主發酵溫度分別為22、24、26、28、30、32、34℃,其他條件均按前面優化后條件,28℃發酵4 d,后轉移到11~15℃下發酵14 d,比較酒度和酸度,結果見圖3。
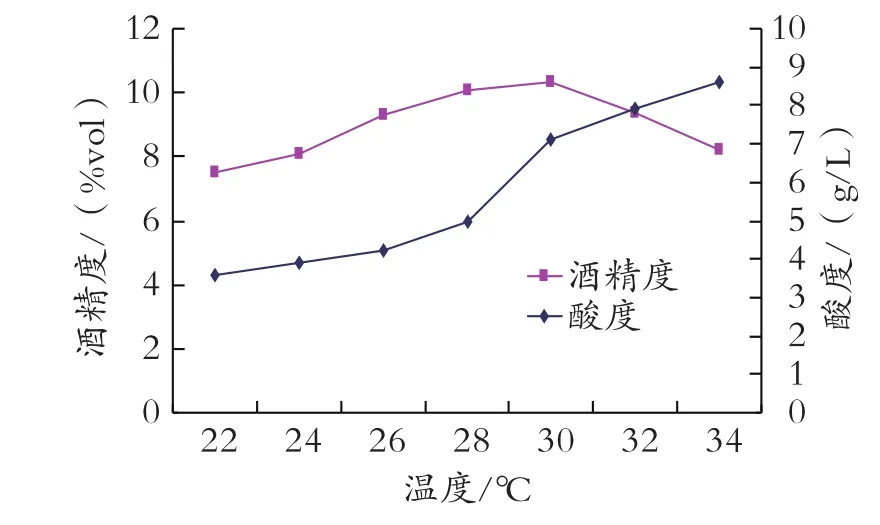
圖3 主發酵溫度對酒度和酸度的影響
從圖3可以看出,主發酵溫度控制在28~30℃時,發酵徹底,酒度較高,但溫度超過28℃時酸度開始明顯上升,對28℃和30℃發酵條件下的酒品評比較,30℃發酵的酒酸味明顯重,且有更濃的苦味;28℃發酵的酒酒味醇厚,酒體協調,酸度適中,因此選用28℃為主發酵溫度較適宜。為增加酒體協調感,進一步豐富酒的口感,主發酵完全后把醪液放置于11~15℃的低溫下后再發酵14 d,這樣經過后酵的酒口感豐富,酒體更協調,酒味也更醇厚。
2.4.1.5 主發酵時間對酒的影響
按照上述優化的條件發酵,從發酵第二天開始,每隔1天進行一次檢測,直到酒度變化不大后繼續發酵2 d,檢測結果如圖4所示。
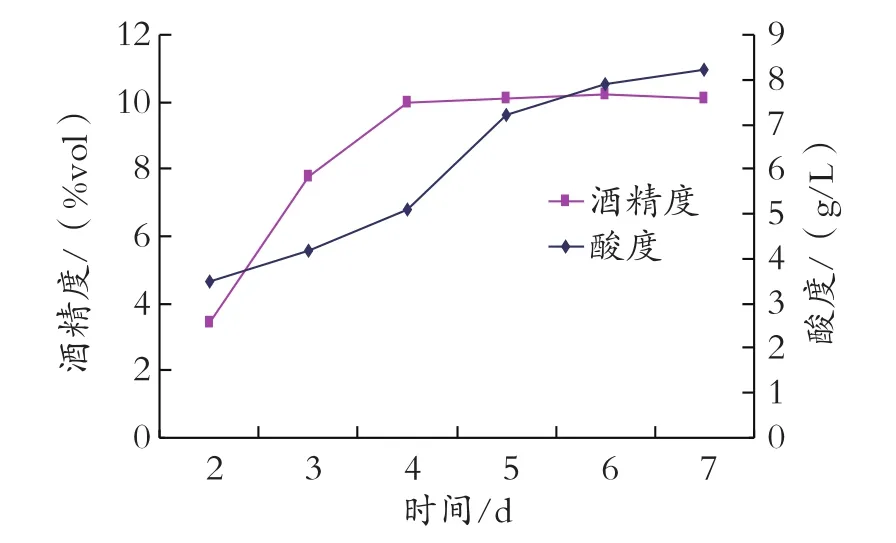
圖4 主發酵時間對酒度和酸度的影響
從圖4可知,當發酵進行到第四天時,主發酵基本結束,此后酒度變化不大,酸度有較明顯上升。對這些批次的酒進行感官比較后,發現發酵 4 d的酒口感明顯優于其他發酵時間的酒。因此主發酵時間控制在4 d最好。
2.4.2 正交試驗設計
參考單因素實驗結果,以酵母菌種類、接種量、溫度、主發酵時間作為考察因子,3次實驗取平均值作為實驗數據,品評結果作為指標設計 L9(34)正交試驗,品評結果參照黃酒評定標準采用打分制,正交試驗設計方案及結果見表5。
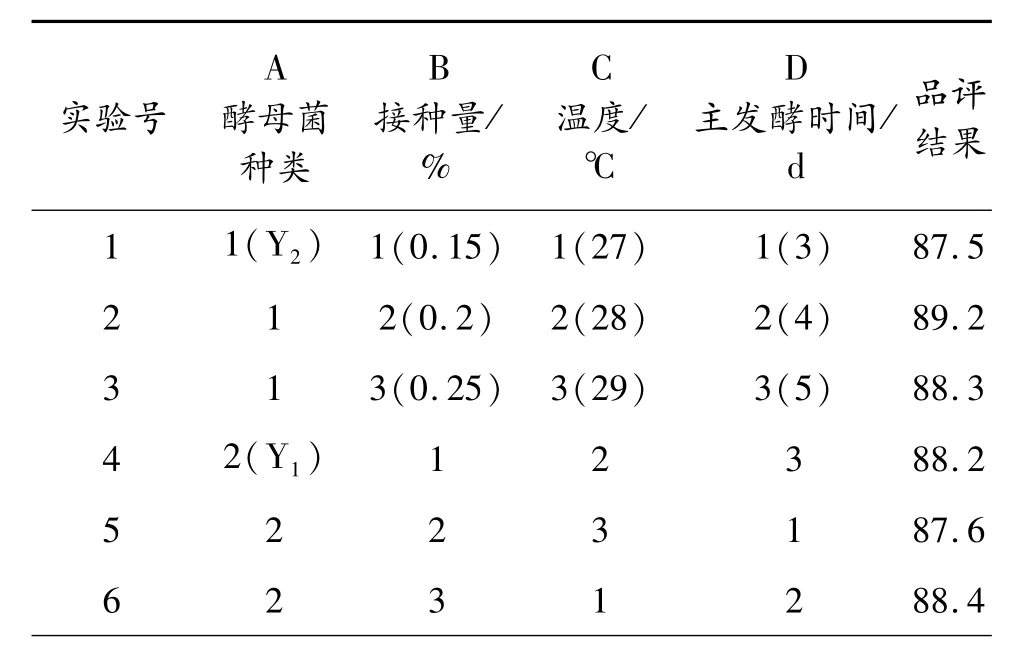
表5 發酵工藝正交試驗設計及結果
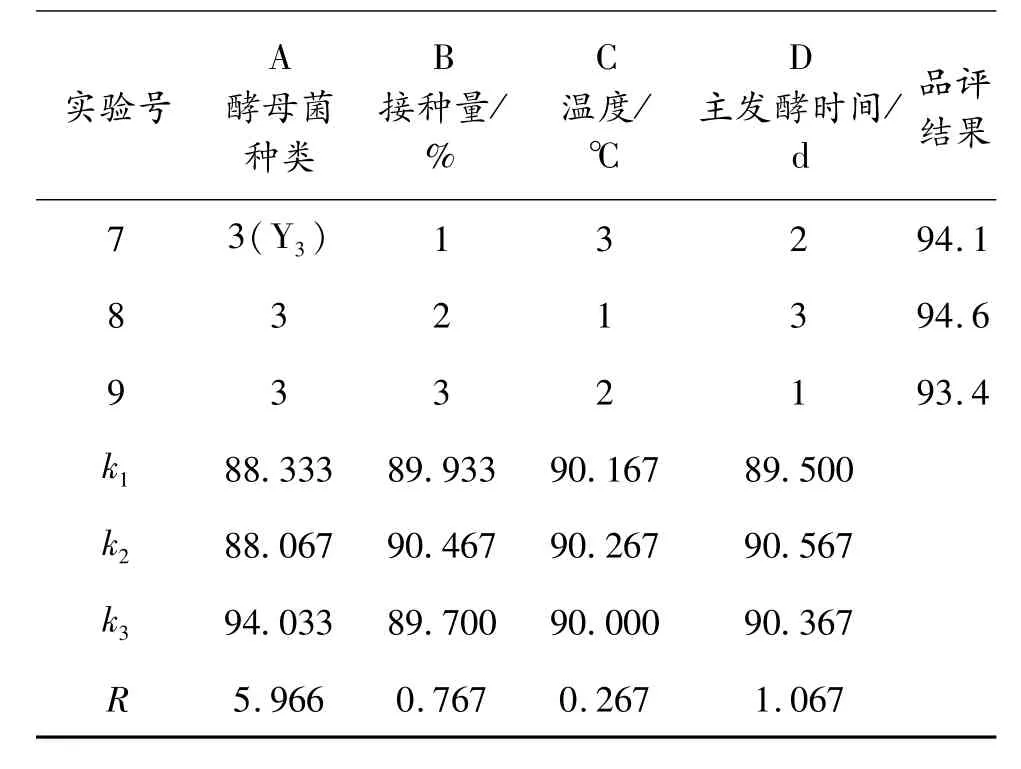
續表5
由表5可知,酵母菌種類對發酵影響最大,其次是主發酵時間和接種量。比較k值可以得出最優的組合方式是 A3B2C2D2,在此條件下進行試驗,品評打分成績96.2,高于其他所有組次,所以最優的發酵條件為:選用酵母 Y3作為菌種,接種量為 0.2%,28℃下發酵4 d后,轉移到 11~15℃條件下發酵14 d。
2.5 甲醇含量的測定
參照國家標準 GB/T 5009.48—2003,分光光度法測定成品酒中甲醇含量,配制甲醇標準溶液,用2 mL比色皿,在590 nm處測定吸光度,繪制標準曲線如圖5所示。
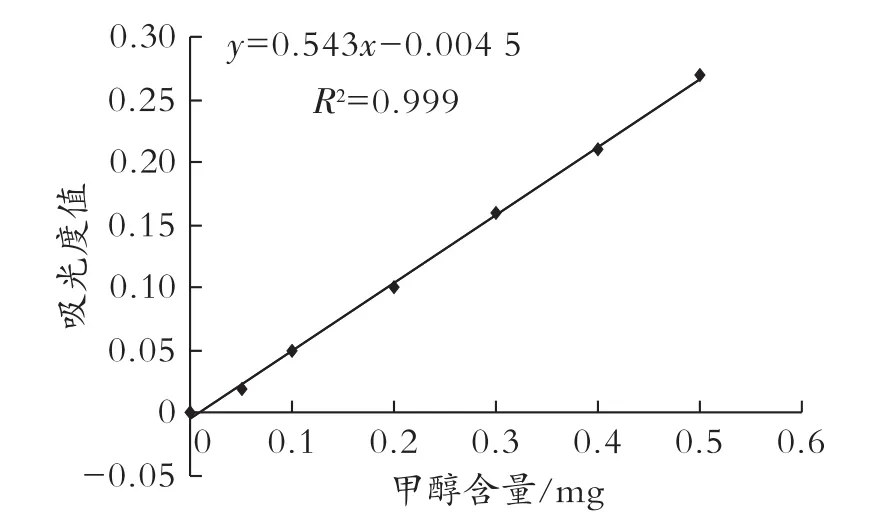
圖5 甲醇標準曲線的測定
依次取2 mL酒樣置于3個比色皿中,按照國標法測定各自吸光度,測得數值依次為 0.98、0.96、0.95,代入回歸方程求得甲醇含量依次為1.82、1.78、1.76 mg。將求得的甲醇數值代入如下公式測定樣品酒中甲醇的含量:X=m/(V×1000)×100,計算得出 X1、X2、X3分別為 0.091、0.089、0.088,平均數為0.089,即每100 mL酒中甲醇含量為0.089 mg,遠低于每100 mL酒中甲醇含量不得超過0.2 mg的標準,達到釀造酒國家標準。
2.6 花青素含量的測定
配制不同濃度錦葵色素標準溶液,濃度依次為0、3、6、9、12、15、18、21、24 μg/mL,在546 nm處測定吸光度,繪制標準曲線如圖6所示。
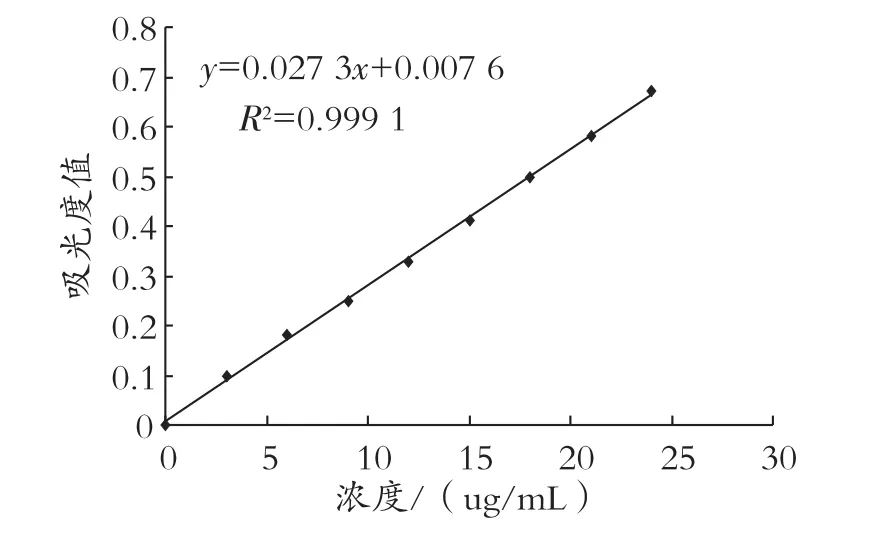
圖6 花青素標準曲線的測定
平行三組測定待測酒樣的吸光度,代入回歸方程求得濃度,三數值求平均值得出酒樣中花青素的濃度為4.3 μg/mL。
2.7 穩定性處理
提高清酒穩定性一直是清酒生產中一項重要的課題,清酒出現不同程度的渾濁、沉淀現象嚴重影響產品的感官品質和銷售。渾濁分為生物渾濁和非生物渾濁,前者是由微生物污染引起的,可通過徹底滅菌和預防雜菌污染來解決;后者則是由蛋白質、多酚等引起的,實驗采用混合添加單寧、明膠去除蛋白質,添加 PVPP(交聯聚乙烯吡咯烷酮)和硅藻土吸附酒中多酚物質,經過穩定性處理的酒樣室溫密封存放3個月,酒樣澄清,口感更佳,適宜存儲后飲用。
3 結論
本研究采用邊蒸煮邊液化操作的方法,液化充分,且有效縮短了工藝流程,提高了能源利用率,節能省時。研究結果表明,采用酵母菌 Y3發酵,接種量為0.2%,28℃下發酵4 d后,轉移到11~15℃下后發酵14 d左右,可得到較高品質的土豆清酒,生產出來的酒清亮透明,呈淡黃色,酒體協調,清雅醇香,具有獨特的紅皮土豆風味。本研究中未經巴氏滅菌或瞬時高溫滅菌,而采用物理方法除菌,保證了純生清酒的“生”,口感新鮮,酒香清醇,口味柔和,營養豐富。終濾膜過濾前,必須經過粗濾和精濾,之所以這樣做是為了減輕終過濾膜的壓力,防止濾膜超負荷引起損壞。終過濾膜的孔徑最大不超過0.45 μm。
[1]楊瑞,蘇慧,張偉.低度紫薯酒及其發酵規律的研究[J].釀酒科技,2008,(9):55-57.
[2]喇錄忠,李善文.青稞清酒混濁的防止措施[J].釀酒,2013,(4):64-65.
[3]GB/T 5514—2008糧油檢驗 糧食、油料中淀粉含量測定[S].
[4]GB/T 13662—2008黃酒[S].
[5]GB/T 5009.48—2003蒸餾酒與配制酒衛生標準的分析方法[S].
[6]胡普信.純生黃酒工藝的研究[J].食品與發酵工業,2010,(8):93-96.
[責任編輯:王東霞]
Study on Brewing Technology of Red Potatoes Draft Sake
LIU Lin-ming,WANG Yan,YANG Ping-ping,ZHANG Hai-tao,SUN Zi-ding
(School of Food and Biological Engineering,Qilu University of Technology,Jinan 250300,Shandong,China)
With red potatoes from Tibet as raw material,the optimization of fermentation conditions was investigated by single factor experiments and orthogonal experiments.The optimum conditions for the brewing process were as following:yeast of 0.2%,main fermentation temperature of 28℃,main fermentation time of 4 d,later fermentation temperature of 11~15℃,later fermentation time of 14 d.The results provide theoretical support for the further industrialized production of red potatoes.
red potatoes;draft sake;fermentation condition
TS262.4
:A
:1006-8481(2015)02-0018-05
2014-07-16
劉林明(1988—),男,齊魯工業大學食品與生物工程學院在讀碩士研究生;王燕(1961—),女,齊魯工業大學食品與生物工程學院教授,博士。

