破骨樣細胞中骨保護素和NF-κB配體受體的表達及其意義
破骨樣細胞中骨保護素和 NF-κB配體受體的表達及其意義
聶斌管思明1張韶英方欣1周韶瓊1
(華中科技大學同濟醫學院附屬武漢市中心醫院老年病科,湖北武漢430014)
摘要〔〕目的探討破骨樣細胞中骨保護素(OPG)和 NF-κB配體受體(RANKL)表達情況。方法單獨培養骨髓單核細胞前體,用巨噬細胞集落刺激因子(M-CSF)和維生素D誘導其轉化為破骨樣細胞,在0、5、10、15 d用光鏡觀察和TRAP染色(抗酒石酸染色)評估破骨樣細胞的轉化程度,用RT-PCR檢測OPG和RANKL的表達情況;然后構建主動脈中膜平滑肌細胞(SMC)與骨髓單核細胞前體共培養的模型,用維生素C和β-磷酸甘油誘導SMC轉化為成骨樣細胞,并在0、5、10、15 d用同樣方法再次檢測共培養中破骨樣細胞轉化的情況,以及兩種細胞中OPG和RANKL的表達情況。結果不管是單獨培養、還是共培養,破骨樣細胞中始終沒有OPG和RANKL的表達。結論破骨樣細胞的轉化可能主要受成骨樣細胞分泌的OPG和RANKL調控,本身并沒有分泌OPG和RANKL進行自身調節的機制存在。
關鍵詞〔〕骨保護素;NF-κB配體受體;成骨樣細胞;破骨樣細胞
中圖分類號〔〕R68〔文獻標識碼〕A〔
基金項目:武漢市衛生計生委科研基金資助(No.WX15C42)
通訊作者:管思明(1951-),女,主任醫師,主要從事老年心血管病專業研究。
1華中科技大學同濟醫學院附屬武漢協和醫院老年病科
張韶英(1963-),女,主任醫師,主要從事老年心血管病專業研究。
第一作者:聶斌(1976-),男,主治醫師,主要從事老年心血管病專業研究。
近年來研究表明,動脈鈣化是與骨形成相似的一種高度可調控的過程〔1〕。動脈中存在著類似于骨中成骨細胞活性的成骨樣細胞,導致動脈局部的鈣沉積;同時也存在著類似骨中破骨細胞活性的破骨樣細胞,可吸收動脈局部的鈣化。如果成骨樣細胞轉化增多,而破骨樣細胞轉化不足,則會導致動脈鈣化的形成〔2〕。目前的研究表明,破骨樣細胞的轉化主要受骨保護素(OPG)/核轉錄因子(NF)-κB配體受體(RANKL)(OPG/RANKL)系統的調控〔3〕。但對于破骨樣細胞自身是否能分泌OPG、RANKL進行自我調控,卻一直很少有研究報道。本文擬探討破骨樣細胞是否存在分泌OPG/RANKL進行自我調控的機制。
1材料和方法
1.1材料健康雄性SD大鼠,體重180~200 g,購自同濟醫學院動物實驗中心;大鼠骨鈣素抗體,堿性磷酸酶(ALP)活性檢測試劑盒,鈣檢測試劑盒購自Bioss公司;大鼠OPG抗體、RANKL抗體購自R等D Systems公司;維生素D、維生素C、β-磷酸甘油、巨噬細胞集落刺激因子(M-CSF)購自上海信宜藥業公司; OPG和RANKL的引物由ProMab公司合成。
1.2破骨樣細胞的單獨培養
1.2.1單核細胞前體的取材、培養〔4〕選用6周齡雄性SD大鼠,斷頸處死,無菌條件下分離股骨,暴露髓腔后用α-MEM培養基(含20%胎牛血清)沖洗骨髓腔,沖洗液用200目篩網過濾后,收集接種于25 ml培養瓶,在5%CO2,37℃培養24 h后,收集未貼壁的細胞,加入淋巴分離液,進行Ficoll/Hypaque梯度離心,然后收集表面的單核細胞層,用磷酸鹽緩沖液(PBS)清洗后,接種于含有α-MEM培養基(含20%胎牛血清)的六孔板中,并在培養液中加入100 U/ml 的青霉素,和100 μg/ml的鏈霉素。
1.2.2誘導單核細胞前體向破骨樣細胞轉化在上述培養液中加入25 ng/ml的M-CSF和1×10-8mol/L的維生素D,分別在第0、5、10、15天,用以下方法檢測單核細胞前體向破骨樣細胞的轉化情況。(1)破骨樣細胞鏡下形態學觀察。(2)破骨樣細胞的抗酒石酸(TRAP)染色檢測:常規細胞爬片,去離子水洗3次,浸入新配置的TRAP染色孵育液37℃中1 h,然后去離子水洗3次,中性樹膠封片,最后在光鏡下觀察,陽性為顯示暗紅色。(3)破骨樣細胞的OPG和RANKL表達:引物由primer3.0軟件設計,并由ProMab公司合成。OPG(rattus)-正義:5'-ATCGGCCACGCGAACCTCAC-3',OPG(rattus)-反義:5'-GCTGCTCGCTGGGTTTGCAG-3',片段長度155 bp,退火溫度59℃;RANKL(rattus)-正義:5'-AGCCTTTCAAGGGGCCGTGC-3',RANKL(rattus)-反義:5'-GGGCCACATCGAGCCACGAA-3',片段長度104 bp,退火溫度58℃。
1.3共培養
1.3.1成骨樣細胞和破骨樣細胞共培養模型的構建〔5〕選取6周齡雄性SD大鼠,無菌條件下分離主動脈,去除筋膜,沿縱軸剪開動脈,小心刮去內膜,然后剝下中膜,剪成約1 mm×1 mm的小組織塊,放入裝有DMEM(含20%胎牛血清)培養液的培養瓶中,并加入100 U/ml 的青霉素和100 μg/ml 的鏈霉素。待細胞從組織塊中游出后,收集放入5% CO2、37℃的培養箱中進行培養。SMC的鑒定采用光鏡下形態學觀察和SMC的特異性標志物α-actin的免疫熒光染色法。實驗所用SMC為培養的第6~8代細胞;SMC和單核細胞前體的共培養則如文獻〔6〕所述,首先將SMC種植于非接觸性共培養體系的下層Lab-TeK腔室玻片上,然后將單核細胞前體種植于上層tissue culture insert(NUNC產品)中。共培養細胞體系也隨機分為兩組:正常組和鈣化組,正常組即為SMC和單核細胞前體的普通共培養,鈣化組則在此培養液中再加入10 mmol/L β-磷酸甘油和50 μg/ml維生素C,以誘導其中的SMC形成鈣化。并在第0,5,10,15天收集兩種細胞分別進行以下檢測。
1.3.2共培養中成骨樣細胞轉化程度的檢測
1.3.2.1成骨樣細胞中鈣離子含量的測定收集共培養中的成骨樣細胞,棄去細胞培養液,將細胞用PBS洗三次后,加入0.6 mol/L的HCl,37℃孵育24 h脫鈣,收集脫鈣上清液,用鈣測定試劑盒(鄰甲酚酞絡合酮比色法)檢測細胞的鈣離子含量;另外,用考馬斯亮藍法測定細胞的蛋白含量,最后結果用蛋白含量標準細胞鈣含量(以μg/mg protein表示)。
1.3.2.2成骨樣細胞中ALP活性的檢測 收集共培養中成骨樣細胞,首先用超聲波裂解細胞,然后向微孔板內添加100 μl底物緩沖液和20 μl樣品,在微孔板振蕩器上充分振蕩1 min后,37℃孵育15 min。添加80 μl反應終止液,在微孔板振蕩器上充分振蕩1 min后,用酶標儀測量405 nm處的吸光值,計算出ALP活性值,最后結果再用考馬斯亮藍法測定的蛋白含量進行標準化。
1.3.2.3成骨樣細胞中骨鈣素的Western印跡檢測收集共培養中成骨樣細胞,常規勻漿,提蛋白,蛋白質變性,進行十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)電泳,使用三明治電轉法將蛋白轉移到硝酸纖維素膜上,然后置于5%的脫脂奶粉中封閉,4℃過夜。棄去封閉液,用PBST漂洗2~3次,加入按1∶100稀釋后的一抗抗大鼠骨鈣素單克隆抗體,室溫下于搖床孵育2 h,PBST漂洗后加入末辛根過氧化物酶(HRP)標記的二抗,室溫下于搖床孵育1 h,PBST漂洗后進行二氨基聯苯胺(DAB)顯色,最后以Gel pro4.0 版凝膠光密度分析軟件進行測量分析。
1.3.3共培養中破骨樣細胞轉化程度的檢測收集共培養中破骨樣細胞,使用上述1.2.2中方法,檢測破骨樣細胞的轉化程度。
1.3.4共培養中兩組細胞的OPG和RANKL實時定量PCR檢測收集共培養中的成骨樣細胞和破骨樣細胞,分別進行OPG和RANKL的實時定量PCR檢測,檢測方法如前所述。
1.4統計學方法應用SPSS17.0軟件進行t檢驗。
2結果
2.1破骨樣細胞的單獨培養
2.1.1單獨培養時破骨樣細胞的轉化情況 單核細胞前體經過15 d誘導后,大多數轉化為多核巨細胞,有偽足,并可以借助偽足的凹凸伸縮而變化形態,而且TRAP染色顯示為紅色。表明培養的單核細胞前體經誘導后大多數已轉化為破骨樣細胞。見圖1。

圖1 破骨樣細胞的轉化
2.1.2單獨培養時破骨樣細胞中OPG、RANKL的表達情況在單核細胞前體轉化為破骨樣細胞的過程中,無論在第0、5、10、15天,其OPG、RANKL的實時定量PCR檢測均表現為無或極其微弱。
2.2共培養
2.2.1共培養時成骨樣細胞的轉化情況共培養中,SMC經鈣化誘導15 d后,其鈣離子含量、ALP活性、骨鈣素Western印跡檢測都為強陽性,表明經過鈣化誘導,SMC已成功轉化為成骨樣細胞。見表1。
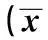
表1 成骨細胞轉化對比 ± s)
與0 d比較:1)P<0.05
2.2.2共培養時破骨樣細胞的轉化情況共培養15 d后,單核細胞前體中僅有一小部分轉化為多核巨細胞,有偽足,并可以借助偽足的凹凸伸縮而變化形態,且TRAP染色顯示為紅色。以上結果表明共培養15 d后,單核細胞前體中有一小部分轉化為破骨樣細胞。見圖2。

圖2 破骨細胞轉化情況
2.2.3共培養時成骨樣細胞OPG、RANKL的表達情況共培養中,成骨樣細胞無論在第0、5、10、15天均一直有OPG表達,且在第0、5、10天中,OPG的表達一直呈上升趨勢,而在第15天OPG的表達明顯下降。成骨樣細胞在第0天無RANKL表達, 而第5、10、15天均有RANKL表達,且表達也一直呈上升趨勢(均P<0.05)。見表2。

表2 成骨細胞OPG、RAWKL表達情況
2.2.4共培養時破骨樣細胞OPG、RANKL的表達情況共培養中,破骨樣細胞無論在第0、5、10、15天,OPG、RANKL的實時定量PCR檢測均仍為無或極其微弱。
3討論
動脈鈣化是鈣磷在動脈壁沉積的一種病理性表現,與各種心血管事件發生率的增加直接相關。近年來許多研究證實,動脈鈣化的形成并非只是鈣磷的被動沉積,而是與骨形成類似的一種高度可調控的主動過程。其中破骨樣細胞因具有抑制動脈局部鈣化發展的作用,從而在動脈鈣化的防治方面具有很好的前景,闡明破骨樣細胞轉化調控的機制因此也具有重要意義〔7〕。目前認為影響破骨樣細胞轉化最關鍵的是OPG/RANKL系統,RANKL促進破骨樣細胞的轉化而OPG則相反。動脈壁的一些細胞,主要是SMC,在發生鈣化轉化為成骨樣細胞的過程中會分泌出大量的OPG和RANKL,進而調控局部的破骨樣細胞轉化〔8〕。
本實驗首先構建了破骨樣細胞單獨轉化的模型,發現此過程中并沒有明顯的OPG和RANKL的表達。雖然單獨培養時破骨樣細胞并沒有表達OPG和RANKL,但并不一定就意味著破骨樣細胞本身沒有分泌OPG和RANKL進行自身轉化調節的可能。因為在人體中很可能存在著各種細胞之間相互作用的復雜機制。在動脈鈣化發生的過程中,也許當成骨樣細胞和破骨樣細胞兩者共存時,成骨樣細胞分泌出的某些因子會影響破骨樣細胞的轉化,使得后者可以分泌OPG、RANKL,參與自身轉化的調節。這正如在骨代謝中,單獨培養破骨細胞時,即使加入足夠的轉化誘導劑,但是能轉化成熟的破骨細胞也往往較少;而當把成骨細胞和破骨細胞放在一起共同培養時,因兩者之間發生的復雜相互作用,最后就可以誘導出大量的成熟破骨細胞〔9〕。因此,本文又構建了成骨樣細胞與破骨樣細胞兩者共培養的模型以模擬人體動脈的微環境,并在培養液中加入了鈣化誘導劑以誘導SMC轉化為成骨樣細胞,以模擬動脈發生鈣化的過程。本實驗表明,破骨樣細胞的轉化調節可能主要受成骨樣細胞分泌的OPG、RANKL影響,本身并沒有進行自我調節的機制存在。
另外,本實驗還發現:在兩者共培養的模型中,當SMC發生鈣化轉化為成骨樣細胞時,只有一小部分的單核細胞前體轉化為破骨樣細胞。這也和許多學者在臨床實踐和動物模型中發現的結果一致:即在發生鈣化的動脈壁上,往往可以檢測到大量的鈣化細胞(即成骨樣細胞),卻只有很少量的破骨樣細胞存在〔10〕。分析造成這種現象的原因很可能是在正常狀態,鈣化的早期以及中期,成骨樣細胞中都有大量的OPG表達,卻沒有或僅有少量的RANKL表達,RANKL的含量相對于OPG處于明顯劣勢,致使此時RANKL促破骨樣細胞轉化的功能完全被OPG所抑制,局部的單核細胞前體得不到RANKL的誘導,因此不能轉化為破骨樣細胞;只有到了鈣化晚期,此時成骨樣細胞OPG的表達已經明顯下降,而RANKL的表達則比以前明顯升高,因此RANKL促破骨樣細胞轉化的功能開始可以有所發揮。單核細胞前體有了RANKL的誘導,于是出現少量的破骨樣細胞轉化。本文認為,之所以無論在細胞共培養的模型還是宏觀動物模型中都只發現少量的破骨樣細胞轉化,是因為大多數情況下局部微環境中OPG的含量超過了RANKL的含量,使得RANKL促破骨樣細胞轉化的功能無法發揮出來所致。
4參考文獻
1Rennenberg RJ,Schurgers LJ,Kroon AA,etal.Arterial calcifications〔J〕.J Cell Mol Med,2010;14(9):2203-10.
2陳雯,郭進,馬隆佰,等.老年人骨質疏松與冠狀動脈鈣化的關系〔J〕.中國老年學雜志,2004;34(6):487-9.
3D'Amelio P,Isaia G,Isaia GC.The osteoprotegerin/RANK/RANKL system:a bone key to vascular disease〔J〕.J Endocrinol Invest,2009;32(4):6-9.
4Roodman GD,Ibbotson KJ,MacDonald BR,etal.1,25-Dihydroxyvitamin D3 causes formation of multinucleated cells with several osteoclast characteristics in cultures of primate marrow〔J〕.Proc Natl Acad Sci USA,1985;82(23):8213-7.
5劉銘,楊康,廖克龍,等.SD大鼠自體平滑肌細胞的獲取和體外培養〔J〕.重慶醫學,2004;33(12):1784-5.
6Goto H,Osaki M,Fukushima T,etal.Human bone marrow adipocytes support dexamethasone-induced osteoclast differentiation and function through RANKL expression〔J〕.Biomed Res,2011;32(1):37-44.
7Zhao Y,Urganus AL,Spevak L,etal.Characterization of dystrophic calcification induced in mice by cardiotoxin〔J〕.Calcif Tissue Int,2009;85(3):267-75.
8Valdivielso JM.Vascular calcification:types and mechanisms〔J〕.Nefrologia,2011;31(2):142-7.
9史風雷,王海彬,楊勇,等.建立成骨與破骨細胞共育體系的一種方法〔J〕.中國矯形外科雜志,2003年;11(22):1550-2.
10Massy ZA,Mentaverri R,Mozar A,etal.The pathophysiology of vascular calcification:are osteoclast-like cells the missing link〔J〕? Diabetes Metab,February 1,2008;34(1):16-20.
〔2015-02-15修回〕
(編輯袁左鳴)

