現代顯微成像技術綜述
張祥翔
摘要:概述了光學寬視場顯微鏡、共聚焦顯微鏡、超分辨率顯微鏡中所應用的現代顯微成像技術,對各種傳統和先進的顯微成像原理進行了總結。光學寬視場顯微鏡最常用的顯微技術有明場成像、暗場成像、相襯成像、偏光成像、微分干涉(DIC)成像、調制對比成像和熒光成像。相襯成像中根據不同的成像結構還有切趾相襯成像。微分干涉除了傳統的偏振光照明還有圓偏振光照明(CDIC)和專用于塑料的微分干涉(PlasDIC)。共聚焦顯微鏡隨著計算機技術和制造技術的發展而有了巨大的發展。除了傳統的共聚焦熒光顯微鏡以外,還有連續反斯托克斯拉曼散射(CARS)共聚焦、多光子共聚焦和白光共聚焦。超分辨率顯微鏡中主要介紹了受激輻射淬滅(STED)技術和緊隨基態淬滅顯微技術的單分子返回(GSDIM)技術。
關鍵詞:寬視場顯微鏡; 共聚焦顯微鏡; 超分辨率; 顯微成像技術
中圖分類號: O 435 文獻標志碼: A doi: 10.3969/j.issn.10055630.2015.06.017
Abstract:The imaging technology in modern microscope for widefield microscope, confocal microscope and superresolution microscope is outlined here. The most frequentlyused technology in the widefield microscope is brightfield, darkfield, phase contrast, polarization, DIC, modulation contrast and fluorescence. In phase contrast, there is also apodized phase contrast. In addition, DIC, CDIC and PlasDIC are also presented. Confocal microscope is developed greatly with the development of computer and manufacture technology. Besides conventional confocal system, the principle of coherent antiStokes Raman scattering(CARS) confocal,multiphoto confocal, white confocal are also explained in detail. As for superresolution microscope, the principle of stimulated emission depletion(STED) and ground state depletion microscopy followed by individual molecule return(GSDIM) are clarified.
Keywords:widefield; confocal; superresolution; microscope imaging technology
引 言
顯微鏡根據成像方式可以分為光學寬視場顯微鏡、共聚焦顯微鏡、體視顯微鏡[1]。光學寬視場顯微鏡和共聚焦顯微鏡更多地應用于生命科學研究,對成像的要求更高,而體視顯微鏡更多應用于工業領域,對數碼化和人性化的要求更高[2]。本文主要闡述用于生命科學領域的顯微成像技術,光學寬視場顯微鏡常用的顯微技術有明場成像、暗場成像、相襯成像、偏光成像、微分干涉(DIC)成像、調制對比成像和熒光成像,共聚焦顯微鏡常用的顯微技術有熒光、全反射、超分辨、多光子和白光共聚焦成像。
1 光學寬視場顯微鏡
在光學寬視場顯微鏡中的各種成像技術中,明場、暗場、偏光和熒光成像是為了使需要觀察的標本結構可見,而相襯、微分干涉、調制對比成像是將標本結構中的相位變化顯現出來。很多情況下幾種成像技術同時使用。
1.1 明場成像和暗場成像
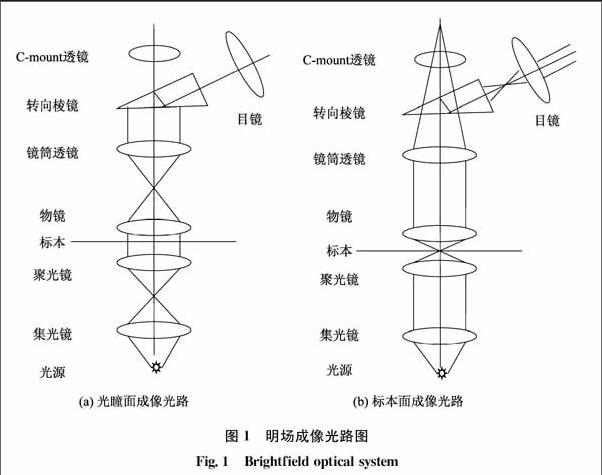
明場成像是最基本的顯微成像技術,其他所有的成像技術都是以明場成像為基礎的。明場成像光路如圖1所示,光源通過集光鏡和聚光鏡聚焦到標本上,如果是臨界照明,燈絲的像直接會聚到標本;如果是科勒照明,燈絲像會聚在聚光鏡前焦面,由聚光鏡再照射到標本上。透射過標本的光線由物鏡收集在物鏡后焦面上形成光瞳的像,光瞳的像是相對于空間的成像光線角度的分布,現代顯微鏡中多用這個位置進行各種對比方式的變化。經過后焦面后,光線進入鏡筒透鏡,鏡筒透鏡將相對于空間的角度分布變換為相對于空間的位置分布,即在鏡筒透鏡的后焦面形成中間像面。現代顯微鏡中,在鏡筒透鏡形成中間像面之前,會利用Cmount鏡頭轉接中間像面到攝像頭上,從而實現數碼成像,便于現代教學和研究。最后中間像面由目鏡成像到眼睛的視網膜上,從而看到放大的像。
暗場成像和明場成像只有照明光路有所區別。暗場成像是以超出物鏡數值孔徑的角度照明,標本由于大角度照明產生衍射光或者散射光,包含在物鏡數值孔徑內的衍射光或者散射光由物鏡收集,按照明場光路投射到眼睛或者攝像頭。暗場照明如圖2所示,有兩種方式:一種是透射式暗場照明,直接用中間不透光的圓環在聚光鏡前焦面攔截光線;另一種是反射式暗場照明,暗場反射鏡面安裝在物鏡外殼靠近標本的位置,光線經過暗場反射鏡面以超出物鏡數值孔徑的角度入射在標本上,標本發出的衍射或者雜散光由物鏡收集后成像。反射式暗場照明鏡面有的是球面,有的是非球面,有的在照明光路中加上微透鏡或者散射片,都是為了實現大面積均勻照明。
1.2 相襯成像
相襯成像光路如圖3所示。相襯成像是在物鏡后焦面或者后焦面的共軛位置,也就是光線角度相對于空間分布的位置(光瞳位置),選取某一環帶的光線,將通過這一環帶0級光線強度降低到和1級衍射光相同,再將0級光線的相位改變180°,和1級衍射光的相位相反。這樣當光線在光瞳面進行相位和強度變換后,鏡筒透鏡將其按照空間位置合成,在中間像面就會凸顯出由1級衍射光所表征的結構特征,同時由于0級光變弱,背景將比較暗。
不同級次的衍射光在經過標本(類似光柵的作用)后分開,0級衍射光經過物鏡中的相襯環后強度和相位發生了變化,物鏡相襯環的寬度小于某種特征結構產生的衍射角對應的寬度,這樣該0級光對應的1級衍射光可以保持強度和相位不變。介于這個角度之間的特征結構,1級衍射光會有部分產生強度和相位的變化,在和0級衍射光合成的時候就會產生光暈,而且角度越小,光暈的影響越大,這是相襯成像的缺點。一般會根據經驗找到一個合適的相襯環寬度,光暈和成像細節平衡得比較好。
正是由于相襯成像的這種特點,只有某種結構的相位變化可以通過相襯成像反映出來。一般是通過相襯成像較易反映細胞內部結構,但不易反映細胞的邊界。其他結構,特別是以上提到的小角度的結構,都或多或少的有一些光暈產生。
Nikon公司采用了切趾相襯成像的方法,將小角度的光線透過率進一步降低,小角度的光線對應于大尺寸的結構,也就是非精細結構的強度降低,同時大角度的光線對應于小尺寸即精細結構更容易顯現出來。
1.3 偏光成像
偏光成像顧名思義就是用偏振光進行成像。偏光成像分為正交偏振和錐光偏振兩種,光路如圖4所示。正交偏振是指經過起偏器的線偏振光經過聚光鏡、標本、物鏡后,標本的偏振特性會使原來的線偏振光的振動方向發生變化,只有垂直于原來線偏振光振動方向的偏振光可以通過后面的驗偏器,從而被目鏡接收。正交偏振是直接用目鏡觀察的偏振成像方式。另外一種錐光偏振是指用勃氏鏡和目鏡直接觀察物鏡后焦面的偏振光成像,其余和正交偏光相同。由于觀察的是物鏡后焦面的成像情況,相當于觀察的是標本面上光線的角度隨空間變化的情況,所以稱之為錐光偏振。錐光偏振一般配合大數值孔徑的物鏡使用。
偏光成像在生命科學領域的應用較少,主要用于地質材料科學研究中。
1.4 微分干涉成像
微分干涉也是將標本的相位差轉化為振幅變化后進行成像,這一點和相襯成像相同。但是微分干涉只對0級光進行調制,而相襯成像對0級光和1級光進行調制。
圖5為微分干涉成像光路圖。在明場成像的基礎上,聚光鏡前焦面上放置起偏器和渥拉斯頓棱鏡。線偏振光被分為尋常光o光和非尋常光e光,它們的振動方向成90°。o光和e光在標本上通過聚光鏡會聚,標本的雙折射性能或者相位偏差會對o光和e光的相對振動方向產生影響,也就是o光和e光不再是相互90°的振動方向,或者o光或者e光有了微小的相位差。標本的相位信息帶入光路中,再通過第二塊渥拉斯頓棱鏡,使o光和e光具有相同的振動方向,這樣帶有相位差的o光或者e光就會進行干涉,相位的變化則轉換為振幅的變化。但是有一些光由于振動方向的變化在經過第二塊渥拉斯頓棱鏡后沒有干涉,變成雜散光,于是就需要驗偏器選擇進行干涉,而且垂直于入射光偏振方向的光進入鏡筒透鏡和目鏡。實際應用中渥拉斯頓棱鏡都換為諾瑪斯基棱鏡,可以保證合適的工作距離。
由于o光和e光是渥拉斯頓棱鏡分出的兩束不同位置的光,也就是o光和e光都會分別成像,它們由第二塊渥拉斯頓棱鏡合成的時候,由于棱鏡的位移作用,所成的像會在X和Y向有所位移,產生浮雕的效果。故如果調解渥拉斯頓棱鏡的相對位置,則可調解浮雕效果。
微分干涉先是微分然后是干涉,先把相位變成了相位的變化(即相位差),再將相位差通過干涉變成振幅變化,而相襯成像中直接把反應結構的相位通過降低背景光的方法顯現出來(本質上也是干涉)。因此微分干涉容易將細胞的邊界顯現出來,因為邊界上對o光和e光的相位變化較大,而內部的連續介質對o光和e光的相位變化就較小。但是相襯成像直接將相位顯現出來,所以通常是內部的精細結構具有更大的相位角,更容易通過相襯方法顯現出來。
微分干涉對相位差的依賴既是其優點,也是其缺點。特別是在線偏振光情況下,只有和偏振方向相同的相位差才能顯現。Zeiss采用圓偏振光(CDIC)[3]后,各個方向的相位差都有所顯現,較好地平衡微分干涉和偏振。
普通微分干涉還需要特殊的物鏡,只能在很小的焦深內實現較好的微分干涉的效果,并且只適用于培養皿為塑料的標本。這些都對微分干涉的應用產生了限制。Zeiss在專利DE 10219804和文獻[2]中提供了一種PlasDIC的微分干涉方式[4],而且已經成功商用。只需要一個偏振片和渥拉斯頓棱鏡就可以實現DIC效果。而且只需要普通物鏡,培養皿為塑料的標本也適用。但是在聚光鏡前必須使用狹縫,物鏡數值孔徑也不能過大,因此僅小于40X物鏡可用。僅有的一對渥拉斯頓棱鏡和驗偏器放在物鏡和鏡筒透鏡之間,非偏振光只有在經過物鏡和該渥拉斯頓棱鏡之后才變成偏振光并分為o光和e光,由于是平行于渥拉斯頓棱鏡的狹縫照明產生的光,所以這里的o光和e光也是相差90的振動方向。同時由于o光和e光已經經過了標本,出現了相位差,所以在驗偏器使o光和e光在同一振動方向時,就發生了干涉,產生了相對于相位變化的振幅變化。
1.5 調制對比成像
調制對比光路見圖6,調制對比成像也是在物鏡后焦面或者后焦面的共軛面上,對傾斜入射的狹縫光,使其+1級衍射光的強度大于背景光,-1級衍射光的強度小于背景光,這樣就形成浮雕效果。調制對比成像也可以配合起偏器和驗偏器,通過旋轉起偏器來調解浮雕效果。調制對比成像適用于各向同性和各向非同性的標本,而微分干涉僅適用于各向同性的標本。
調制對比和相襯成像類似都是利用的1級或者-1級光進行調整,相對于DIC利用0級光的能量降低很多,因此調制對比成像的效果不如DIC,但是由于其對物鏡的要求低、不需要復雜的棱鏡、適用范圍廣,還是受到了廣泛的歡迎。
1.6 熒光成像
熒光成像是在落射光照明下的成像技術。光源通常為汞燈或者LED。熒光成像很多情況下標本必須用多種熒光染色劑進行染色(也有自發熒光物質,但是自發熒光能量較弱),不同的熒光染色劑會附著在細胞中需要觀察的不同結構上。不同的熒光染色劑在不同波長的光的激發下會產生不同波長的熒光,這樣被附著的各種細胞結構就會被觀察到。通常會用多種波長的光進行激發,從而得到多種波長的熒光圖像,然后再進行圖像綜合,這樣就可以得到多種顏色的標本圖像。熒光成像中最重要的元件就是激發濾光片和截止濾光片。
圖7(a)為普通熒光成像。熒光光源汞燈或者LED通過落射照明光路由分光棱鏡入射到物鏡中,并激發標本產生熒光,返回到物鏡中,通過鏡筒透鏡成像。入射到物鏡的光會被激發濾光片濾出一定波長的激發光,被激發光激發的熒光染色劑會產生不同波段的熒光,由截止濾光片將其他波段的光截止,最終激發出的熒光到達鏡筒透鏡。由于激發光和被激發熒光之間的波長差,使得截止濾光片可以選出被激發熒光,同時截止激發光。
熒光成像由于被激發的熒光來自不同的焦面位置,特別是對厚標本,使得真正焦面上圖像的對比度會有所下降。全反射熒光技術利用全反射光透過介質的倏逝波照明,倏逝波只滲透進標本100 nm,可以有效地防止不在焦面的被激發熒光對圖像對比度的影響。全反射熒光如圖7(b)所示,其技術要求物鏡數值孔徑在1.45以上,而且只能對粘附性標本成像,否則倏逝波無法照射。
熒光成像在共聚焦顯微鏡和超分辨率顯微鏡中也得到廣泛的應用。
2 共聚焦顯微鏡[5]
共聚焦顯微鏡是為了減少在焦點之外的光暈,僅僅對衍射極限尺寸的點照明進而成像。共聚焦顯微原理早在20世紀50年代早期就發明出來了,但是由于激光技術、計算機技術、數碼成像算法的制約,直到1987年才出現了第一臺商用共聚焦顯微鏡。到20世紀90年代以后,大容量存儲技術、顯示增強技術、計算機處理技術的發展給共聚焦顯微鏡帶來更廣闊的應用。
2.1 熒光共聚焦成像
共聚焦主要應用在熒光共聚焦成像上。
所謂共聚焦就是發射光源點、焦面上物點和探測器成像像點共同被聚焦。共聚焦顯微鏡光路見圖8。連續激光光源通過小孔光闌,由分光鏡會聚樣本上,分光鏡在X和Y向移動掃描標本上的點,被照射的標本激發出熒光會聚到探測器上。在物鏡成像焦面的上下同樣會有很多激發熒光產生,這些熒光和探測器上的成像點不共聚焦,這部分不共聚焦的熒光只有一小部分可以通過探測器前小孔光闌,所以大部分不共聚焦的熒光沒有被成像。傳統的熒光照明中,整個標本都被照明,這樣焦面上下產生的熒光就會被探測到,降低了焦面圖像的對比度。
共聚焦顯微鏡中的激光光源經過擴束后,必須準確地照射到物鏡的后焦面,這是共聚焦顯微鏡最嚴格的要求之一,目的是為了保證照明的均勻和遠心。探測器前的小孔光闌作為空間濾波器,其位置必須和物鏡焦面的位置完美共軛,這樣可以保證焦面的激發熒光被探測器準確接收。小孔光闌有多種尺寸可選,是為了適應不同數值孔徑的物鏡衍射極限的要求。
共聚焦顯微鏡的分光鏡掃描系統是其關鍵而復雜的組件之一。其掃描速度和精度直接影響共聚焦成像的效率和像質。分光鏡掃描系統不僅起到轉折光線的作用,而且需要使聚焦點在X和Y向進行掃描,并且在掃描過程中物鏡的光瞳必須準確被照明。掃描標本的原理是在標本的后焦面或者后焦面的共軛面上轉動反光鏡的角度實現成像點在標本上的二維平移。后焦面上角度的變化對應于成像面上位移的變化。現在商用的共聚焦顯微鏡中至少有三種掃描裝置如圖9所示。Olympus采用的是中繼透鏡加兩個掃描鏡的方式,Zeiss采用的是兩個緊挨的掃描鏡旋轉的方式,Leica采用的是一個掃描鏡二維旋轉的方式。以上為串行掃描,速度較慢,有一種采用Nipkow盤配合微透鏡的并行掃描方式,在圓盤上刻有很多小孔,可以同時掃描多個成像點,速度大幅提高,但是能量損失較大,商用受限。
共聚焦顯微鏡是不能像普通光學寬視場顯微鏡一樣從目鏡觀察標本。其通過對多點掃描所得到的圖像進行重構,然后利用計算機完成圖像顯現。所以要求很大的圖像存儲空間和復雜的計算機圖像處理技術。
2.2 白光共聚焦成像
普通的熒光共聚焦成像需要用到3~5種熒光染色劑來同時探測。不同的熒光染色劑對激發光和發射光都有不同的要求,也就是要有不同光譜的光源。普通顯微鏡中采用變換濾光片的方法得到不同波段的光源,但是濾光片的機械式轉換速度較慢,還可能帶來像面偏移,而且濾光片受到潮濕、高溫、高能量照射的環境下,還可能改變濾出的波長。白光共聚焦技術就是是利用聲光器件的可調光譜技術,波長和強度都可調,幾乎可以克服普通濾光片的所有缺點。
白光共聚焦技術中的關鍵器件之一是切換不同光譜的聲光器件,聲光器件是一種特殊的雙折射晶體,通過對加載在晶體上的聲音頻率的控制,可以改變晶體的衍射性能,從而實現快速的變換波長。
顯微鏡中用到的聲光器件是在二氧化碲或者石英晶體上粘接一塊壓電傳感器。當無線電頻率施加在壓電傳感器上時,壓電傳感器產生高頻聲波,該高頻聲波在二氧化碲或石英晶體中會引起材料折射率的周期分布。改變壓電傳感器加在晶體上的頻率可以改變折射率變化的周期分布。根據聲光晶體的相位匹配條件,出射光的波長由下式決定
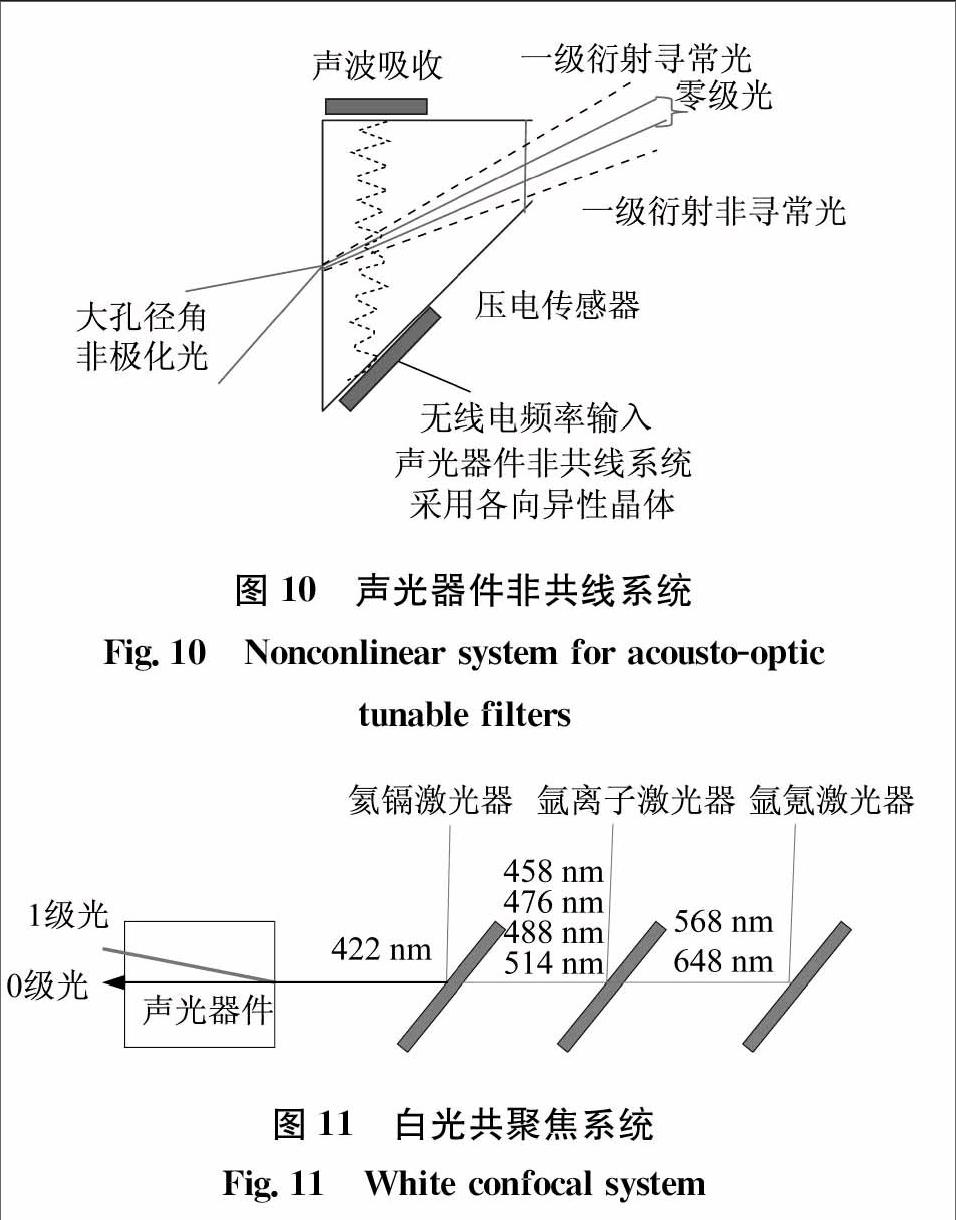
現代顯微鏡中的聲光器件是非共線系統,并且是各項異性的晶體,具體如圖10所示。非共線系統相對于共線系統可以使非極化光情況下入射光和出射的1級衍射光分開一定的角度,這樣就不需要起偏器。而各項異性晶體相對于各向同性晶體,在入射光孔徑較大時仍可以保持較窄的光譜帶寬。一定帶寬的照明是熒光激發的必要條件之一,所以用各向同性晶體就需要準直光,而用各向異性晶體則不需要。
聲光器件在白光共聚焦系統中的應用如圖11所示。三種激光光源通過分色片耦合進入聲光濾光器。氦鎘激光器,氬離子激光器和氬氪激光器通過分色片將422 nm、458 nm、476 nm、488 nm、514 nm、568 nm和648 nm共同入射進聲光器件,聲光器件通過調節無線電頻率調節輸出光的波長。聲光器件輸出的0級光被光陷阱吸收,而1級衍射光由光纖導出照亮樣本。
2.3 多光子共聚焦成像[6]
普通共聚焦顯微鏡中,由于標本受到連續激光直接照射,細胞結構可能受損,特別是很多需要紫外光激發的熒光,對標本的損傷更大。多光子共聚焦技術通過用長波長光子激發標本,而長波長光子的能量比短波長光子低,這樣可以減少對標本的損傷。
將共聚焦顯微鏡中的普通連續激光光源換成長波長的脈沖光源,比如用700 nm的脈沖光源替代350 nm連續激光光源,這樣標本需要吸收兩個光子才能達到同等350 nm光源所產生的能量,也就是在標本中700 nm光子的能量密度大。而在連續光源系統中,激光激發的幾率和光子密度成線性關系;在兩個光子的系統中,熒光激發的幾率和光子密度成平方關系,也就是說在標本的焦面以外,兩個光子的系統比連續光源的系統,光子密度下降的更快。這樣兩個光子的系統對焦面以外的熒光激發所帶來的雜光有更好的抑制作用,得到圖像的對比度更好。
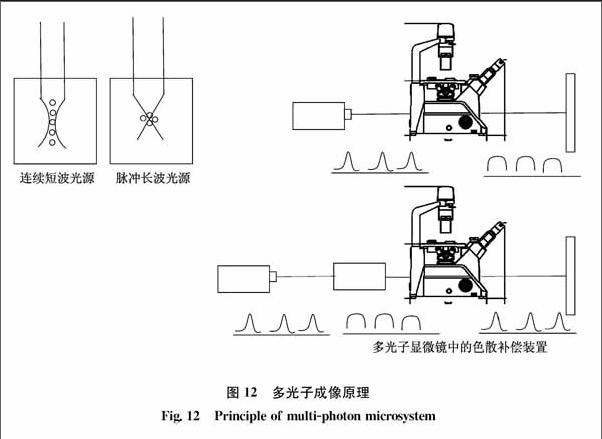
多光子共聚焦顯微鏡還要配備一個色散補償器,如圖12所示,這是因為光學系統中的光學元件(如衰減片、棱鏡、透鏡等)對光波有色散作用。一定頻率的脈沖光源進入光學系統后會被展寬,能量降低,熒光激發效果變差,這個色散補償器通過對光學元件色散的補償使得最終入射到標本上的激光脈沖和光源處的盡量一致。
色散補償器[7]可以用鍍膜反射鏡套件來實現。當激光脈沖由不同波長組成時,在其通過光學系統的玻璃器件時,這些介質的折射率的非線性波長相關性,引起了脈沖展寬,對于典型的光學玻璃,波長越短,折射率越高,導致短波比長波的傳播速度慢。通過優化反射鏡套件的鍍膜,可以使長波比短波的群速度延遲的更多,從而使長波和短波具有相同的速度。光波在經過光學膜系反射后的群延遲色散為
式中:φr為反射相位;ω為光波頻率。反射相位和膜層厚度、折射率和光束入射角相關,因此通過優化膜系,選擇合適的膜層厚度、折射率和光束入射角,就可以得到需要的補償色散。
當然色散補償器還可以用光柵或者棱鏡實現,但是棱鏡補償色散會引入高階色散,光柵補償色散會引起較大損耗,結構不能做的很緊湊。
2.4 CARS共聚焦成像[8]
不管是熒光共聚焦還是多光子共聚焦都需要對標本進行熒光染色或者標記,這都會對標本產生影響。而連續反斯托克斯拉曼散射(CARS)共聚焦成像技術,通過放大標本的拉曼散射光譜并使其成像,不需要進行熒光染色或者標記,對標本有較好的保護。
CARS共聚焦成像和普通共聚焦成像的區別主要是激光光源。CARS共聚焦成像原理見圖13,使用一束近紅外連續激光和一束斯托克斯激光同時照射標本,受到近紅外激光激發的分子躍遷到第一虛擬激發態上,然后立即返回到斯托克斯激光所代表的低能量振動能級上。調節近紅外連續激光的波長,可以得到不同的低能量振動能級,但是都比斯托克斯振動能級能量高。這些低能量的振動能級帶有標本化學信息,為了能對這些不同的低能量振動能級分子成像,將標本用取樣光束照明(取樣光束可以和用于激發的近紅外連續激光相同),那些在低能量振動能級上的分子又會躍遷到新的虛擬激發態上,由于連續照射低能量振動態能級已滿,新躍遷的分子直接返回基態,釋放能量發射光子,由于該光子的能量較激發用的近紅外連續激光高,所以發出的光譜會往短波移動,這就是反斯托克斯光譜。由于連續激發,CARS信號比傳統拉曼散射信號強10萬倍,足以成像。
3 超分辨顯微成像
以上所有的顯微成像方法都受到衍射極限的限制。但是超分辨顯微成像從分子級別上改變成像原理,突破了衍射極限。下面介紹兩種超分辨顯微成像,即受激輻射淬滅(STED)和緊隨基態淬滅顯微技術的單分子返回(GSDIM)。
3.1 STED[9]
STED成像原理見圖14。標本受到第一束激光激發產生熒光,形成具有衍射極限的圓斑,這個位置同時被第二束發散角為圓環的激光激發,第二束激光正好可以激發同一照射位置所形成光斑的非中心區域,產生不能夠被探測器收集的光波,而光斑的中心區域由于非中心區域的侵占,直徑可以變得無限小,這樣就突破了瑞利衍射極限。
3.2 GSDIM[10]
瑞利衍射極限的物理解釋為:電子從激發態到基態的躍遷大約為納秒的量級,而探測器的響應時間一般為毫秒量級,所以所有不同時間發出的熒光都會被探測器接收并顯示,而且不同時間發出的熒光的位置會略有不同,這就造成了成像斑點的展寬,也就是衍射極限的由來。也就是說如果探測器能夠記錄某一時間發射的熒光,而不是所有不同時間的,那么光斑就會很窄,衍射極限就會被突破。
GSDIM成像原理見圖15。通常情況下,激光能量越大,發射的熒光也應該越大,但是達到一定極限后,熒光的能量反而減少。這是因為熒光能量和激發光源的能量成線性變化時,電子是在第1激發態和基態之間躍遷。但是如果三重態上反轉自旋的電子足夠多,導致第1激發態和基態上幾乎沒有電子,熒光能量就會隨著激發能量增大而減少。如果激發能量進一步增大,基態上僅有的幾個電子在吸收激發光后會在基態和第1激發態上躍遷幾千次,這樣就會產生很高能量的受激熒光,即光子爆發。光子爆發就是某一時間發射的熒光的增強,其他不同時間的應該發出的熒光進入了三重態不在發光,也就是說由該增強的熒光形成的光斑突破了衍射極限。
為了增大從三重態上躍遷到基態的電子數目,從而加快光子爆發的時間,還可以用第二束激光(405 nm)照射標本。在GSDIM技術中,強激發光源被反復開關,這樣產生三重態發出增加熒光的位置就是隨機的,通過記錄這些光點的位置,就可以重構標本的GSDIM圖像。
如果在GSDIM光路中加入柱面鏡[11],就可以形成三維圖像。柱面鏡可以根據三維圖像中的成像位置控制成像光點的PSF,然后通過計算機重建出模擬的三維圖像。
GSDIM既可以在共聚焦顯微鏡中使用也可以在寬視場顯微鏡中使用。
4 總 結
現代顯微鏡中以寬視場光學顯微鏡明場成像技術為基礎,衍生出很多對比度增強基礎(比如相襯、DIC、調制對比、暗場、偏光),而共聚焦技術將焦面上的物點準確成像,本質上也是一種對比度增加技術。這些技術都受到了衍射極限的限制。超分辨率技術從分子層面突破了衍射極限,通過激發光來調整熒光物質的發光特性,從而縮小了發光點的發光面積。
參考文獻:
[1]王莉,蔣洪,孫麗麗.顯微鏡的發展綜述[J].科技信息,2009(11):117118,133.
[2]袁望.面向體式顯微鏡的立體圖像處理方法[D].寧波:寧波大學,2012.
[3]DANZ R,GRETSCHER P.CDIC:a new microscopy method for rational study of phase structures in incident light arrangement[J].Thin Solid Films,2004,462/463:257262.
[4]DANZ R,VOGELGSANG A,KTHNER R,et al.PlasDICeine nützliche modifikation des differentiellen interferenzkontrastes nach Smith/Nomarski in DurchlichtAnordnung[J].Photonik,2004(1):4246.
[5]WEBB R H.Confocal optical microscopy[J].Reports on Progress in Physics,1996,59(3):427471.
[6]ZIPFEL W R,WILLIAMS R M,WEBB W W.Nonlinear magic:multiphoton microscopy in the biosciences[J].Nature Biotechnology,2003,21(11):13691377.
[7]羅震岳.光學色散補償薄膜的研究[D].杭州:浙江大學,2010.
[8]DOWNES A,MOURAS R,ELFICK A.A versatile CARS microscope for biological imaging[J].Journal of Raman Spectroscopy,2009,40(7):757762.
[9]PUNGE A,RIZZOLI S O,JAHN R,et al.3D reconstruction of highresolution STED microscope images[J].Microscopy Research and Technique,2008,71(9):644650.
[10]DYBA M,SIMONUTTI G A,FLLING J.Recent developments in GSDIM microscopy[J].SPIE,2012,8228:82280R.
[11]ZHANG X W,HUANG B,BAIES W M.Subdfiffraction limit image resolution in three dimensions:US,US 20110002530A1[P].20081209.
(編輯:程愛婕)

