配水管網水中菌落總數分布的調查
配水管網水中菌落總數分布的調查
王海青1,周東海1,張駿鵬2,王晉宇1,陳玲瑚1,李偉英2
(1. 蘇州市自來水有限公司,江蘇蘇州215002;2. 同濟大學環境科學與工程學院,上海200092)
摘要通過對蘇州X水廠的出廠水靜態水質、配水管網的水質分析檢測,并采用兩種培養基分別檢測水中菌落總數,考察了蘇州市配水管網中菌落總數分布情況。結果表明采用 R2A 培養基及較長的培養時間得到的菌落總數,能較好地反映飲用水中微生物的水平,也能表達飲用水中的游離余氯與菌落總數之間呈較為明顯的負指數相關。
關鍵詞配水管網飲用水菌落總數分布游離余氯
中圖分類號:TU991文獻標識碼: B
[收稿日期]2014-11-17
[作者簡介]王海青(1978—),女,工程師,本科,從事凈水工藝優化和水質檢測工作。電話: 13914016166;E-mail: qingqing2018158@sina.com。
[通訊作者]陳玲瑚,電話: 13815256133;E-mail: zi-lai-shui@126.com。
Investigation of Distribution of Total Bacterial Count in Drinking Water of Distribution Network
Wang Haiqing1, Zhou Donghai1, Zhang Junpeng2, Wang Jinyu1, Chen Linghu1, Li Weiying2
(1.SuzhouCityWaterCompanyLtd.,Suzhou215002,China;
2.CollegeofEnvironmentalScienceandEngineering,TongjiUniversity,Shanghai200092,China)
AbstractThe distribution of total bacterial count in drinking water in Suzhou was investigated by static water quality analysis of finished water in Suzhou X waterworks. The result shows that total bacterial count got from R2A medium with longer culture time can reflect the real microbial growth level in drinking water, and there is a significant negative exponential correlation between free residual chlorine and total bacterial count in drinking water.
Keywordsdistribution networkdrinking waterdistribution of total bacterial countfree residual chlorine

配水管網中細菌繁殖及其引起的問題日益受到人們的關注。調查發現管網中細菌的大量繁殖可加劇管道腐蝕,產生鐵銹和管垢,消耗水中溶解氧,提高水色和水的不良氣味,增大濁度,產生生物黏泥,為大型生物體和致病菌的繁殖創造有利條件,直接威脅凈水廠運行和人民身體健康安全[1]。
目前檢測管網水中菌落總數的方法主要參照GB/T 5750.12—2006的平板計數法,該方法采用營養瓊脂(NA)作為培養基,于36℃培養48h后進行菌落計數。然而由于營養瓊脂培養基營養成分高,部分已被證實存在的細菌(如弧菌(Vibrio)、沙門氏菌(Salmonella)等)根本就不能在檢測環境中生長或者生長相對緩慢,在該檢測條件下不能形成可見菌落從而導致結果報告偏低[2]。
目前,國外已經采用了新型的培養基來檢測水中的菌落總數,如貧營養的R2A培養基,同時通過降低培養溫度(28℃),延長培養時間等方法檢測飲用水中的菌落總數[3]。筆者嘗試采用R2A培養基,檢測管網水中的菌落總數,并與傳統的NA培養基的檢測結果進行對比,以考察管網水中菌落總數的變化規律,為全面提高和保障飲用水水質安全提供依據和對策。
1材料與方法
1.1試驗方案
以蘇州X水廠的出廠水及管網水為研究對象,開展了出廠水靜態試驗及配水管網水質監測。蘇州X水廠采用臭氧—活性炭深度處理工藝,在2013年度其出廠水游離余氯在0.50~0.95mg/L范圍內,渾濁度在0.05~0.15 NTU范圍內。
1.2出廠水靜態試驗
采集出廠水,立即測定其游離余氯和菌落總數,然后在室溫下靜置,每隔一段時間重復取樣測定,旨在考察靜態時水質變化規律[4]。
1.3采樣地點
選擇X水廠主干管水質監測點4個,每個點采樣2次,進行渾濁度、游離余氯和菌落總數的檢測分析,檢測結果取平均值。
1.4檢測方法
游離余氯采用Hach便攜式余氯測定儀進行測定;渾濁度采用Hach 2100P型便攜式濁度儀檢測。
菌落總數測定:
營養瓊脂培養基(NA)和R2A瓊脂培養基均購自青島海博生物技術有限公司。
采用平板澆鑄法培養。當使用NA培養基時,培養條件為36℃、48h;當采用R2A瓊脂培養基時,培養條件為28℃、168h[5]。
2結果與討論
2.1出廠水靜態水質變化
出廠水的靜態水質分析結果如圖1所示。
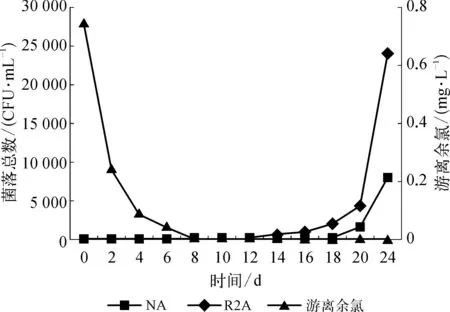
圖1 靜態下X水廠出廠水的菌落總數和游離余氯濃度的變化 Fig.1 Variation of Total Bacterial Count and Free Residual Chlorine in Static Experiment of Finished Water in X Waterworks
由圖1可知在連續24d的靜態試驗中,采用NA作為培養基時出廠水的菌落總數指標在前14d均未檢出,到達第18d時,采用NA作為培養基時其菌落總數指標已經超過了《生活飲用水衛生標準》(GB 5749—2006)的限值(100 CFU/mL);而采用R2A培養基時,在前10d均未檢出,后期的數據與采用NA作為培養基時進行比較,發現同一天的數據通常比采用NA作培養基時高近一個數量級。而游離余氯濃度則呈明顯遞減的趨勢,至第8d時游離余氯幾乎未檢出。
在第8d至第14d期間內,游離余氯濃度盡管很低,但菌落總數也依舊很低,可能的原因是水中的生物可同化有機碳(AOC)指標很低,無法為微生物生長提供相應的營養因素。筆者嘗試采用Kooij等的方法[6,7]檢測水中的AOC指標,其結果為95μg乙酸碳/L,該值介于Lechevallier等[8]所報道的加氯水AOC在50~100μg乙酸碳/L的生物穩定范圍內。這表明X水廠出廠水的生物穩定性相對較高,理論上飲用水自出廠時起,在管網中停留16d,其菌落總數指標依然能夠達到國家標準的要求。
2.2配水管網水質監測
由于實際管網的情況會與靜態試驗的條件有一定的差異,筆者還對X水廠主干管網上的管網水進行檢測,結果如表1所示。
由表1可知4個監測點的游離余氯濃度相對較高,采用NA作為培養基時的菌落總數均未檢出,而采用R2A作為培養基時,其菌落總數的檢測結果顯著高于采用NA作為培養基時的檢測結果,并且與游離余氯的濃度的負相關性較好,與渾濁度的正相關性較好。將采用R2A作為培養基時的菌落總數結果進行對數轉換,與游離余氯的相關系數達到0.9567,與渾濁度的相關性達到0.9593,均高于自由度為3、顯著性水平為0.05時候的相關系數的臨界值(0.8783)。
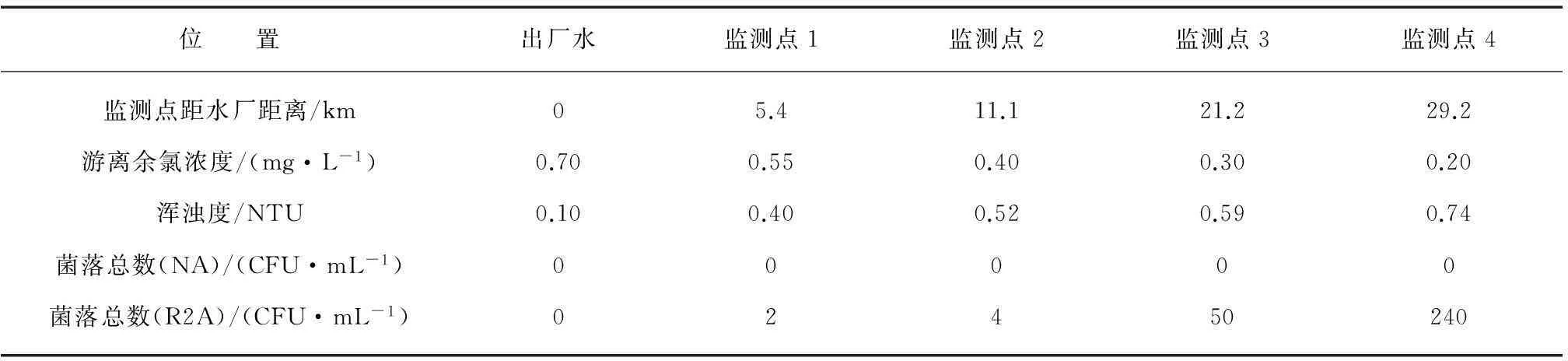
表1 X水廠配水管網沿線管網水中菌落總數和游離余氯濃度的變化
采用R2A作為培養基的菌落總數的檢測結果顯著升高,可能的原因是水中存在的部分耐氯菌在R2A培養基上生長良好,培養5~7d后,生長緩慢的耐氯菌菌落開始出現[9]。而水中的渾濁度可以附著營養物質而支持細菌生長,渾濁度越高其附著的細菌數也相應越多[10]。因此,控制水中的渾濁度是降低飲用水菌落總數的重要方面。
3結論
生活飲用水的游離余氯隨水齡的增長而遞減,菌落總數則隨管網長度的增長、余氯的減少而遞增。因此,導致菌落總數超標的主要原因是水的停留時間過長、余氯衰減較快。建議控制飲用水在管網中的停留時間,必要時,在管網中間補加余氯,從而維持水中一定的游離余氯濃度。
通過配水管網水質監測結果發現采用 R2A 培養基及較長的培養時間得到的菌落總數,能較好地反映飲用水中微生物的水平,得到更為接近于實際狀態的結果。游離余氯與菌落總數有較好的負相關關系,管網末梢處的菌落總數明顯高于其他點位。而渾濁度與菌落總數之間存在較好的正相關關系。
參考文獻
[1] 余國忠,王根鳳,龍小慶,等.給水管網的細菌生長可能機制與防治對策[J].中國給水排水,2000,16(8): 18-20.
[2] 顧孔珍,錢純,羅岳平.用R2A培養基提高飲用水中細菌總數檢出率[J].凈水技術,2004,23(1): 42-44.
[3] Salvatore Massa, Marisa Caruso, Francesca Trovatelli,etal. Comparison of plate count agar and R2A medium for enumeration of heterotrophic bacteria in natural mineral water[J]. World Journal of Microbiology and Biotechnology, 1998, 14(5): 727-730.
[4] 談勇.飲用凈水管網余氯與細菌總數的相關性研究[J].中國給水排水,2009,25(13): 105-107.
[5] 白曉慧,吳漢靚,王海亮,等.飲用水中異養菌平板計數檢測方法的比較[J].凈水技術,2007,26(5): 65-67.
[6] D van der Kooij, J P Oranje, W A Hijnen. Growth of Pseudomonas aeruginosa in tap water in relation to utilization of substrates at concentrations of a few micrograms per liter[J]. Appl. Environ. Microbiol., 1982, 44(5): 1086-1095.
[7] D van der Kooij, W A M HIJNEN. Substrate Utilization by an Oxalate-Consuming Spirillum Species in Relation to Its Growth in Ozonated Water[J]. Appl. Environ. Microbiol., 1984, 47(3): 551-559.
[8] M W Lechevallier, N E Shaw, L A Kaplan,etal. Development of a rapid assimilable organic carbon method for water[J]. Appl. Environ. Microbiol., 1993, 59(5): 1526-1531.
[9] 吳卿,趙新華.飲用水細菌總數及相關指標關系[J].中國公共衛生,2006,22(3): 280-281.
[10] Mark W, Lecheballier T M. Effect of turbidity on chlorination efficiency and bacterial persistence in drinking water[J]. Appl Environ Microbial, 1981, 42(1): 159-167.


