BAPTA-AM脂質體抗大鼠重癥急性胰腺炎的作用
BAPTA-AM脂質體抗大鼠重癥急性胰腺炎的作用
宋必衛,鄭彩云,俞巧麗
(浙江工業大學 藥學院,浙江 杭州 310014)
摘要:為觀察BAPTA-AM脂質體(BA-L)抗重癥急性胰腺炎(SAP)的作用,采用胰膽管逆行注射4%牛黃膽酸鈉(TC)制作大鼠SAP模型.BA-L治療組于造模后立即尾靜脈注射相應劑量BA-L,給藥24 h后,觀察各組大鼠的死亡情況,檢測各組大鼠血清AMS,LDH,TNF-α水平以及胰腺組織勻漿MDA水平及SOD活性,HE染色觀察胰腺組織病理學改變.結果表明:給予BA-L治療后SAP大鼠死亡率明顯降低,血清AMS,LDH,TNF-α水平和胰腺組織勻漿MDA水平顯著降低,SOD活性增高,HE染色組織切片顯示BA-L明顯減輕胰腺組織損傷.表明BA-L能顯著減輕大鼠SAP,為開發BA-L成臨床SAP治療新藥物提供必要的藥效學依據.
關鍵詞:BAPTA-AM;急性胰腺炎;Ca`(2+);TNF-α
收稿日期:2015-04-17
作者簡介:宋必衛(1956—),男,安徽岳西人,教授,研究方向為神經分子藥理學,E-mail:bwsong@zjut.edu.cn.
中圖分類號:R965
文獻標志碼:A
文章編號:1006-4303(2015)05-0562-05
Abstract:To explore the protective effect of BAPTA-AM liposome (BA-L) on severe acute pancreatitis (SAP), a rat SAP model was established by retrograde injection of 4% sodium taurocholate (TC) into pancreatic duct. After modeling, BA-L groups were immediately administered BA-L in different doses. After 24 h of BA-L administration, the mortality of rats, serum AMS, LDH and TNF-α levels, tissue MDA and SOD levels were detected. Pathological changes of pancreatic tissue were examined. The results show that BA-L could significantly reduce the mortality compared to the modeling. A comparison of the modeling groups shows that the AMS, LDH, TNF-α and MDA levels of the BA-L group were reduced remarkably, however, the SOD activity was increased significantly. These changes were also associated with parallel changes in histopathological appearance. In conclusion: The results above demonstrated that BA-L can exert an admirable protection against TC induced SAP in rats. The study also provides the essential therapeutic basis for BA-L to be developed as an anti-SAP drug.
Keywords:BAPTA-AM; acute pancreatitis; Ca`(2+); TNF-α
Protective effect of BAPTA-AM liposome on severe acute pancreatitis in rats
SONG Biwei, ZHENG Caiyun, YU Qiaoli
(College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
急性胰腺炎是臨床較為多見的急腹癥之一,是由多種病因引發的胰酶在胰腺內部被異常激活后,繼發胰腺組織自身消化、水腫、出血甚至壞死的一系列炎癥反應.其發病率呈逐年上升趨勢,大部分急性胰腺炎患者病情具有自限性,預后良好;但有20%~30%的患者可進展為重癥急性胰腺炎(Severe acute pancreatitis,SAP),SAP可引發全身炎癥反應綜合征(Systemic inflammatory response syndrome,SIRS),以致多器官功能障礙綜合征(Multiple organ dysfunction syndrome,MODS),甚至是多器官功能衰竭(Multiple system organ failure,MSOF),從而導致死亡[1-2].目前,臨床SAP治療效果差,仍缺乏針對發病因素、能很好保護胰腺細胞特效治療藥物,SAP病死率仍然高達10%~30%[3].SAP的發病機制極其復雜,誘因諸多,如膽道疾病、內分泌與代謝障礙、大量飲酒與暴飲暴食、胰管阻塞、藥物、手術創傷等[4].目前認為腺泡細胞Ca2+超載、溶酶體水解酶特別是組織蛋白酶B釋放、微循環障礙致缺血缺氧-再灌注損傷、TNF-α等炎癥因子釋放,是SAP發生發展的主要分子機制[5].
Ca2+作為細胞內重要的第二信使,在胰腺腺泡細胞的生理與病理過程中起重要作用,細胞內Ca2+超載是造成SAP的一個重要因素[6-7].BAPTA[1,2-bis(o-aminophenoxy)ethane-N,N,-Nc,Nc-tetraaceticacid;1,2,雙-鄰氨苯氧乙烷基-N,N,-Nc,Nc-四乙酸]是目前國際上實驗室常用的Ca2+絡合劑,其乙酰氧甲基化物(BAPTA-AM)極易進入細胞,在細胞內被酯酶水解后釋放BAPTA,消除細胞內Ca2+超載,調節鈣穩態[8].本課題組通過大量的研究發現:BAPTA-AM對正常人肝細胞(L-02)、人肝癌細胞(HepG-2)、犬腎小管細胞(MDCK)和神經細胞等細胞具有很好的保護作用,能大幅度降低細胞死亡,提高細胞存活率[9-11];整體實驗研究已證明BAPTA-AM脂質體(BAPTA-AM liposome,BA-L)對小鼠急性肝衰竭、大鼠急性腎損傷都有良好的治療作用[12-13].以此為依據,本研究通過建立實驗性大鼠SAP模型,觀察BA-L抗SAP的作用及機制.
1材料與方法
1.1藥品與試劑
BA-L(粒徑125~130 nm)合肥恒星科技開發有限公司提供;牛黃膽酸鈉(Sodium taurocholate,TC),批號101388587,購自美國Sigma公司;腫瘤壞死因子α(Tumor necrosis factor alpha,TNF-α)ELISA試劑盒,批號24010981024,由武漢博士德生物工程有限公司提供;淀粉酶(Amylase,AMS)試劑盒,批號20141210,乳酸脫氫酶(Lactate dehydrogenase,LDH)試劑盒,批號20141211,超氧化物歧化酶(Superoxide dismutese,SOD)試劑盒,批號20141208,考馬斯亮藍試劑盒,批號20141212,丙二醛(Malondialdehyde,MDA)試劑盒,批號20141211,均由南京建成生物工程研究所提供.
1.2實驗動物
采用清潔級健康SD雄性大鼠,體重約220~250 g,購自浙江省醫學科學院動物中心.動物許可證號:scxk(浙)20140001.
1.3分組與給藥
隨機將大鼠分為正常組(control),偽手術組(sham),模型組(model),BA-L分3個劑量給藥組(劑量分別為98,140,200 μg/kg),每組8只(不包含死亡率檢測).SAP造模后,給藥組立即尾靜脈注射(按0.05 mL/kg的容積給藥)相應劑量BA-L,正常組、偽手術組和模型組分別尾靜脈注射等體積的生理鹽水.
1.4大鼠SAP模型的制備
大鼠實驗前12 h禁食不禁水,用10%水合氯醛(3 mL/kg)腹腔注射麻醉,依照Aho和郝建志等的方法復制SAP模型[14-15]:腹部剃毛消毒后,于劍突下正中切開2 cm開腹.進腹沿著胃向下1~2 cm處找到十二指腸系膜緣處的胰腺,胰腺中間可見透明胰管.用手食指托起中段十二指腸,找到腸管壁內潛在的十二指腸大乳頭,用注射針頭于十二指腸外側壁無血管區域扎一個小孔,再用膽管插管從小孔進入腸管后再沿著乳頭方向探入膽胰管內,并與膽胰管呈平行方向平行推入1 cm,再用無創血管鑷夾住固定,同時在肝門下的肝管匯合處,用另一無創血管鑷夾閉肝總管.以勻速緩慢注入4%牛黃膽酸鈉溶液(1 mL/kg),隨即可見胰腺呈彌漫性紅腫.滯留5 min后拔去膽管插管,松開無創血管鑷,消毒針口后逐層縫合關腹.偽手術組不注射4%牛黃膽酸鈉溶液,僅作開腹及做針頭穿刺動作.
1.5大鼠血液和組織樣本的采集
給藥后24 h,通過腹腔注射水合氯醛麻醉大鼠,經左頸總動脈取血.血液用離心機3 000 r/min離心10 min獲取血清,分裝于Eppendorf管-20 ℃冷凍保存,用于血清AMS,LDH,TNF-α檢測.取血后立即取胰腺組織,用4 ℃的生理鹽水洗去表面血液,取胰腺組織的尾部以PH值為7.2±0.1的PBS為介質,制備10%的組織勻漿,按試劑盒操作步驟檢測MDA水平和SOD活性.
1.6胰腺組織的病理學改變
取同一部位胰腺組織,置于10%的福爾馬林溶液固定至少24 h以上,常規石蠟包埋,制成厚度為4 μm的切片,用乙醇梯度脫水,二甲苯透明,最后HE染色.依照Rongione等[16]的標準,在200 倍光鏡下觀察胰腺組織病理學改變,隨機選取8個視野,從組織水腫、炎癥浸潤、細胞壞死、出血四個方面的損傷輕重程度,進行組織病理評分.
1.7統計學分析
實驗數據采用Graphpad Prism 5.0軟件處理,數據用Mean±S.E.M表示,除特別說明之外,其余實驗數據均采用One way ANOVA檢驗均數顯著性差異,以P<0.05為有顯著性差異.
2結果
2.1BA-L對SAP大鼠死亡率的影響
SAP大鼠死亡率(24 h)見表1,采用Chi-square test檢驗均數顯著性差異,偽手術組與正常對照組均無大鼠死亡,而模型組死亡率高達37.5%,給藥組除了低劑量組有1例死亡外,中劑量和高劑量均無大鼠死亡.提示BA-L可降低SAP大鼠死亡率.
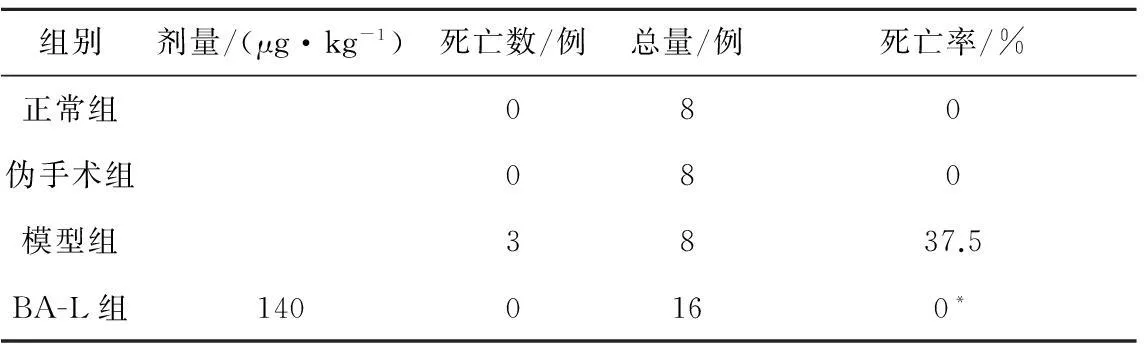
表1 BA-L降低SAP大鼠(24 h)死亡率 1)
注:1) 與模型組比較,*P<0.05.
2.2BA-L降低SAP大鼠血清AMS活性和LDH水平
SAP的特異性血清AMS活性和非特異性LDH水平見圖1和圖2,與正常組比較,偽手術組指標無顯著差異;模型組血清AMS活性和LDH水平均顯著性升高(P<0.001),提示大鼠胰腺損傷明顯.不同劑量的BA-L給藥組血清AMS均極其顯著降低(P<0.001),當劑量為140 μg/kg時,效果最佳,進一步加大劑量為200 μg/kg則無進一步降低趨勢.BA-L在140 μg/kg劑量時,抑制SAP引起LDH釋放(P<0.01)的效果最明顯,SAP引起的LDH釋放為各組實驗值減去正常組均值.
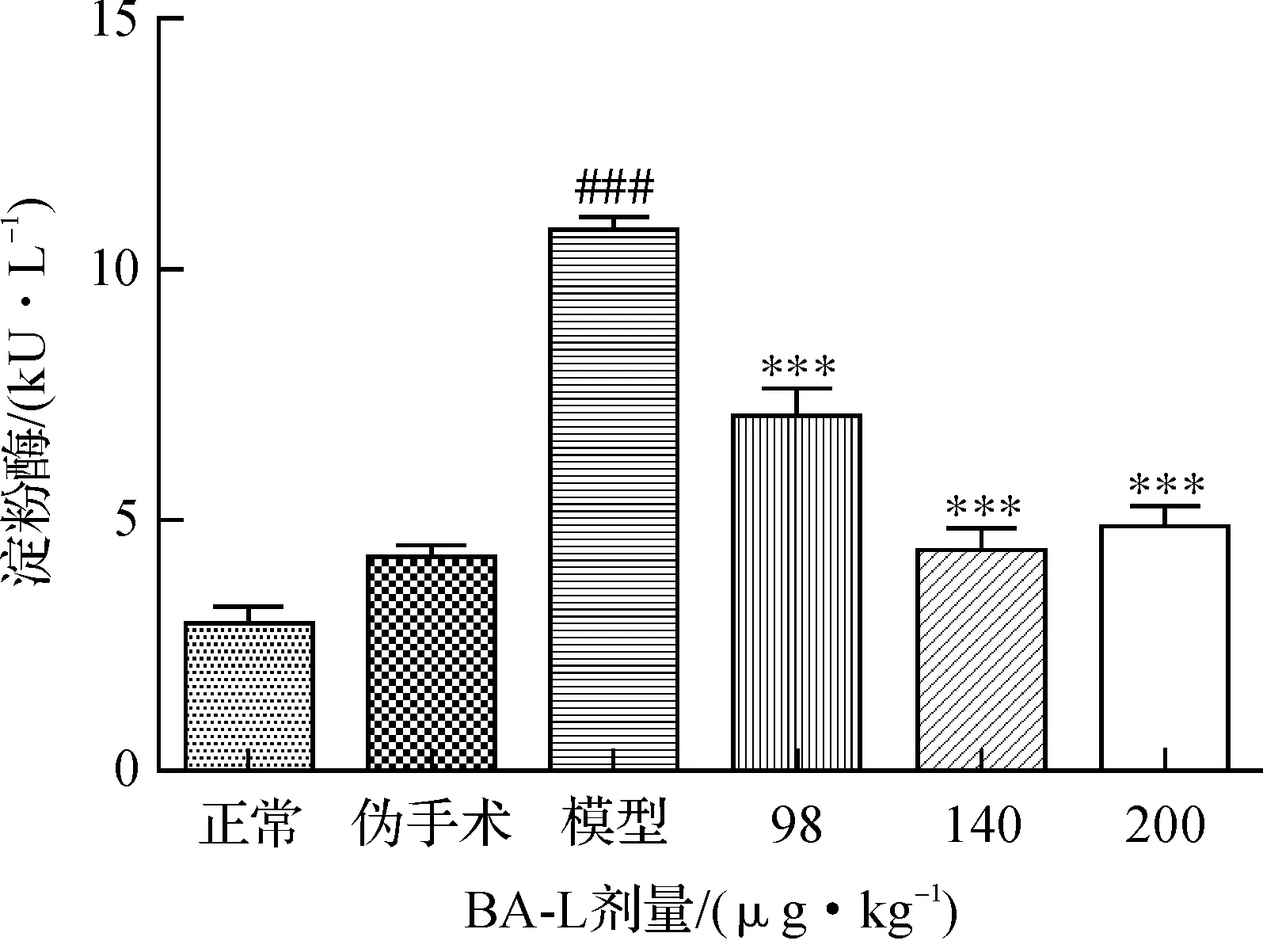
與正常組比較, ###P<0.001;與模型組比較, ***P<0.001 圖1 BA-L降低SAP大鼠血清AMS活性 Fig.1 BA-L lowered the serum activities of AMS in rats with SAP
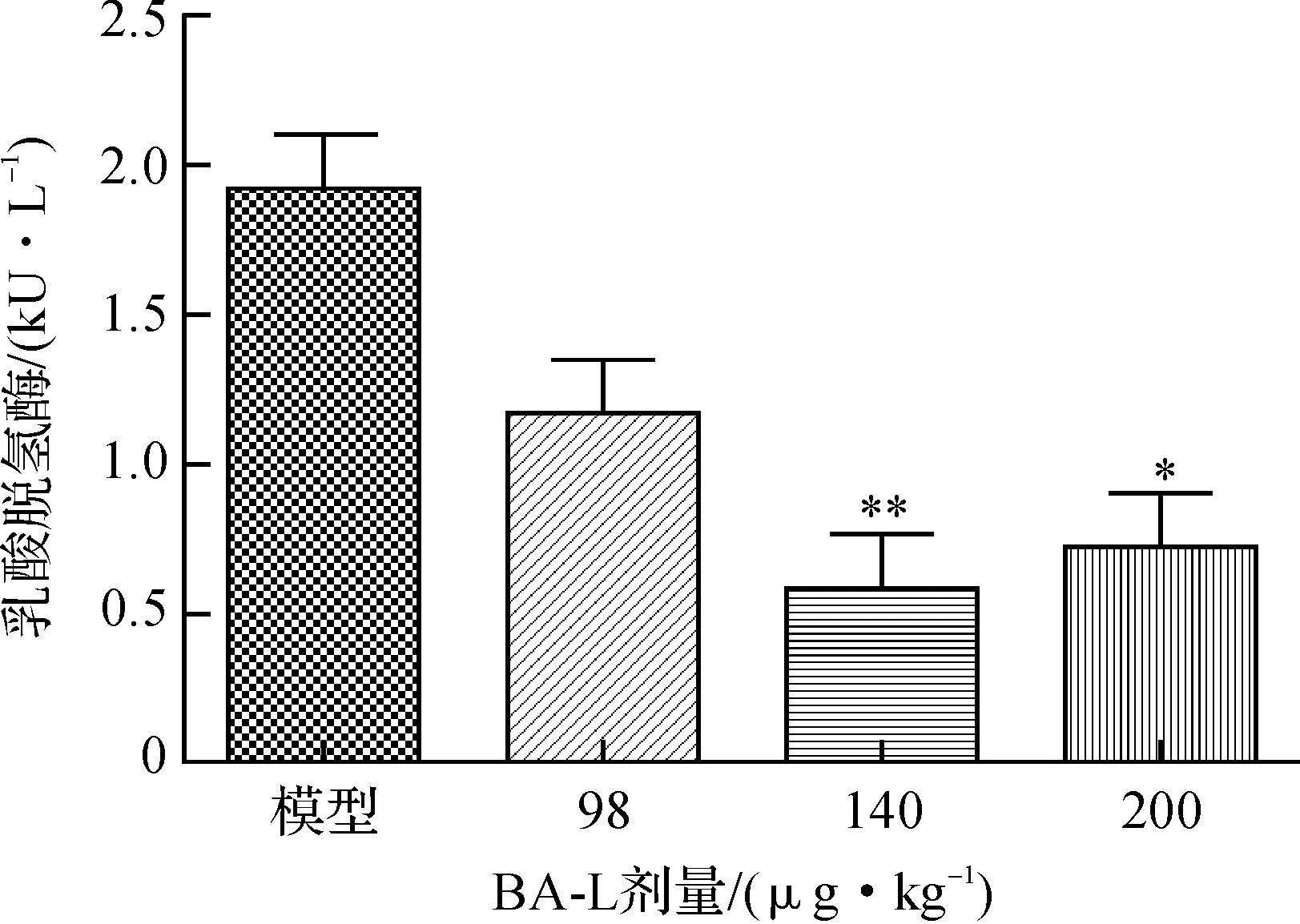
與模型組比較, *P<0.05, **P<0.01 圖2 BA-L抑制SAP引起的LDH釋放 Fig.2 BA-L inhibited LDH release induced by SAP
2.3BA-L減輕SAP大鼠胰腺組織氧化損傷
胰腺組織MDA水平、SOD活性測定結果見表2,模型組MDA水平顯著增高(P<0.001),同時SOD活性明顯降低(P<0.001).BA-L治療顯著降低MDA水平(P<0.001),恢復SOD活性.結果顯示:模型組MDA水平顯著上升,同時SOD活性降低,提示氧化損傷參與了SAP的發病過程;BA-L可抗氧化損傷,起保護胰腺的作用,并存在一定的劑量依賴性趨勢.

表2 BA-L抗SAP大鼠胰腺組織勻漿氧化
注:1) 與正常組比較,###P<0.001;與模型組比較,**P<0.01,***P<0.001.
2.4BA-L改善SAP大鼠胰腺病理學變化
綜合以上實驗的結果,選取BA-L 140 μg/kg劑量組的胰腺組織進行HE染色,200倍光鏡下隨機選擇8個視野觀察大鼠胰腺組織病理學變化(圖3),按組織壞死、出血、炎癥、水腫4個方面進行病理學評分.圖3(a,b)胰腺結構清晰,形態完整,間質無滲出,無明顯的炎癥滲出,無出血與壞死.圖3(c)結構模糊不清,胰閏管和小葉間導管極顯著擴張,胰腺間質明顯水腫,炎癥細胞浸潤,小葉有大量彌漫性出血及壞死.圖3(d)與模型組相比,胰腺結構清晰,病變明顯減輕,可見小葉間水腫,少量炎癥細胞浸潤,個別有出血及壞死現象.病理學評分(表3)可見:模型組得分相比正常對照組明顯增高,胰腺損傷程度很重;BA-L治療組的得分顯著減低,表明損傷較輕.
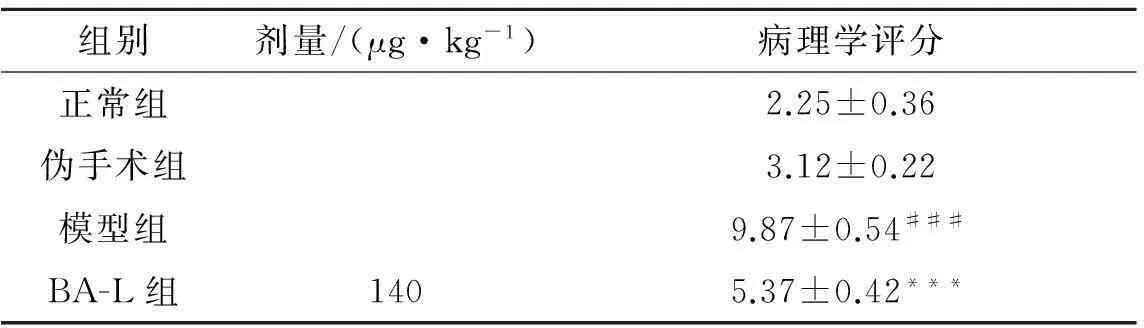
表3 大鼠胰腺組織損傷病理學評分(HE染色)
注:1) 與正常組比較,###P<0.001;與模型組比較,***P<0.001.
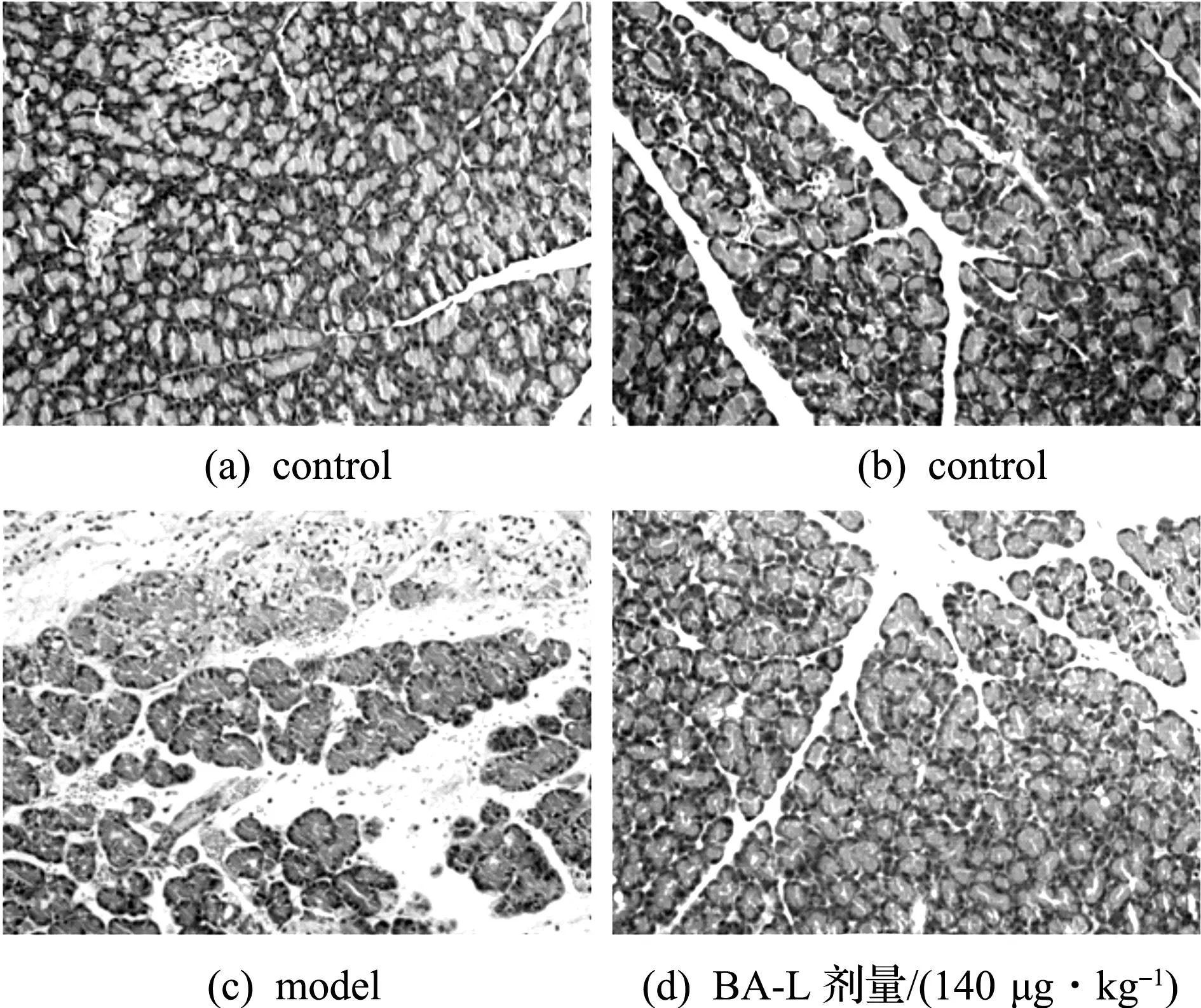
圖3 BA-L改善SAP大鼠胰腺組織病理學變化 Fig.3 BA-L ameliorated the injury of pancreatic tissue
2.5BA-L降低血清TNF-ɑ水平
1.1 對象 2011年1—6月在我科住院且使用靜脈留置針的老年患者300例,按住院號的單雙分為實驗組和對照組各150例,兩組患者性別、年齡、文化程度、病種、靜脈條件和用藥情況比較差異無統計學意義(P>0.05),具有可比性。
血清TNF-ɑ水平見圖4.模型組水平是正常組的4倍以上(P<0.001);與模型組比較,BA-L各給藥組TNF-ɑ表達水平均極明顯下降;當BA-L劑量為140 μg/kg時,TNF-ɑ表達水平降低尤為明顯.
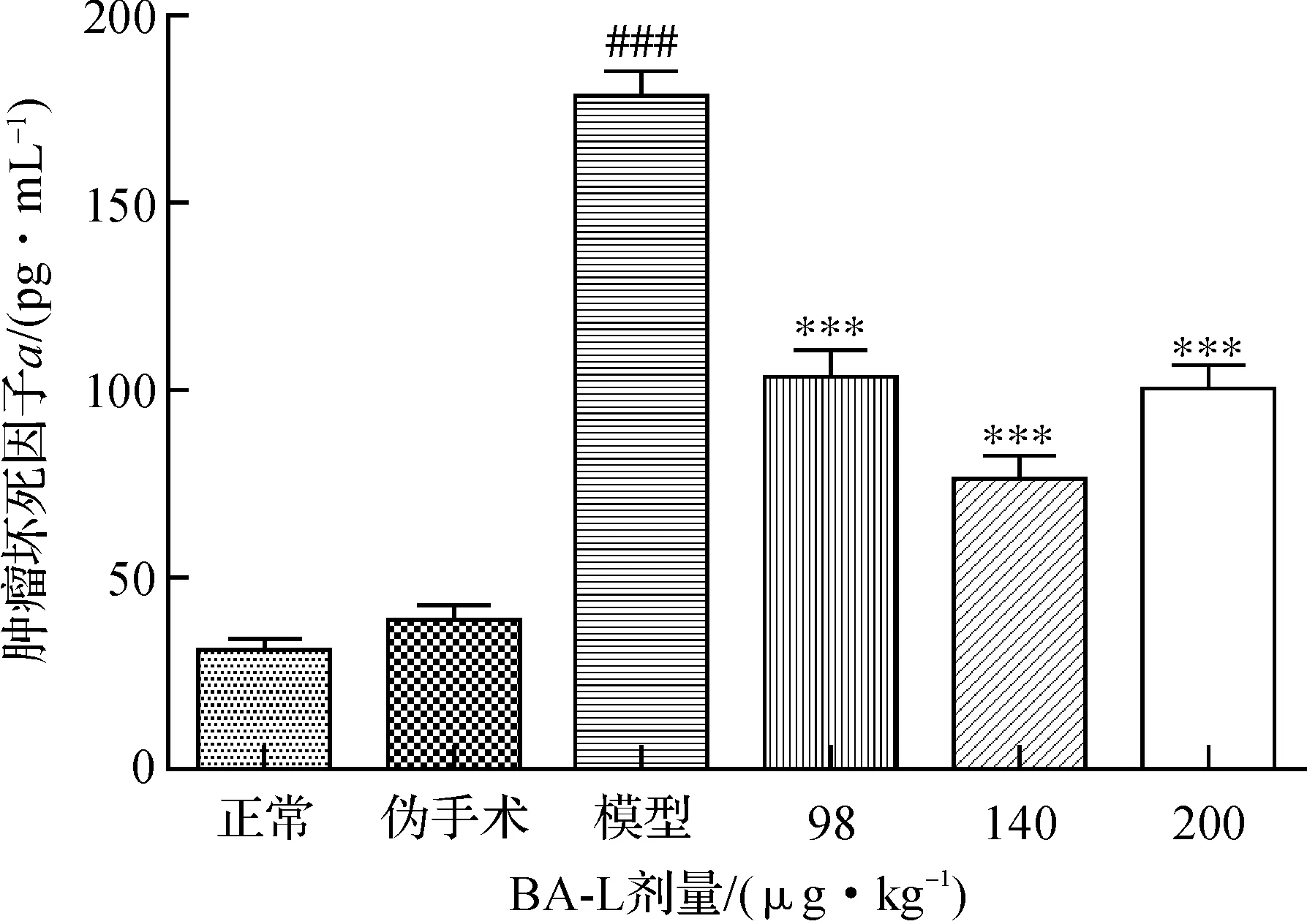
與正常組比較, ###P<0.001;與模型組比較, ***P<0.001 圖4 BA-L降低SAP大鼠血清TNF-α水平 Fig.4 BA-L decreased the serum levels of TNF-α in rats with SAP
3討論
多種誘因均可導致SAP,如膽源性、酒精性及高脂血癥等,目前沒有特效的治療方法.當SAP發生時,常伴有血鈣降低,提示SAP時胰腺損傷與Ca2+水平異常有關.近年來,Ca2+在SAP病理生理學過程中的作用研究是SAP領域研究焦點之一,細胞內Ca2+超載被普遍認為是導致胰腺腺泡細胞死亡的關鍵因素[17].Wittel等[18]的研究顯示在大鼠SAP模型中,腺泡細胞內Ca2+濃度升高,可導致胰腺水腫和壞死.Dante等[19]動態觀察了胰腺組織中的Ca2+濃度的變化,發現在SAP的早期,胰腺組織中就有Ca2+的異常聚集,并且隨著疾病的發展而加重.這是由于在多種致病因素的相互作用下,破壞了細胞膜的完整性,細胞外的Ca2+可以通過異常開放的Ca2+通道流入細胞內,從而造成胰腺腺泡細胞內Ca2+超載.體外實驗也證實SAP時細胞內Ca2+持續升高,且與SAP 的嚴重度正相關[20].Mooren等[21]分別結扎了大鼠和小鼠的胰管造成SAP模型,測得胰腺細胞內Ca2+明顯升高,細胞內鈣穩態遭到破壞.腹腔給與鈣絡合劑預處理,可抑制大SAP模型鼠胰腺細胞內Ca2+升高,證實細胞內Ca2+信號變化直接參與了SAP的發生發展.BAPTA-AM是極易進入細胞的Ca2+絡合劑,在胞內被酯酶水解后釋放BAPTA,消除細胞內Ca2+超載,達到調節鈣穩態的目的.本實驗采用逆行胰膽管注射4%牛黃膽酸鈉建立大鼠SAP模型,探索BAPTA-AM抗SAP的作用.
胰腺是一個有內、外分泌功能的重要器官,它的生理和病理變化都與生命息息相關.AMS主要由唾液腺和胰腺分泌.其功能主要是能分解多糖,如淀粉和糖原.血清AMS升高最多見于SAP.當SAP發生時,AMS升高,臨床上一般都用AMS作為重癥急性胰腺炎診斷的首選指標.LDH是細胞破裂的非特異標志物,在胰腺損傷過程中釋放[22].MDA是自由基引發的脂質過氧化過程中合成的醛類物質,其含量高低反映了機體內氧化損傷程度.SOD可通過清除體內氧自由基,發揮抗氧化作用來保護細胞.TNF-α是造成胰腺損傷的主要炎癥因子,是胰腺炎癥事件中最早起作用的因素之一.TNF-α與TNF受體結合,激活死亡受體通路,分別能引起胰腺細胞和毛細血管內皮細胞細胞凋亡、程序性壞死,并通過激活NF-κB通路引起炎癥反應[23-24].本實驗中,正常組和偽手術組AMS活性、TNF-α水平、氧化應激指標以及組織形態學特征幾乎未見異常,表明實驗手術過程未對胰腺造成任何損傷.SAP模型組中血清AMS,LDH活性和TNF-α水平急劇增高、嚴重的氧化損傷及形態學特征變化等表明了動物模型的成功.給予BA-L治療后大鼠各項指標水平明顯降低,表明BA-L具有胰腺保護作用,并能顯著減輕SAP大鼠胰腺損傷,其作用機制可能與抗氧化損傷、減少TNF-α表達有關,開發前景良好.
4結論
研究首次證明BA-L靜脈注射給藥,能顯著減輕SAP大鼠胰腺損傷.在劑量為140 μg/kg時效果最佳,單次給藥療效可維持24 h以上,證明BA-L有良好的抗SAP功效.BA-L抗SAP機制可能與抗氧化損傷,減少TNF-α表達有關.實驗給藥時間是在SAP大鼠造模成功后,屬于治療用藥,故實驗結果比一般的預防用藥更符合臨床的治療實際,為BA-L開發成SAP治療藥物提供了一條全新思路.
參考文獻:
[1]MUNSELL M A, BUSCAGLIA J M. Acute pancreatitis[J]. Journal of Hospital Medicine,2010,5(4):241-250.
[2]WU B U, BANKS P A. Clinical management of patients with acute pancreatitis[J]. Gastroenterology,2013,144(6):1272-1281.
[3]LANKISCH P G. Treatment of acute pancreatitis: an attempted historical review[J]. Pancreatology,2010,10(2/3):134-141.
[4]陳其奎.急性胰腺炎的病因和發病機制[J].現代消化及介入治療,2007,12(3):160-162.
[6]DAVID C, MICHAEL C, BEN M, et al. The role of Ca2+influx in endocytic vacuole formation in pancreatic acinar cells[J]. Biochemical Journal,2015,465(3):405-412.
[7]PETERSEN O H. Ca2+signaling in pancreatic acinar cells: physiology and pathophysiology[J]. Brazilian Journal of Medical & Biological Research,2009,42(1):9-16.
[8]宋必衛,儲紹興.BAPTA-AM的研究現狀[J].中國藥理學報,2009,25(7):851-853.
[9]施水娟,宋必衛.BAPTA-AM對MDCK細胞的保護作用及其機制[J].中國藥理學通報,2012,28(2):255-260.
[10]宋必衛,駱錢芬.BAPTA-AM對OGD-再灌致HepG-2細胞損傷的保護作用研究[J].浙江工業大學學報,2013,41(2):133-137.
[11]蔡燕,付再林,顧喜燕,等.BAPTA-AM抗D-GalN致L-02細胞損傷作用[J].浙江工業大學學報,2010,38(3):326-331.
[12]楊毅,宋必衛.BAPTA-AM脂質體抗D-GalN/LPS所致的小鼠急性肝衰竭[J].浙江工業大學學報,2013,41(3):280-285.
[13]宋必衛,何治宇,樊俏玫,等.BAPTA-AM脂質體抗大鼠急性腎損傷作用[J].浙江工業大學學報,2014,42(5):491-495.
[15]郝建志,方馳華,范應方,等.一種效果確切的大鼠重癥急性胰腺炎模型[J].中國組織工程研究,2011,15(28):5193-5196.
[16]RONGIONE A J, KUSSKE A M, KWAN K, et al. Interleukin 10 reduces the severity of acute pancreatitis in rats[J]. Gastroenterology,1997,112(3):960-967.
[17]FRICK T W. The role of calcium in acute pancreatitis[J]. Surgery,2012,152(3):S157-S163.
[18]WITTEL U A, WIECH T, CHAKRABORTY S, et al. Taurocholate-induced pancreatitis: a model of severe necrotizing pancreatitis in mice[J]. Pancreas, 2008, 36(2): e9-e21.
[19]DANTE G S. The pancreas[M]. Baltimore: Lippincott Williams& Wikin USA, 2001:441-450.
[20]KRüGER B, ALBRECHT E, LERCH M M. The role of intracellular calcium signaling in premature protease activation and the onset of pancreatitis[J]. American Journal of Pathology, 2000, 157(1): 43-50.
[21]MOOREN F C, HLOUSCHEK V, FINKES T, et al. Early changes in pancreatic acinar cell calcium signaling after pancreatic duct obstruction[J]. Journal of Biological Chemistry, 2003, 278(11): 9361-9369.
[22]PAVLIDIS T E, PAVLIDIS E T, SAKANTAMIS A K. Advances in prognostic factors in acute pancreatitis: a mini-review[J]. Hepatobiliary Pancreat Diseases International,2010,9(5):482-486.
[23]GE Ning, XIA Qing, YANG Zhonghua, et al. Vascular endothelial injury and apoptosis in rats with severe acute pancreatitis[EB/OL].[2015-04-02]. http://dx.doi.org/10.1155/2015/235017.html.
[24]ZHONG Ke. Curcumin mediates a protective effect via TLR-4/NF-κB signaling pathway in rat model of severe acute pancreatitis[EB/OL].[2015-04-03]. http://link.springer.com/article/10.1007/s12013-015-0664-y.html.
(責任編輯:劉巖)

