RNA干擾MSTN基因鯉的肌纖維密度及染色體核型分析
閆學春,欒培賢,何立川,吳學工
(中國水產科學研究院黑龍江水產研究所,淡水魚類育種國家地方聯合工程實驗室,淡水水產生物技術與遺傳育種重點實驗室,黑龍江 哈爾濱 150070)
RNA干擾MSTN基因鯉的肌纖維密度及染色體核型分析
閆學春,欒培賢,何立川,吳學工
(中國水產科學研究院黑龍江水產研究所,淡水魚類育種國家地方聯合工程實驗室,淡水水產生物技術與遺傳育種重點實驗室,黑龍江 哈爾濱 150070)
本實驗分析RNA干擾MSTN基因鯉(以下簡稱RNA干擾鯉,體質量為116.2g和110.3g)的染色體,測定該鯉肌肉中的肌纖維密度。結果表明:(1)三組實驗魚的肌纖維密度分別為163.7根/mm2、171.9根/mm2和162根/mm2,對照魚的普通鯉(Common carp)為142根/mm2,實驗魚高于對照魚。單因素方差分析表明:實驗魚組間肌纖維密度差異不顯著(F=0.83,P=0.44>0.05),而與對照魚差異顯著(F=5.24,P=0.034<0.05)。(2)PHA和秋水仙素體內注射法分析核型表明,實驗魚的染色體數為2n=100,核型公式為:2n=30m+24sm+28st+18t,臂比(NF)156,對照魚染色體數為2n=100,核型公式為:2n=30m+26sm+28st+16t,臂比(NF)156。結果說明RNA干擾基因的插入并未影響鯉染色體組成。
RNA干擾;MSTN;肌纖維密度;染色體核型
RNA干擾(RNA interference,RNAi)是由雙鏈RNA(Double-stranded RNA,dsRNA)介導的抑制基因表達的現象,引發RNA干擾現象的RNA稱為干擾RNA。在后基因組時代,RNA干擾技術作為一種抑制基因表達的基因沉默技術,可以特異性抑制目的基因表達,現已成為基因功能研究中的一種快速、簡便的有效方法[1]。1998年,Fire等[2]在研究線蟲基因沉默時,證實RNA干擾現象由雙鏈RNA介導完成,隨后證明RNA干擾現象廣泛存在于多種真核生物中,如植物、真菌、果蠅、動物等。RNA干擾引起特定基因沉默主要有轉錄前水平的基因沉默(TGS)和轉錄后水平的基因沉默(PTGS)兩類:TGS是通過DNA修飾或染色體異染色質化等原因使基因不能正常轉錄;PTGS是啟動了細胞質內靶mRNA序列特異性的降解機制,已在魚類研究中有很多報道[3-9]。目前有兩種常用方式實現RNA干擾:1)構建DNA表達載體導入受體細胞,通過在體內表達合成dsRNA;2)采用體外合成可誘導基因沉默的dsRNA,再通過適當的手段導入受體細胞或機體。二者不同之處在于產生可誘導基因沉默dsRNA的方式,但其目的都是使目的基因表達水平下降或者完全沉默。
肌肉生長抑制素(MSTN)屬TGF-β超家族,是一類分泌型的多肽。1997年Mcpherron等[10]首次在小鼠骨骼中發現了MSTN基因。該基因對骨骼肌生長起負調節作用,抑制肌肉發育。近些年許多學者都致力于研究不同物種肌肉生成抑制因子[11-13],試圖通過實驗方法導致MSTN基因突變使肌細胞的增殖和肥大。在魚類中,Acosta等[14]在斑馬魚Barchydanio rerio var中發現,通過RNAi沉默MSTN基因,抑制了MSTN基因表達解除其對斑馬魚肌肉生長的抑制作用,促進了斑馬魚的生長。
本文通過顯微注射技術將攜帶H1啟動子的RNA干擾真核表達載體導入鯉受精卵核區附近,獲得一批具有MSTN基因沉默表型的RNA干擾鯉,實驗證明該鯉比普通鯉生長速度快[7]。MSTN基因對肌肉生長起負調節作用,通過RNA干擾沉默MSTN基因能夠解除對肌肉生長的抑制作用,引起肌肉纖維密度變化。RNA干擾還能引起染色體異染色質化,引起核型改變。本研究利用肌肉纖維密度測定技術和核型分析技術分析RNA干擾鯉,探究RNA干擾MSTN基因對鯉肌肉纖維纖維密度和核型的影響。
1 材料和方法
1.1 材料
實驗魚為黑龍江水產研究所制備的RNA干擾鯉,對照魚為普通鯉(Common carp),取自黑龍江水產研究所松浦試驗站。實驗魚和對照魚飼養在兩個333.3m2的相鄰池塘中,每個池塘各放800尾同期孵化的魚苗,采用相同的喂養方法,飼養102d。
1.2 方法
1.2.1 肌纖維密度測定
實驗魚15尾,平均體質量為140g,隨機分成三組。對照魚共取5尾,平均體質量為138g。取實驗魚和對照魚的背鰭下方、側線上方的肌肉(去鱗、去皮),樣品大小為1cm×1cm×0.5cm,平放入Bouin氏液中固定,采用石蠟包埋切片,厚度為8μm,切面與肌肉纖維方向垂直,蘇木素-伊紅染色,常規封片,每個樣品3張,在光學顯微鏡下進行觀察[19]。
在Olympus CN2.0顯微鏡目鏡中放入網格測微尺,在10×40倍下使用Motic plus2.0測量軟件測定肌纖維密度,每片取30個視野,記錄視野網格內肌纖維根數[20]。
1.2.2 核型分析
實驗魚和對照魚各10尾,平均體質量分別為116.2g和110.3g,在實驗室內室溫充氣暫養。實驗前一天注射PHA(植物凝集素),劑量為200g/g魚體質量。注射PHA后18h,活體胸腔注射秋水仙素,劑量為50μg/g魚體質量,注射4 h后將魚處死取前腎[21]。
將前腎放入生理鹽水中研磨,將細胞懸液吸入離心管中,1 000r/min離心6min,將上清液吸出,用低滲液懸浮沉淀,處理30min,在離心、懸浮等處理后用卡諾氏液(甲醇∶冰醋酸=3∶1)固定三次,每次30min[22]。
將載破片從冰水中取出,每片滴三滴腎懸浮液,待干燥后,用Giemsa染色液染色20min。用自來水細流沖洗片子,室溫干燥后進行核型分析。
核型分析時,取10個染色體分散較好的中期分裂相計數以確定染色體數目,在顯微鏡的油鏡下照相、測量、統計[23]。
2 結果與分析
2.1 肌纖維密度
在光鏡下觀察發現,三組實驗魚和對照鯉的肌纖維密度分別為163.7根/mm2、171.9根/mm2、162根/mm2和142根/mm2(圖1)。單因素方差分析表明,實驗魚組間肌纖維密度差異不顯著(F=0.83,P=0.44>0.05),而實驗魚與對照魚之間肌纖維密度差異顯著(F=5.24,P=0.034<0.05)(圖2和圖3)。
2.2 RNA干擾鯉的染色體數目
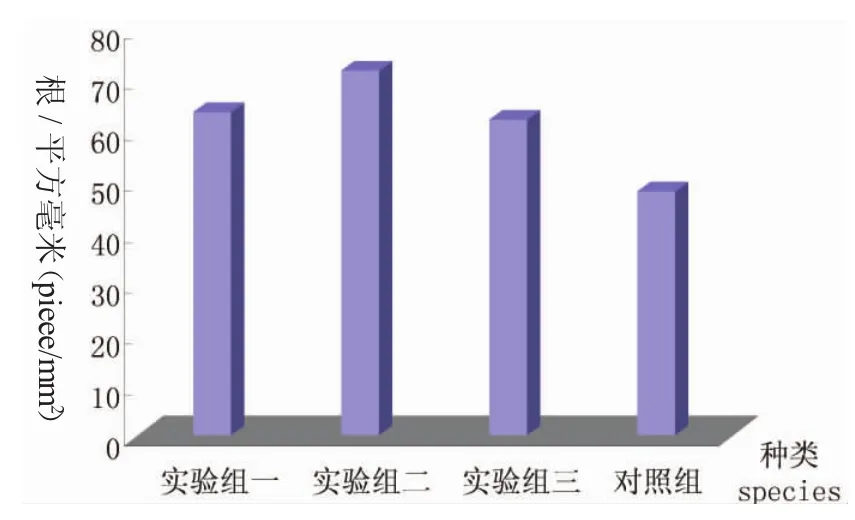
圖1 RNA干擾鯉肌纖維密度比較Fig.1 Comparison of muscle fiber density in the RNA interference common carp

圖2 RNA干擾鯉肌纖維顯微切片圖Fig.2 The muscle fibers of the RNA interference common carp

圖3 對照魚肌纖維顯微切片圖Fig.3 The muscle fibers of the control fish
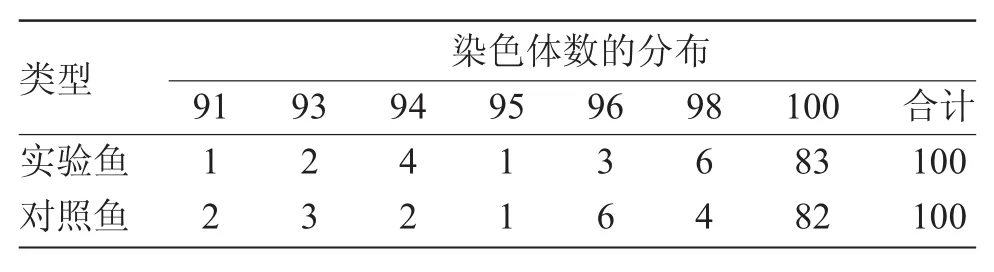
表1 實驗魚和對照魚染色體的數目分布Tab.1 The chromosome numbers in the RNA interference common carp and the control common carp

圖4 RNA干擾鯉腎細胞染色體中期分裂相Fig.4 Metaphase division of nephrocyte chromosome in the RNA interference common carp

圖5 對照魚腎細胞染色體中期分裂相Fig.5 Metaphase division of nephrocyte chromosome in the control common carp
由表1可知,染色體數目為100的分裂相最多,RNA干擾鯉有83個,占83%;對照魚有82個,占82%。可確定實驗鯉和普通鯉二倍體染色體的數目均為100,2n=100(圖4、圖5)。
2.3 染色體核型
經過測量計算得出:RNA干擾鯉染色體核型公式:2n=30m+24sm+28st+18t,染色體臂數NF=156,即有15對m染色體(中部著絲點)、12對sm染色體(亞中部著絲點)、14對st染色體(亞端部著絲點)和9對t染色體(端部著絲點)(圖6);普通鯉染色體核型公式:2n=30m+26sm+28st+16t,染色體臂數NF=156,即有15對m染色體(中部著絲點)、13對sm染色體(亞中部著絲點)、14對st染色體(亞端部著絲點)和8對t染色體(端部著絲點)(圖7)。實驗鯉與普通鯉染色體的大小差異不大,染色體數和臂數一致。
3 討論
隨著RNA干擾研究的進一步深入,對魚類肌肉發育相關基因進行RNA干擾的研究已有報道。如閆學春等[7]通過顯微注射技術將肌肉生長抑制基因的真核表達載體導入鯉中,促進了鯉肌肉的生長;Acosta等[14]通過注入dsRNA發現,抑制肌肉生長抑制基因都能夠引起斑馬魚肌肉生長變快,促進斑馬魚的生長。應用表明,可以通過RNA干擾技術對MSTN基因進行沉默,以提高魚類肌肉生長速度,這為獲得具有特殊經濟性狀的基因工程魚提供了新的技術手段。

圖6 轉RNA干擾鯉腎細胞核型Fig.6 Karyotype of nephrocyte chromosome in the RNA interference common carp

圖7 對照魚腎細胞核型Fig.7 Karyotype of nephrocyte chromosome in the control common carp
肌纖維類型、直徑、密度、面積比例和肌節長度、結締組織特性和肌肉脂肪含量與分布等肌肉組織學特性,是肌肉肉質的重要指標。魚肌纖維作為肌肉的基本構成單位,肌肉纖維密度與肌肉的品質密切相關。如李池陶等[19]對大頭鯉Cyprinus pellegrini、黑龍江鯉Cyprinus carpio haematopterus Temminck et Schlegel、德國鏡鯉 Cyprinus carpio var. specularis和雜種F3肌肉密度的比較顯示,雜種F3的肌肉密度增加,大于德國鏡鯉和黑龍江鯉,與大頭鯉接近,表明雜種F3的肌肉品質與大頭鯉相似;候粲等[23]的測定和分析結果表明:虹鱒Oncorhynchus mykiss肌肉結締組織含量少,肌纖維密度大,口感細膩,肉質鮮美。郁二蒙等[24]對脆肉鯇與普通草魚Ctenopharyngodon idellus背部白肌、腹部白肌和背部紅肌纖維結構進行了分析,結果說明脆肉鯇肌肉的直徑及密度與其肌肉硬度具有一定相關性;Johnston等[25]對大西洋鮭Salmo salar肌纖維結構的分析發現,肌纖維密度與肌肉硬度成正比,即肌肉硬度隨肌纖維密度增大而增大。李西等[26]研究證明轉Fst1基因可促進斑馬魚肌肉生長的同時,也進行了肌肉組織學的研究,表明在高表達卵泡抑素的轉基因魚骨骼肌中,肌纖維密度增加,但肌纖維大小變化不明顯;Jannel等[14]將雙鏈RNA顯微注射到斑馬魚后,體重增長比對照組魚高45%,肌纖維含量平均增長了48.7%。本研究中,RNA干擾鯉的肌纖維密度顯著高于對照魚,表明RNA干擾有效抑制了肌肉生長抑制素基因的表達,促進了肌纖維的增長和肌纖維密度的增加,為提升魚類肌肉品質提供了新方法。
染色體是細胞中重要的遺傳結構,往往被用作細胞遺傳學分析的主要依據,但每種魚染色體數目和結構的恒定性具有相對性,在一定的自然和人為條件下,可能發生變異[15]。本研究結果表明:RNA干擾MSTN基因鯉與正常鯉的染色體基本一致,未發現異型性染色體、隨體和次縊痕,只是在染色體組型上有差異。這種染色體組型的差異,可能是染色體數目多造成測量和配組等方面的誤差,至于具體原因還有待進一步研究。
綜上所述,本實驗RNA干擾技術沉默MSTN基因,鯉肌纖維密度產生了顯著變化,特異性地抑制了肌肉生長抑制素基因的表達。染色體核型分析證明其RNA干擾基因的插入對RNA干擾鯉的染色體核型沒有影響。因此,利用RNA干擾技術干擾MSTN基因的表達,對提高魚類肌肉含量、改進肌肉的品質和促進魚類肌肉的生長可起到重要作用。
[1]Fire A,Xu S,MontgomeryMK,etal.Potentand specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806-811.
[2]劉月英,周志平,馬俊蓮,等.RNAi及其抑制目的基因表達的機制[J].安徽農業科學,2007,35(13):3826-3827.
[3]韓林強,李勝杰,于凌云,等.RNA干擾技術在魚類中的研究進展[J].南方水產,2009,5(3):67-73.
[4 Wargelius A,Ellingsen S and Fjose A.Double-stranded RNA induces specific developmental defects in zebrafish embryos[J].BiochemBiophysResCommun,1999,263(1): 156-161.
[5]Oates A C,Bruce A E and Ho RiK.Too much interference: injection of double-stranded RNA has nonspecific effects in the zebrafish embryo[J].DevBiol,2000,224:20-28.
[6]Li YX,Farrell MJ,Liu R,et al.Double-stranded RNA injection produces null phenotypes in zebrafish[J].Dev Biol 2000,217:394-405.
[7]閆學春,梁利群,曹頂臣,等.應用RNAi技術構建的轉基因鯉的檢測分析[J].水產學雜志,2013,26(3):1-5.
[8]楊少麗,鄭蘭紅,閻松,等.小分子干擾RNA對斑馬魚VEGF基因的沉默作用[J].高技術通訊,2007,17(12): 1278-1282.
[9]Zhao Z X,Cao Y,Li M,et al.Double-stranded RNA injection produces nonspecific defects in zebrafish[J].Dev Biol, 2001,229(1):215-223.
[10]Mcpherron A C,Lamler A M and Lee S J.Regulation of skeletal muscle mass bya newTGF-β superfamilymember[J].Nature,1997,387(6628):83-89.
[11]馬現永,馬靜云,曹永長,等.肌肉生長抑素基因工程疫苗免疫動物的效果研究[J].廣東畜牧獸醫科技, 2003,28(6):41-43.
[12]秦瑞峰,顧曉明,陳金武,等.鼠肌肉轉錄調節因子MyoD基因真核表達載體的構建[J].中國修復重建外科雜志,2001,15(5):257-260.
[13]馬現永,施振旦,曹永長,等.雞、鵝肌肉生成抑制因子基因的克隆及序列分析[J].華南農業大學學報:自然科學版,2004,25(2):85-88.
[14 Acosta J,Carpio Y,Borroto I,et al.Myostatin gene silenced by RNAi show a zebrafish giant phenotype[J]. Biotech,2005,119(4):324-331.
[15 Arif M,Kocabas H K R and Dunham Z L.Molecular characterization and diferential expression of the myostatin genein channel catfish(Ictalurus punctatus)[J]. Biochimica et Biophysica Acta,2002,1575:99-107.
[16]閆素麗,安玉麟,孫瑞芳,等.染色體核型分析及染色體顯微分離技術研究進展[J].生物技術通報,2008(4): 70-74.
[17]閆學春,杜科,梁利群.回交鯉與回交荷包紅鯉染色體核型的比較分析[J].水產學雜志,2012,25(2):7-10.
[18]殷亞杰,聶春雨,劉偉石,等.馬鹿肌肉組織學特征與肉質關系的研究[J].中國農學通報,2012,28(35):51-54.
[19]李池陶,關海紅,胡雪松,等.大頭鯉、黑龍江鯉、德國鏡鯉及其雜種F3肌肉品質比較[J].水產學報,2008,3(1):45-50.
[20]閆學春,梁利群.鯉鯽雜交回交鯽染色體核型及DNA含量的分析[J].水產學雜志,2014,27(1):8-11.
[21]范瑞,姜志強,李雅娟,等.太平洋鱈魚染色體核型及銀染分析[J].水生生物學報,2014,38(1):115-120.
[22 Levan A,Fredga K and Sandberg A.Nomencalture for centromericposition on chromosomes[J].Hereditas,1964, 52(2):201-220
[23]侯粲,楊曙明,周宇,等.虹鱒肌肉纖維組織學特性研究[J].安徽農業科學,2013,41(9):3902-3904.
[24]郁二蒙,謝駿,盧炳國,等.脆肉鯇與普通草魚肌肉纖維結構觀察[J].南方農業學報,2014,45(4):671-675.
[25]Johnston I A,Alderson R,Sandham C,et al.Muscle fibre density in relation to the colour and texture of smoked Atlantic salmon(Salmo salar L.)[J].Aquaculture,2000, 189(3-4):335-349.
[26]李西,聶芬,殷戰,等.轉基因高表達卵泡抑素1對斑馬魚肌肉生長促進作用研究[J].中國科學:生命科學, 2011,41(1):53-60.
Muscle Fiber Density and Karyotype in RNA Interference MSTN Genne Common Carp
YAN Xue-chun,LUAN Pei-xian,HE Li-chuan,WU Xue-gong
(National Local Joint Engineering Laboratory of Freshwater Fish Breeding,Key Laboratory of Freshwater Aquatic Biotechnology and Genetic Breeding,Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China)
In this study,fiber density was determined in muscle and karyotype in chromosome was observed in RNA interference MSTN gene common carp(Cyprinus carpio)(referred as the RNA interference carp)and Amur River Common carp(Cyprinus carpio haematopterus Temminck et Schlegel)with body weight of 116.2 g and 110.3 g by PHA and colchicine injected in vivo.The results showed that there was muscle fiber density of 163.7 ind./mm2,171.9 ind./mm2,and 162 ind./mm2in the three RNA interference carp groups,respectively,without significant difference(F=0.83,P=0.44>0.05),and significantly higher than that in the control group(142 ind./mm2)(F=5.24,P=0.034<0.05),theoretical indicating that the RNA interference carp had good muscle quality.Karyotype analysis revealed that the RNA interference carp had chromosome number of 2n=100,and karyotype formula of 2n=30m+24sm+30st+18t,NF=156.The common carp in the control group showed chromosome number of 2n=100,and karyotype formula of 2n=30m+26sm+28st+16t,NF=156.The findings indicated that the insertion of RNA interference gene has no effect on the chromosomes of common carp.
RNA interference;MSTN;muscle fiber density;chromosome karyotype
S917
A
1005-3832(2016)05-0032-05
2016-02-23
國家高技術研究發展計劃(863計劃)項目(2011AA100404);國家水產種質資源平臺項目;淡水魚類育種國家地方聯合工程實驗室開放課題項目(KF-2015-003).
閆學春(1964-),男,研究員,從事分子生物學與基因工程育種研究.E-mail:yanxc8@163.com

