量氣法的改進及應用
董志強 任艷平
(廈門大學化學化工學院,福建廈門361005)
量氣法的改進及應用
董志強 任艷平*
(廈門大學化學化工學院,福建廈門361005)
通過在反應管(瓶)上端加一恒壓分液漏斗以改進一般量氣法中隔離反應物的方式稱為改進量氣法。應用改進量氣法對Mg摩爾質量、Al合金中Al含量、無水Na2CO3基準物和工業純堿總堿度以及鈣片中CaCO3含量進行了測定,并將其測定結果與其他測定方法的實驗結果進行了比較。結果表明,改進量氣法能更方便、簡單、快速、環保地應用于有定量氣體產生的有關常數測定以及一些定量分析的實驗中。
量氣法;恒壓分液漏斗;改進
量氣法利用的是封閉體系中化學反應產生的氣體,通過測量反應前后的氣體體積變化,得到反應所產生的氣體體積,再利用分壓定律、連通器原理和理想氣體狀態方程以及相應定量關系計算得到待測值。量氣法具有實驗原理簡單、操作簡便快速、實用性強等特點,是常數測定和定量化學分析實驗中常用的經典實驗方法[1]。很多大學化學實驗教材中都有與量氣法相關的實驗內容,如置換法測定Mg的摩爾質量[2]、摩爾氣體常數R的測定[3-7]、氣體摩爾體積的測定、CaO2含量的分析[6]、電解法測定阿伏伽德羅常數[8]以及第43屆國際奧林匹克化學競賽實驗預備題——鈣鹽組成的測定[9]等。
然而,在一般量氣法應用過程中遇到了密閉體系反應前反應物(尤其是含有液體反應物)的安全、有效隔離問題。如置換法測定Mg的摩爾質量(裝置如圖1所示),反應前要將反應物隔離,本實驗中,用滴管將稀H2SO4送入反應管底部,而將Mg條用水粘在反應管上端內壁。若不小心,Mg條就很容易掉入酸中,造成實驗失敗。對于細碎狀、粉末狀以及絲狀等無法粘附固定在反應管壁的反應物,則必須借助小試管或胖肚管[10]。對于不同性狀的反應物需要不同的附加裝置,并且實驗時既不方便也不能安全有效地隔離反應物,這使一般量氣法的應用受到了很大限制。
為了克服這一缺點,通過在反應管(瓶)上端加一恒壓分液漏斗以改進一般量氣法中隔離反應物的方式稱為改進量氣法。將液體反應物裝入恒壓分液漏斗中,固體反應物定量放入反應管或反應瓶中,如圖2所示,這樣就巧妙地實現了密閉體系反應前兩種反應物的安全、有效隔離。改進后的量氣法不但具有一般量氣法簡單、快捷等優點,而且可以應用于細碎、粉末狀甚至都是液體的反應物的實驗,如石灰石中Ca含量的測定、蛋殼中CaCO3含量的測定、H2O2含量測定、2Na2CO3?3H2O2活性氧的分析等都可用改進量氣法進行實施,拓寬了量氣法的應用范圍。
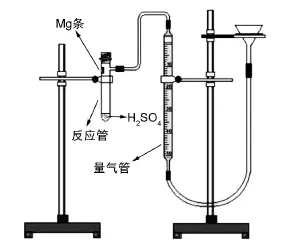
圖1 一般量氣法裝置示意圖

圖2 改進量氣法裝置示意圖
為了進一步驗證改進量氣法的可靠性及通用性,本文用改進量氣法分別對Mg摩爾質量、Al合金中Al含量、無水Na2CO3基準物和工業純堿總堿度以及鈣片中CaCO3含量進行了測定,并將測定結果與其他測定方法的實驗結果進行了比較和討論。
1 Mg摩爾質量的測定
分別采用改進量氣法和一般量氣法[2]對Mg的摩爾質量進行了測定,都分別平行測定3次。相關實驗數據及結果如表1所示。
實驗結果表明,采用改進量氣法與一般量氣法測得Mg的摩爾質量值基本一致,這說明改進量氣法是切實可行的。
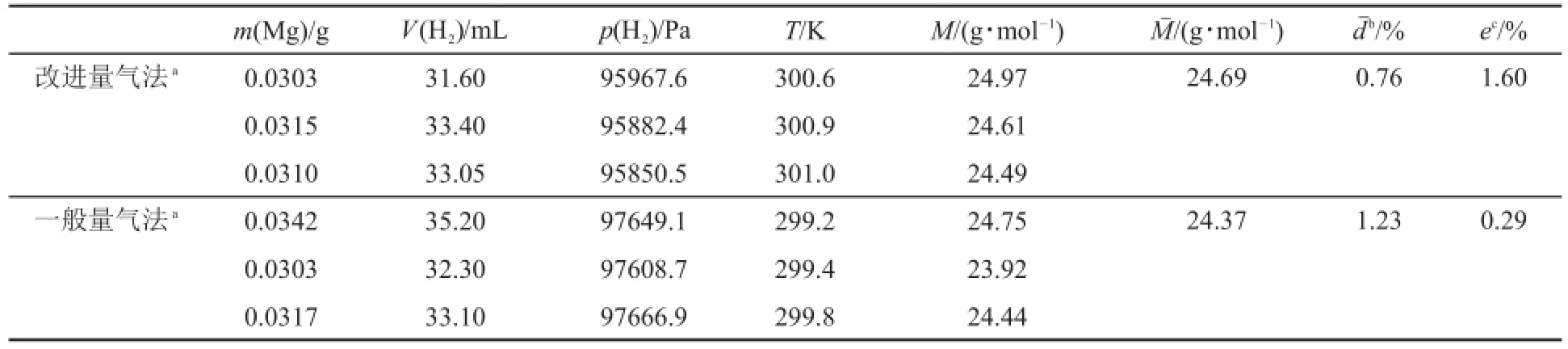
表1 Mg摩爾質量測定的實驗數據及結果
2 Al合金中Al含量的測定
分別采用改進量氣法和置換滴定法[2]對Al合金中Al含量進行了測定,相關實驗數據如表2和表3所示。
從表2和表3可以看出兩種方法所測得的合金中Al含量在方法誤差范圍內基本一致,這說明改進量氣法應用于Al合金中Al含量測定實驗是可行的。但在測定的便捷程度上,改進量氣法相對于置換滴定法則具備了明顯的優勢。采用置換滴定法測定時,首先需要對定量Al合金試樣進行溶解、定量稀釋,然后定量移取Al合金試樣,并加入定量EDTA溶液,之后需要用NH3?H2O和鹽酸精心調節體系的pH為3-4,還需要水浴或電熱板加熱一定時間后加入六次甲基四胺緩沖溶液,再依次用Zn2+標準溶液返滴定,加入NH4F溶液加熱后置換滴定。同時需要使用基準物配制標準溶液及其他多種試劑,并且要用到如NH3?H2O、NH4F等具有揮發性、腐蝕性的試劑以及水浴鍋或電熱板等加熱工具[2],滴定終點廢液多(每個學生至少有300 mL)。置換滴定法整個分析過程操作步驟繁多,并且需使用的試劑多、實驗產生的廢液多,同時也非常耗時(完成整個分析過程需要5-6小時)。而用改進量氣法測定Al合金中Al含量時,其操作步驟簡單、耗時少、使用試劑只有一種(6 mol?L-1HCl)、實驗過程產生的廢液很少,具有簡單、安全、環保等特點。

表2 改進量氣法測定Al合金中Al含量a的實驗數據及結果

表3 置換滴定法測定Al合金中Al含量a的實驗數據及結果
3 碳酸鹽含量的測定
為了考查改進量氣法對碳酸鹽類化合物含量測定的準確程度,我們首先采用改進量氣法對基準物無水Na2CO3的含量進行了測定,相關實驗數據及結果如表4所示。

表4 改進量氣法測定基準物無水Na2CO3a含量b的實驗數據及結果
從實驗結果可以看出,采用改進量氣法測得的結果偏低,其主要原因是CO2在水中的溶解所造成的。采用改進量氣法測得的Na2CO3含量比國藥集團化學試劑有限公司所標識的含量小3%,如果這3%的誤差主要考慮為CO2在水中的溶解,那么可推算實驗中溶解的CO2體積約為1 mL;而在100 kPa和300 K條件下,CO2在水中的溶解度約為0.7 mL?g-1[11],實驗時加入5 mL 1 mol?L-1H2SO4,理論上在反應液中應有約3.5 mL的CO2溶解(由于量氣管中的水與CO2接觸面積小,因此CO2在量氣管水中的溶解可忽略),但考慮到酸過量,反應液為酸性,CO2的溶解會受到一定程度的抑制,因此最終約有1 mL CO2溶于反應液中,造成了上述測定的誤差。同樣,也用上述方法對工業純堿的總堿度(以w(Na2O)表示)進行了測定,有關實驗數據及結果見表5。
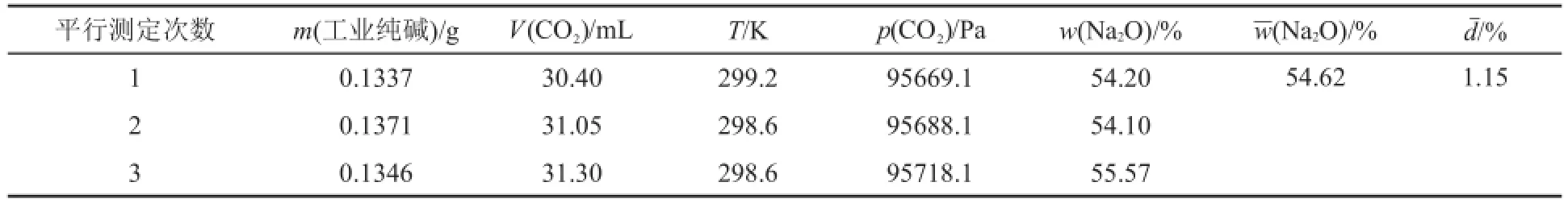
表5 改進量氣法測定工業純堿總堿度a的實驗數據及結果
眾所周知,測定工業堿總堿度最簡單的方法就是酸堿滴定法[2]。然而,與改進量氣法相比,酸堿滴定法測定工業堿總堿度需要基準物標定鹽酸的濃度等,相對操作步驟多,尤其是用甲基橙指示滴定終點溶液顏色由黃至橙變化很不敏銳,橙色色系范圍廣,大部分學生難以較準確地判斷滴定終點,造成實驗結果精密度和準確度差。當然用甲基紅-溴甲酚綠混合指示劑代替甲基橙可使滴定終點顏色變化更敏銳、學生更容易把握,但滴定過程不同階段顏色變化多,還需要加熱。所以,在沒有特別要求時,應用改進量氣法測定工業純堿總堿度,確實簡單、快速,結果也準確。
同時,也分別采用改進量氣法和配位滴定法[2]對鈣片中CaCO3的含量進行了測定,相關實驗數據如表6和表7所示。
實驗結果表明,采用改進量氣法和配位滴定法分別測得每片鈣片中的CaCO3含量與生產廠家標識的藥品說明書中每片鈣片中CaCO3(250 mg?片-1)含量基本相當,也進一步說明了改進量氣法的可靠性。而配位滴定法同樣是實驗步驟多,需要對基準物進行處理以及實驗過程需要加熱等,并且所用試劑種類多,用到氨性緩沖溶液(給實驗環境造成一定污染)以及鉻黑T指示劑,滴定終點廢液需要收集專門處理。除了配位滴定法,Ca含量測定的常用方法還有KMnO4法(如石灰石中Ca含量的測定[3,12]),但是測定過程需要加熱、沉淀、陳化、過濾、洗滌、濾液檢驗等,實驗條件苛刻,同時還須用到KMnO4、NH3?H2O和鹽酸等揮發性、腐蝕性試劑,并且整個實驗過程耗時7個小時。上述3種測定方法相比,體現了改進量氣法簡單、快速、環保的優點。
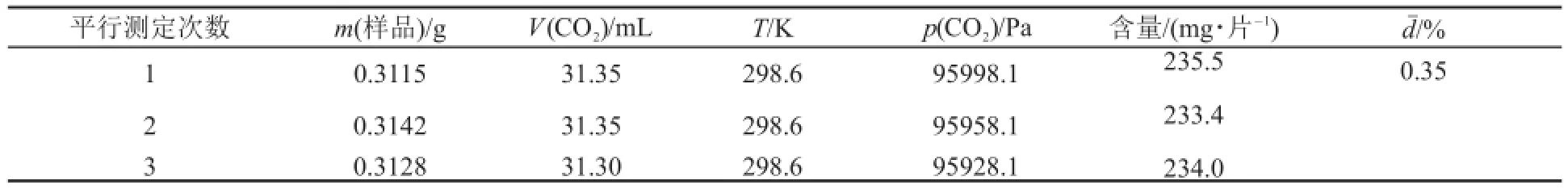
表6 改進量氣法測定鈣片a中CaCO3含量b的實驗數據及結果
綜合以上實驗結果可以看出,改進量氣法是一種方便、簡單、快速、環保、可靠的實驗方法,可廣泛應用于有定量氣體產生的有關常數測定以及一些定量分析實驗。當然,從目前的實驗結果來看,改進量氣法得到的實驗結果的精密度還較低,這可能與實驗時溫度、壓力的波動以及在讀取量氣管液面讀數時的人為因素有關。進一步分析上述實驗結果,發現應用改進量氣法測量氣體為H2時,所得到的實驗結果與滴定分析的結果吻合較好;而當測量氣體為CO2時,所得到的結果比滴定分析的結果稍偏小,這主要是由于CO2在水中的溶解導致測量氣體的體積變小而使最終結果稍變小。我們也試圖在量氣管中注入0.1 mol?L-1H2SO4溶液代替H2O以減少CO2的溶解,但實驗結果表明CO2在量氣管水中的溶解很少,而主要在反應液中溶解,所以可以采取減少反應液體積以及較劇烈攪拌以減少CO2溶解的方法。
另外,在應用量氣法的實驗中,還應該考慮鹽酸等溶液揮發所帶來的蒸氣壓影響。在考慮反應速率適當的前提下,上述有關實驗中盡可能使用低濃度的鹽酸,即可忽略鹽酸蒸氣壓對實驗結果的影響。
實際實驗時,選擇改進量氣法還是滴定法,需要根據實驗目的和實驗要求(知識點和方法等)以及具體的實驗條件,具體問題具體分析。
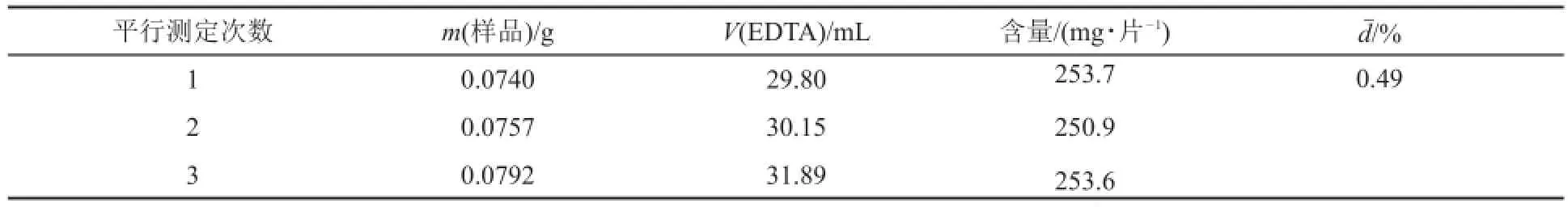
表7 配位滴定法測定鈣片a中CaCO3含量b的實驗數據及結果
[1]任艷平,董志強,阮嬋姿.大學化學,2015,30(2),22.
[2]蔡維平.基礎化學實驗(一).北京:科學出版社,2004.
[3]蘭州大學化學化工學院大學化學實驗中心.大學化學實驗(基礎化學實驗I,下冊).第2版.蘭州:蘭州大學出版社,2011.
[4]鄭春生,楊楠,李梅,崔春仙.基礎化學實驗(無機及化學分析實驗部分).天津:南開大學出版社,2001.
[5]吳泳.大學化學新體系實驗.北京:科學出版社,1999.
[6]沈建中,馬林,趙濱,衛景德.普通化學實驗.上海:復旦大學出版社,2007.
[7]吳江.大學基礎化學實驗.北京:化學工業出版社,2005.
[8]張鑫雨,丁家琦,謝祎祎,蘇澤彬,顧春暉,楊藝.大學化學,2013,28(5),82.
[9]Preparatory Problems 43rd International Chemistry Olympiad 2011 Ankara,Turkey(第43屆國際奧林匹克化學競賽實驗預備題,土耳其,2011年),Practical Problem 32Analysis of calcium salts.
[10]浙江大學普通化學教研組.普通化學實驗.第3版.北京:高等教育出版社,1996.
[11]迪安,J.A.蘭氏化學手冊.第13版.北京:科學出版社,1991.
[12]徐家寧,門瑞芝,張寒琦.基礎化學實驗(上冊)——無機化學和分析化學實驗.北京:高等教育出版社,2006.
Improvement on the Equipment and Application of Eudiometry
DONG Zhi-QiangREN Yan-Ping*
(College of Chemistry and Chemical Engineering,Xiamen University,Xiamen 361005,Fujian Province,P.R.China)
Through improving the way of isolating reactant in the eudiometry,the improved eudiometry is applied to quantitative determination,and the results are compared with that by other methods.The results show that the improved eudiometry is convenient,simple,fast and environmentally friendly,and can be applied to determine constants and quantitative analyses which involve quantitative generation of the gaseous product.
Eudiometry;Constant pressure funnel;Improvement
G64;O652
*通訊作者,Email:ypren@xmu.edu.cn
2016年度教育部“基礎學科拔尖學生培養試驗計劃”研究課題;福建省高等學校教學改革研究項目(JAS14634);
國家基礎科學人才培養基金(J1210014)
10.3866/PKU.DXHX201603024
www.dxhx.pku.edu.cn

