VEGF、EGFR、PDGF在人腦膠質瘤中的表達及其與惡性程度和預后的關系
李連進,佟建洲,崔敬,吳紅紀,王惠賓
(保定市第一中心醫(yī)院神經外二科,河北 保定 071000)
VEGF、EGFR、PDGF在人腦膠質瘤中的表達及其與惡性程度和預后的關系
李連進,佟建洲,崔敬,吳紅紀,王惠賓
(保定市第一中心醫(yī)院神經外二科,河北 保定 071000)
目的 探討血管內皮生長因子(VEGF)、表皮生長因子受體(EGFR)、血小板衍生生長因子(PDGF)在人腦膠質瘤中的表達及其與腫瘤惡性程度和患者預后的關系。方法選取我院神經外科2010年11月至2013年8月手術切除并經病理證實的腦膠質瘤標本68例及同期正常腦組織標本12例,采用SP免疫組化法檢測所有標本中VEGF、EGFR、PDGF的表達,分析其與膠質瘤各臨床特征的關系,采用Spearman等級相關分析方法分析VEGF、EGFR、PDGF三者間的關系。結果膠質瘤組織中VEGF、EGFR和PDGF的表達陽性率分別為63.24%(43/68)、51.47%(35/68)和52.94%(36/68),均明顯高于正常腦組織的0(0/12)、8.33%(1/12)和33.33%(4/12),差異均有統(tǒng)計學意義(P<0.05);在生存率方面,VEGF陽性患者低于VEGF陰性患者(23.26%vs 60.00%),EGFR陽性患者低于EGFR陰性患者(28.57%vs 51.52%),PDGF陽性患者低于PDGF陰性患者(27.78%vs 62.50%),差異均有統(tǒng)計學意義(P<0.05);Spearman等級相關分析顯示,VEGF、EGFR及PDGF的表達與膠質瘤WHO分級呈顯著正相關(rVEGF=0.428,rEGFR=0.407,rPDGF=0.431,P<0.05)。結論VEGF、EGFR、PDGF在人腦膠質瘤發(fā)生發(fā)展中起重要調節(jié)作用,可作為判斷膠質瘤惡性程度和預后的重要生物學參考指標。
膠質瘤;血管內皮生長因子;表皮生長因子受體;血小板衍生生長因子;預后;相關性
膠質瘤是一種高度血管化的中樞神經系統(tǒng)原發(fā)性惡性腫瘤,其發(fā)生和發(fā)展與微血管形成密切相關。病理情況下腫瘤細胞釋放出多種成血管因子誘導微血管形成,腫瘤組織經微血管從宿主獲取養(yǎng)分,同時經微血管轉送腫瘤細胞至宿主身體的其他部位,繼續(xù)生長和誘導新的微血管形成,實現遠處轉移[1]。血管內皮生長因子(VEGF)、表皮生長因子受體(EGFR)、血小板衍生生長因子(PDGF)均在腫瘤血管生成中發(fā)揮著重要作用,其中VEGF是腫瘤細胞誘導微血管形成過程中的一個最重要的調節(jié)因子,參與了血管形成的全過程;EGFR是一種具有酪氨酸蛋白激酶活性的細胞膜受體,其與配體生長因子結合后自身磷酸化激活,進而通過多條信號轉導功能,促進內皮細胞分裂增殖[2],最終促進血管生成;而PDGF是一種旁分泌生長因子,可通過自分泌及旁分泌作用刺激間質增生和微血管生成,與腫瘤生長、侵襲和轉移密切相關。本研究通過檢測人腦膠質瘤組織中VEGF、EGFR、PDGF的表達并與正常腦組織進行比較,分析其與腫瘤惡性程度和預后的關系,以期為膠質瘤抗血管生成治療及生物免疫治療提供理論基礎。
1 資料與方法
1.1 一般資料 選取我院神經外科2010年11月至2013年8月手術切除并經病理證實的腦膠質瘤標本68例,患者術前均未進行放療、化療及生物免疫治療等輔助治療。其中男性39例,女性29例,年齡22~76歲,平均(42.76±6.49)歲。所有標本經常規(guī)組織病理學檢查,其中確診為星形細胞瘤36例,膠質母細胞瘤24例,少突星形和毛細胞形細胞瘤各4例。按照2007年WHO中樞神經系統(tǒng)膠質瘤分類標準[3]分級:Ⅰ級4例、Ⅱ級28例、Ⅲ級25例、Ⅳ級11例。12例正常人腦組織來源于腦外傷行去骨瓣減壓手術患者,設為正常對照。
1.2 方法
1.2.1 儀器及試劑 (1)儀器:全自動封閉型組織脫水機、石蠟切片機(德國SLEE),倒置光顯微鏡、顯微鏡成像系統(tǒng)(日本OLYMPUS),烤箱及孵箱(上海實驗儀器廠有限公司);(2)試劑:鼠抗人VEGF單克隆抗體(1:300)、鼠抗人EGFR單克隆抗體(1:200)、鼠抗人PDGF單克隆抗體(1:300)及通用型SP廣譜試劑盒、DAB顯色劑(ZLI-9031)、磷酸鹽緩沖液(PBS),均購自上海億新生物科技有限公司,均購自上海億欣生物科技有限公司。
1.2.2 SP免疫組化染色法 將所有組織標本采用10%中性甲醛固定,常規(guī)石蠟包埋,行4 μm連續(xù)切片。石蠟切片脫蠟至水,加入3%H2O2,37℃孵育10 min,PBS沖洗3次,5 min/次。微波抗原熱修復,加入50 μL牛血清白蛋白封閉液(BSA)封閉,置于37℃孵育,傾去勿洗。10 min滴加VEGF、EGFR、PDGF一抗(1:50稀釋),4℃冰箱孵育過夜,PBS沖洗3次,5 min/次。滴加生物素標記的二抗,37℃孵育40 min,PBS沖洗3次,5 min/次;加入辣根過氧化物酶標記的鏈霉素卵白素工作液,37℃孵育30 min,PBS沖洗3次,5 min/次;DAB顯色3~5 min,自來水充分沖洗;蘇木素復染,常規(guī)脫水,透明,干燥,封片,顯微鏡下觀察。操作均嚴格按照試劑盒說明書步驟進行。以PBS代替一抗作為陰性對照,以已知陽性切片作為陽性對照。
1.2.3 結果判定 VEGF表達于細胞質,呈棕黃色顆粒;EGFR表達于細胞膜和細胞質,呈棕黃色顆粒;PDGF表達于細胞質,呈棕黃色或棕褐色顆粒。高倍視野下(×400)隨機選取10個視野,每個視野計數100個腫瘤細胞,計算陽性細胞百分率。計分標準:陽性細胞百分率<10%為0分;10%~25%為1分;26%~50%為2分;51%~75%為3分;>75%為4分。染色強度評分標準:無色為0分;淡黃色為1分;棕黃色為2分;棕色或棕褐色為3分。以計分和染色強度評分乘積>4分定義為陽性。
1.3 統(tǒng)計學方法 所有數據經核對證實后均經SPSS17.0統(tǒng)計學軟件進行數據處理,計量資料以均數±標準差(±s)表示,兩組間計數資料比較采用χ2檢驗,采用Spearman等級相關分析方法分析VEGF、EGFR及PDGF的表達與膠質瘤惡性程度的關系,以P<0.05為差異有統(tǒng)計學意義。
2 結 果
2.1 人腦膠質瘤和正常腦組織中VEGF、EGFR及PDGF的表達差異 VEGF在正常腦組織中不表達,EGFR及PDGF在正常腦組織中低表達,VEGF、EGFR及PDGF均在人腦膠質瘤組織中高表達。人腦膠質瘤和正常腦組織中VEGF、EGFR及PDGF的表達陽性差異具有統(tǒng)計學意義(P<0.05),見表1。
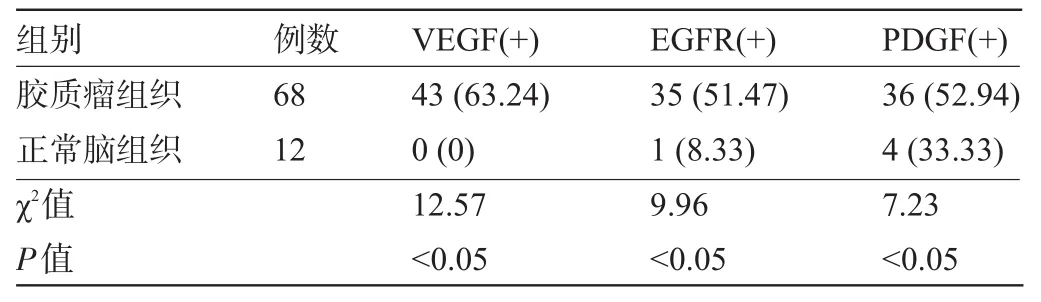
表1 人腦膠質瘤和正常腦組織中VEGF、EGFR及PDGF的表達陽性率的比較[例(%)]
2.2 VEGF、EGFR及PDGF的表達與人腦膠質瘤WHO分級的相關性 VEGF、EGFR及PDGF在不同級別膠質瘤組織中的表達陽性見表2和圖1。結果顯示,VEGF、EGFR及PDGF的表達陽性率隨腫瘤分級的升高呈上升趨勢,以在Ⅳ級膠質瘤組織中表達陽性率最高,其次為Ⅲ級,再次為Ⅱ級,最低為Ⅰ級,差異具有統(tǒng)計學意義(χ2VEGF=8.104,χ2EGFR=7.948,χ2PDGF= 6.774,P<0.05)。Spearman等級相關分析顯示,VEGF、EGFR及PDGF的表達與膠質瘤WHO分級呈顯著正相關(rVEGF=0.428,rEGFR=0.407,rPDGF=0.431,P<0.05)。
2.3 VEGF、EGFR及PDGF表達與患者生存的關系 VEGF、EGFR及PDGF表達陽性及陰性的生存曲線分析見圖2。VEGF(23.26%)、EGFR(28.57%)及PDGF(27.78%)表達陽性患者累積生存率明顯低于表達陰性患者(60.00%、51.52%、62.50%),差異均具有統(tǒng)計學意義(P<0.05)。

表2 VEGF、EGFR及PDGF在不同級別膠質瘤組織中的表達[例(%)]
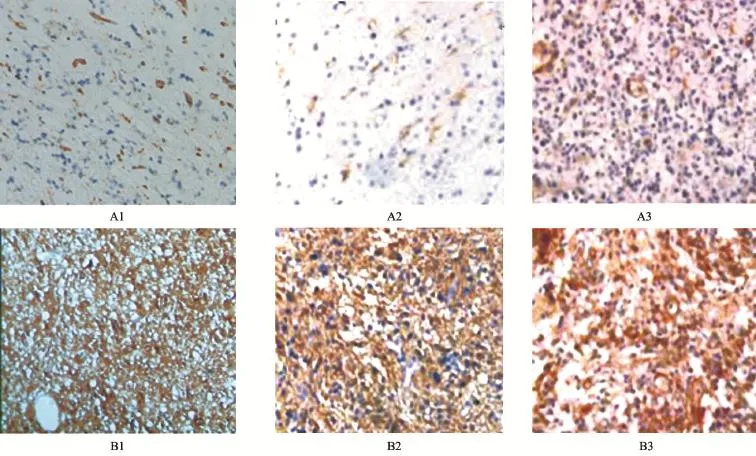
圖1 VEGF、EGFR及PDGF在WHOⅡ級和Ⅳ級人腦膠質瘤中的表達
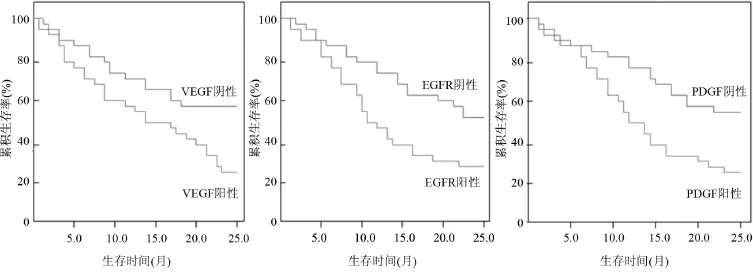
圖2 VEGF、EGFR及PDGF表達陽性及陰性的生存曲線
3 討 論
微血管生成在實體瘤生長和發(fā)展中起重要作用,若實體瘤內無微血管形成,腫瘤僅可以通過擴散緩慢生長,一旦形成微血管,腫瘤即呈指數型快速生長并進一步向周圍浸潤和進入血循環(huán)向遠處轉移,因此實體瘤的生長和發(fā)展具有血管依賴性[4]。而腦膠質瘤是一種高度血管化的中樞神經系統(tǒng)原發(fā)性惡性腫瘤,微血管生成是其生長和侵襲過程中的重要階段。無控性增殖、侵襲性生長等特性導致腦膠質瘤臨床治愈率低,預后差,是神經外科治療中最棘手的難治性腫瘤之一[5]。近年來,隨著分子靶向治療研究的不斷深入,針對腦膠質瘤微血管生成因子或受體的分子靶向治療已成為研究的熱點之一[6]。
VEGF、EGFR、PDGF均在腫瘤微血管生成中發(fā)揮重要作用,項高波等[7]研究顯示,膠質瘤組織中VEGF的表達與腫瘤微血管密度呈明顯正相關,其表達高水平可反映腫瘤微血管生成呈高度活躍。Wang等[8]研究報道,惡性膠質瘤中常出現EGFR擴增和過度表達,通過促進內皮細胞增殖,加快微血管生成,進而促進腫瘤進展。劉愛軍等[9]研究報道,PDGF可與VEGF相互作用,通過自分泌及旁分泌作用刺激間質增生和微血管生成,從而有利于腫瘤生長、侵襲和轉移。此外,已有多項研究證實,通過阻斷VEGF、EGFR、PDGF信號轉導可抑制腫瘤微血管形成,進而達到抑制腫瘤生長的目的[10-11]。因此,檢測腦膠質瘤組織中VEGF、EGFR、PDGF是否為異常表達對評估VEGF、EGFR、PDGF作為腦膠質瘤分子靶向治療的靶點的可行性具有較重要的臨床意義。本研究采用免疫組織化學染色法檢測68例腦膠質瘤組織和12例正常腦組織標本中VEGF、EGFR、PDGF的表達情況,并分析其與腦膠質瘤惡性程度和預后的關系。結果顯示,人腦膠質瘤組織中VEGF、EGFR、PDGF表達陽性率均明顯高于正常腦組織,且三者在不同分級的膠質瘤中的表達具有較大差異,隨著膠質瘤分級增高,三者在膠質瘤組織中的表達陽性率上升,相關性分析顯示VEGF、EGFR、PDGF的表達與膠質瘤WHO分級呈明顯的相關性,且VEGF、EGFR、PDGF表達陽性的患者的生存率明顯低于表達陰性者。表明VEGF、EGFR、PDGF在膠質瘤發(fā)生和發(fā)展中具有重要作用,且與膠質瘤惡性程度呈明顯正相關,與膠質瘤惡性程度越高、浸潤越明顯、預后越差的臨床屬性相符合,可作為判斷膠質瘤惡性程度和預后的重要生物學參考指標。此外,VEGF、EGFR、PDGF在腦膠質瘤組織中高表達,而在正常腦組織中低表達或無陽性表達,提示VEGF、EGFR、PDGF可作為腦膠質瘤分子靶向治療的靶點。
綜上所述,EGF、EGFR、PDGF在人腦膠質瘤發(fā)生發(fā)展中起重要調節(jié)作用,三者共同參與促進微血管形成的作用。VEGF、EGFR、PDGF的表達可作為判斷膠質瘤惡性程度和預后的重要生物學參考指標,針對VEGF、EGFR、PDGF為靶點的腦膠質瘤信號轉導干預治療有待進一步的研究,有望通過抗膠質瘤微血管生成達到抑制腫瘤生長的目的。
[1]Jhaveri N,Chen TC,Hofman FM.Tumor vasculature and glioma stem cells:Contributions to glioma progression[J].Cancer Lett, 2014,16(14):783-786.
[2]唐天友,許瑩瑩,王建設,等.人腦膠質瘤組織MGMT和EGFR及Ki-67表達臨床意義分析[J].中華腫瘤防治雜志,2013,20(11): 840-844.
[3]Rychly B,Sidlová H,Dani? D.The 2007 World Health Organisation classification of tumours of the central nervous system,comparison with 2000 classification[J].Cesk Patol,2008,44(2):35-36.
[4] Sun H,Guo D,Su Y,et al.Hyperplasia of pericytes is one of the main characteristics of microvascular architecture in malignant glioma[J].PLoS One,2014,9(12):e114246.
[5]楊群英,沈冬,賽克,等.初診惡性腦膠質瘤患者綜合治療的生存情況分析[J].中華醫(yī)學雜志,2013,93(1):8-10.
[6]Khasraw M,Ameratunga MS,Grant R,et al.Antiangiogenic therapy for high-grade glioma[J].Cochrane Database Syst Rev,2014,9: CD008218.
[7]項高波,鄧勇,鮑風,等.IL-24與VEGF在腦膠質瘤中的表達以及與腫瘤微血管密度的關系[J].安徽醫(yī)科大學學報,2013,48(7): 810-813.
[8]Wang S,Zhao Y,Ruan Z,et al.Association between EGF+61 G/A and glioma risk in a Chinese population[J].BMC Cancer,2010,10: 221.
[9]劉愛軍,王樹偉,徐翔,等.血小板源性生長因子(PDGF)、血清反應因子(SRF)和波形蛋白在人腦膠質瘤中表達的臨床意義[J].復旦學報:醫(yī)學版,2014,41(1):111-114.
[10]李燾,王雄偉.EGFR及其下游通路在膠質瘤治療中的研究進展[J].癌癥防治研究,2011,38(10):1204-1206.
[11]Gressot LV,Doucette TA,Yuhui Y,et al.Signal transducer and activator of transcription 5b drives malignant progression in a PDGFB-dependent proneural glioma model by suppressing apoptosis[J].International Journal of Cancer,2015,136(9):2047-2054.
Expression and its relationship with the degree of malignancy and prognosis of VEGF,EGFR and PDGF in human brain gliomas.
LI Lian-jin,TONG Jian-zhou,CUI Jing,WU Hong-ji,WANG Hui-bin.Department of Neurosurgery,Baoding First Central Hospital,Baoding 071000,Hebei,CHINA
ObjectiveTo investigate the expression and its relationship with the degree of malignancy and prognosis of vascular endothelial growth factor(VEGF),epidermal growth factor receptor(EGFR),platelet derived growth factor(PDGF)in human gliomas.MethodsSixty-eight samples of brain glioma confirmed by pathology and 12 samples of normal brain tissue in Department of Neurosurgery in our hospital from November 2010 to August 2008 were selected.The SP immunohistochemical method was used to detect the expression of VEGF,EGFR and PDGF in all specimens,and analyzed the relationship between the expression of VEGF,EGFR,PDGF and the malignancy of glioma. The relationship between VEGF,EGFR and PDGF was analyzed by Spearman rank correlation analysis.ResultsThe expression positive rates of VEGF,EGFR and PDGF in glioma tissue were significantly higher than those in normal brain tissues[63.23%(43/68)vs 0(0/12),51.47%(35/68)vs 8.33%(1/12),52.94%(36/68)vs 33.33%(4/12),P<0.05].In terms of survival,the VEGF positive rates were significantly lower than VEGF negative(23.26%vs 60.00%),and EGFR positive rates were significantly lower than the EGFR negative(28.57%vs 51.52%),PDGF positive rates were significantly lower than PDGF negative(27.78%vs 62.50%,P<0.05).Spearman rank correlation analysis showed that the expression of VEGF,EGFR and WHO was significantly positively correlated with the WHO grading of gliomas(rVEGF=0.428,rEGFR=0.407,rPDGF=0.431,P<0.05).ConclusionVEGF,EGFR,PDGF play an important role in the occurrence and development of human glioma.It can be used as an important biological reference index to judge the degree of malignancy and prognosis of gliomas.
Glioma;Vascular endothelial growth factor(VEGF);Epidermal growth factor receptor(EGFR); Platelet derived growth factor(PDGF);Prognosis;Relationship
R687.4
A
1003—6350(2016)14—2251—04
10.3969/j.issn.1003-6350.2016.14.006
2016-01-27)
李連進。E-mail:6653879@qq.com

