纖維素降解真菌DF14101的篩選與鑒定
鄒瀟瀟, 易子霆,2, 孫前光, 鮑時翔, 黃惠琴*
(1.中國熱帶農業科學院 熱帶生物技術研究所,海南 海口 571101;2.海南大學 環境與植物保護學院,海南 海口 570228)
纖維素降解真菌DF14101的篩選與鑒定
鄒瀟瀟1, 易子霆1,2, 孫前光1, 鮑時翔1, 黃惠琴1*
(1.中國熱帶農業科學院 熱帶生物技術研究所,海南 海口 571101;2.海南大學 環境與植物保護學院,海南 海口 570228)
纖維素是植物細胞壁的主要成分,也是人類寶貴的天然可再生資源之一。由于纖維素不易降解,嚴重限制了生物質廢棄物中纖維素的有效利用。從海口、儋州、屯昌市郊的森林、農田以及香蕉園采集土壤和腐爛秸稈樣品中,篩選獲得1株產纖維素酶能力較強的真菌DF14101。在以香蕉秸稈粉為碳源的培養基中,28 ℃、180 r/min培養5 d時,該菌株發酵液的內切葡聚糖酶酶活(CMCase)為43.98 U/mL,濾紙酶活(FPA)為14.05 U/mL。結合形態學特征和ITS序列系統發育分析結果,將該菌株鑒定為草酸青霉(Penicilliumoxalicum)。
纖維素酶;篩選;鑒定;草酸青霉
纖維素是植物細胞壁的主要成分,自然界每年通過光合作用合成的纖維素超過1 000億t[1],是人類寶貴的天然可再生資源之一。但由于纖維素的理化性質非常穩定,自然條件下難以降解,嚴重限制了生物質廢棄物中纖維素的有效利用。纖維素由吡喃型D-葡萄糖以β-1, 4糖苷鍵結合而成。纖維素酶是降解β-1, 4-糖苷鍵的酶類的總稱,包括內切葡聚糖水解酶、外切葡聚糖水解酶和β-葡萄糖苷酶等組分[2-3]。纖維素酶來源廣泛,自然界中的細菌、真菌、放線菌等微生物都具有產生纖維素酶的種類[4]。相對于細菌和放線菌,真菌具有生長速度快、產纖維素酶活性高、酶系組成全面等優點,而且在生長過程中真菌菌絲的穿透作用會對作物秸稈造成機械破壞效果;同時,真菌還可以分泌大量胞外酶降解纖維素,這些特性使得產纖維素酶真菌被廣泛應用于工業生產。海南省位于我國最南端,屬熱帶季風性氣候,常夏無冬,光照充足,雨量充沛。特殊的熱帶生態環境蘊藏著豐富的微生物資源,其中不乏產纖維素酶能力強的微生物。此外,海南省也是我國高效農業和海洋生產大省,每年產生的農作物和大型海藻類生物質廢棄物數量相當可觀,這些都是纖維素的寶貴來源。但長期以來,大量的農業廢棄物和海藻藻體廢棄物多以焚燒或堆積于田間、灘頭的方式進行處理,不僅對周邊環境造成了污染,也是資源的極大浪費。如果可以提高纖維素的降解效率,不但可以解決環境污染問題,還有利于改善農村生態環境、增加農民收入,具有良好的經濟、社會和生態效益。因此,本研究旨在從海南豐富的熱帶微生物資源中篩選出產纖維素酶能力強的真菌,為纖維素的可再生利用奠定基礎。
1 材料與方法
1.1 材料
1.1.1 樣品來源 從海口、儋州、屯昌市郊的森林、農田以及香蕉園采集土壤和腐爛秸稈,置于潔凈塑料袋,及時帶回實驗室進行菌株分離,剩余樣品置4 ℃冰箱保存備用。
1.1.2 培養基 CMC-Na(羧甲基纖維素鈉)瓊脂培養基:(NH4)2SO42.0 g,MgSO4·7H2O 0.5 g,KH2PO41.0 g,NaCl 0.5 g,CMC-Na 20.0 g,pH 7.2,瓊脂20.0 g ,蒸餾水1 000 mL。加入青霉素、鏈霉素使終濃度為100 U/mL,以抑制細菌生長,便于真菌分離。濾紙條培養基:(NH4)2SO41 g,KH2PO41 g,MgSO4·7H2O 1.7 g,NaCl 0.5 g,蒸餾水1 000 mL。向試管中加入培養基5 mL,并垂直放入瓦特曼濾紙(6 cm×1 cm),部分露出液面。液體發酵培養基:香蕉秸稈粉 30 g,(NH4)2SO41.4 g,KH2PO42.0 g,CO(NH2)20.3 g,CaCl20.3 g,MgSO4·7H2O 0.3 g,FeSO4·7H2O 5.0 mg,ZnSO4·7H2O 1.4 mg,MnSO4·H2O 1.6 mg,CoCl22.0 mg,pH 7.2,蒸餾水1 000 mL。PDA培養基:稱取200 g去皮的馬鈴薯切塊,加水煮沸20~30 min,過濾,定容至1 000 mL,加入葡萄糖 20 g,瓊脂20 g。
1.2 方法
1.2.1 產酶菌株的初步篩選 稱取樣品5 g,磨碎后加入45 mL滅菌水,充分震蕩20 min,制備成樣品原液。梯度稀釋后涂布于羧甲基纖維素鈉(CMC-Na)瓊脂平板,28 ℃倒置培養3~5 d。挑取生長快、菌落形態不同的真菌進行劃線純化后,點接到新的CMC-Na瓊脂平板,28 ℃倒置培養5 d,用0.1%剛果紅染液對培養平板染色,再用1 mol/L NaCl溶液進行脫色[5],測量并計算透明水解圈與菌落直徑比值(Hc)。同時將菌株接種到放置于濾紙條培養基中的濾紙條上(露在上面部分),28 ℃、180 r/min培養5 d,觀察濾紙條的潰爛程度。選擇透明水解圈/菌落直徑比大、濾紙潰爛程度高的菌株進行復篩。
1.2.2 產酶菌株的復篩 將初篩得到的活性菌株接種到以香蕉秸稈粉為碳源的液體發酵培養基中,接種量為2%。180 r/min、28 ℃培養5 d后,取發酵液,4 000 r/min離心10 min,測上清液(初酶液)的羧甲基纖維素(CMC)酶活、濾紙纖維素(FPA)酶活[6]。①羧甲基纖維素(CMC)酶活的測定:取0.5 mL粗酶液,加入2 mL 1% CMC溶液(溶于pH 6.8 磷酸鹽緩沖液),50 ℃恒溫水浴60 min。加入1.5 mL DNS試劑,混合均勻,置于沸水浴中加熱10 min。冷卻后用蒸餾水稀釋至25 mL。空白對照測定時,取0.5 mL粗酶液,先加DNS試劑1.5 mL,后加2 mL 1%CMC溶液,其余步驟相同。540 nm波長測定其吸光值,測量3次取平均值。②濾紙纖維素(FPA)酶活的測定:取0.5 mL粗酶液,在試管中加入2 mL pH 6.8 磷酸鹽緩沖液和1條1.0 cm×6.0 cm去淀粉處理的定性濾紙,50 ℃恒溫水浴60 min。加入1.5 mL DNS試劑,混合均勻,置于沸水浴中加熱10 min。冷卻后用蒸餾水稀釋至25 mL。空白對照測定時,取0.5 mL粗酶液,先加DNS試劑1.5 mL,再加2 mL pH 6.8磷酸鹽緩沖液和定性濾紙,其余步驟同上。540 nm波長測定吸光值,測量3次取平均值。酶活定義:在反應溫度50 ℃、pH 4.8的條件下,1 mL酶液在1 min內使底物產生1 μg葡萄糖所需酶量定義為一個酶活單位(U/mL)。
1.2.3 真菌菌株降解香蕉秸稈實驗 將真菌菌株接種于以香蕉秸稈為唯一碳源的液體發酵培養基,接種量2%,搖瓶培養16 d,稱取殘留物質干重,并計算測量香蕉秸稈干重的失重率:失重率(%)=(Mck-M)/M×100%,其中,Mck:對照發酵后香蕉秸稈干重(g);M:處理的樣品發酵后香蕉秸稈干重(g)。
1.2.4 菌株分類鑒定 ①形態鑒定:將菌株點接到PDA固體培養基上,28 ℃培養,觀察菌落形態。待菌株產孢后挑取菌體于載玻片上,用棉蘭染液染色后置于顯微鏡下觀察。菌株形態鑒定參照文獻[7-8]提供的方法進行。②ITS序列測定及其系統發育分析:利用TIANGEN公司的基因組DNA提取試劑盒提取菌株基因組DNA,以提取的DNA為模板,擴增菌株的ITS序列,引物為Pf(5′-AACCTGGTTGATCCTGCCAGT-3′)、Pr(5′-CGACGGGCGGTGTGTAC-3′)[9]。PCR產物經1%瓊脂糖凝膠電泳檢測,合格樣品送上海生工生物工程有限公司測序。將測得序列于NC-BI中進行BLAST比對(http://ncbi.nlm.nih.gov/blast),選取同源性高的菌株序列利用Clustal X2.1進行多序列比對,在MEGA 5.0軟件中采用Neighbor-Joining法構建進化樹[10]。
2 結果與分析
2.1 菌株的篩選
利用CMC-Na固體培養基從采集的樣品中分離到104株具有纖維素降解能力的真菌,其中40株透明水解圈/菌落直徑(Hc)在1.30~2.85之間,相對酶活較高,用于進一步液體發酵產酶復篩。通過液體產酶復篩獲得5株FPA、CMC酶活較高的真菌(表1)。其中,菌株DF14101的兩種酶活力均較高,其發酵液的CMC酶活力為43.98 U/mL、FPA酶活力為14.05 U/mL。觀察濾紙條降解情況,發現濾紙條被折斷,降解程度較高。
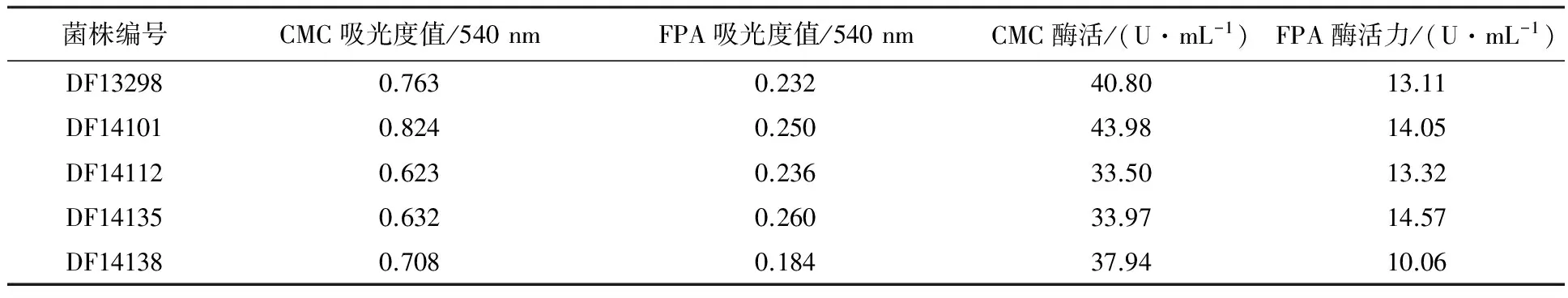
表1 菌株發酵液纖維素酶活力
2.2 菌株DF14101降解秸稈能力測試
通過產纖維素酶真菌的初篩和復篩,發現菌株DF14101產CMC和FPA酶能力均較強,為進一步驗證該菌株降解秸稈的能力,將菌株DF14101接種到以香蕉秸稈為唯一碳源的液體發酵培養基中,搖瓶培養16 d,測量香蕉秸稈干重的失重率。以未接種產纖維素能力的菌株為對照。實驗結果表明,菌株DF14101發酵后,香蕉秸稈干重的失重率達29.18%(表2),說明該菌株具有較好的秸稈降解的能力。
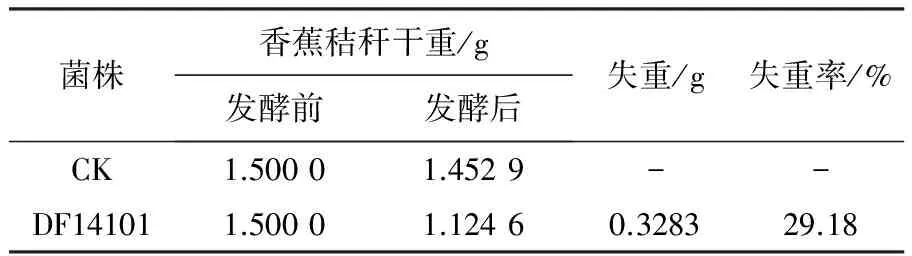
表2 降解秸稈實驗
2.3 菌株DF14101的分類鑒定
2.3.1 形態特征 菌株DF14101在蛋白質、PDA培養基上生長迅速,初生菌絲白色,菌落藍綠色,培養后期有水滴滲出,大量產孢,無可溶性色素。帚狀枝單輪生,較緊密;分生孢子橢圓形、鏈狀(圖1)。根據菌落特征和顯微結構特征,初步鑒定DF14101隸屬于半知菌綱、叢梗孢目、叢梗孢科、青霉屬。
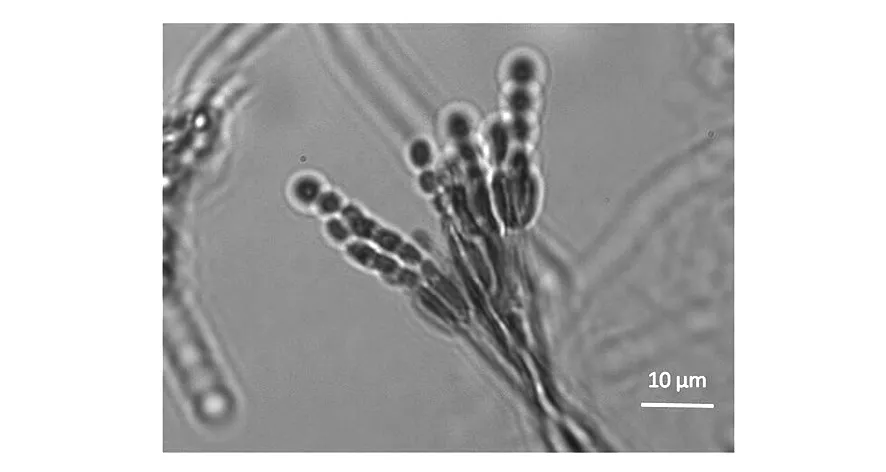
圖1 菌株DF14101的產孢結構Fig.1 Sporogenous structure of strain DF14101
2.3.2 ITS序列測定及其系統發育分析 通過測序獲得菌株DF14101的ITS序列為533 bp,將所得ITS序列提交至GenBank數據庫進行BLAST同源性比對,結果顯示,與菌株同源性高的菌株均為青霉屬,與PenicilliumoxalicumB7(JN676114)同源性最高,ITS序列相似性達100%。選擇同源性較高的相關菌株在MEGA5.0中利用Neighbor-joining法構建系統發育樹(圖2),菌株DF14101與P.oxalicum的菌株處在同一分支,表明它們的親緣關系最近。對菌株DF14101與P.oxalicumB7的形態進行比較,發現它們的特征基本一致:菌絲、分生孢子梗有橫隔,光滑,基部無足細胞,頂端不形成膨大的頂囊,分生孢子梗不對稱分支、掃帚狀,分生孢子橢圓形,光滑。因此,結合菌株形態特征和ITS系統發育分析,鑒定菌株DF14101為Penicilliumoxalicum(草酸青霉)。
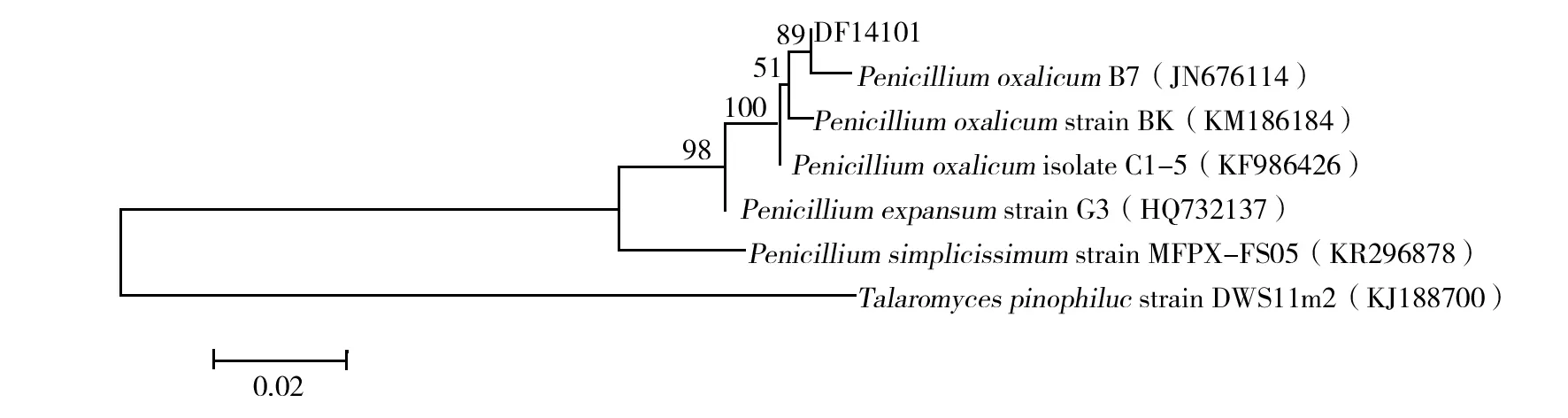
圖2 基于ITS序列構建的DF14101菌株與相關菌株的系統發育樹Fig.2 Phylogenetic tree of stain DF14101 and related strains based on ITS sequences
3 討 論
纖維素酶來源廣泛,自然界中很多微生物都能產生纖維素酶。雖然從各種自然環境中分離到了大量的產纖維素微生物,但它們普遍酶活力低,酶系組成不全,不能用于工業生產[11]。因而,產纖維素酶微生物的篩選是生物法降解纖維素的首要問題。透明水解圈法是分離纖維素菌株的常用方法[12-13],產酶愈多,透明水解圈愈大;產酶越快,透明水解圈出現越早。該方法因觀察方便而得到廣泛應用。本研究中首先用CMC-Na固體培養基對產纖維素酶真菌進行快速篩選,結合透明水解圈法測定了各菌株纖維素酶的相對酶活,為避免漏掉那些產酶量小但酶活高的菌株,實驗中還測定了菌株對濾紙條的降解率,結合兩種方法篩選到40株相對酶活較高的菌株。通過液體發酵對產酶菌株進行復篩,獲得了最優菌株DF14101。
傳統的真菌鑒定以形態鑒定為主,但由于形態描述具有主觀性,缺乏統一標準,不同培養條件對真菌形態也有影響,對形態鑒定造成了一定的困擾。因此,研究者在形態鑒定的同時,又引入了分子鑒定的手段。本研究結合形態鑒定和分子鑒定兩種手段,將菌株DF14101鑒定為草酸青霉。
目前廣泛應用的產纖維素酶真菌有木霉(Trichderm)、曲霉(Aspergillus)、青霉(Penicillium)、根霉(Rhizopus)等[4]。其中,里氏木霉(Trichodermareesei)因具有產生大量纖維素酶的能力而得到廣泛地研究和應用[14],但其產生的β-葡萄糖苷酶的活力很低,限制了其對纖維素的降解效率。研究發現,青霉能分泌較全的降解纖維素的聚糖酶系。與木霉相比,青霉能產生較多的β-葡萄糖苷酶,且其生長速度也比木霉快[15-16],因而青霉具有明顯的商業價值和應用潛力。當前研究較多的降解纖維素青霉有斜臥青霉(P.decumbens)、繩狀青霉(P.funiculosum)和微紫青霉(P.janthinellum)等[17-20],但是對草酸青霉的研究報道很少。因此,本研究篩選和鑒定出的草酸青霉高活性產纖維素酶菌株,為農業生物質廢棄物和大型海藻中纖維素的有效降解提供了新的菌種資源。
[1] Zhang Y H P, Himmel M E, Mielenz J R. Outlook for cellulose improvement: Screening and selection strategies[J]. Biotech Adv, 2006, 24(5):452-481.
[2] 陳燕勤,毛培宏,曾憲賢. 細菌纖維素酶結構和功能的研究[J]. 化學與生物工程, 2004, 21(6):4-6.
[3] 吳顯榮,穆小民. 纖維素酶分子生物學研究進展及趨向[J]. 生物工程進展, 1994, 14(4): 25-27.
[4] 張傳富,顧文杰,彭科峰,等. 微生物纖維素酶的研究現狀[J]. 生物信息學, 2007, 5(1): 34-36.
[5] 高建民,翁海波,席宇,等. 一株嗜熱嗜酸纖維素酶高產霉菌分離鑒定及其酶學性質研究[J]. 微生物學通報, 2007, 34(4): 715-718.
[6] Coward-Kelly G, Aiello-Mazzari C, Kim S, et al. Suggested improvements to the standard filter paper assay used to measure cellulose activity[J]. Biotechnol Bioeng, 2003, 82(6): 745-749.
[7] 戴芳瀾. 真菌的形態和分類[M]. 北京:科學出版社,1987.
[8] 魏景超. 真菌鑒定手冊[M]. 上海:上海科學技術出版社,1979.
[9] 吳碧文,胡永華,方哲,等. 抗MRSA海綿真菌的分離及菌株W0707的鑒定[J]. 中國海洋藥物, 2006, 25(1): 39-43.
[10]Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J]. Mol Biol Evol, 1987, 4(6): 406-425.
[11]蔣倩婷,宋斌,閆文娟. 產纖維素酶菌株選育技術研究進展[J]. 江蘇農業科學, 2011, 39(6): 584-587.
[12]Herdrick CW, Doyle D, Hugley B. A new solid medium for enumerating cellulose-utilizing bacteria in soil[J].Appl Environ Microb, 1995, 61(5): 2016-2019.
[13]高榕,鄧迎達. 高生產效率纖維素酶菌株初篩方法的研究[J]. 纖維素科學與技術, 2004, 12(3): 20-24.
[14]Seidl V, Seiboth B.Trichodermareesei: Genetic approaches to improving strain efficiency[J]. Biofuels, 2010, 1(2):343-335.
[15]Gusakov A V. Alternatives toTrichodermareeseiin biofuel production[J]. Trends in Biotechnology, 2011, 29(9):419-425.
[17]Liu Y T, Luo Z Y, Long C N, et al. Cellulase production in a new mutant strain ofPenicilliumdecumbensML-017 by solid state fermentation with rice bran[J]. New Biotechnology, 2011, 28(6):733-737.
[18]Castro A M D, Leite S G F, Pereira N. Cellulases fromPenicilliumfuniculosum: production, properties and application to cellulose hydrolysis[J]. Journal of Industrial Microbiology & Biotechnology, 2010, 37(2):151-158.
[19]Singhvi M S, Adsul M G, Gokhale D V. Comparative production of cellulases by mutants ofPenicilliumjanthinellumNCIM 1171 and its application in hydrolysis of Avicel and cellulose[J]. Bioresource Technology, 2011, 102(11):6569-6572.
[20]Gusakov A V, Sinitsyn A P. Cellulases fromPenicilliumspeciesfor producing fuels from biomass[J]. Biofuels, 2012, 3(4):463-477.
歡迎訂閱《微生物學雜志》
Screening and Identification of a Cellulose-Degrading Fungus DF14101
ZOU Xiao-xiao1, YI Zi-ting1, 2, SUN Qian-guang1, BAO Shi-xiang1, HUANG Hui-qin1
(1.Inst.ofTropicalBiosci. &Biotech.,CATAS,Haikou,Hainan571101; 2.Coll.ofEnviron’t&PlantProtect.,HainanUni.,Haikou,Hainan570228)
Cellulose is the major ingredient of plants’ cell walls, and is one of the valuable natural renewable resources for human beings. The difficulty of cellulose degradation severely limits the effective utilization of bio-waste. Adding cellulolytic microorganism during the composting process of plant stalks, can effectively improve degradation rate of fibers. Strain DF14101 with cellulose degrading capability was screened out from soil and the rotten stalks on CMC-Na agar. The endoglucanase (CMCase) activity and filter paper activity (FPA) of the strain were at 43.98 U/mL and 14.05 U/mL respectively, when cultured in medium with banana stalk powder as a carbon source for five days at 180 r/min and 28 ℃. Combined with the results of morphological characteristics with phylogenetic analysis based on ITS sequences, strain DF14101 was identified asPenicilliumoxalicum.
cellulase; screening; identification;Penicilliumoxalicum
公益性行業(農業)科研專項(201303094);海洋公益性行業科研專項(2014050402);海南省科技興海專項(XH201408);
鄒瀟瀟 女,博士。研究方向為微生物資源應用研究。E-mail:zouxiaoxiao@itbb.org.cn
易子霆 男,碩士研究生。研究方向為微生物資源與利用。E-mail:648241879@qq.com。前兩位作者為并列第一作者。
2016-02-21;
2016-04-07
Q939
A
1005-7021(2016)06-0068-05
10.3969/j.issn.1005-7021.2016.06.011
中央級公益性科研院所基本科研業務費專項資金(ITBB2015ZD08,ITBB2015RC07)
* 通訊作者。女,博士,研究員。研究方向為微生物資源與利用。E-mail:huanghq21@163.com

