油菜花粉活性部位對尿生殖竇誘導的鼠前列腺增生的治療作用*
李 璐,張 紅,吳 云,李 娜,曹 亮,楊義芳,丁 崗,鄭高利,蕭 偉**
(1. 江蘇康緣藥業股份有限公司 連云港 222001;2. 中藥制藥過程新技術國家重點實驗室連云港 222001;3. 中國醫藥工業研究總院上海醫藥工業研究院 創新藥物與制藥工藝國家重點實驗室上海 200040;4. 浙江省醫學科學院藥物研究所 杭州 310013)
油菜花粉活性部位對尿生殖竇誘導的鼠前列腺增生的治療作用*
李 璐1,2,張 紅1,2,吳 云1,2,李 娜1,2,曹 亮1,2,楊義芳3,丁 崗1,2,鄭高利4**,蕭 偉1,2**
(1. 江蘇康緣藥業股份有限公司 連云港 222001;2. 中藥制藥過程新技術國家重點實驗室
連云港 222001;3. 中國醫藥工業研究總院上海醫藥工業研究院 創新藥物與制藥工藝國家重點實驗室上海 200040;4. 浙江省醫學科學院藥物研究所 杭州 310013)
目的:研究油菜花粉總脂肪酸部位(PN1)和總黃酮部位(PN2)對前列腺增生的治療作用。方法:采用前列腺腹葉 植入16-18日胎齡大鼠尿生殖竇組織致大鼠前 列腺增生模型,通過灌胃給予PN1、PN2、PN 1+PN2進行治療,連續給藥33天后,取前列腺,分離出背葉及腹葉,稱重、測定體積,計算前列腺濕重及指數,測定前列腺液中卵磷脂小體密度及白細胞數量,并檢測血清酸性磷酸酶(ACP)及前列腺特異性酸性磷酸酶(PACP)的活性。結果:與模型組相比,PN1高劑量組,PN1+PN2高、中劑量組前列腺重量明顯減少(P<0.01,P<0.05),其中PN1+PN2的高劑量組前列腺指數明顯降低(P<0.01);PN1高劑量組、PN2高劑量組前列腺液中卵磷脂小體密度明顯增加(P<0.05),PN1各劑量,PN2中、低劑量組和PN1+PN2高劑量組均白細胞數目明顯降低(P<0.01,P<0.05);PN2高劑量組PACP活性明顯降低(P<0.05),PN1+PN2中劑量組ACP活性明顯降 低(P<0.05)。結論:本工藝制得的油菜花粉總脂肪酸部位及總脂肪部位與總黃酮部位聯合使用,有明顯抗前列腺增生的作用,有望開發成相關的藥物。
油菜花粉 總脂肪酸 總黃酮 良性前列腺增生 尿生殖竇
良性前列腺增生(Benign Prostatic Hyperplasia,BPH)是老年男性常見的生理病變,目前發病率呈逐年上升趨勢,對老年男性的身體和心理健康造成威脅[1]。臨床上用于治療BPH的藥物主要有[2]:α1-腎上腺受體拮抗劑、5α-還原酶抑制劑、天然產物制劑等。化學藥物雖然有良好的療效,但都存在一定的不良反應。天然產物制劑作為慢性前列腺增生的治療藥物有很好的應用前景。近年來國內外研究證明[3,4]油菜花粉具有明確的抗BPH的功效,而且它不良反應少,資源豐富,適合長期使用。國內常用藥物前列康,也是一種油菜花粉片,具有明確治療效果,但服用劑量大[5]。本實驗 室提取純化得到油菜花粉的有效部位:總脂肪部位(PN1)和總黃酮部位(PN2),在此對其抗前列腺增生作用進行考察,以期開發出治療前列腺增生的有效藥物。
1 材料
1.1 儀器
JJ-1大功率電動攪拌器(常州國華電器有限公司),索特真空干燥箱(南京索特干燥設備廠),HA121-50-02型超臨界萃取裝置(江蘇南通華安超臨界萃取有限公司),BC-R501旋轉蒸發器(上海貝凱生物化工設備有限公司),DZF-6020真空干燥箱(上海博訊實業有限公司醫療設備廠),Millipore純水儀(上海密理博貿易有限公司),CAMRY EK 3252型電子秤(廣東香山衡器集團股份有限 公司),DA 100 g亞太電子天平(青島亞太計量電子衡器有限公司),AEL-200電子分析天平(LIBROR),KCC高精度計數天平(上海恒平科學儀器有限公司),Synergy 2多功能酶標儀(美國Biotek公司),Motic顯微數碼攝像系統(廈門麥克澳迪實業有限公司)。
1.2 試藥
油菜花粉,產于內蒙古集寧,經江蘇康緣藥業股份有限公司質量部鑒為 油菜花粉;LS-305A大孔吸附樹脂(陜西藍深特種樹脂有限公司);乙醇,食用級(徐州香醅酒業有限公司);吐溫-80(上海就醫化學試劑有限公司,批號:F20060402);前列康(普樂安片)(浙江康恩貝制藥股份有限公司,批號:140161);保列治(非那雄胺片)(杭州默沙東制藥有限公司,批號:J013085);酸性磷酸酶測定試劑盒(上海復星長征醫學科學有限公司,批號:P1407010)。
1.3 實驗動物
SD大鼠,清潔級,雄性20只,雌性40只,體質量240-260 g,動物合格證號:0013916;SD大鼠,清潔級,雄性150只,體質量250-280 g,動物合格證號:0012018。
2 方法
2.1 樣品的制備
2.1.1 油菜花粉總脂肪部位(PN1)的制備
取油菜花粉適量,加6倍量水常溫攪拌4.0 h,濾干或離心,除去上清液,沉淀減壓干燥,得油菜花粉水洗部位。將油菜花粉水洗部位粉碎成粗粉,稱取1 000 g,置萃取釜中加熱加壓循環提取,控制CO2流量為1.5 L·min-1,萃取溫度57℃,萃取時間200 min,萃取壓力35-37 MPa,提取完成后從出料口出料,得超臨界提取物及藥渣。
取超臨界提取物,加50倍量80%乙醇于50℃密閉攪拌提取1.5 h,放冷至室溫,濾過,濾渣棄去,上清液減壓濃縮至干為油狀物,即得。臨用前用水配制并加吐溫-80助溶,如溫度過低可50℃以下加熱溶解。
2.1.2 油菜花粉總黃酮部位(PN2)的制備
取“2.1”項下的超臨界萃取后的藥渣,加10倍量90%乙醇常溫攪拌提取4.0 h,濾過,藥渣棄去,上清液減壓濃縮至藥渣0.5 g·mL-1,倒入事先在4℃冰箱預冷的水中,邊加邊攪拌,于4℃靜置48 h。離心,棄上清液,沉淀中加入投料藥渣1倍量的70%乙醇中,常溫攪拌0.5 h,4℃靜置0.5 h。離心,棄沉淀,上清液以每小時1倍柱體積的流速通過LS-305大孔樹脂吸附,然后再用7倍柱體積70%乙醇以每小時1倍柱體積的流速洗脫,收集上樣流出液和70%乙醇洗脫液,減壓濃縮(70℃,-0.09 MPa)至稠膏,減壓干燥(70℃,-0.09 MPa),即得。臨用時用水配制即可。
2.2 尿生殖竇的準備
成年SD大鼠,雌性40只,雄性20只,雌雄2∶1合籠,每天早晨檢查陰栓,用小鑷子張開陰門,如見到交配后精液在陰道凝固而成一白色栓子(陰栓),堵塞于陰道中,說明已交配,以陰栓出現日為妊娠第1天,常規飼養至孕16-18天脫頸臼處死母鼠,解剖取出胎鼠,仔細分離尿生殖竇,置于盛有生理鹽水的玻璃平皿內備用。
2.3 造模
雄性SD大鼠,150只,體質量250-280 g,常規飼養20天左右,增重增至340-400 g。戊巴比妥鈉60 mg·kg-1腹腔麻醉下,無菌操作打開下腹部,仔細分離前列腺腹葉,用尖鑷子向前列腺腹葉內植入兩個16-18日胎齡同品系的尿生殖竇組織,經檢查證實植入須小心防止滑出。另取大鼠l0只,在前列腺腹葉用針頭探刺兩次作為假手術組。術后連續3天腹腔注射青霉素抗菌。
2.4 分組與給藥
術后3天,除假手術組外,將造模的大鼠隨機分成12組,每組10只,分組及給藥劑量如表1所示,各給藥組每天灌胃給藥1次,連續給藥33天,假手術組及模型組給予等容積蒸餾水,組別及劑量設計見表1。
2.5 主要指標檢測
末次給藥24 h后眼眶取血,檢測血清酸性磷酸酶,包括總酸性磷酸酶(Acid Phosphatase,ACP)和前列腺特異磷酸酶活性(Prostatic Acid Phosphatase,PACP),然后4%水合氯醛麻醉大鼠后分離前列腺左側背葉,取前列腺液計數磷脂小體密度(直接鏡檢)、白細胞數量(3%醋酸液體固定),分離大鼠前列腺右側背葉和腹葉,分別用分析天平稱取各組織濕重,測定體積(排水法),計算前列腺總重及臟器指數[臟器指數=腺體濕重(mg)/體重(g)]。
3 實驗結果
3.1 PN1和PN2對大鼠前列腺重量、體積及臟器指數的影響
與假手術組比較,模型組前列腺總重及臟器指數均都顯著增加(P<0.01),背葉,腹葉的重量及體積均有所增加(P<0.01,P<0.05),提示尿生殖竇誘導大鼠產生前列腺增生,造模成功。給予藥物治療后,保列治組能顯著降低前列腺總重量和臟器指數(P<0.01),能顯著降低尿生殖竇誘導的前列腺背葉和腹葉重量和體積(P<0.01);PN1高劑量組和PN1+PN2中、高劑量組的前列腺重量均明顯降低(P<0.01,P<0.05),其中,PN1高劑量組前列腺背葉和腹葉的重量和體積均有所降低(P<0.05),PN1+PN2中、高劑量組前列腺腹葉的重量和體積均下降(P<0.01,P<0.05)。實驗結果詳見表2。
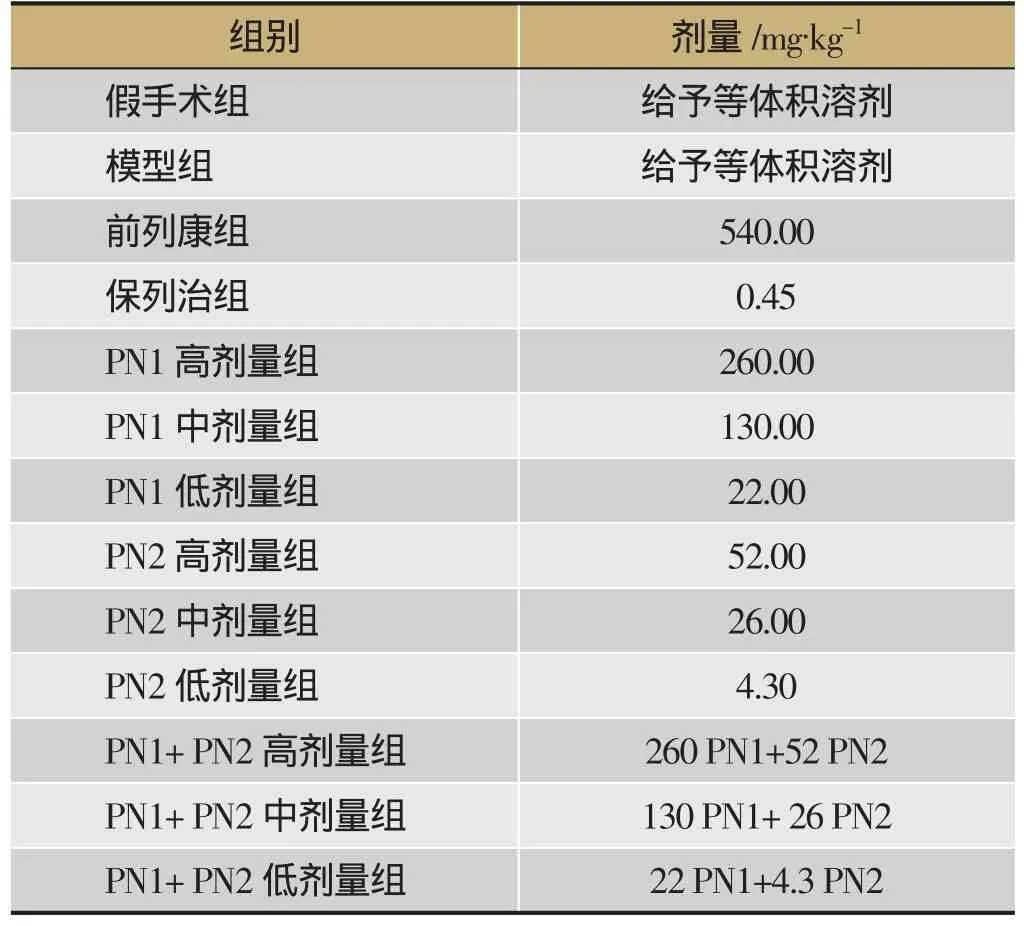
表1 組別及劑量設計
表2 PN1和PN2對大鼠前列腺重量,體積及臟器指數的影響,n=10)
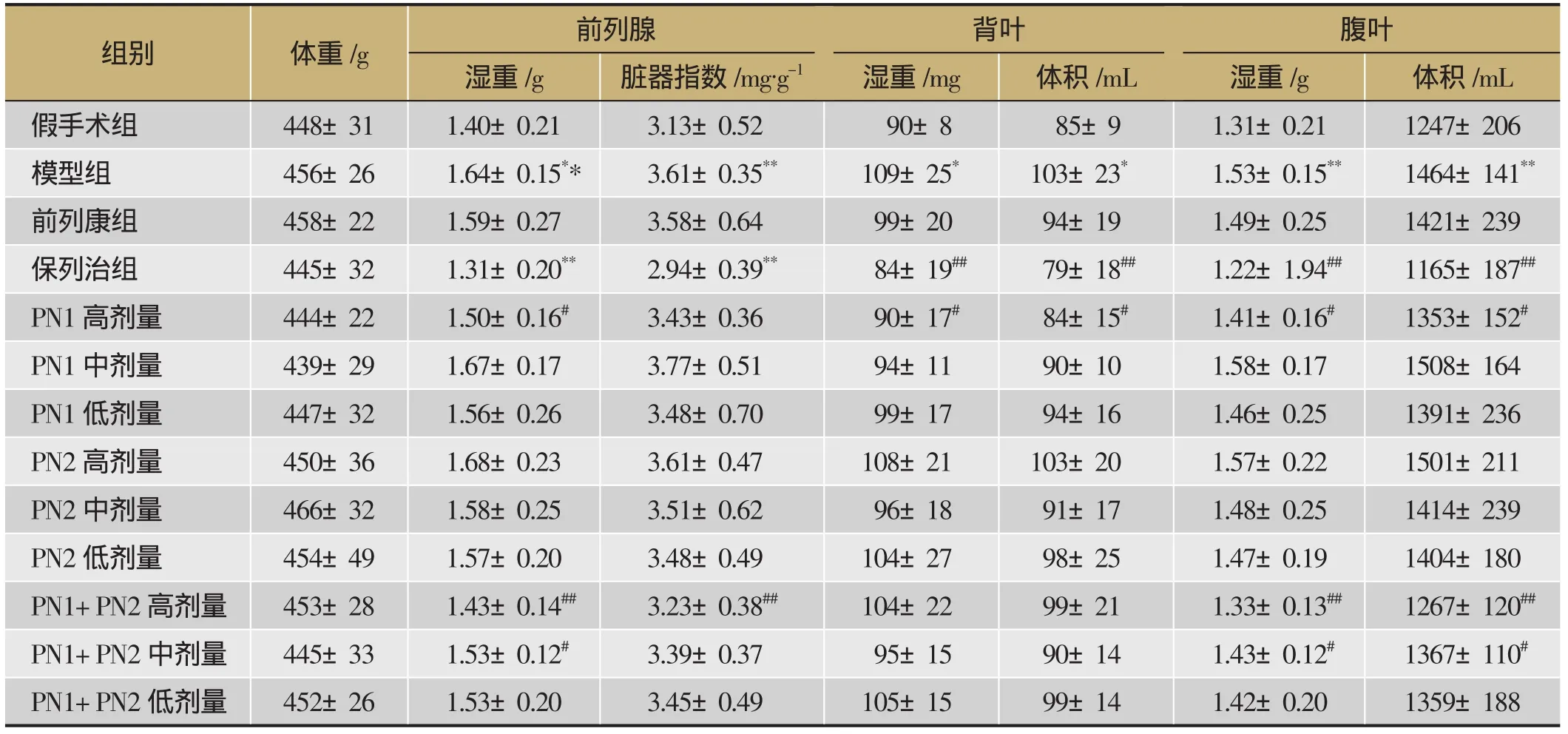
表2 PN1和PN2對大鼠前列腺重量,體積及臟器指數的影響,n=10)
注:與假手術組比較,*P<0.05,**P<0.01;與模型組比較,#P<0.05,##P<0.01。
3.2 PN1和PN2對前列腺增生模型大鼠血清ACP、PACP及時前列腺液中卵磷脂小體和白細胞的影響
與假手術組比較,模型組大鼠血清總ACP和PACP活性均顯著增加(P<0.05);前列腺液中卵磷脂小體的密度明顯減小(P<0.01),前列腺液中白細胞數目明顯增加(P<0.05)。與模型組比較,前列康組可顯著改善前列腺增生導致的總ACP和PACP活性的增加(P<0.05),PN2高劑量組的PACP活性也顯著性降低(P<0.05)。給予藥物治療后,前列康、保列治、PN1高劑量組和PN2高劑量組的前列腺液中卵磷脂小體密度明顯增加。PN1各組、PN2中和低劑量組和PN1+PN2高劑量組的前列腺液中白細胞數明顯低于模型組(P<0.01,P<0.05),表明油菜花粉的活性部位PN1和PN2對抗尿生殖竇致前列腺增生炎癥有一定的抑制作用。詳見表3。
表3 PN1和PN2對前列腺增生模型大鼠血清ACP、PACP及炎癥的影響(,n=10)

表3 PN1和PN2對前列腺增生模型大鼠血清ACP、PACP及炎癥的影響(,n=10)
注:與假手術組比較,*P<0.05,**P<0.01;與模型組比較,#P<0.05,##P<0.01。
4 討論
良性前列腺增生是50歲以上男性的常見病,組織學表現為前列腺間質和腺體成分的增生、解剖學表現為前列腺增大、臨床表現為下尿路癥狀及尿動力學上的膀胱出口梗阻[6]。
尿生殖竇植入性大鼠前列腺增生模型與人體良性前列腺增生相似,被認為能代表人類良性前列腺增生[7,8]。該實驗發現,給大鼠前列腺植入16-18日胎齡的尿生殖竇組織,可引起前列腺重量顯著增加,PACP活性增加,前列腺液中卵磷脂小體個數的降低及白細胞個數的增加,說明此方法成功復制了大鼠前列腺增生模型,并且該模型同時伴隨前列腺炎癥的發生,是篩選抗前列腺增生藥物較好的實驗模型。油菜花粉的PN1高劑量和PN1+PN2高、中劑量組能直接改善尿生殖竇誘導的前列腺模型大鼠前列腺重量,背葉和腹葉體積的增加,使臟器指數趨近正常。
PACP是溶酶體的標志酶,在酸性條件下能水解各種正磷酸單酯的酶。前列腺增生時其表達水平升高,是診斷前列腺疾病的一項經典的檢測方法[9]。該實驗前列腺增生模型組也顯示,血清總ACP及PACP活性增強,PN2高劑量組可抑制PACP的活性。
良性前列腺增生被證實與炎癥的發生發展存在一定相關性[10-12],前列腺液中的卵磷脂和白細胞是前列腺液炎癥檢查中兩個主要指標。卵磷脂小體的多少與衡量前列腺液是否正常相關。正常前列腺液內卵磷脂小體幾乎布滿視野,當前列腺發生炎癥時,巨噬細胞吞噬大量脂類,卵磷脂小體減少,并有成堆聚集現象。PN1、PN2降低白細胞數量的同時,高劑量組還能增加卵磷脂小體的密度,提示PN1和PN2對前列腺炎癥有一定改善作用。
本研究采用尿生殖竇植入法復制大鼠前列腺增生模型,分別考察了總脂肪酸提取部位、總黃酮提取部位及二者合用對前列腺增生的影響,結果提示不同提取部位在各指標上表現出不同的作用,而合用后降低前列腺重量,抑制前列腺增生,改善炎癥反應的作用有所增強,但是均未表現出明顯的劑量依賴作用,其可能原因是其有效部位成分還不明確和有效劑量有待繼續考察,因此我們將進一步對其有效部位進行細分,明確有效成分,進行合理的組合,并考察其有效性,為開發治療前列腺增生新藥提供參考和依據。
參考文獻
1 Untergasser G, Madersbacher S, Berger P. Benign prostatic hyperplasia: age-related tissue remodeling. Exp Gerontol, 2005, 40(3)∶ 121-128.
2 李浩勇,胡波,劉繼紅.良性前列腺增生的藥物治療.醫學導報, 2011, 30(1)∶ 557-559.
3 Zhang X, Habib F K, Ross M, et al. Isolation and characterization of a cyclic hydroxamic acid from a pollen extract, which inhibits cancerous cell growth in vitro. J Med Chem, 1995, 38(4)∶ 735-738.
4 李坤,楊義芳,李永輝.油菜花粉抗前列腺增生與炎癥的活性部位研究.中草藥, 2010, 41(5)∶ 798-802.
5 童路,陳建平.花粉提取工藝及其初步藥理、臨床試驗.中成藥, 1998, 20(4)∶ 41-45.
6 邱云橋,常德,李信平,等.益腎通對前列腺炎及前列腺增生組織學的影響.中藥新藥與臨床藥理, 2013, 24(4)∶ 363-367.
7 Mori F, Oda N, Sakuragi M, et al. New histopathological experimental model for benign prostatic hyperplasia: stromal hyperplasia in rats. J Urol, 2009, 181(2)∶ 890-898.
8 申青,朱著,朱柳,等.尿生殖竇植入致大鼠良性前列腺增生的組織形態學研究.中華男科學雜志, 2010, 18(8)∶ 703-709.
9 Muniyan S, Ingersoll M A, Batra S K. Cellular prostatic acid phosphatase, a PTEN-functional homologue in prostate epithelia, functions as a prostate-specific tumor suppressor. Biochim Biophys Acta, 2014, 1846(1)∶ 88-98.
10 吳自余,馬松,王洪兵,等.組織學前列腺炎對前列腺增生臨床進展的影響因素分析.醫學臨床研究, 2011, 28(8)∶ 1460-1462.
11 Zlotta A R, Egawa S, Pushkar D, et al. Prevalence of inflammation and benign prostatic hyperplasia on autopsy in Asian and Caucasian men. Eur Urol, 2014, 66(4)∶ 619-622.
12 De Nunzio C, Kramer G, Marberger M, et al. The controversial relationship between benign prostatic hyperplasia and prostate cancer: the role of inflammation. Eur Urol, 2011, 60(1)∶ 106-117.
Therapeutic Effects of Active Parts of Brassica Campestris Pollen on Urogenital Sinus Induced Benign Prostatic Hyperplasia Rat Model
Li Lu1,2, Zhang Hong1,2, Wu Yun1,2, Li Na1,2, Cao Liang1,2, Yang Yifang3, Ding Gang1,2, Zheng Gaoli4, Xiao Wei1,2
(1. Jiangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China; 2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceuti cal Process, Lianyungang 222001, China; 3. State Key Laboratory of New Drug and Pharmaceutical Process, Shanghai Institute of Pharmaceutica l Industry, China State Institute of Pharmaceutical Industry, Shanghai 200040, China; 4. Institute of Materia Medica, Zhejiang Academy of Medical Sciences, Hangzhou 310013, Chin a)
This study was aimed to know the therapeutic effects of the total fatty acid part (PN1) and total flavonoids part (PN2) of Brassica campestris pollen on benign prostatic hyper plasia (BPH) . BPH rat model was established by implanting urogenital sinus of sixteen- to eighteen-day-old embryo in mature rat ventral prostate. After oral administration of PN1, PN2, or PN1 + PN2 for 33 days, rats were sacrificed for measuring wet weight, volume of the dorsolateral and ventral lobes of prostates, the weight and index of prostate, detecting serum acid phosphatase (ACP), prostatic acid phosphatase (PACP), the density of lecithin corpuscles and white blood cell count of rat prostatic fluid. The results showed that compared with the model group, prostate weight of PN1 high dose group, PN1 + PN2 high and middle dose group decreased significantly (P < 0.01, P < 0.05), and index of prostate in PN1 + PN2 high dose group was also decreased (P < 0.01). Density of lecithin corpuscles in PN1 high dose group and PN2 high dose group increased significantly (P < 0.05). White blood cell count in all dose groups of PN1, PN2 middle dose and low dose group, PN1 + PN2 high dose group presented lower levels when compared with the model group (P < 0.01, P < 0.05). Compared with the model group, the activity of PACP of PN2 high dose group and activity of ACP in PN1 + PN2 middle dose group were attenuated significantly (P < 0.05, respectively). It was concluded that PN1 and the combination of PN1 and PN2 of Brassica campestris pollen displayed obvious therapeutic effects on BPH rats, which was potential for drug discovery and development in the future.
Brassica campestris pollen, total fatty acid, total flavonoids, benign prostatic hyperplasia, urogenital sinus
10.11842/wst.2016.02.024
R285
A
(責任編輯:朱黎婷 張志華,責任譯審:朱黎婷 王 晶)
2015-10-16
修回日期:2015-11-26
* 科學技術部國家“重大新藥創制”科技重大專項“十二五”計劃資助項目(2013ZX09402203):現代中藥創制集群與數字制藥技術平臺,負責人:王振中。
** 通訊作者:鄭高利,博士,研究員,主要研究方向:藥理學研究和新藥開發與評價;蕭偉,本刊編委,博士,研究員、級高級工程師,主要研究方向:中藥新藥的研究與開發。

