超細支氣管鏡、DP電子導航、GS外周超聲小探頭、玫瑰系統聯合評價外周(1/3)肺感染性病灶的價值
李雅潔,謝巍,張鵬,薛艷超,馮靖,曹潔
?
超細支氣管鏡、DP電子導航、GS外周超聲小探頭、玫瑰系統聯合評價外周(1/3)肺感染性病灶的價值
李雅潔,謝巍,張鵬,薛艷超,馮靖△,曹潔△
摘要:目的評價超細支氣管鏡、Direct Path電子導航系統、Guide sheath(GS)外周超聲小探頭K201/K203系統、快速現場評價(玫瑰系統,ROSE)即四加技術(UNRE)引導下肺活檢對外周(1/3)肺感染性病灶的診斷價值及安全性。方法連續納入2014年4月1日—2015年3月31日在天津醫科大學總醫院就診的胸部CT發現外周(1/3)肺感染性病變的患者共97例,將其隨機分為四加技術組49例及非四加技術組48例,分別行四加技術或非四加技術引導下的經支氣管肺活檢(TBLB),分別比較四加技術組及非四加技術組的診斷率、安全性以及不同感染程度患者肺泡灌洗液肺泡巨噬細胞自發熒光強度的差異。結果四加技術組診斷率明顯高于非四加技術組(81.63% vs 56.25%,χ2=7.313,P < 0.01),病灶包含支氣管征亞組四加技術診斷率高于非四加技術組。所有患者均僅在活檢時見少許出血,無咯血、氣胸等并發癥發生。處于不同感染狀態的患者,其肺泡灌洗液肺泡巨噬細胞自發熒光強度亦不相同。結論四加技術引導下肺活檢診斷率高、并發癥少,選擇合適的病例能夠提高診斷率,肺泡灌洗液肺泡巨噬細胞自發熒光強度對外周(1/3)肺感染性病變的嚴重程度有提示作用。
關鍵詞:超細支氣管鏡;導航支氣管鏡;外周超聲小探頭;快速現場評價(玫瑰系統);肺部感染;外周肺病變;自發熒光;四加技術
呼吸道感染是呼吸科醫師永恒的話題,不僅因其是最常見、最多發的感染性疾病,還因為其是呼吸科為數不多的可治愈性疾病之一。外周(1/3)肺感染性病灶指在CT影像上處于距離肺門外側1/3橢圓區域[1],且被肺實質包繞,但在支氣管鏡下未發現氣道內的病變、外壓、黏膜下的腫物或支氣管的狹窄、炎癥及出血的一類感染性病變[2]。鑒于其特殊的位置,某些情況下其與腫瘤性病變常常難以區分,且當對其行經驗性治療效果不佳時,常需取得呼吸系統的標本來明確病變的病因。感染性疾病的發病離不開致病微生物,通過支氣管鏡準確到達病變部位進行致病微生物的采集尤為重要。近年來一些輔助技術被推廣應用于外周肺病變(PPLs)的診斷[3],但罕有將其聯合應用于外周(1/3)肺感染性病灶診斷的報道。本研究旨在探討聯合超細支氣管鏡、Direct Path (DP)電子導航系統、Guide sheath(GS)外周超聲小探頭K201/K203系統(EBUS-GS)、快速現場評價(玫瑰系統,ROSE)的四加技術(UNRE)診斷外周(1/3)肺感染性(除外結核病、真菌感染等)病灶的價值及安全性。
1 對象與方法
1.1對象連續納入2014年4月1日—2015年3月31日就診于天津醫科大學總醫院,胸部螺旋CT顯示為外周(1/3)肺病變,年滿14周歲的患者,根據患者就診順序進行編號,編號為奇數的患者行四加技術引導下經支氣管鏡肺活檢(TBLB),即UNRE組,編號為偶數患者,再進行隨機編號,并將編號除以3,余數為0者行ROSE加超細支氣管鏡檢查,余數為1者行ROSE加DP電子導航系統檢查,余數為2者行ROSE加EBUS-GS檢查,此3組稱為非四加技術(NUNRE)組,行非四加技術引導下的TBLB。術前完善心電圖、出凝血時間、血常規、人免疫缺陷病毒(HIV)、梅毒、肝炎標志物等檢查,確認無相關禁忌證。本研究獲得天津醫科大學總醫院倫理委員會批準,所有患者均于術前簽署知情同意書。排除標準:(1)常規氣管鏡下出現如下病變之一,包括氣道內的病變、外壓、狹窄或支氣管的出血。(2)高度懷疑或組織病理證實為非感染性病變(腫瘤性病變、結節病、韋格肉芽腫、瘢痕、間質性肺疾病等)、結核病、真菌感染等。(3)有肺臟外科手術病史者。(4)有嚴重的結構性肺病、心腦血管疾病等因其他原因不能耐受者。共有97例患者入選了本次研究,其中UN?RE組49例,NUNRE組48例,2組患者性別、年齡差異均無統計學意義,根據CURB-65評分,將所有患者評為低危、中危及高危,2組患者CURB-65評分情況比較差異無統計學意義,見表1。NUNRE組行ROSE加超細支氣管鏡檢查者16例,行ROSE加DP電子導航系統檢查者16例,行ROSE 加EBUS-GS檢查者16例。
1.2設備64排螺旋CT(GEmedical SysteLightSpeed VCT);迪夫快速細胞染色液AB液(珠海貝索生物技術有限公司);醫用低速離心機(B40,白洋離心機廠);細胞涂片離心機(TXD3,湖南長沙湘儀離心機儀器有限公司);藥用振蕩器(WZR-D951,蘇州市東吳醫用電子儀器廠);活檢鉗(JHYFB-18-105-O-O-A1,常州市久虹醫療器械有限公司);常規支氣管鏡(外徑5.5mm,BF-F260);超細支氣管鏡(外徑4mm,BF-P-260F),虛擬支氣管鏡導航軟件(DirectPath V1.02,Cybernet Systems),內鏡超聲系統(MAJ-935),外部直徑為1.4mm的20mHz腔內超聲探頭(UM-S20-17S)和引導鞘套裝(K201/K203),顯微鏡(CX31),倒置熒光相差顯微鏡(CKX41),均購自奧林巴斯公司。

Tab.1 Characteristics of patients in UNRE group and NUNRE group表1 四加技術組與非四加技術組患者的一般情況
1.3術前準備
1.3.1DP電子導航準備患者取仰臥位;高分辨率CT (HRCT)掃描,軸向,電壓120 kV,螺距1mm,掃描層面厚度5.0mm,層間距5.0mm。掃描時要求肺為最大充氣量(吸一口氣然后屏住呼吸)。放射科醫師將掃描數據傳送至Direct?Path系統,后者可以自動讀入數據并自動重建三維支氣管樹。在支氣管檢查之前或之中,通過在CT圖像上放置一個三維球形標記來確定目標病變的位置,一旦目標對象被確定,軟件會計算出通過氣道到達病灶的路徑。
1.3.2患者準備術前6h禁食禁水,確保7 d內無使用抗凝血藥物記錄,監測血壓、心電圖,簽署知情同意書,霧化吸入2%利多卡因5mL。
1.4術中操作患者取仰臥位,鼻導管吸氧,術中監測心率、血壓、血氧。采用超細支氣管鏡經鼻插入,根據DP電子導航引導到達病灶所在部位或者最接近病灶的部位,同時助手將超聲探頭插入引導鞘內,然后沿活檢孔道將兩者送入檢查部位,直至術者感覺有明顯阻力時開始超聲掃描,同時緩慢、勻速將超聲探頭往外抽出,隨時觀察超聲圖像的變化,出現病灶圖像時估測探頭從剛開始掃描到出現病灶圖像過程中的移動距離,并在相鄰的細支氣管行超聲檢查以爭取采集到病灶最佳的超聲圖像,同時明確探頭與病灶的位置關系,之后固定引導鞘管。隨后抽出超聲探頭,沿活檢孔道插入活檢鉗行肺活檢,活檢組織滾片至一張載玻片,將此載玻片依次放入迪夫快速細胞染色液A、B液中,隨后由2名經驗豐富的細胞學醫師顯微鏡觀察細胞成分及形態變化。在檢查過程中如超聲圖像顯示未見明顯異常,則按常規方法采取盲檢法,并按上述方法行ROSE檢查。如ROSE示感染性病變,則在發現ROSE異常后再活檢4~5塊即終止操作,如ROSE不具有診斷性,則從不同位置取樣以期獲得具有診斷性的樣本。收集滾片后其余活檢組織送檢病理學檢查。最后,將引導鞘管抽出,在目標或接近目標的亞段支氣管行支氣管肺泡灌洗,將支氣管鏡固定在目標亞段支氣管后,經支氣管鏡灌入100mL室溫生理鹽水,分3~5次灌入,每次灌入生理鹽水后,負壓吸引進行回吸收,每次不小于灌入量的5%,回吸收10mL(至少5mL)用于后續檢查。
1.5肺泡灌洗液中肺泡巨噬細胞自發熒光的圖像采集與處理灌洗液取出后立即用單層紗布濾除黏液,然后將其用吸管吸取5mL至滴管中,采用1 200 r/min離心10min后,棄去上清液,使剩余的細胞團充分震蕩20 s,即刻用細胞涂片離心機做細胞涂片,細胞涂片后呈圓形,吹干后將其置于倒置熒光相差顯微鏡下,采用340~370 nm紫外激發濾片,>420 nm阻斷濾片,暗室,恒溫,使用S-gauge軟件采用相同的曝光時間、增益、變焦、光圈等值,關閉自動白平衡,采取圓形細胞涂片6點方向最下端的細胞熒光圖像,然后立即將細胞涂片進行改良瑞氏染色,再次將其置于倒置熒光相差顯微鏡下,在相同位置采取圖像,與上一圖像一一對應,以區分肺泡巨噬細胞與其他細胞的自發熒光。隨后用Image-Pro Plus 6.0軟件測量巨噬細胞熒光強度,分別比較不同CURB65評分亞組的患者肺泡巨噬細胞自發熒光強度,以及血C反應蛋白(CRP)正常與異常患者的肺泡巨噬細胞自發熒光強度(血CRP正常標準:<8.0mg/L)。
1.6病理結果判定如活檢后ROSE未能獲得細胞病理結果、病理學未能明確診斷,則根據患者的要求,采取CT引導下經皮肺穿刺活檢術、手術或治療后隨訪6個月。所有患者的活檢組織均由2位經驗豐富的病理科醫師判定,如結果不一致則交由第3位病理科醫師共同討論決定。
1.7統計學方法使用SPSS 17.0軟件包進行統計分析,符合正態分布計量資料以±s表示,2組間比較采用t檢驗,多組間比較采用單因素方差分析(ANOVA),組間多重比較采用Bonferroni法,計數資料采用χ2檢驗。檢驗水準雙側α= 0.05。
2 結果
2.1患者診斷結果97例患者中肺炎63例,肺膿腫8例,感染伴機化21例,慢性炎癥所致肺不張5例,見表2。97例中有67例經四加技術或非四加技術診斷明確,余30例患者中11例行CT引導下經皮肺穿刺活檢術,2例行手術切除,17例經治療后隨訪至病灶吸收。
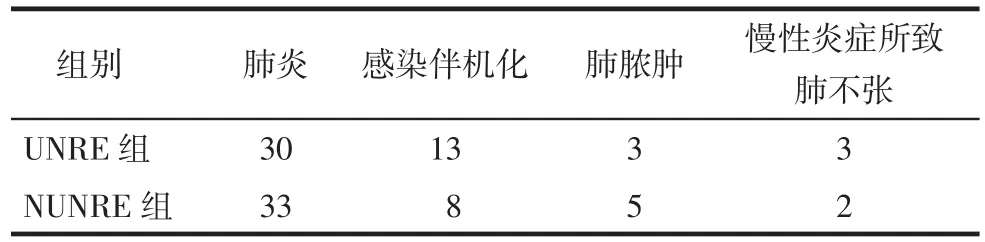
Tab.2 The diagnosis of UNRE group and NUNRE group表2 UNRE組與NUNRE組患者診斷結果 (例)
2.2四加技術組及非四加技術組各自診斷率結果四加技術組49例,四加技術明確診斷40例,診斷率為81.63%;非四加技術組48例,非四加技術明確診斷27例,診斷率為56.25%,四加技術組診斷率高于非四加技術組,差異有統計學意義(χ2=7.313,P < 0.01)。在支氣管征陽性亞組中,四加技術組診斷率高于非四加技術組(P < 0.05),見表3。
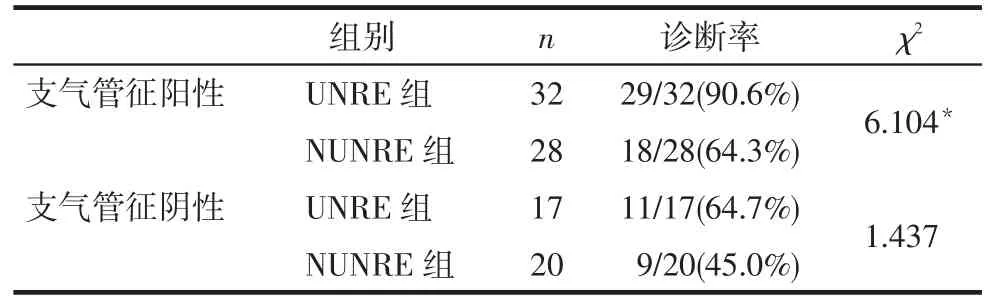
Tab.3 Diagnostic yield according to different parameters in UNRE group and NUNRE group表3 四加技術及非四加技術組不同參數的診斷率
2.3肺泡灌洗液肺泡巨噬細胞自發熒光強度變化結果97例患者中,中危及高危組自發熒光強度均低于低危組(均P < 0.05),中危組與高危組自發熒光強度差異無統計學意義(P>0.05)。97例患者中,CRP異常組自發熒光強度低于CRP正常組(P < 0.05),見表4。
Tab.4 Changes of autofluorescence intensity of alveolarmacrophage in different groups of patients表4 不同分組患者肺泡巨噬細胞自發熒光強度的變化(±s)
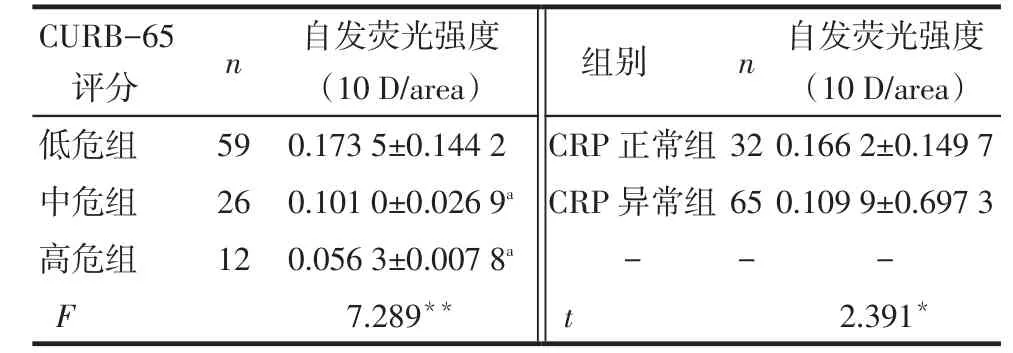
Tab.4 Changes of autofluorescence intensity of alveolarmacrophage in different groups of patients表4 不同分組患者肺泡巨噬細胞自發熒光強度的變化(±s)
*P<0.05,**P<0.01;a與低危組比較,P<0.05
n n CURB-65評分低危組中危組高危組F自發熒光強度(10 D/area)0.166 2±0.149 7 0.109 9±0.697 3 -2.391*59 26 12自發熒光強度(10 D/area)0.173 5±0.144 2 0.101 0±0.026 9a0.056 3±0.007 8a7.289**組別CRP正常組CRP異常組-t 32 65 -
2.4外周(1/3)肺感染性病變CURB 65評分低危患者與高危患者行四加技術檢查的結果(1)CT。低危患者CT示右下葉基底段實變及磨玻璃密度影,高危患者CT示右肺下葉后基底段軟組織影(箭頭示)。(2)超細支氣管鏡。低危及高危患者超細支氣管鏡均示右下葉基底段管腔通暢。(3)DP電子導航系統。軟件模擬出的虛擬支氣管鏡到達病灶部位(圓球所示)。(4)EBUS-GS。低危患者EBUS-GS可見導管徑向暴風雪征。高危患者EBUS-GS可見導管徑向不規則回聲。(5)ROSE。低危患者ROSE示較多中性粒細胞浸潤。高危患者ROSE示大量中性粒細胞浸潤;上皮細胞增生、退化、變性、壞死、甚至形成“核絲”;伴背景無結構壞死物或嗜酸性黏液;淋巴細胞、組織細胞和其他炎癥細胞混雜并存。(6)倒置熒光相差顯微鏡。低危患者肺泡灌洗液巨噬細胞自發熒光強度較高危患者高。見圖1、2。
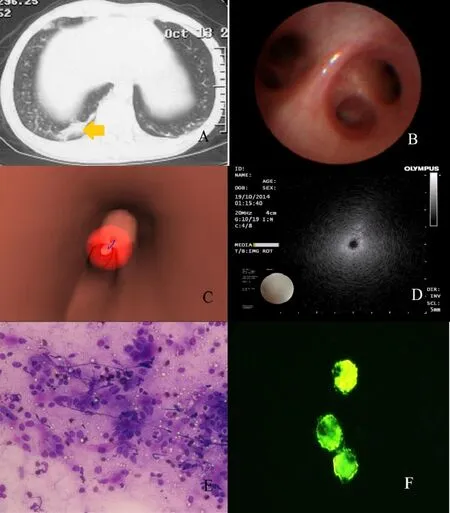
A:CT;B:超細支氣管鏡;C:Direct Path電子導航系統;D:Guide sheath(GS)外周超聲小探頭K201/K203系統;E:快速現場評價(改良瑞氏染色,×200);F:倒置熒光相差顯微鏡(×400);圖2同Fig.1 Manifestation of UNRE located in the peripheral third of the lung field in a patient with low risk bacterial infection圖1 外周(1/3)肺感染性病變低危患者行四加技術檢查的結果
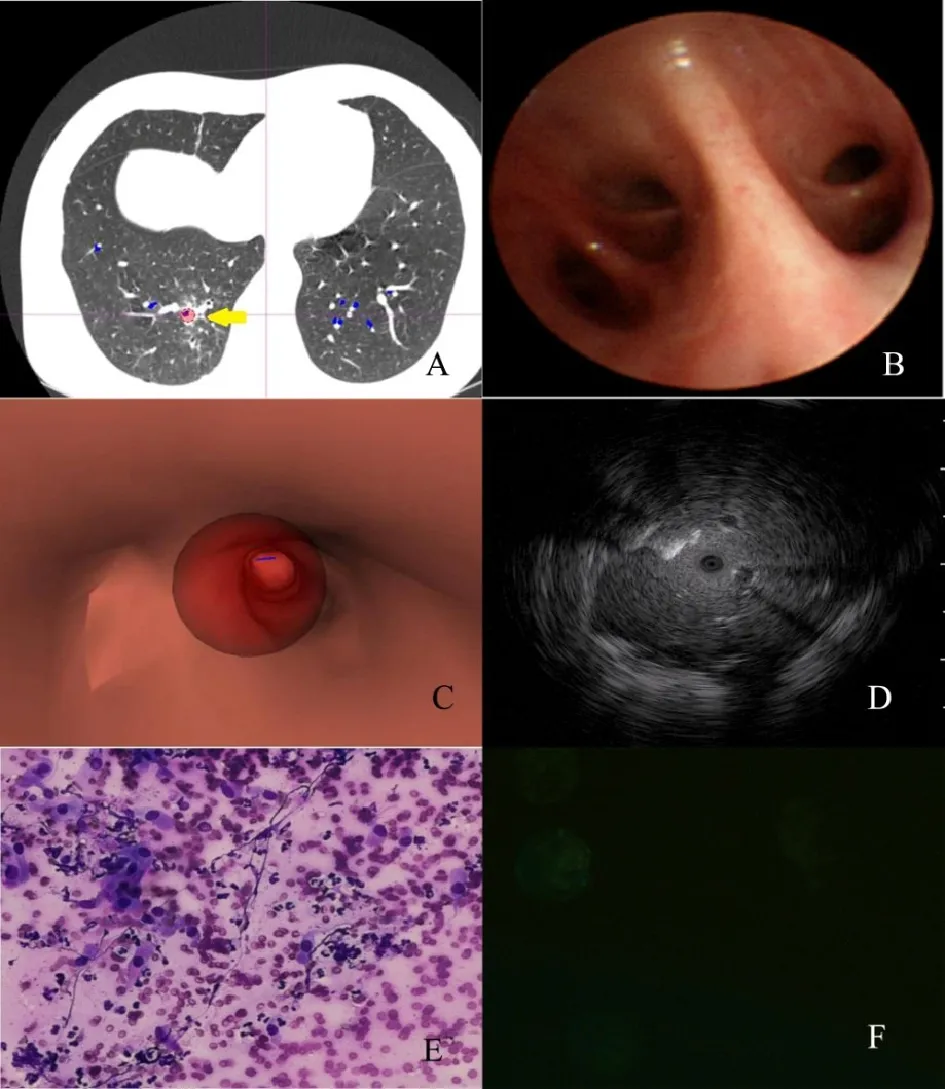
Fig.2 Manifestation of UNRE located in the peripheral third of the lung field in a patient withhigh risk bacterial infection圖2 外周(1/3)肺感染性病變高危患者行四加技術檢查的結果
2.5并發癥患者均能很好耐受操作,無一例出現氣胸、大咯血等并發癥。
3 討論
研究表明,超細支氣管鏡是診斷PPLs的基礎[4],因其可以在直視及DP電子導航系統導航下到達6~ 8級支氣管,而常規支氣管鏡只能到達4級支氣管。支氣管鏡需要醫師根據術前CT呈現的二維軸向圖像建立起三維視野,然后選擇通往病變的路徑。然而這種選擇在亞段支氣管水平往往是不準確的,為了解決這個問題,DP電子導航支氣管鏡被引入臨床。DP電子導航系統是一種將到達外周病變的支氣管路徑虛擬成支氣管圖像,并指導氣管鏡操作的方法。Asano等[2]發現DP電子導航系統聯合超細支氣管鏡對良性病變的診斷率為71.4%,但兩者聯合并不能提高其診斷率,其原因可能在于DP電子導航系統缺乏實時的引導,在支氣管分叉處,支氣管鏡輕易一次拐入與病灶臨近的支氣管,即可導致支氣管鏡不能到達病灶部位。為了確保氣管鏡準確到達病變部位,有必要將DP電子導航系統與另外一種技術EBUS-GS結合。一項隨機臨床試驗報道DP電子導航系統與EBUS-GS聯合使用可以提高診斷率,并縮短到達活檢部位的時間及總體檢查的時間[5]。Asano等[6]也發現聯合電子導航及外周超聲小探頭時,電子導航聯合外周超聲小探頭組比單獨外周超聲小探頭組診斷率高。Asano等[7]還發現聯合超細支氣管鏡、EBUS-GS及DP電子導航系統對PPLs的診斷率為84.4%。雖然借助超細支氣管鏡可以到達更周圍的部位,但其獲取的病理組織卻很少,因此,提高活檢次數及提升細胞標本的有效使用就顯得尤為重要。馮靖等[8]提出快速現場微生物學評價(microbiological ROSE,M-ROSE)的優勢主要體現在微生物形態學和中性粒細胞、巨噬細胞或淋巴細胞吞噬細菌兩大方面,更為重要的是,它可以提供明確的細胞學背景,感染性疾病的細胞學背景如壞死、中性粒細胞及淋巴細胞的大量浸潤,與非感染性疾病如哮喘的嗜酸性粒細胞為主的細胞學背景存在明顯差異,而慢性支氣管炎的杯狀細胞大量增生提示患者氣道的高分泌性。研究表明,徑向超聲聯合ROSE檢查能縮短患者的支氣管鏡檢查操作時間,此外,其也可減少支氣管鏡操作的并發癥,并通過現場反饋來提高支氣管鏡檢查的診斷性能[9]。本研究表明四加技術組的診斷率明顯高于非四加技術組,其可能是電子導航系統能夠引導超細支氣管鏡到達外周病灶,而EBUS-GS則能確認超細支氣管鏡是否到達目標病灶,TBLB后ROSE則能確認是否鉗取到目標病灶。
Asano等[6]發現聯合電子導航及外周超聲小探頭時,在支氣管征陽性亞組中四加技術組診斷率較非四加技術組診斷率高。本研究與之相符,可能原因是電子導航使用支氣管路徑的虛擬圖像來引導支氣管鏡,電子導航軟件對沒有支氣管征的病例不能準確建立虛擬路徑。
肺泡巨噬細胞的吞噬殺菌活性是其在抗感染的免疫防御反應中最基本的功能。吞噬細胞抗菌系統的主要成分是NADPH氧化酶(NOX),當發生炎癥反應時,這種膜酶在有氧情況下通過催化NAD(P)H的氧化反應生成活性氧類(ROS)來殺菌,與此同時胞質內的NAD(P)H被大量消耗。因此,NAD(P)H熒光探測可以作為表征細胞新陳代謝的內在探針。Aubin[10]發現細胞內大部分的自發熒光是由細胞內的NAD(P)H及黃素產生的。本研究采用340~370 nm紫外激發濾片,>420 nm阻斷濾片,過濾掉黃素腺嘌呤二核苷酸(FAD)及核黃素-5-磷酸(FMN)的自發熒光,確保觀察到的自發熒光來自NAD(P)H。本研究觀察到不同感染程度患者其肺泡灌洗液肺泡巨噬細胞的自發熒光強度具有差異性,中危組及高危組患者肺泡灌洗液巨噬細胞自發熒光強度均低于低危組,CRP升高者自發熒光強度則較CRP正常者低,這可能是發生炎癥反應時,在NOX活化生成ROS,NAD(P)H大量消耗所致,而中危組與高危組患者肺泡灌洗液巨噬細胞自發熒光差異無統計學意義,可能是樣本量過小導致。
有Meta分析顯示,在肺部結節患者中,應用輔助支氣管鏡技術發生氣胸的概率為1.5%,發生呼吸衰竭需要氣管插管的概率為0.1%[11]。本研究與其相符。
綜上所述,四加技術診斷率高、并發癥低,用于診斷外周(1/3)肺感染性病灶安全有效,選擇合適的病例能提高外周(1/3)肺感染性病灶的診斷率。另外,肺泡灌洗液肺泡巨噬細胞自發熒光強度對患者的感染狀態具有提示作用。
參考文獻
[1] Baaklini WA, ReinosomA, Gorin AB, et al.Diagnostic yield offiber?optic bronchoscopy in evaluating solitary pulmonary nodules[J].Chest,2000,117(4): 1049-1054.doi:10.1378/chest.117.4.1049.
[2] Asano F, Shinagawa N ,Ishida T, et al.Virtual bronchoscopic navi?gation combined with ultrathin bronchoscopy.A randomized clini?cal trial[J].Am J Respir Crit Caremed,2013, 188 (3): 327-333.doi: 10.1164/rccm.201211-2104OC.
[3] Gilbert C, Akulian J, Ortiz R, et al.Novel bronchoscopic strategies for the diagnosis of peripheral lung lesions: present techniques and future directions[J].Respirology,2014, 19(5):636- 644.doi:10.1111/resp.12301.
[4] Rooney CP, Wolf K,mcLennan G.Ultrathin bronchoscopy as an ad?junct to standard bronchoscopy in the diagnosis of peripheral lung lesions.A preliminary report[J].Respiration,2002,69(1):63-68.
[5] Ishida T, Asano F, Yamazaki K,et al.Virtual bronchoscopic naviga?tion combined with endobronchial ultrasound to diagnose small pe?ripheral pulmonary lesions: a randomised trial[J].Thorax,2011, 66 (12):1072-1077.doi:10.1136/thx.2010.145490.
[6] Asano F, Shinagawa N, Ishida T,et al.Virtual bronchoscopic naviga?tion improves the diagnostic yield of radial- endobronchial ultra?sound for peripheral pulmonary lesions with involved bronchi on CT [J].Internmed,2015,54(9):1021- 1025.doi: 10.2169/internalmedi?cine.54.3497.
[7] Asano F,matsuno Y, Tsuzuku A, et al.Diagnosis of peripheral pul?monary lesions using a bronchoscope insertion guidance system combined with endobronchial ultrasonography with a guide sheath [J].Lung Cancer,2008,60(3):366- 373.doi:10.1016/j.lungcan.2007.10.022.
[8] Feng J, Chen BY, Wu Q.It′s time for this"ROSE"to flower: rapid on site evaluation in interventional pulmonology[J].Tianjinmed J, 2014, 42(3):193-196.[馮靖,陳寶元,吳琦.應重視介入呼吸病學的快速現場評價[J].天津醫藥, 2014, 42(3): 193- 196].doi: 10.3969/j.issn.0253-9896.2014.03.001.
[9] Steinfort DP, Leong TL, Laska IF, et al.Diagnostic utility and accu?racy of rapid on-site evaluation of bronchoscopic brushings[J].Eur Respir,2015,45(6):1653-1660.doi:10.1183/09031936.00111314.
[10] Aubin JE.Autofluorescence of viable culturedmammalian cells[J].Jhistochem Cytochem, 1979, 27 (1): 36-43.
[11] Wangmemoli JS,Nietert PJ,Silvestri GA.Meta-analysis of guided bronchoscopy for the evaluation of the pulmonary nodule[J].Chest, 2012,142(2): 385-393.doi:10.1378/chest.11-1764.
(2015-09-14收稿2015-11-10修回)
(本文編輯李國琪)
Value of ultrathin bronchoscopy, virtual bronchoscopic navigation, endobronchial ultrasonography with a guide sheath and rapid on-site evaluation in evaluation of bacterial infections in the peripheral third of the lung field
LI Yajie, XIE Wei, ZHANG Peng, XUE Yanchao, FENG Jing△, CAO Jie△
Department of Respiratory, Tianjinmedical University Generalhospital, Tianjin 300052, China△Corresponding Author E-mail: zyyhxkfj@126.com; tjcaojie@sina.com
Abstract:Objective To evaluate the diagnostic yield and safety of transbronchial lung biopsy (TBLB) under virtual bronchoscopic navigation (Direct Path), endobronchial ultrasonography with a guide sheath (GS) and rapid on-site evaluation using an ultrathin bronchoscopy (UNRE) for bacterial infection located in the peripheral third of the lung field.Methods Ninety-seven patients with bacterial infection, which located in the peripheral third of the lung field on CT images, were ran?domly assigned to UNRE (n=49) or non-UNRE (NUNRE, n=48) groups, who were treated in Generalhospital of Tianjinmedical University between April 1, 2014 andmarch 31, 2015.The TBLB guided by UNRE was performed in two groups.The diagnostic yield, safety and complication rate were compared between two groups.Moreover, the differences of autofluo?rescence intensity of alveolarmacrophage in alveolar lavage fluid were compared between two groups of patients.Results The diagnostic yield was significantlyhigher in UNRE group than that of NUNRE group (81.6% vs 56.2%,χ2=7.313, P < 0.01).The diagnostic yield washigher in UNRE group with bronchus sign compared to that of NUNRE.All patientshad amild bleeding at the time of biopsy.There were nohemoptysis, pneumothorax or other serious complications.The autofluores?cence intensity of alveolarmacrophage was different in different levels of infection in patients.ConclusionThe procedure of UNREhashigher diagnostic rate and fewer complications.The careful selection of suitable cases can further improve the diagnostic accuracy.The autofluorescence intensity of alveolarmacrophage in alveolar lavage fluid indicates the severity of infection in patients.
Key words:ultrathin bronchoscopy; navigational bronchoscopy; endobronchial ultrasonography with guide sheath; rap?id on site evaluation; pulmonary infection; peripheral pulmonary lesion; autofluorescence; UNRE
通訊作者△E-mail: zyyhxkfj@126.com;tjcaojie@sina.com
作者簡介:李雅潔(1989),女,碩士在讀,主要從事介入呼吸病學方面研究
基金項目:國家自然科學基金資助項目(81270144,30800507,81570084);國家十二五科技支撐計劃(2015BAI12B00,2012BAI05B02)
中圖分類號:R563
文獻標志碼:A
DOI:10.11958/20150162
作者單位:天津醫科大學總醫院呼吸科(郵編300052)

