多花筋骨草高頻再生體系的建立
趙佳佳,宇 佳,遲德富
(東北林業大學林學院,中國 哈爾濱 150040)
?
多花筋骨草高頻再生體系的建立
趙佳佳,宇佳,遲德富*
(東北林業大學林學院,中國 哈爾濱150040)
摘要為了建立一個高效的多花筋骨草組織培養再生體系,以多花筋骨草嫩葉為外植體,進行了不同激素配比對愈傷組織誘導,不定芽增殖及根誘導.結果表明:6-BA,KT及2,4-D組合從外植體誘導出愈傷;6-BA和NAA組合可從外植體誘導出苗;6-BA可誘導不定芽及不定芽增殖;IBA可誘導根系發生.
關鍵詞多花筋骨草;外植體;愈傷組織;不定芽;組織培養
Establishment of a Complete Plant Regeneration System onAjugaMultiflora
ZHAOJia-jia,YUJia,CHIDe-fu*
(College of Forestry, Northeast Forestry University, Harbin 150040, China)
AbstractTender leaves ofAjugamultiflorawere used to study the effect of different concentration ratios of hormones on the callus induction, adventitious bud multiplication, root genesis and development differentiation. The results showed that callus was induced from explants on the medium with different concentration ratios of 6-BA, KT and 2,4-D. Plant developments are induced by explants on the medium with 6-BA, as well as with NAA.The best hormone for adventitious bud induction and adventitious bud multiplication is 6-BA. Root induction occurs on the medium with IBA.The goal of this research is to establish an effective regeneration system forAjugamultiflora.
Key wordsAjugamultifloraBunge; explant; callus; adventive bud; tissue culture
多花筋骨草(AjugamultifloraBunge)是唇形科(Lamiaceae)筋骨草屬(AjugaL.)常綠多年生草本植物.株高25~30 cm,輪傘花序,花冠藍紫色或藍色,較集中開放時間為4~5月,種子成熟期在5~6月[1].該植物具有清肺止咳、緩解咽喉腫痛、清熱解毒之功效,可用于治療肝炎、腹瀉、外傷出血等病癥,對多種細菌性病癥有抑制功能[2].近來研究發現該屬植物具有收縮血管、抗腫瘤、抑菌等藥理活性[3].服用筋骨草以后,臨床檢測到的白細胞數值增加,血清中谷丙轉氨酶的活力顯著下降,表明其對病毒性疾病及腫瘤確有一定療效[4].目前已從該屬中分離提取出甾體類、苷類、黃酮類、二萜類及多糖類等活性物質,研究表明該植物所含的蛻皮甾酮能調節核糖體中蛋白的合成,影響核酸mRNA的合成速率,并在一定程度上調節動物體內的血糖血脂,降低膽固醇[5-6].其所含的β-蛻皮甾酮是一種能調控昆蟲生長發育的天然化合物,因此具有較高的潛在應用價值.一些學者希望利用蛻皮甾酮來影響昆蟲的生長發育或其生理機能,抑制昆蟲的生活力和發育速度,從而達到長期有效地控制有害生物種群的目的[7-8].
國內外對筋骨草成分的提取和分離主要以天然植物資源為主,然而許多種類資源有限,數量急劇減少,日漸處于瀕危狀態.現在多花筋骨草多采用分株繁殖,無法滿足實際生產需要.植物離體繁殖不受地理氣候條件限制,且能降低成本、縮短生長周期、節省土地,還可保證材料來源一致、遺傳背景均一、重復性好.同時,離體保存的材料不易受各種病蟲害及雜菌的侵染,有利于種質資源的地區間及國際間的交換[9].世界上已建成許多年產百萬苗木的組織培養工廠,繁育了許多種組培苗,組培苗市場已經國際化[10].目前有關多花筋骨草組織培養方面的研究尚未見報道.本研究以多花筋骨草為試驗材料,首先通過高效液相法分別測得其根、莖、葉的蛻皮激素含量,發現以葉片中最多,莖次之,根中最少.因此對多花筋骨草葉片進行離體培養,脫分化獲得愈傷組織,利用細胞全能性進行再分化,以器官發生型形成完整植株.同時通過葉片離體培養,不經過愈傷組織階段,直接誘導分化不定芽,研究并得到其高頻再生的最適培養基,建立了再生頻率高達90%以上的多花筋骨草離體快繁體系.為多花筋骨草的大規模生產、基因轉化以及遺傳、生理、生化和病理學的研究奠定一定基礎.
1材料與方法
1.1試驗材料
本試驗材料采自遼寧省沈陽福陵森林公園,移栽至東北林業大學林學院實驗室.經東北林業大學生命科學學院植物教研室鄭寶江副教授鑒定為多花筋骨草.
1.2試驗方法
1.2.1外植體處理將葉片于流動自來水下沖洗20 min;在超凈工作臺上用體積分數(下同)為70%的酒精消毒30 s;無菌水沖洗3次;加入適量的2.5%的NaClO溶液,置100 r/min搖床上8 min;去除NaClO溶液后,再用無菌水徹底沖洗殘留的NaClO溶液,約5~6次;最后用無菌濾紙吸去外植體表面的水分;用解剖刀切去葉片邊緣,再將其切成1 cm2大小葉片,正面朝上接種于誘導培養基上.
1.2.2培養基及培養條件愈傷誘導培養基:MS+0.2 mg/L 6-BA+0.2mg/L KT+(0,0.2,0.4,0.6,0.8,1.0)mg/L 2,4-D;胚性愈傷誘導培養基:MS+1.0 mg/L 6-BA+0.2 mg/L 2,4-D;不定芽誘導培養基:MS+(0.5,1.0,1.5,2.0) mg/L 6-BA;生根培養基:MS+(0.3,0.6,0.9) mg/L IBA;直接誘導不定芽培養基:MS+0.05 mg/L NAA+(0.5,1.0,1.5,2.0) mg/L 6-BA, 以上培養基均加入20 g/L 蔗糖,5.5~7.0 g/L 瓊脂,將pH值調至6.2~6.4.培養條件為溫度25 ℃,光照強度2 000 lx,光/暗周期為16 h/8 h.
1.2.3葉片愈傷組織及不定芽的誘導以MS為基本培養基,采用0.2 mg/L 6-BA+0.2 mg/L KT與(0,0.2,0.4,0.6,0.8,1.0 ) mg/L 2,4-D的激素組合對葉片進行愈傷組織誘導,每種培養基接種20瓶,培養25 d,重復3次.將愈傷繼代于MS+1 mg/L 6-BA+0.2 mg/L 2,4-D的培養基上,進行多花筋骨草胚性愈傷組織的誘導.將質量較好的胚性愈傷組織轉接至MS+(0.5,1.0,1.5,2.0 ) mg/L 6-BA的培養基上,進行不定芽的誘導,培養條件為溫度25 ℃,光照強度2 000 lx,光/暗周期為16 h/8 h. 觀察不定芽的誘導情況.
1.2.4不定芽的增殖培養用不定芽誘導培養基誘導出密集的不定芽后,切成1 cm2大小的方塊進行繼代培養,繼代培養基與誘導培養基相同,25 d后統計外植體分化情況.
1.2.5叢生芽的生根培養及移栽將誘導的高于4 cm的健壯幼苗轉接到生根培養基中.生根培養基為MS+(0.3,0.6,0.9)mg/L IBA,培養25 d后統計生根情況.將形成完整根系的植株移栽到已消毒的蛭石:腐殖土為1∶1的栽培基質中,移栽前要先煉苗5~6 d,即對試管苗提高光強鍛煉,同時將瓶口包扎物打開,使其慢慢適應外界環境,增強小苗體質以提高移苗成活率.
1.2.6不經愈傷階段直接獲得不定芽采用MS(蔗糖20 g/L,瓊脂5.5~7 g/L,pH值6.2~6.4)培養基,附加(0.5,1.0,1.5,2.0) mg/L 6-BA和 0.05 mg/L NAA的激素組合,研究直接誘導不定芽的高頻最佳激素組合.
1.2.7數據統計25 d后進行外植體誘導率的統計,同時觀察愈傷組織、不定芽及根的生長狀況.
誘導率=(誘導出的愈傷或不定芽個數/未污染的外植體個數)×100%.
2結果與分析
2.16-BA,KT與2,4-D組合對多花筋骨草愈傷誘導的影響
外植體培養8 d時葉片膨大、卷曲,15 d開始出愈傷,并且葉片由深綠變為淺綠,愈傷(圖1A)由緊致變得疏散.培養25 d時植物激素 0.2 mg/L 6-BA,0.2 mg/L KT 與不同濃度2,4-D組合對多花筋骨草愈傷組織誘導結果見表1.由表1可見,不添加2,4-D時外植體僅僅膨大卷曲而無愈傷組織;2,4-D為 0.2 mg/L時僅在葉片傷口貼合培養基處有少量愈傷組織并且質地較硬,深綠色;2,4-D為 0.4 mg/L時整個外植體被愈傷覆蓋,愈傷組織為疏松顆粒狀,黃綠色;0.8 mg/L,1.0 mg/L 的2,4-D培養時整個外植體被愈傷覆蓋但愈傷水澤狀部分褐化,顏色為乳白色.因此,一定范圍內較高濃度的2,4-D有利于多花筋骨草良好愈傷組織的誘導;超過這一濃度范圍誘導出的愈傷開始出現水澤狀,呈乳白色,并且褐化現象也相對明顯;濃度較低時誘導的愈傷較硬、量少、顏色深.若從進一步提高植株再生率來考慮,以0.2 mg/L 6-BA, 0.2 mg/L KT與0.4 mg/L 2,4-D激素組合誘導的愈傷組織為最佳.圖1B為植物激素組合誘導的多次繼代的松散愈傷.
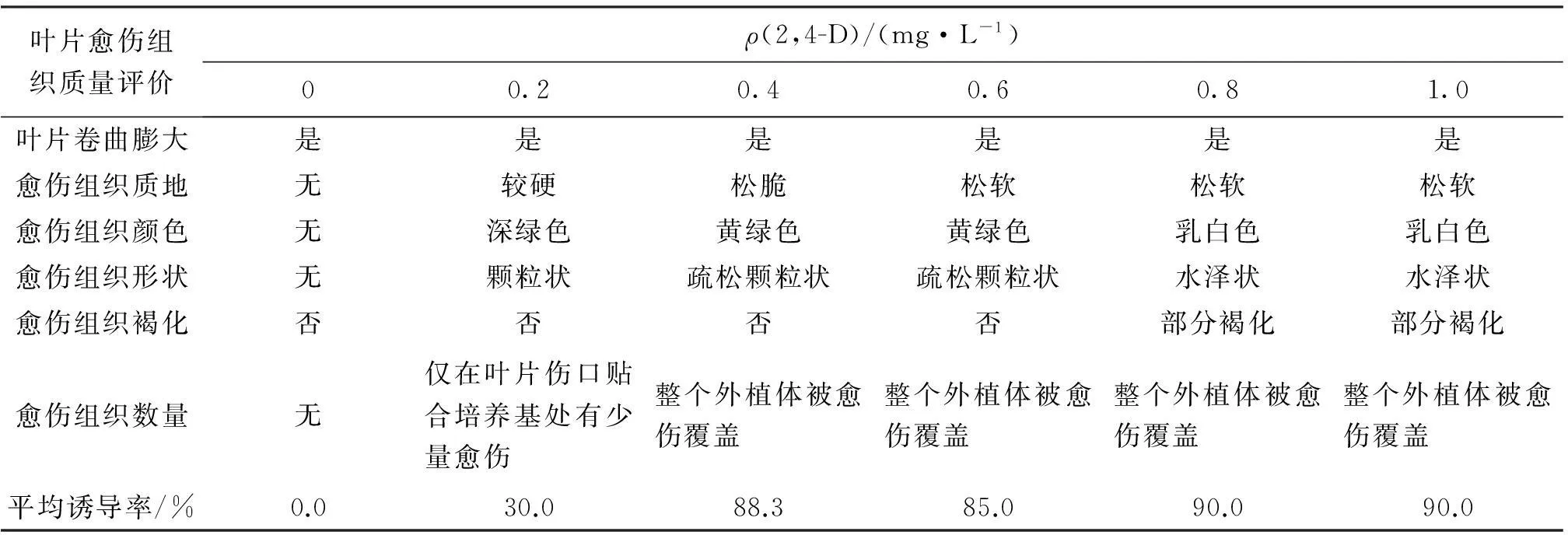
表1 0.2 mg/L 6-BA,0.2 mg/L KT 與不同質量濃度2,4-D 配比的培養基中愈傷誘導情況
2.2愈傷組織再分化的比較
先將愈傷組織接到胚性愈傷組織誘導培養基內進行胚性誘導,再轉接到只含 6-BA的MS培養基中進行芽誘導,到第7 d時部分愈傷褐化,無褐化部分愈傷變綠并伴有膨大生長,25 d誘導出芽,但多數芽表現出玻璃化現象(圖1C),僅有16.7%的芽正常.對愈傷組織在不同濃度6-BA中不定芽的分化率情況進行比較,分化率結果見表2.由表2可知,6-BA為0.5 mg/L時不能誘導出不定芽,6-BA質量濃度超過1.0 mg/L后即可分化出不定芽,但濃度越高玻璃化率越嚴重,僅1.0 mg/L 的6-BA能分化出少量正常苗.
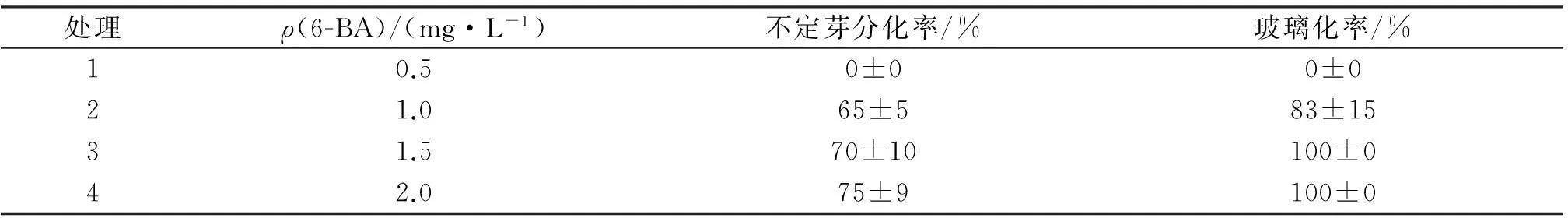
表2 6-BA不同配比培養基中愈傷組織再分化情況

A.葉片誘導愈傷;B.多次繼代愈傷;C.再生芽點;D.叢生芽;E.叢生芽;F.不定根誘導A.The callus induced by leaf; B.Multiple transgenerational callus; C.regeneration buds; D.bud clumps; E.bud clumps; F. induction of adventitious root圖1 多花筋骨草再生過程不同時期的生長狀態Fig.1 Growth state of Ajuga multiflora Bunge in different regeneration periods
2.36-BA與NAA組合直接誘導不定芽
根據Stamp[11]等和von Adventivknospen[12]等研究結果,設計了NAA與6-BA激素不同配比的誘導不定芽試驗.結果表明,較低濃度NAA配合低濃度的6-BA有利于多花筋骨草外植體直接誘導不定芽發生.除MS+0.5 mg/L 6-BA+0.05 mg/L NAA組合培養的葉片僅表現出卷曲膨大但無芽點無愈傷外,其他各組合均在培養12 d后僅切口處膨大或微有愈傷組織,之后開始顯現芽點,20 d后已有多數芽點,分化出小苗.表明6-BA質量濃度在1 mg/L 以上時均可誘導出不定芽.而且以1 mg/L誘導效果最好,其他質量濃度均有不同程度的玻璃化現象發生,6-BA為1.5 mg/L時玻璃化率為20%,6-BA為2.0 mg/L時玻璃化率為42%.對葉片外植體在不同質量濃度6-BA與NAA激素組合中不定芽的分化情況對比,分化率結果見表3.

表3 6-BA 和 NAA 不同配比培養基中不定芽誘導情況
2.46-BA對多花筋骨草葉芽增殖誘導的影響
誘導出的優質小苗轉接到增殖培養基中進行繼代,觀察葉芽增殖情況,見表4.由表4可知,不添加6-BA時,葉芽平均增殖數只有3.33個,隨6-BA質量濃度升高葉芽增殖個數先迅速增加后平穩升高,1.0 mg/L的 6-BA誘導的葉芽平均增殖數達到10個左右且無玻璃化現象,平均植株高度為1.1 cm,6-BA為1.5 mg/L時葉芽平均誘導數仍近10個,但出現17%的玻璃化率并且植株高度下降為0.73 cm,6-BA為2.0 mg/L時玻璃化率達到47%,植株平均高度為0.66 cm.因此,6-BA為1 mg/L時對多花筋骨草葉芽增殖誘導效果最佳.
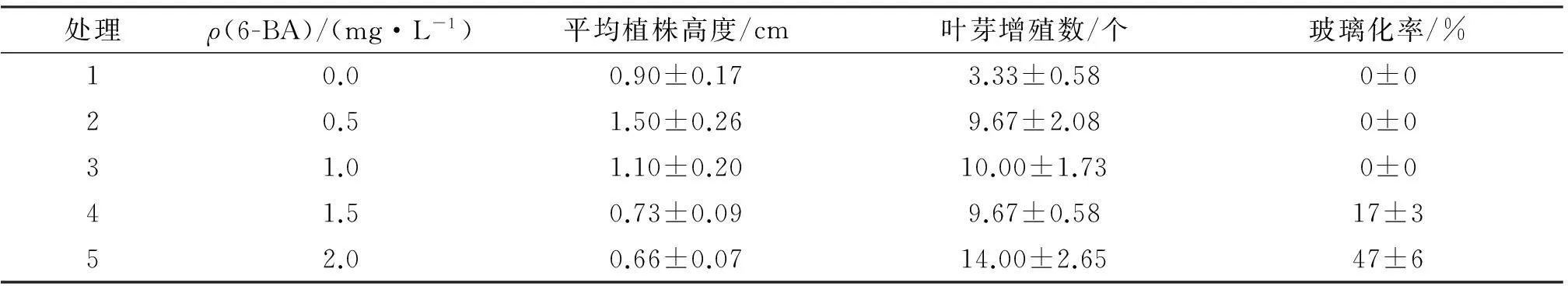
表4 6-BA不同配比培養基中葉芽增殖的情況
2.5完整植株的誘導
將長度大約為2 cm的無根苗接種在MS+(0.3,0.6,0.9)mg/L IBA 的培養基(pH 6.2~6.4)上培養,2~3周后即可誘導出根,形成完整的植株(圖1F).3個濃度的IBA均可誘導出發達的根系(表5),IBA為1 mg/L時根長可達8.0 cm,然而此根系太長不利于移栽操作;0.3和0.6 mg/L的IBA有利于誘導良好的根系發生,即根系發達,有一定程度木質化且長度適宜.為節約材料,選擇0.3 mg/L IBA進行根系誘導.

表5 不同培養基中誘導不定芽的生根情況
2.6植株移栽成活率
選擇具有完整根系的多花筋骨草植株,除去其培養瓶的包扎物,在自然光照條件下煉苗5~6 d,然后洗凈根系上殘留的瓊脂,移栽于V(蛭石)∶V(腐殖土)為1∶1的栽培基質中培養,并用遮陰網遮陰,保證所需濕度,2~3 d澆一次營養液.移栽成活率可達90%以上.由此可見具有發達且一定木質化的根系,是獲得高成活率試管苗移栽的關鍵.
3討論
本試驗以多花筋骨草嫩葉為外植體,MS+0.2 mg/L 6-BA+0.2 mg/LKT+0.4 mg/L 2,4-D 誘導愈傷組織較好,所得愈傷組織質地松脆,呈黃綠色,大多數為顆粒狀.MS+1 mg/L 6-BA可誘導莖芽,但用愈傷誘導的葉芽常伴有玻璃化現象,而MS+1 mg/L 6-BA+0.05 mg/L NAA有利于葉片直接分化不定芽,并且誘導時間較短,玻璃化現象相對較輕,長勢良好,更適于葉芽增殖.MS+0.3 mg/L IBA適于生根培養,所得根系發達,有一定程度木質化,移栽宜成活.有研究表明:植物生長調節物質對植物離體培養中的細胞脫分化、再分化及形態建成起著重要的調節作用.一般來說,2,4-D誘導的愈傷不能分化出芽,需轉入含有細胞分裂素的分化培養基中培養2-3代才能出芽[13-14].研究報道6-BA促進愈傷組織不定芽的發生,長勢和成芽數量隨其濃度升高而降低,這與本試驗結果一致[15].因此,可將愈傷組織用高濃度6-BA誘導后再轉入低濃度增殖,從而獲得較好的分化率.高濃度的6-BA會導致嚴重的玻璃化現象,這與高紅兵[16]等研究一致.高濃度6-BA影響誘導的組培苗內源激素失衡,從而導致了玻璃化現象的發生.
本研究初步建立了多花筋骨草離體快速繁殖體系,在短時間內可以獲得大量無菌苗,縮短生長周期、節省土地、降低成本、并且不受地理氣候條件限制.目前,有關多花筋骨草快速繁殖及組織培養方面的研究尚未見報道.本體系的建立為多花筋骨草次生代謝產物的大規模生產及基因轉化研究奠定了基礎.
參考文獻:
[1]劉開全,鄧洪平,馬學萍. 國產唇形科筋骨草屬(Ajuga)研究概況[J]. 曲靖師范學院學報, 2010,29(6):32-35.
[2]江蘇新醫學院.中藥大辭典 [M].上海:上海人民出版社, 1977.
[3]MIDORI T, HARUKUNI T, HOYOKU N,etal. Cancer chemopreventive a-gents (antitumor-promoters) from Ajuga decumbens[J]. J Nat Prod, 1999,62(7):972.
[4]楊秀偉. 麻花頭屬和漏蘆屬藥用植物中蛻皮甾酮類成分及其生物活性研究[J]. 中國現代中藥, 2013,15(11):922-935.
[5]CATALAN R E, MARTINES A M, ARAGONES M D. In vitro effect of ecdysterone on protein kinase activity[J]. Comp Biochem Physiol, Part B, 1982,71(2):301-303.
[6]TAKEI M, ENDO K, NISHIMOTO N,etal. Effect of ecdysterone on histamine release from rat peritoneal mast cells [J]. J Pharm Sci, 1991,80(4):309-310.
[7]黎昕,錢晶晶,李曉燦,等. 匍枝筋骨草懸浮培養生產蛻皮甾酮的研究[J]. 中國農學通報, 2013,29(34):127-133.
[8]趙曉杰. IBA、NAA、光質對匍枝筋骨草生長及β-蛻皮甾酮含量的影響[D].哈爾濱:東北林業大學, 2011.
[9]王征. 杜仲組織培養及愈傷組織植株再生體系的建立[D].長沙:中南林業科技大學, 2013.
[10]黃曉紅. 藥用植物廣豆根組培快繁體系的建立[D].南寧:廣西大學,2012.
[11]STAMP J A, COLBY S M, MEREDITH C P. Improved shoot organogenesis from leaves of grape[J]. J Am Soc Hortic Sci, 1990,115(6):1038-1042.
[12]VON ADVENTIVKNOSPEN D B. Adventitious bud formation in leaf explants of some grapevine rootstock and scion cultivars[J]. Vitis, 1990,29:151-158.
[13]李文靜,李學強,賈毛毛,等. 6-BA、NAA和2,4-D不同配比對薺菜愈傷組織誘導、生長及植株再生的影響[J]. 植物生理學報, 2012,48(2):141-146.
[14]王曉春,師尚禮,梁慧敏,等. 2,4-D和6-BA組合配比對金達苜蓿愈傷組織誘導與分化的影響[J]. 草地學報, 2010,18(2):219-222.
[15]趙曉杰,遲德富,李曉燦. 匍枝筋骨草再生體系構建[J]. 中國農學通報, 2011,27(4):120-124.
[16]高紅兵,唐曉杰,孟慶繁.高濃度 6-BA 誘導酸櫻桃苗的玻璃化苗內源激素含量變化[J].林業科學研究, 2006,19(4):488-490.
(編輯WJ)
中圖分類號Q813.1+2
文獻標識碼A
文章編號1000-2537(2016)01-0030-05
*通訊作者,E-mail:chidefu@126.com
基金項目:國家自然科學基金資助項目(31370649)
收稿日期:2015-04-04
DOI:10.7612/j.issn.1000-2537.2016.01.006

