高脂誘導BRL-3A細胞胰島素抵抗模型的建立
金 磊,王 帥,王 欣,海春旭,李文麗*(第四軍醫大學軍事預防醫學院毒理學教研室,陜西省自由基生物學與醫學重點實驗室,陜西 西安 710032)
?
高脂誘導BRL-3A細胞胰島素抵抗模型的建立
金 磊,王 帥,王 欣,海春旭,李文麗*
(第四軍醫大學軍事預防醫學院毒理學教研室,陜西省自由基生物學與醫學重點實驗室,陜西 西安 710032)
【摘要】目的: 采用棕櫚酸(PA)誘導BRL-3A細胞,建立肝細胞胰島素抵抗體外模型。方法:分別用不同濃度(0、50、100、200、300、400 μmol/L)棕櫚酸處理BRL-3A細胞不同時間(6、12、24 h)后,檢測細胞生存率、基礎葡萄糖消耗及胰島素刺激葡萄糖消耗的變化。結果:高濃度PA(200、300、400 μmol/L)使細胞生存率顯著降低(P<0.05);低濃度PA(50、100 μmol/L)短時間(6和12 h)作用對細胞生存率無明顯影響(P>0.05);不同濃度PA短時間(6 h)作用于細胞,其基礎葡萄糖消耗及胰島素刺激葡萄糖消耗與正常組相比無顯著變化(P>0.05),作用24 h后細胞葡萄糖消耗量均明顯下降(P<0.05),100 μmol/L的PA處理12 h可降低細胞基礎葡萄糖消耗及胰島素刺激的葡萄糖消耗量(P<0.05),且在繼續培養至72 h攝糖能力無明顯改變。結論:100 μmol/L的PA作用12 h可誘導BRL-3A細胞產生胰島素抵抗。
【關鍵詞】棕櫚酸;胰島素抵抗;葡萄糖消耗;葡萄糖氧化酶法
作者信息: 金 磊,E-mail:kingleer001@163.com。*通信作者,李文麗,E-mail:liwenli@fmmu.edu.cn
Induction of insulin resistance by palmitic acid in BRL-3A cells
JIN Lei,WANG Shuai,WANG Xin,HAI Chunxu,LI Wenli*
(Shaanxi Key Lab of Free Radical Biology and Medicine, Department of Toxicology, School of Preventive Medicine, Fourth Military Medical University, Xi’an 710032, Shaanxi, China)
【ABSTRACT】OBJECTIVE: To investigate an insulin resistance in BRL-3A cells after their exposure to palmitic acid (PA). METHODS:BRL-3A cells were incubated with PA (0,50,100,200,300,400 μmol/L) for 6,12 or 24 hours. After the exposure,cell viability,basic and insulin-stimulated glucose consumption were assayed. RESULTS:Incubation of cells with high concentrations of PA (200,300,400 μmol/L) significantly decreased survival of cells (P<0.05). Incubation of cells with low concentrations of PA (50,100 μmol/L) for 6 and 12 h had no significant effect on cell viability (P>0.05). The basic and insulin-stimulated glucose consumption in these cells were not altered by different concentration of PA incubation for 6 h (P>0.05). However,24 h after the exposure,all concentrations of PA decreased glucose consumption (P<0.05). At 12 h after the exposure,100 μmol/L of PA decreased basic and insulin-stimulated glucose consumption (P<0.05),and this ability remained unchanged after 72 h of continuing cultured. CONCLUSION:Incubation of BRL-3A cells with 100 μmol/L of PA for 12 h could induce insulin resistance in vitro.
【KEY WORDS】palmitic acid;insulin resistance;glucose consumption;glucose oxidase peroxidase
胰島素抵抗(insulin resistance,IR)是指生理劑量胰島素在機體內產生生物學效應低于正常,主要表現為胰島素敏感靶器官(肝臟、骨骼肌及脂肪)對胰島素介導的糖、脂質、蛋白質代謝能力下降。目前公認的“共同土壤”學說認為IR是代謝綜合征、高血壓、高尿酸血癥、2型糖尿病、心腦血管疾病等聚集發病臨床征候群的共同發病基礎[1]。長期IR人群出現心腦血管意外等終點事件的概率明顯高于正常人群。
肝臟作為胰島素作用的靶器官之一,可合成、儲存與釋放糖原,并與脂肪代謝密切相關。高能量飲食可使肝臟減少糖原合成,增加糖異生及肝糖原分解,是形成高血糖的主要原因之一[2-3]。建立IR肝細胞模型有助于在細胞水平和分子水平深入研究IR發生機制。目前IR細胞模型多采用3T3-L1(脂肪細胞)、HepG2(人肝癌細胞)細胞系等,對于常用實驗動物大鼠的正常肝細胞IR模型尚未見報道。本研究采用葡萄糖氧化酶法(glucose oxidase peroxidase,GOD-POD),觀察棕櫚酸(palmitic a cid,PA)誘導大鼠正常肝細胞系(BRL-3A)產 生IR的可能性及穩定性,為研究肝組織IR機制及改善肝組織IR藥物的篩選提供一種簡單可靠的IR細胞模型。
1 材料與方法
1.1 材料與儀器
BRL-3A肝細胞系購自中國科學院上海細胞生物所,RPMI 1640培養基購自Gibco公司,PA、結晶牛胰島素購自Sigma公司,四甲基偶氮噻唑藍[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]購自Amresco公司,新生牛血清購自杭州四季青生物工程材料有限公司,胰蛋白酶、牛血清白蛋白購自西安國安生物科技有限公司,葡萄糖測定試劑盒購自北京普利萊基因技術有限公司。其余常規試劑均為國產分析純。酶標儀為美國TECAN公司的Infinite 200 PRO。
1.2 實驗方法
1.2.1 PA儲備液的配制 用無水乙醇配制200 mmol/L 的PA溶液,再加入溶有牛血清白蛋白的PBS平衡鹽溶液配制成5 mmol/L的PA儲備液,期間振蕩及50 ℃助溶,用0.22 μm孔徑一次性濾器進行過濾分裝后-4 ℃凍存。使用前先取出儲備液放入37 ℃水浴鍋中,解凍并預熱30 min,冷卻至室溫后用無血清RPMI 1640培養液稀釋成所需濃度。
1.2.2 酶標儀的精密度評估及葡萄糖濃度測定的線性范圍驗證 采用10 mmol/L葡萄糖標準品對本實驗檢測儀器Infinite 200 PRO酶標儀的精密度進行評估,結果符合實驗要求。同時按照美國臨床實驗室標準化委員會(Clinical and Laboratory Standards Institute,CLSI)的EP6-A文件[4]《定量測定項目的線性評價》要求驗證葡萄糖濃度測定的線性范圍,結果符合試劑說明書的要求(在0.02~20 mmol/L內葡萄糖濃度與吸光度值呈線性關系,R2>0.99)。
1.2.3 BRL-3A細胞培養 BRL-3A細胞用含10%新生牛血清的RPMI 1640培養液,于37 ℃、飽和濕度、CO2體積分數為5%的條件下培養。隔日換液1次,待細胞生長至匯合度超過90%后,胰酶消化離心后按1∶ 3傳代培養。按每孔1.0×104個接種至96孔培養板,細胞匯合度超過80%時進行分組處理。
1.2.4 實驗分組 實驗分正常對照組、PA組(濃度分別為50、100、200、300、400 μmol/L)及溶劑組(與PA組相對應,乙醇含量分別為0.025、0.05、0.1、0.15、0.2 ml/L),每組設9個復孔。
1.2.5 細胞相對生存率檢測 各組細胞處理完畢(6、12、24 h)后吸棄孔內培養液,每孔加入5 mg/mL的MTT 20 μL,于37 ℃繼續孵育4 h,終止培養,棄上清,每孔加入DMSO 150 μL,置于酶標儀振蕩3 min后,測定490 nm波長處吸光度D(490)值,各處理組細胞相對生存率=各處理組D(490)值/對照組D(490)值×100%。
1.2.6 IR模型的評估 細胞按實驗分組(0、50、100、200、300、400 μmol/L)處理完畢(6、12 、24 h)后吸棄孔內培養液,PBS溶液洗2次,每孔加入100 μL無血清RPMI 1640培養液繼續培養24 h,檢測各孔葡萄糖濃度,計算基礎葡萄糖消耗量。各孔消耗葡萄糖量=空白孔葡萄糖濃度-各孔葡萄糖濃度。
同樣,細胞分組處理后,每組其中5孔加含1×10-7mol/L胰島素的無血清RPMI 1640培養液100 μL,另5孔僅加無血清RPMI 1640培養液100 μL,30 min后吸棄孔內培養液,PBS溶液洗2次,每孔加入100 μL無血清RPMI 1640培養液繼續培養2 h后,檢測各孔葡萄糖濃度,計算胰島素刺激葡萄糖消耗量。各孔消耗葡萄糖量的計算方法同上。
根據Trinder反應原理,葡萄糖在葡萄糖氧化酶(glucose oxidase,GOD)作用下生成葡萄糖酸和過氧化氫,然后用過氧化物酶(peroxidase,POD)催化過氧化氫,使色原物質生成醌亞胺,顏色深淺與葡萄糖濃度呈正比。因此采用GOD-POD法可使用酶標儀簡便測定葡萄糖濃度。
1.2.7 IR模型穩定性評估 綜合1.2.5及1.2.6結果選取合適PA濃度及作用時間點處理BRL-3A細胞建模成功后,吸棄孔內培養液,PBS溶液洗2次,每孔加入100 μL無血清培養液,分別培養24、48、72 h后檢測基礎葡萄糖消耗和胰島素刺激葡萄糖消耗變化。
采用SPSS 20.0軟件對數據進行統計學分析,數據用表示,多組間均數比較采用單因素方差分析,并用LSD-t檢驗進行兩兩比較。以α=0.05為檢驗水準。
2 結 果
2.1 PA對BRL-3A細胞生存率的影響
2.1.1 乙醇對BRL-3A細胞生存率的影響 不同濃度乙醇的溶劑組作用于BRL-3A細胞6、12和24 h后,其相對生存率與正常對照組相比差異無統計學意義(P> 0.05),即溶劑對細胞活性無干擾作用。結果見圖1。
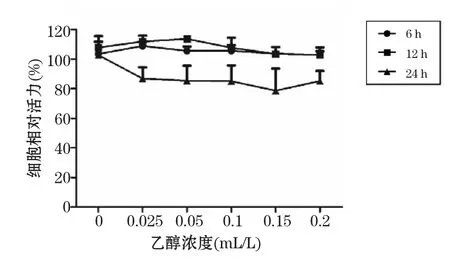
圖1 不同濃度乙醇對BRL-3A細胞相對生存率影響
2.1.2 PA對BRL-3A細胞生存率的影響 50、100 μmol/L的PA作用于BRL-3A細胞不超過12 h,細胞生存率與正常對照組相比差異無統計學意義(P>0.05)。隨PA作用濃度增加和作用時間延長,細胞生存率比正常對照組顯著降低(P<0.05),存在時間及劑量依賴關系。結果提示,用于建模的PA適宜濃度為小于200 μ mol/L,作用時間為12 h。結果見圖2。

與對照組比較,*P<0.05.圖2 不同濃度棕櫚酸對BRL-3A細胞相對生存率影響
2.2 PA對BRL-3A細胞基礎葡萄糖消耗的影響
2.2.1 乙醇對BRL-3A細胞基礎葡萄糖消耗的影響 不同濃度乙醇的溶劑組作用于BRL-3A細胞6、12、24 h后,其葡萄糖消耗與正常對照組相比差異無統計學意義(P>0.05),即溶劑對細胞基礎葡萄糖消耗無明顯影響。結果見圖3。
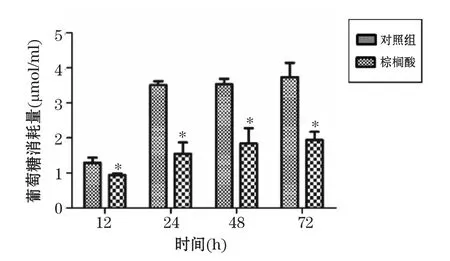
2.2.2 PA對BRL-3A細胞基礎葡萄糖消耗的影響 50 μmol/L的PA作用BRL-3A細胞不同時間(6、12和24 h)后,消耗葡萄糖量與對照組相比差異均無統計學意義(P>0.05)。隨PA濃度增加和作用時間延長,BRL-3A細胞消耗葡萄糖量逐漸下降。100 μmol/L的PA作用12 h,BRL-3A細胞消耗葡萄糖量與正常對照組相比顯著降低(P<0.05)。結合PA對細胞生存率的結果,提示PA建模的適宜濃度為100 μmol/L,適宜作用時間為12 h。結果見圖4。

圖3 不同濃度乙醇對BRL-3A細胞基礎葡萄糖消耗的影響

與對照組比較,*P<0.05.圖4 不同濃度棕櫚酸對BRL-3A細胞基礎葡萄糖消耗的影響
2.3 PA對BRL-3A細胞胰島素刺激葡萄糖消耗的影響
正常對照組細胞在胰島素刺激后葡萄糖消耗量與未刺激時相比明顯增加(P<0.05)。隨PA作用濃度增加及作用時間延長,胰島素刺激后細胞葡萄糖消耗量與同組細胞未刺激時相比差距逐漸下降。PA作用時間超過12 h的細胞,胰島素刺激后葡萄糖消耗量與未刺激時無明顯變化。進一步證實,100 μmol/L的PA作用12 h可誘導BRL-3A細胞產生IR。結果見圖5。
2.4 PA誘導的IR細胞模型穩定性評估
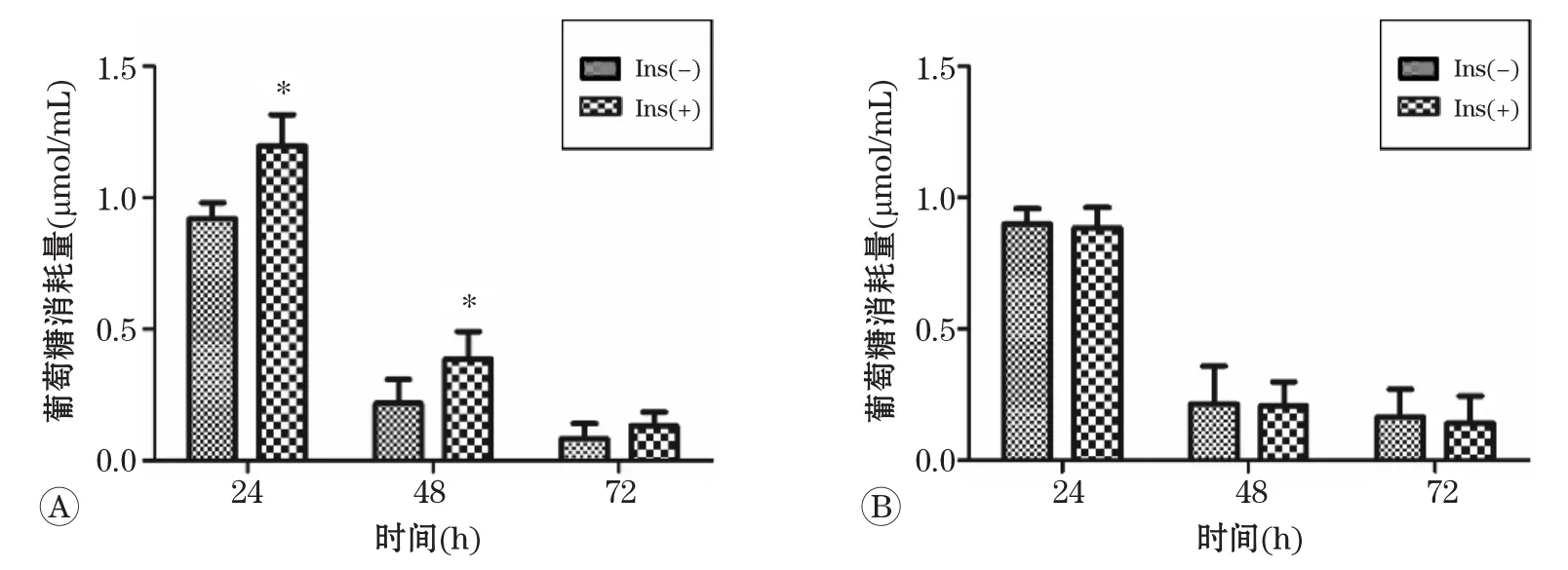
2.4.1 IR模型細胞繼續培養后基礎葡萄糖消耗變化 模型組BRL-3A細胞繼續培養直至72 h,其基礎葡萄糖消耗與正常對照組細胞相比仍較低,且繼續培養不同時間,細胞消耗葡萄糖量無明顯變化(P>0.05),提示在72 h內細胞模型較穩定。結果見圖6。
2.4.2 IR模型細胞繼續培養后胰島素刺激葡萄糖消耗變化 正常對照組在胰島素刺激后細胞消耗葡萄糖量均增加 (P<0.05),模型組細胞繼續培養直至72 h,胰島素刺激后細胞攝糖量與未刺激組無明顯變化(P>0.05),進一步提示在72 h內模型細胞較穩定。結果見圖7。

A:棕櫚酸作用6 h;B:棕櫚酸作用12 h;C:棕櫚酸作用24 h. 與對照組比較,*P<0.05.圖5 不同濃度棕櫚酸作用不同時間對BRL-3A細胞胰島素刺激葡萄糖消耗的影響
與對照組比較,*P<0.05.圖6 IR模型BRL-3A細胞繼續培養不同時間后基礎葡萄糖消耗的變化
3 討 論
IR是多基因遺傳基礎上受環境、精神、飲食、運動等因素綜合作用的結果。具體與肥胖、炎癥、氧化應激、內分泌激素、神經中樞調節等方面有關。近年研究表明,脂肪代謝紊亂,尤其血清游離脂肪酸(free fatty acid,FFA)在非脂肪組織(肝臟、肌肉、腎臟等)的異位沉積是引起IR的始動原因[5-7]。過量FFA被輸送至肝臟、肌肉,引起多種細胞因子(TNF-α、IL-6和PAI-1等)的分泌,巨噬細胞誘導的脂肪分解增強,出現內皮功能異常、高凝狀態、炎性反應增強[2-3,8],活性氧產生大量增加,引起脂肪酸β氧化增加,導致氧化應激損傷,影響胰島素信號通路,造成肝葡萄糖輸出,同時肝糖原合成下降、糖異生增強,肝酶及脂蛋白升高,肝細胞損傷加劇,最終導致非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)的發生[9-10]。而脂肪在胰腺的沉積亦可造成β細胞功能障礙,骨骼肌脂肪沉積可導致胰島素敏感性降低,腎臟的脂質蓄積可改變腎濾過和重吸收功能[11],因此目前人們對于IR機制的認識從“血糖中心論”逐漸轉為“脂肪代謝紊亂中心論”。為研究機體肝細胞IR,目前常用的模型是HepG2細胞系(人肝癌細胞)[12],但HepG2細胞株在氧化應激、信號轉導、細胞代謝等蛋白組學表達均不同于正常細胞[13],決定了它在葡萄糖攝取、糖原、脂質合成研究中存在不足。因此,本研究選取大鼠正常肝細胞系,建立飽和高級脂肪酸誘導的IR模型具有重要意義。
A:正常對照組;B:模型組. 與對照組比較,*P<0.05.圖7 IR模型BRL-3A細胞繼續培養不同時間后對胰島素刺激葡萄糖消耗變化
目前體外實驗中檢測葡萄糖主要采用C、H同位素標記法示蹤[14-19],此法能高靈敏度直接反映糖代謝過程中的葡萄糖轉運、氧化、糖原合成等具體情況,但存在易造成放射性污染、操作不便等不足。臨床檢測血糖常用的GOD-POD法,其采用酶標儀、分光光度計、生化分析儀等常規儀器即可進行,可靈敏、準確地判斷細胞糖攝取能力及評價胰島素敏感性。本研究采用此法對BRL-3A細胞葡萄糖消耗進行定量檢測,評價胰島素敏感性。由于此法為微量檢測,操作中干擾因素多,易出現實驗誤差。故在實驗中均使用同批次配置的無血清RPMI 1640培養液,未額外添加葡萄糖;各種干預結束后均用PBS平衡鹽溶液洗滌后檢測以消除干擾因素(血清、PA、胰島素等)。
隨著PA 作用濃度增大及時間延長,細胞活力及葡萄糖攝取逐漸降低已達成共識,但PA制備模型的濃度因細胞而不同。溫宇等[20]報道,PA濃度達到1.0 mmol/L時才可明顯抑制3T3-L1細胞胰島素刺激下葡萄糖轉運,而高濃度PA可對細胞生存產生明顯抑制。因此本實驗首先檢測了PA對細胞生存率的影響,在排除乙醇溶劑對結果影響后發現,較低濃度PA (50、100 μmol/L)較短時間(6和12 h)作用對細胞生存率無影響,高濃度PA (200、300、400 μmol/L)長時間(24 h)作用后,細胞生存率與對照組相比明顯下降。與韓玲玲等[21]研究PA對細胞生存率的影響基本一致。
本實驗研究了不同作用濃度和時間后細胞基礎葡萄糖消耗變化,發現PA短時間作用(6 h)對細胞基礎葡萄糖消耗無影響,而作用24 h后細胞耗糖量明顯下降,但因長時間作用對細胞生存率影響較大,故6 h、24 h兩個時間點均不適合用于建模,PA作用12 h結果提示,100、200、300、400 μmol/L的PA可使細胞基礎葡萄糖消耗量下降,結合細胞生存率實驗結果表明,100 μmol/L的PA作用12 h可作為BRL-3A細胞誘導IR的建模條件。IR一旦產生,則模型除基礎葡萄糖消耗會減少,還會對胰島素敏感性下降,表現為胰島素介導的葡萄糖消耗減低。因此,我們還用胰島素誘導的葡萄糖消耗實驗進一步驗證PA是否可誘導BRL-3A細胞產生IR。結果證實,候選IR建模條件處理的細胞在胰島素刺激后葡萄糖消耗并不增加,另外隨濃度增大、作用時間延長,細胞對胰島素介導的葡萄糖攝取能力逐漸下降。故兩種方法均證實100 μmol/L濃度的PA作用12 h可誘導細胞產生IR。
對IR細胞模型的穩定性進行評估有利于進一步對IR機制及相關藥物進行研究。因此,本研究最后還探討了模型的穩定性。結果表明,建模后更換正常培養液培養至72 h,細胞基礎和胰島素刺激葡萄糖消耗均無明顯變化。提示該模型在正常培養72 h內可保持穩定。因此,本研究成功建立了PA誘導的BRL-3A細胞胰島素抵抗模型,為研究肝臟IR發生機制及改善肝臟IR的藥物篩選提供了實驗依據。
參考文獻
[1] Reaven GM. Banting lecture 1988:Role of insulin resistance in human disease[J]. Diabetes,1988,37(12):1595-1607.
[2] Chen X,Iqbal N,Boden G. The effects of free fatty acids on gluconeogenesis and glycogenolysis in normal subjects[J]. J Clin Invest,1999,103(3):365-372.
[3] Tarcin O,Bajaj M,Akalin S. Insulin resistance,adipocyte biology,and thiazolidinediones:a review[J]. Metab Syndr Relat Disord,2007,5(2):103-115.
[4] Tholen DW,Kroll M,Astles JR,et al. Evaluation of the linearity of quantitative measurement procedures:a statistical approach approved guideline CLSI document EP6-A[S]. Wayne,Pa:CLSI,2003:1-60.
[5] Jacob S,Machann J,Rett K,et al. Association of increased intramyocellular lipid content with insulin resistance in lean nondiabetic offspring of type 2 diabetic subjects[J]. Diabetes,1999,48(5):1113-1119.
[6] Johannsen DL,Tchoukalova Y,Tam CS,et al. Effect of 8 weeks of overfeeding on ectopic fat deposition and insulin sensitivity:testing the“adipose tissue expandability” hypothesis [J]. D iabetes Care,2014,37(10):2789-2797.
[7] Masoodi M,Kuda O,Rossmeisl M,et al. Lipid signaling in adipose tissue:Connecting inflammation & metabolism[J]. Biochim Biophys Acta,2015,1851(4):503-518.
[8] Shulman GI. Ectopic fat in insulin resistance,dyslipidemia,and cardiometabolic disease[J]. N Engl J Med,2014, 371 (12):1131-1141.
[9] Gaggini M,Morelli M,Buzzigoli E,et al. Non-alcoholic fatty liver disease (NAFLD) and its connection with insulin resistance,dyslipidemia,atherosclerosis and coronary heart disease[J]. Nutrients,2013,5(5):1544-1560.
[10] Gruben N,Shiri-Sverdlov R,Koonen DP,et al. Nonalcoholic fatty liver disease:A main driver of insulin resistance or a dangerous liaison?[J]. Biochim Biophys Acta, 2014,1842 (11):2329-2343.
[11] Guebre-Egziabher F,Alix PM,Koppe L,et al. Ectopic lipid accumulation:A potential cause for metabolic disturbances and a contributor to the alteration of kidney function[J]. Biochimie,2013,95(11):1971-1979.
[12] Tatarczyk T,Ciardi C,Niederwanger A,et al. Postprandial triglyceride-rich lipoproteins induce hepatic insulin resistance in HepG2 cells independently of their receptor-mediated cellular uptake[J]. Mol Cell Endocrinol,2011,343(1/2):71-78.
[13] 鎖愛莉,姚 煜,張王剛. 人肝癌細胞HepG2和人正常肝細胞7702的差異蛋白質組學研究[J]. 西安交通大學學報:醫學版,2011,32(5):545-549.
[14] Yin J,Gao Z,Liu D,et al. Berberine improves glucose
metabolism through induction of glycolysis[J]. Am J Physiol Endocrinol Metab,2008,294(1):148-156.
[15] Regazzetti C,Peraldi P,Gremeaux T,et al. Hypoxia decreases insulin signaling pathways in adipocytes[J]. Diabetes,2009,58(1):95-103.
[16] Anil KK,Marita AR. Troglitazone prevents and reverses dexamethasone induced insulin resistance on glycogen synthesis in 3T3 adipocytes[J]. Br J Pharmacol,2000,130(2):351-358.
[17] Gao Y,Yang MF,Su YP,et al. Ginsenoside Re reduces insulin resistance through activation of PPAR-gamma pathway and inhibition of TNF-alpha production[J]. J Ethnopharmacol,2013,147(2):509-516.
[18] Nobuhara M,Saotome M,Watanabe T,et al. Mitochondrial dysfunction caused by saturated fatty acid loading induces myocardial insulin-resistance in differentiated H9c2 myocytes:a novel ex vivo myocardial insulin-resistance model[J]. Exp Cell Res,2013,319(7):955-966.
[19] Yoon EK,Jeong YT,Li X,et al. Glyceollin improves endoplasmic reticulum stress-induced insulin resistance through CaMKK-AMPK pathway in L6 myotubes[J]. J Nutr Biochem,2013,24(6):1053-1061.
[20] 溫 宇,王宏偉,盧慧玲,等. 脂肪酸誘導的3T3-L1脂肪細胞胰島素抵抗的研究[J]. 中國病理生理雜志,2007,23(3):543-547.
[21] 韓玲玲,李 佳,陳 穎,等. 高脂環境對大鼠成肌細胞糖脂代謝的影響[J]. 中國病理生理雜志,2011,27(11):2156-2159.
基金項目:國家自然科學基金(31170807)
收稿日期:2015-07-03;
修訂日期:2015-12-16
中圖分類號:R587.1
文獻標志碼:A
文章編號:1004-616X(2016)01-0046-06
doi:1 0.3969/j.issn.1004-616x.2016.01.010

