高黏度熱聚合乳清分離蛋白-三聚磷酸鈉的研制及其性質
解思雨,侯俊財,馮憲民,肖洪亮,王 利,王占東,王青云,程建軍※(. 東北農業大學食品學院,哈爾濱50030; . 黑龍江省完達山乳業股份有限公司,哈爾濱 50060)
?
高黏度熱聚合乳清分離蛋白-三聚磷酸鈉的研制及其性質
解思雨1,侯俊財1,馮憲民1,肖洪亮2,王利2,王占東2,王青云2,程建軍1※
(1. 東北農業大學食品學院,哈爾濱150030;2. 黑龍江省完達山乳業股份有限公司,哈爾濱 150060)
摘要:為了探究三聚磷酸鈉(sodium tripolyphosphate, STPP)及熱改性條件對乳清分離蛋白(whey protein isolate, WPI)聚合物性質的影響,該研究通過單因素和Box-Behnken優化試驗進行工藝優化;利用熒光分光光度計、旋轉流變儀、激光粒度分析儀和電子掃描顯微鏡對乳清分離蛋白聚合物性質進行研究。結果表明:在質量分數為10% WPI、0.09% STPP、90℃和pH值8.40條件下,熱聚合反應42 min,WPI-STPP熱聚合物黏度高達5 083 mPa·s。對WPI-STPP熱聚合物性質分析發現:與空白、WPI熱聚合體相比,WPI-STPP熱聚合物的持水性顯著提高(P<0.05);表面疏水性有顯著增加(P<0.05)。WPI-STPP熱聚合物粒徑((292.09±2.17) μm)顯著增大(P<0.05),且表現出較高的彈性模量。WPI-STPP熱聚合物具有較大片狀微觀結構且呈不規則性,這有利于黏度的增大。研究結果為改性乳清蛋白及其在酸奶方面的應用提供理論依據與技術參考。
關鍵詞:黏度;凝膠;優化;乳清分離蛋白;三聚磷酸鈉;熱聚合
解思雨,侯俊財,馮憲民,肖洪亮,王利,王占東,王青云,程建軍. 高黏度熱聚合乳清分離蛋白-三聚磷酸鈉的研制及其性質[J]. 農業工程學報,2016,32(2):287-293.doi:10.11975/j.issn.1002-6819.2016.02.041http://www.tcsae.org Xie Siyu, Hou Juncai, Feng Xianmin, Xiao Hongliang, Wang Li, Wang Zhangdong, Wang Qingyun, Cheng Jianjun. Preparation and characters of whey protein isolate-sodium tripolyphosphate aggregates by heating [J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(2): 287-293. (in Chinese with English abstract)doi:10.11975/j.issn.1002-6819.2016.02.041http://www.tcsae.org
0 引 言
乳清蛋白作為干酪生產的副產物,因其具有較高的營養價值和良好的功能特性,逐漸引起人們重視[1]。但由于其具有較小的、近乎球狀的蛋白顆粒,不能以傳統的增稠劑利用[2]。通過熱聚合改性使乳清蛋白分子顆粒增大,可使其蛋白溶液的有效動力學體積分數增大,從而提高其黏度,以進一步應用于食品加工中來改善產品的黏稠程度[3]。
熱聚合改性技術的改性效果主要受乳清蛋白濃度、pH值、離子強度以及熱處理方式的影響[4-8]。李鐵紅等[9]對乳清蛋白熱改性進行研究,提出了熱聚合技術生產乳清蛋白膠黏性產品可理論上替代果膠。郭明若等發明了一種利用乳清分離蛋白(whey protein isolate, WPI)在堿性條件下熱聚合制備酸奶結構改良劑及酸奶的制備方法[10]。Britten等[11]將乳清蛋白聚合物加入到中性的牛奶中,與脫脂乳粉樣品相比,在發酵過程中聚合物交聯使酸奶的黏度從393 mPa·s提高到了813 mPa·s,持水性也由7.2 mL/g增至19.8 mL/g,進而提高發酵酸奶的質地。
Enomoto等[12]對糖基化β-乳球蛋白進行磷酸化,結果表明,β-乳球蛋白的熱穩定性和乳化性都有所改善。還有研究指出雞蛋蛋白和大豆乳清蛋白干法磷酸化反應1~5 d,其功能特性得到提高[13-14];磷酸根離子會提高熱凝膠的硬度,彈性等凝膠性質[15-16]。由于引進了磷酸根基團,磷酸化蛋白質體系的電負性增強,提高了蛋白質分子之間的靜電斥力,使之在食品體系中更易分散,相互排斥,因而提高了溶解度和聚結穩定性[17]。但上述研究中,干法磷酸化后蛋白體現出熱凝膠狀態(heat-set gel),在酸奶生產中無法應用;且反應時間較長,與濕法磷酸化相比,生產效率較低。
本研究以乳清分離蛋白和三聚磷酸鈉為原料,采用濕法制備WPI-STPP熱聚合物,縮短反應時間,提高生產效率。并通過黏度、表面疏水性、流變特性和微觀結構等指標分析濕法改性WPI-STPP熱聚合物性質。探討乳清蛋白可溶性聚合物(soluble aggregates)形成規律,揭示磷酸化與熱改性對其結構與性質的影響,進而改善酸奶的質地結構,為磷酸化熱改性乳清蛋白替代果膠在酸奶中的應用提供參考。
1 試驗材料
1.1原料和主要試劑
乳清分離蛋白(蛋白質質量分數為82.03%±1.27%,水分6.88%±0.16%,脂肪6.00%±0.02%,灰分2.58%±0.01%)購于恒天然乳品集團;三聚磷酸鈉(sodium tripolyphosphate, STPP)及其他試劑均為分析純。
1.2主要儀器設備
S-3400N電子掃描顯微鏡(日本HITACHI公司),MASTERSIZER-2000型激光粒度分析儀(英國Malvern公司),F-4500熒光分光光度計(日本日立公司),旋轉流變儀(英國Malvern公司),FD5-4型冷凍干燥機(美國SIM公司),NDJ-5S數字式黏度計(上海精密科學儀器有限公司)等。
2 試驗方法
2.1熱聚合物的制備
WPI-STPP熱聚合物:把一定量的STPP加入到WPI溶液中,室溫(25±1)℃下磁力攪拌3 h,調溶液pH值,一定溫度下熱聚合不同時間,取出于冰水浴中迅速冷卻到室溫(25±1)℃,制得的樣品于室溫下待測。部分樣品-50℃冷凍干燥,過80目篩,待測。
WPI熱聚合體:質量分數為10% WPI溶液,室溫下磁力攪拌3 h,調溶液pH值為8.4,90℃熱聚合42 min,迅速于冰水浴中冷卻至室溫(25±1)℃。部分樣品冷凍干燥,過80目篩,待測。
空白:10%WPI溶液,室溫下磁力攪拌3 h。部分樣品冷凍干燥,過80目篩,待測。
2.2聚合條件對WPI-STPP熱聚合物黏度的影響
WPI質量分數分別選擇8.0%、8.5%、9.0%、9.5%、10.0%和10.5%,加熱溫度分別選擇70、75、80、85、90 和95℃,pH值分別選擇7.0、7.5、8.0、8.5和9.0,STPP質量分數分別選擇0.03%、0.05%、0.07%、0.09%和0.11%,加熱時間分別選擇20、30、40、50和60 min。以黏度為指標優化出較佳聚合條件。黏度測定:參考Wang等[18]的方法,用NDJ-5S數字式旋轉黏度計測量所得樣品黏度值。
2.3WPI-STPP熱聚合物工藝條件的Box-Behnken 優化
根據單因素試驗結果,采用Box-Behnken模型設計試驗,因素水平編碼見表1。

表1 Box-Behnken模型設計因素水平編碼Table 1 Factors and levels of Box-Behnken experiment design
2.4WPI-STPP熱聚合物性質及結構組成分析
溶解度的測定:參照Lawal等[19]方法。稱取0.50 g各干燥樣品,用蒸餾水定容至50 mL,磁力攪拌2 h。然后25℃條件下離心12 000 g×30 min,采用凱氏定氮法測定上清液中的蛋白質量。

持水性的測定:參考美國谷物化學家協會方法(america association of cereal chemist, AACC 88-04)。稱取2.00 g干燥粉樣(W1,g),放入已知質量(W2,g)的50 mL離心管內,加入20 mL蒸餾水,振蕩混合均勻,靜置10 min,25℃條件下,4 000 g離心20 min,取出,移去上清液,稱量(W3,g)。持水性(WHC)表示為每克蛋白的含水量
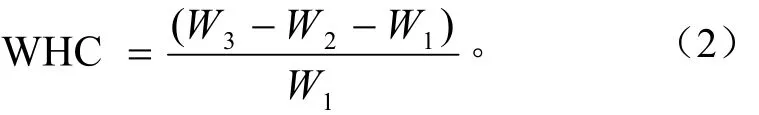
表面疏水性的測定:參照Wagner等[20]的方法。利用1-苯胺基-8-萘磺酸(1-anilino-8-naphthalene-sulfonate,ANS)作為熒光探針測定樣品的表面疏水性。用蒸餾水稀釋成不同濃度的樣品溶液,使溶液中蛋白濃度控制在0.005~0.1 mg/mL。取20 μL ANS(8.0 mmol/L)溶液加到7.0 mL樣品溶液中,混合均勻,并于室溫下避光10 min。在激發波長390 nm、發射波長470 nm以及狹縫5 nm的條件下進行測定。以熒光強度值對蛋白溶液濃度作圖,記斜率為蛋白質的表面疏水性指數,表示表面疏水性。
流變學性質的測定:參照Purwanti等[21]方法。剪切應力(τ)和表觀黏度(η)測試:選用夾具為直徑60 mm的平行板,平行板間距為500 μm,剪切速率(γ)為1~300 s-1,測試溫度設為25℃。黏彈性測試:測試樣經4℃冷置過夜(12 h),測試前置于室溫(25℃)環境中平衡1 h。選用夾具為直徑60 mm的平行板,平行板間距為500 μm。選擇一定應力(預試驗所得),在頻率范圍0.1~10 Hz下進行動態頻率掃描測試,記錄測試樣的黏性模量(G″)和彈性模量(G′),以黏、彈性模量對頻率作圖。
粒度分析:參考Sa?lam等[22]方法。凍干樣品顆粒吸收率為0.1,同時用超純水做分散劑,其折射率為1.33。
電鏡掃描分析:參考Helen等[23]方法。將干燥樣品進行粘臺處理,放入離子濺射鍍射儀中經15 min的減壓處理后,對樣品離子濺射鍍膜約10 min,最后將樣品移至掃描電鏡中觀察并取相。
2.5統計分析
試驗數據分析采用Design expert 7.0、SPSS11.5、Microsoft Excel分析軟件,Origin7.5繪圖軟件。試驗重復3次,數據以平均值±標準差的形式表示。
3 結果與分析
3.1聚合條件對WPI-STPP熱聚合物黏度影響分析
3.1.1WPI質量分數對WPI-STPP熱聚合物黏度的影響
蛋白濃度越大,形成的熱聚合體越大,從而黏度增大[24-25],而且較大的聚合蛋白顆粒則更有利于后續冷凝膠的形成。WPI質量分數在9.5%~10%時,黏度由71 mPa·s增加到1 643 mPa·s,提高了22倍。如圖1a所示,當濃度繼續增大時,WPI-STPP熱聚合物呈凝膠態,10%為較佳濃度。高濃度蛋白溶液中蛋白分子的分布較密集,蛋白與蛋白之間的相互聚合占主導[3]。同時,加入的三聚磷酸鈉可能與加熱展開的蛋白分子間相互作用,使其更易聚合成較大顆粒,使黏度增加,表現出NaCl與WPI熱處理時的作用一致[26-27]。
3.1.2加熱溫度對WPI-STPP熱聚合物黏度的影響
溫度對WPI-STPP熱聚合物黏度的影響見圖1b。90℃時,乳清蛋白聚合物黏度達到4 577 mPa·s(高黏度液體),當溫度升高到95℃時,聚合物黏度達到6 030 mPa·s(凝膠狀),表現出呈倍數增長的趨勢,因此熱聚合溫度選擇在90℃為宜。隨著溫度的增加,乳清蛋白分子間熱聚合程度更為劇烈,蛋白分子展開加速,而展開的蛋白結構更有利于進一步聚合,從而黏度不斷增大[28]。Kiokias 等[29]研究發現75~90℃是β-乳球蛋白和α-乳白蛋白變性的穩定平衡階段,磷酸鹽(STPP)使得WPI的變性溫度提高,提高溫度使蛋白間的聚合作用顯著增加,這類似于WPI熱處理時NaCl的加入[30]。
3.1.3pH值對WPI-STPP熱聚合物黏度的影響
隨著pH值的增加,WPI-STPP熱聚合物的黏度增大(圖1c),當pH值達到9.0時,乳清蛋白聚合物黏度達到8 530 mPa·s(凝膠狀)。黏度在pH值7.5時降至最低,這可能是由于STPP在偏堿性環境中與乳清蛋白發生了化學磷酸化作用有關[17]。蛋白磷酸化是磷酸基團與蛋白質氨基間的化學反應,隨著自由氨基的減少,引入的磷酸根會使乳清蛋白表面的陰離子增多,靜電斥力增加有利于蛋白分子的分散和穩定[17]。在遠離WPI等電點的環境中,聚合物黏度增加的更快,因為在高pH值環境的蛋白聚合中二硫鍵的作用變得更重要[31],當pH值進一步增大時易形成三維網狀結構的凝膠[32]。
3.1.4STPP質量分數對WPI-STPP熱聚合物黏度的影響
根據GB2760-2011《食品添加劑使用標準》中規定磷酸根在食品中的添加量最多為0.5%,本試驗選取的STPP添加量符合國標的添加標準。隨著STPP質量分數的增加,WPI-STPP熱聚合物蛋白黏度呈現增加的趨勢,較高的聚合能力有利于凝膠三維網絡結構的形成。如圖1d所示,當STPP質量分數達到0.09%時,聚合物黏度較大;當STPP質量分數達到0.11%時,流動性較差。作為一種金屬離子螯合劑和pH值調節劑,STPP的添加促進了乳清蛋白分子間的聚合[33]。
3.1.5加熱時間對WPI-STPP熱聚合物黏度的影響
如圖1e所示,隨加熱時間的延長,WPI-STPP熱聚合物黏度不斷增大,長時間的熱處理會使聚合更加完全,聚合物顆粒增大,數量增多。20 min熱處理和30 min的處理無顯著差異(P<0.05),其后,隨加熱時間延長,黏度則顯著增加,加熱處理50 min,黏度值達4 930 m Pa·s;當加熱60 min時,樣品出現凝膠狀態。預試驗結果發現熱處理時間較短,WPI不能完全變性展開以相互聚合,因此蛋白分子的變性和展開與加熱時間有關,當時間達到臨界值時,才會有較好的聚合而不形成凝膠的效果。隨時間的增加,WPI-STPP熱聚合物黏度增加,這與Kulmyrzaev等[34]研究結果一致。
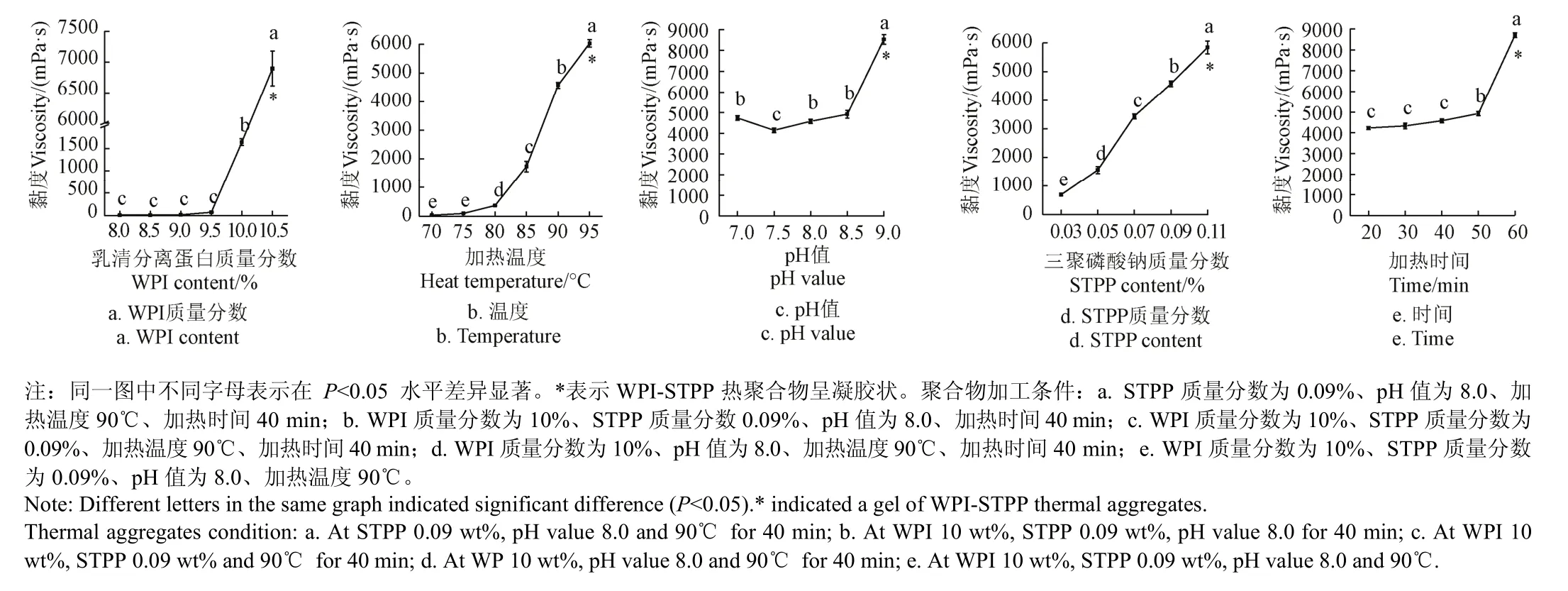
圖1 聚合條件對WPI-STPP熱聚合物黏度的影響Fig.1 Effects of aggregation factors on viscosity of WPI-STPP thermal aggregates
3.2不同黏度WPI-STPP熱聚合物的工藝條件優化
3.2.1模型建立與顯著性檢驗
以溫度、pH值、STPP質量分數和時間為因子,乳清蛋白質量分數為10%,以黏度為響應值,采用Box-Behnken模型設計試驗方案(表2)。
Box-Behnken響應面優化設計的方差分析見表3。試驗中所得模型的決定系數R2=0.9855。由表3分析可知,本研究所得回歸模型極顯著(P<0.0001),此模型可行。剔除差異不顯著的因子后,得到的回歸方程為:
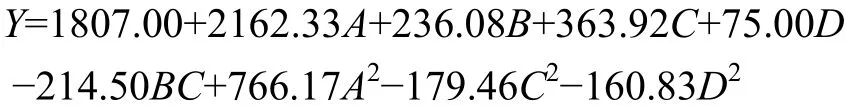
失擬項P值=0.0909>0.05,差異不顯著。模型R2為0.9855,擬合度>90%,說明模型能夠反應響應值(黏度)的變化。回歸方程的回歸系數影響其黏度,其絕對值的大小直接體現黏度受各因素影響的大小。
3.2.2最適條件和回歸模型的驗證
由響應面和實際生產條件求得的高黏度最佳工藝參數是加熱溫度90℃,pH值為8.40,STPP質量分數為0.09%以及時間為42 min時,預測值為4 954 mPa·s,實測值為(5 083±190) mPa·s,相對誤差為2.60%。說明本試驗得到的回歸模型能較好的應用于高黏度WPI-STPP熱聚合物制備參數和黏度的預測。
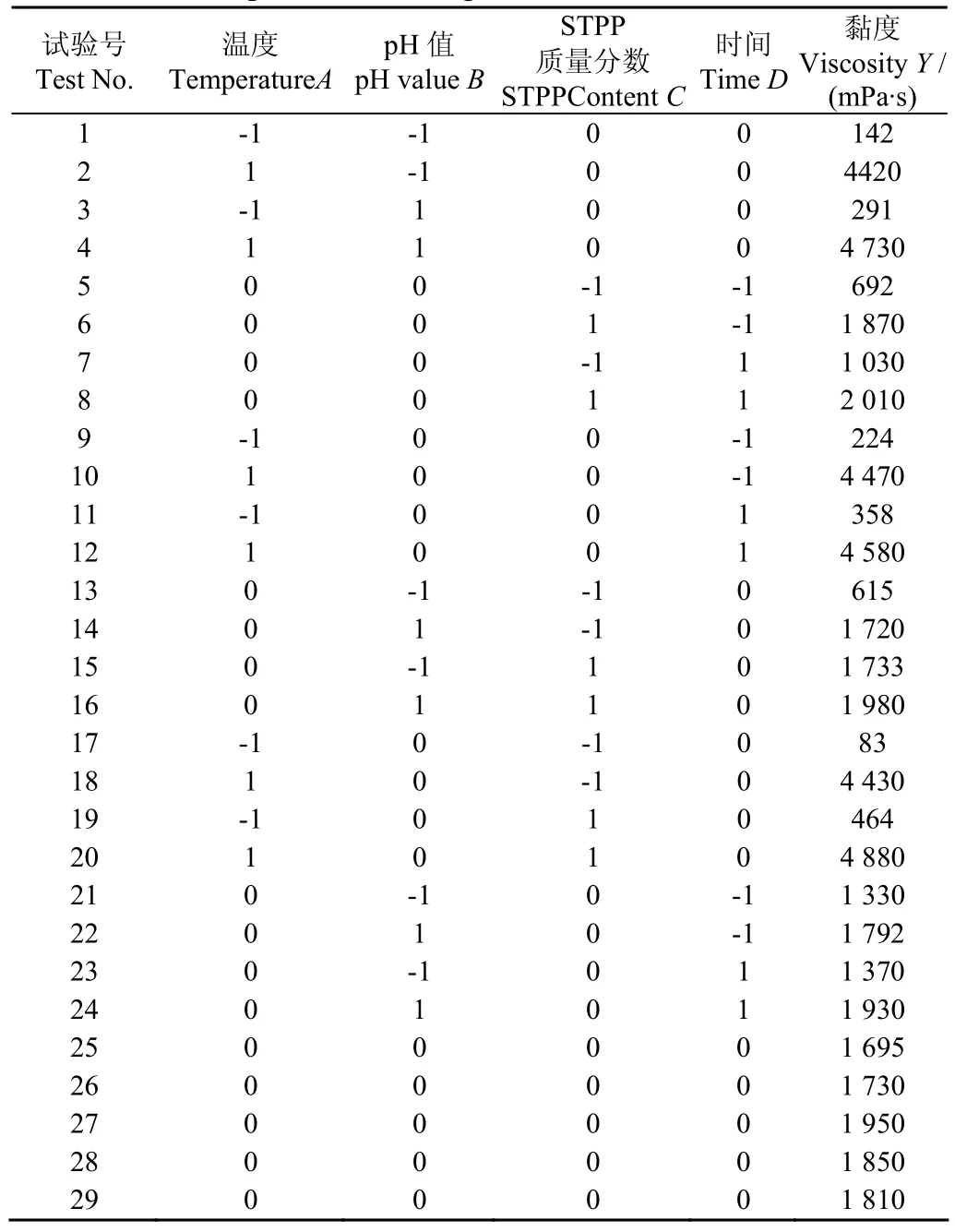
表2 Box-Behnken設計和響應值Table 2 Experimental design and results of Box-Behnken
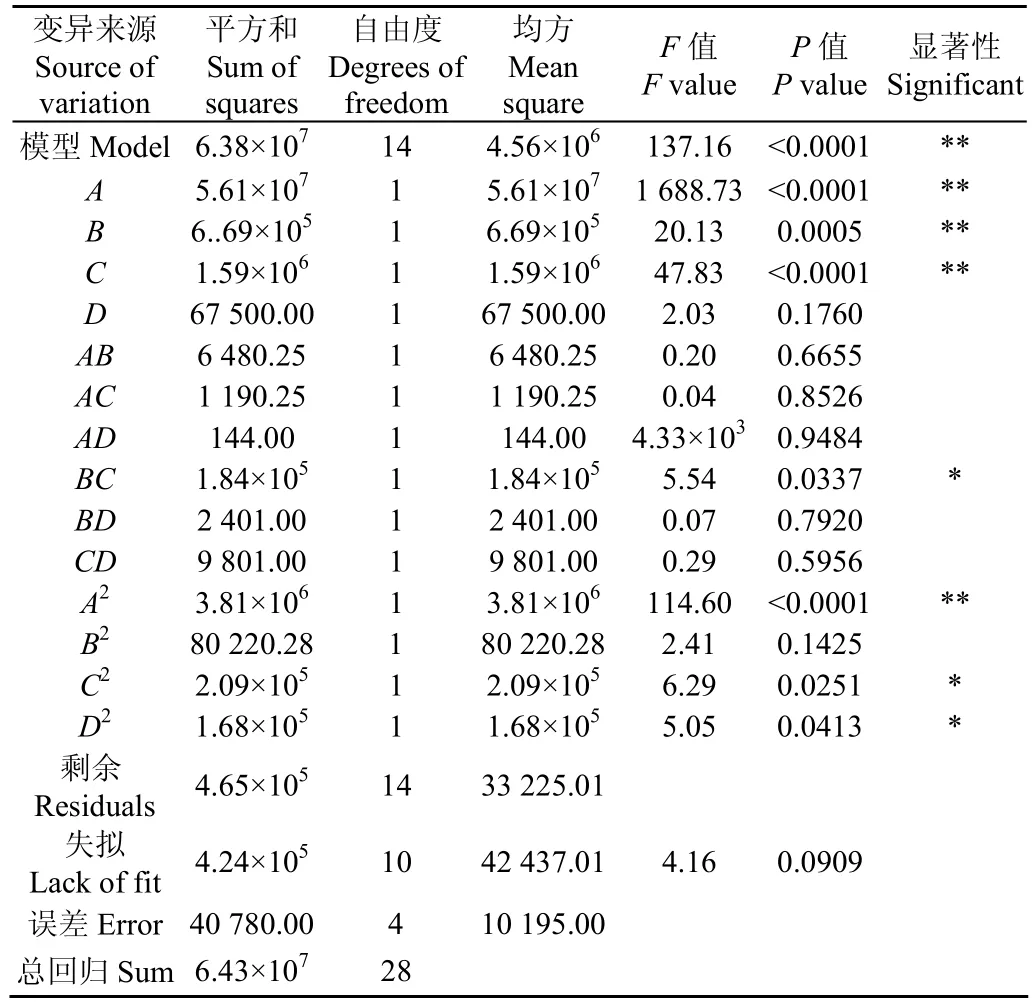
表3 Box-Behnken設計方差分析表Table 3 Analysis of variance of regression parameters for Box-Behnken design model
3.3WPI-STPP熱聚合物性質測定及結構組成分析
3.3.1WPI-STPP熱聚合物溶解度測定
由表4可知,與WPI原樣相比,WPI-STPP熱聚合物和WPI熱聚合體的溶解度都有顯著下降,溶解度由空白的88.50%分別降到了34.5%和23.0%。WPI-STPP熱聚
合物溶解度比WPI熱聚合體的高(P<0.05),說明三聚磷酸鈉的添加有利于蛋白溶解度的增加。研究表明,離子環境可以影響蛋白聚合物之間的相互作用,添加STPP形成的高離子強度環境通過增加蛋白的水合作用從而增加WPI的溶解性[35],因此,WPI-STPP熱聚合物的溶解度較純熱處理的蛋白樣高。同時,一部分的磷酸化作用也會引入磷酸基團,增加乳清蛋白分子間的靜電斥力,提高了蛋白的溶解性,但效果不明顯。
3.3.2WPI-STPP熱聚合物持水性測定
如表4所示,空白的持水性未測出,蛋白天然構象不會束縛大量的水。而WPI-STPP熱聚合物的持水性顯著高于WPI熱聚合體(P<0.05)。熱聚合引起持水性增加可能是蛋白多肽鏈展開的同時,活性氨基酸側鏈基團暴露[36]。STPP的加入使持水性增加較多,一是蛋白聚合顆粒較大,呈不規則片狀的蛋白結構吸水更多;二是引入的磷酸根會造成蛋白質分子的表面形狀和表面電荷的變化,這些變化對蛋白質的水化層及蛋白分子間的作用力都將產生較大的影響[24]。
3.3.3WPI-STPP熱聚合物表面疏水性測定
加熱促進蛋白粒子展開,大量疏水基團暴露,如表4所示,WPI-STPP熱聚合物的表面疏水性最大,說明三聚磷酸鈉的加入可能使蛋白形態和疏水性氨基酸發生更大的變化,導致了乳清分離蛋白的組成也發生了變化。疏水性的增加能使蛋白綁定脂肪能力增加[37],這也驗證了3.3.2節中的結果。
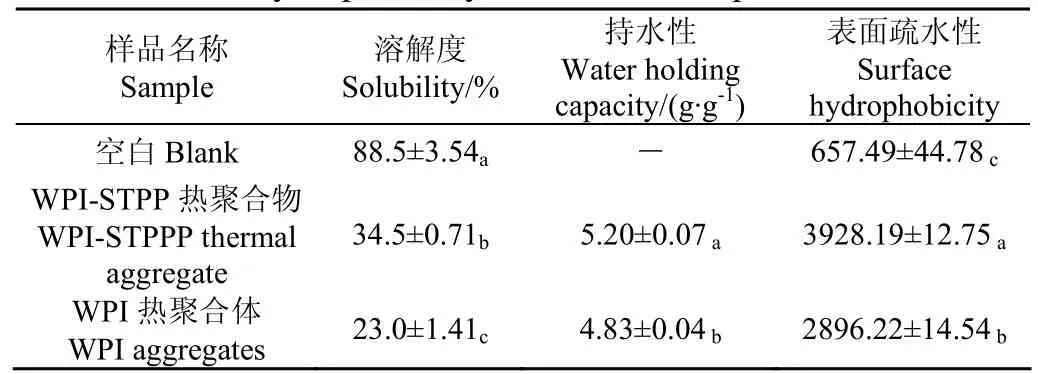
表4 不同處理樣品的性質比較Table 4 Solubility, water holding capacity and surface hydrophobicity of different samples
3.4WPI-STPP熱聚合物流變性質測定
3.4.1剪切應力與表觀黏度
WPI-STPP熱聚合物剪切應力變化如2a所示,根據冪律模型[38-39],空白組、WPI-STPP熱聚合物和WPI熱聚合體均表現出非牛頓流體的性質。
如圖2b隨著剪切速率的增加,3種樣品的表觀黏度都有下降的趨勢。與空白相比,WPI-STPP熱聚合物和WPI熱聚合體剪切稀釋作用明顯。WPI-STPP熱聚合物剪切應力以及表觀黏度的增加與蛋白變性及聚合物的形成有關,流體半徑增加,表觀出較好的流變性。
3.4.2黏彈性
如圖2c隨著掃描頻率的增加,樣品的彈性模量(G′)和黏性模量(G″)都有增加的趨勢。WPI-STPP熱聚合物的彈性模量始終大于其黏性模量,表現出較好的微凝膠結構特性。而WPI熱聚合體綜合表現出流體的特性。在STPP存在時,展開的乳清分離蛋白間排斥力進一步減少,促進了蛋白間的更大的聚合反應,因此冷置時易形成微凝膠狀態,G′大于G″,表現出似固體的彈性性質[40]。
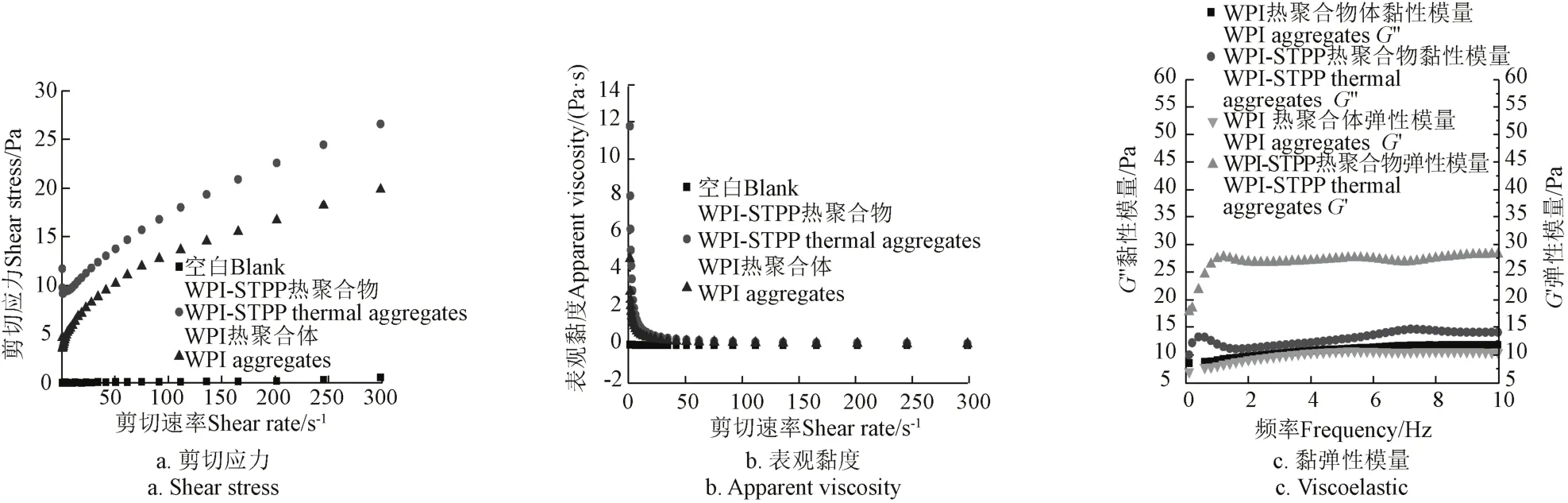
圖2 不同樣品的剪切應力、表觀黏度和黏彈性模量比較Fig.2 Shear stress, apparent viscosity and viscoelastic graph of different samples
3.5WPI-STPP熱聚合物粒度分析
圖3顯示,WPI-STPP熱聚合物的平均粒徑為((292.09±2.17)μm),與WPI熱聚合體((269.89±10.16)μm)和空白組((31.39±1.81 μm)相比,差異顯著(P<0.05)。有研究表明,粒徑大小與黏度呈正相關關系[41]。STPP的加入有效地屏蔽了電荷或降低了電荷密度,增大了WPI顆粒。

圖3 不同樣品的粒度分布比較Fig.3 Particle size distribution of different samples
3.6WPI-STPP熱聚合物掃描電鏡分析
從圖4a中可以看出空白顆粒形狀呈球形,是典型的的乳清蛋白;WPI經熱改性4c后,顆粒形狀由球形變成不規則的碎片狀,顆粒大小不一,碎片松散;WPI-STPP熱聚合4b后,片狀顆粒直徑大于圖4c中WPI熱聚合體的顆粒。長線型和不規則的碎片狀聚合體有利于溶液黏度的增加以及制備冷凝膠[42],因此,在所測樣品中,WPI-STPP熱聚合物黏度最大。

圖4 不同樣品的掃描電鏡圖譜比較(×500)Fig.4 Scanning electron microscopic images of different samples
4 結 論
1)通過單因素試驗確定了各因素對乳清蛋白-三聚磷酸鈉(whey protein isolate-sodium tripolyphosphate,WPI-STPP)熱聚合物黏度的影響規律,用Box-Behnken分析法對各因素的最佳水平范圍及其交互作用進行研究和建立了預測WPI-STPP熱聚合物黏度的二次多項式數學模型,并得到最佳制備工藝條件:WPI質量分數為10%,加熱溫度為90℃,pH值為8.40,STPP質量分數為0.09%以及加熱時間為42 min,黏度值達5 083 mPa·s,回歸模型擬合情況較好(R2=0.9855)。
2)通過流變儀、粒徑分析儀以及掃描電鏡對WPI-STPP熱聚合物性質分析,WPI-STPP溶解度(34.5%)、持水性(5.20 g/g)、表面疏水性(3 928.19)、平均粒徑(292.09±2.17)μm(P<0.05),流變學特性都較空白組和熱聚合WPI有所改善。
[參考文獻]
[1] Madureira A R, Tavares T, Gomes A M P, et al. Invited review: Physiological properties of bioactive peptides obtained from whey proteins[J]. J Dairy Sci, 2010, 93(2): 437-455.
[2] Vardhanabhuti B, Foegeding E A. Rheological properties and characterization of polymerized whey protein isolates[J]. J Agr Food Chem, 1999, 47(9): 3649-3655.
[3] Bryant C M, McClements D J. Optimizing preparation conditions for heat-denatured whey protein solutions to be used as cold-gelling ingredients[J]. J Food Sci, 2000, 65(2): 259-263.
[4] Nicolai T, Britten M, Schmitt C. β-Lactoglobulin and WPI aggregates: Formation, structure and applications[J]. Food Hydrocolloid, 2011, 25(8): 1945-1962.
[5] Jung J M, Savin G, Pouzot M, et al. Structure of heat-induced β-lactoglobulin aggregates and their complexes with sodium-dodecyl sulfate[J]. Biomacromolecules, 2008, 9(9): 2477-2486.
[6] Gulzar M, Bouhallab S, Jeantet R, et al. Influence of pH on the dry heat-induced denaturation/aggregation of whey proteins[J]. Food Chem, 2011, 129(1): 110-116.
[7] Ryan KN, Vardhanabhuti B, Jaramillo DP. Stability and mechanism of whey protein soluble aggregates thermally treated with salts[J]. Food Hydrocolloid, 2012, 2(27): 411-420.
[8] Vardhanabhuti B, Allen Foegeding E. Effects of dextran sulfate, NaCl, and initial protein concentration on thermal stability of β-lactoglobulin and α-lactalbumin at neutral pH[J]. Food Hydrocolloid, 2008, 22(5): 752-762.
[9] 李鐵紅,戴顯祺,史亞麗. 功能型乳清蛋白熱改性技術的研究與應用[J].中國乳業,2009(1):50-52. Li Tiehong, Dai Xianqi, Shi Yali. Research and application of thermal modification of whey protein[J]. China Dairy,2009(1): 50-52. (in Chinese with English abstract)
[10] 郭明若,張鐵華,高峰,等. 一種酸奶結構改良劑及酸奶的制備方法:中國專利,102696758A. [P]. 2012-10-03.
[11] Britten M, Giroux H J. Acid-induced gelation of whey protein polymers: Effects of pH and calcium concentration during polymerization[J]. Food Hydrocolloid, 2001, 15(4): 609-617.
[12] Enomoto H, Li C P, Morizane K. Glycation and phosphorylation of β-lactoglobulin by dry-heating: Effect on protein structure and some properties[J]. J Agr Food Chem,2007, 55(6): 2392-2398.
[13] Li C P, Chen D, Peng J, et al. Improvement of functional properties of whey soy protein phosphorylated by dry-heating in the presence of pyrophosphate[J]. LWT-Food Sci Technol,2010, 43(6): 919-925.
[14] Hayashi Y, Nagano S, Enomoto H, et al.. Improvement of foaming property of egg white protein by phosphorylation through dry-heating in the presence of pyrophosphate[J]. J of Food Sci, 2009, 74(1): 68-72.
[15] Li C P, Enomoto H, Ohki S, et al. Improvement of functional properties of whey protein isolate through glycation and phosphorylation by dry-heating. J Dairy Sci, 2005, 88(12): 4137-4145.
[16] Li C P, Ibrahim H R, Sugimoto Y, et al. Improvement of functional properties of egg white protein through phosphorylation by dry heating in the presence of pyrophosphate. J Agr Food Chem, 2004, 52(18): 5752-5758.
[17] 李陽陽. 大豆分離蛋白磷酸化及功能性質研究[D]. 天津:天津商學院,2006. Li Yangyang. Phosphorlation of Soy Protein Isolate and Research on Functional Properties[D]. Tianjin: Tianjing university of commerce, 2006. (in Chinese with English abstract)
[18] Wang G, Zhang T, Ahmad S, et al. Physicochemical and adhesive properties, microstructure and storage stability of whey protein-based paper glue[J]. Int J Adhes Adhes, 2013,41(1): 198-205.
[19] Lawal O S, Adebowale K O, Adebowale Y A. Functional properties of native and chemically modified protein concentrates from bambarra groundnut[J]. Food Res Int, 2007,40(8): 1003-1011.
[20] Wagner J R, Sorgentini D A, Anon M C. Relation between solubility and surface hydroponicity as an indicator of modifications during preparation processes of commercial and laboratory-prepares soy protein isolates[J]. J Agr Food Chem, 2000, 48(8): 3159-3165.
[21] Purwanti N, Smiddy M, Jan van der Goot A, et al. Modulation of rheological properties by heat-induced aggregation of whey protein solution[J]. Food Hydrocolloid,2011, 25(6): 1482-1489.
[22] Sa?lam D, Venema P, de Vries R, et al. Exceptional heat stability of high protein content dispersions containing whey protein particles[J]. Food Hydrocolloid, 2014, 34(1): 68-77.
[23] Helen W, Jane R, Gregory H, et al. Physico-chemical properties, probiotic survivability, microstructure, and acceptability of a yogurt-like symbiotic oats-based product using pre-polymerized whey protein as a gelation Agent[J]. J Food Sci, 2010, 75(5): 327-337.
[24] Mudgal P, Daubert C R, Foegeding E A. Cold-set thickening mechanism of β-lactoglobulin at low pH: concentration effects[J]. Food hydrocolloid, 2009, 23(7): 1762-1770.
[25] Purwanti N, Smiddy M, Jan van der Goot A, et al. Modulation of rheological properties by heat-induced aggregation of whey protein solution[J]. Food Hydrocolloid,2011, 25(6): 1482-1489.
[26] Hussain R, Gaiani C, Jeandel C, et al. Combined effect of heat treatment and ionic strength on the functionality of whey proteins[J]. J Dairy Sci, 2012, 95(11): 6260-6273.
[27] Ryan K N, Vardhanabhuti B, Jaramillo D P, et al. Stability and mechanism of whey protein soluble aggregates thermally treated with salts[J]. Food Hydrocolloid, 2012, 27(2): 411-420.
[28] Kazmierski M, Corredig M. Characterization of soluble aggregates from whey protein isolate[J]. Food Hydrocolloid,2003, 17(5): 685-692.
[29] Kiokias S, Dimakou C, Oreopoulou V. Effect of heat treatment and droplet size on the oxidative stability of whey protein emulsions[J]. Food Chem, 2007, 105(1): 94-100.
[30] Hussain R, Gaiani C, Jeandel C, et al. Combined effect of heat treatment and ionic strength on the functionality of whey proteins[J]. J Dairy Sci, 2012, 95(11): 6260-6273.
[31] Hoffmann M A M, van Mil P J J M. Heat-induced aggregation of β-lactoglobulin: role of the free thiol group and disulfide bonds[J]. J Agr Food Chem, 1997, 45(8): 2942-2948.
[32] Ramos ó L, Pereira J O, Silva S I, et al. Effect of composition of commercial whey protein preparations upon gelation at various pH values[J]. Food Res Int, 2012, 48(2): 681-689.
[33] Unterhaslberger G, Schmitt C, Sanchez C, et al. Heat denaturation and aggregation of β-lactoglobulin enriched WPI in the presence of arginine HCl, NaCl and guanidinium HCl at pH 4.0 and 7.0[J]. Food Hydrocolloid, 2006, 20(7): 1006-1019.
[34] Kulmyrzaev A, Bryant C, McClements D J. Influence of sucrose on the thermal denaturation, gelation, and emulsion stabilization of whey proteins[J]. J Agr Food Chem, 2000,48(5): 1593-1597.
[35] Vardhanabhuti B, Foegeding E A, McGuffey M K, et al. Gelation properties of dispersions containing polymerized and native whey protein isolate[J]. Food Hydrocolloid, 2001,15(2): 165-175.
[36] Manoi K, Rizvi S S H. Rheological characterizations of texturized whey protein concentrate-based powders produced by reactive supercritical fluid extrusion[J]. Food Res Int, 2008,41(8): 786-796.
[37] Voutsinas L P, Nakai S. A simple turbidimetric method for determining the fat binding capacity of proteins[J]. J Agri Food Chem, 1983, 31(1): 58-63.
[38] Rioux L E, Turgeon S L. The Ratio of Casein to Whey protein impacts yogurt digestion in vitro[J]. Food Digestion,2012, 3(1/2/3): 25-35.
[39] 董貝森,朱海濤,于躍芹. 花生蛋白粉溶液流變學特性及功能性的研究[J]. 農業工程學報,1999(1):251-252. Dong beisen, Zhu haitao, Yu yueqin. The research of peanut powder solution rheology and characteristics[J]. Transactions of the Chinese Society of Agricultural Engineering, 1999(1): 251-252. (in Chinese with English abstract)
[40] Lorenzen P C, Schrader K. A comparative study of the gelation properties of whey protein concentrate and whey protein isolate[J]. Dairy Sci Technol, 2006, 86(4): 259-271.
[41] Cheng Q, Mcclements D J. Formation of nanoemulsions stabilized by model food-grade emulsifiers using high-pressure homogenization: factors affecting particle size[J]. Food Hydrocolloid. Food Hydrocolloids, 2011, 25(5): 1000-1008.
[42] Nicolai T, Durand D. Led food protein aggregation for new functionality[J]. Curr Opin Colloid In, 2013, 18(4): 249-256.
Preparation and characters of whey protein isolate-sodium tripolyphosphate aggregates by heating
Xie Siyu1, Hou Juncai1, Feng Xianmin1, Xiao Hongliang2,
Wang Li2, Wang Zhangdong2, Wang Qingyun2, Cheng Jianjun1※
(1. College of Food Science, Northeɑst Agriculturɑl University, Hɑrbin 150030, Chinɑ; 2. Heilongjiɑng Wondersun Dɑiry Co.,Ltd, Hɑrbin 150060, Chinɑ)
Abstract:This study was aimed to prepare the whey protein isolate (WPI) - sodium tripolyphosphate (STPP) aggregates using heating at higher pH value and evaluate their characteristics. The results of single-factor experiment showed that the increase of viscosity of polymers was different from the increasing of WPI concentration, temperature, pH value, STPP content and aggregation time. The models were obtained by using a Box-Behnken optimization experiment design with the 4 factors (temperature, pH value, STPP content and aggregation time) based on the results of single-factor experiments. The results of Box-Behnken optimization experiment showed that the order of the effect of the 4 factors on viscosity was as follows: temperature > STPP content > pH value > aggregation time. The optimized condition determined was that 10% (w/w) WPI,0.09% (w/w) STPP at 90°C for 42 min with pH value of 8.40, and the actual viscosity was 5083 mPa·s. The prepared WPI-STPP thermal aggregates were the thick sample with a semi flow state, and the regression model was fitted well. Determination of properties and structural analysis of WPI, WPI-STPP thermal aggregates and WPI aggregates showed the water holding capacity, surface hydrophobicity and rheological characteristics of WPI-STPP thermal aggregates were improved compared with WPI and WPI aggregates. For WPI aggregates, water holding capacity increased from 4.83 to 5.20 g per gram protein (P<0.05). However, the solubility of WPI-STPP thermal aggregates decreased from 88.5% to 34.50%, which was lower than that of WPI. Heat treatment and STPP significantly affected the surface hydrophobicity of the soluble aggregates. WPI-STPP thermal aggregates could form good cold-induced gels, which could widen its application in foods of gel type. When STPP was added, the average particle size of whey protein thermally polymerized increased from 31.39±1.81 μm for WPI to 292.09±2.17 μm for WPI-STPP thermal aggregates. The difference between strong and weak soluble gels could be assessed by the oscillatory dynamic experiments using parallel-plate geometries. Rotational rheometer showed that the rheological characteristics of WPI-STPP thermal aggregates were improved. The rheological characteristics were determined from storage and loss moduli as the functions of time and frequency. WPI-STPP thermal aggregates had higher storage modulus values. The results showed that the increasing of particles played a significant role in the water holding capacity and rheological properties of these dispersions. The microscopic structure analysis of WPI-STPP thermal aggregates showed that they denatured fully, and the larger irregular fractal aggregates of WPI-STPP thermal aggregates could be most useful to increase the viscosity. Transmission electron microscopy showed that heat-induced WPI-NaCl soluble gels had a dense structure and a higher number of cross-links. The utilization of WPI-STPP thermal aggregates is very attractive due to the low-complexity processing conditions needed, lower production cost and higher nutritive value. The production cost of yogurt is less than yogurt with pectin according to the optimal technological condition of the experiment. The application of this technology proposed in this paper will bring great economic benefits for the yogurt processing industry.
Keywords:viscosity; gels; optimization; whey protein isolate; sodium tripolyphosphate; thermal aggregation
通信作者:※程建軍,男,黑龍江人,教授,研究方向為農產品加工。哈爾濱東北農業大學食品學院。Email:cheng577@163.com
作者簡介:解思雨,女,河北省獻縣人,研究方向為農產品加工。哈爾濱東北農業大學食品學院,150030。Email:xiesiyu2406@163.com
基金項目:“十二五”農村領域國家科技計劃課題(2013BAD18B07)
收稿日期:2015-09-21
修訂日期:2015-10-12
中圖分類號:TS201
文獻標志碼:A
文章編號:1002-6819(2016)-02-0287-07
doi:10.11975/j.issn.1002-6819.2016.02.041

