南黃海網采浮游植物碳含量及群落結構的季節變化*
楊 洋 孫曉霞,
(1. 中國科學院海洋研究所膠州灣海洋生態系統國家野外科學觀測研究站 青島 266071; 2. 中國科學院大學 北京 100049;3. 青島海洋國家實驗室海洋生態與環境科學功能實驗室 青島 266071)
浮游植物是海洋生態系統中最重要的初級生產者,其類群組成、數量及分布的變動與海洋生態環境的變化密切相關(Nuccioet al,2003; Irwinet al,2006)。研究者在中國近海針對浮游植物的群落變動開展了大量生態調查。在北黃海(劉述錫等,2013)、黃海中南部(王俊,2003; Gaoet al,2013)、東海海域(劉海嬌等,2015; 趙其彪等,2015)、南海海域(朱根海等,2003; 馬威,2012)等區域的浮游植物調查結果顯示,不同季節浮游植物的分布和類群結構存在顯著差異,優勢種具有明顯季節演替,反映出浮游植物在不同季節具有不同的生態適應性。
然而,浮游植物群落結構的研究往往是以各個類群的豐度為基礎,未考慮到不同種群、不同細胞個體之間形態和大小上存在的差異(孫軍等,2000)。而細胞體積的差異在一定程度上導致各浮游植物類群在生態系統中的貢獻不同。由此,根據已有的浮游植物細胞個體體積與碳含量轉換關系(Mullinet al,1966;Strathmann,1967; Eppleyet al,1970; Verityet al,1992),可以從各類群生物量變動的基礎上探討浮游植物群落時空變動的內在原因,深入了解能量的內在流動(Sunet al,2000)。
本文利用 2011—2012年 5個月份的調查資料,從碳含量的角度分析了南黃海網采浮游植物的類群組成、空間分布及季節變化,并進一步結合理化因子探討浮游植物季節變化的內在原因,為該海域生態系統狀況的研究提供基礎資料。
1 材料與方法
1.1 研究海域與站位布設
本文研究的海域位于 32°—37°N、120°—124°E之間的南黃海西側海域,浮游植物樣品分別來源于 4月(2011年)、6月(2012年)、8月(2012年)、10月(2012年)和11月(2011年)的航次調查。采樣站位的布設如圖1所示,各個航次的站位經緯度保持大體一致,實際采樣站位根據各航次的實際情況有略微調整,但誤差均維持在0.25°的范圍以內。
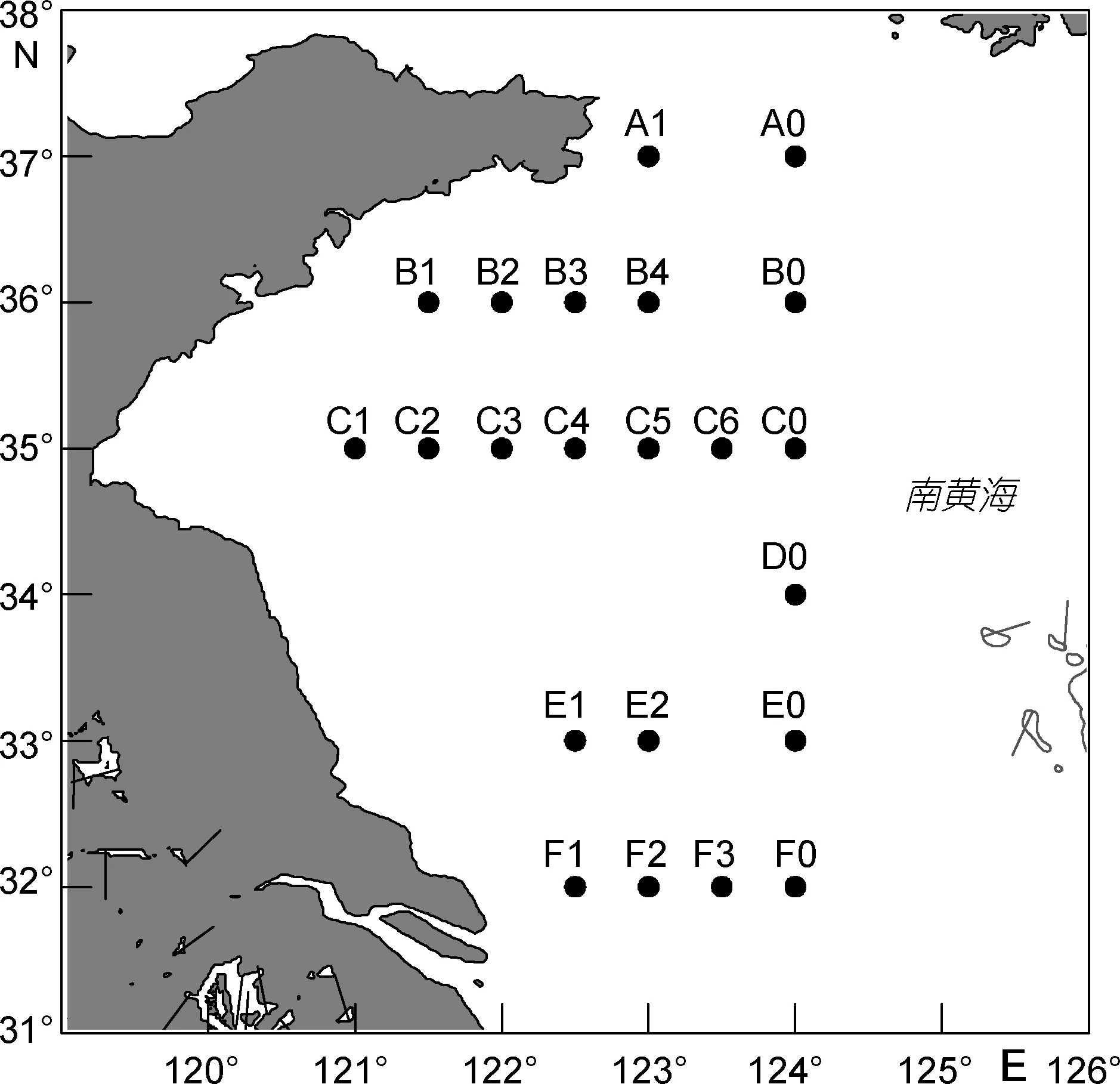
圖1 調查海域采樣站位分布圖Fig.1 Location of sampling stations in the South Yellow Sea
1.2 浮游植物樣品的采集與分析
浮游植物樣品的采集與保存遵照《海洋調查規范第 6部分: 海洋生物調查》(GB/T12763.6-2007)的要求進行。采樣工具為小型浮游生物采集網(孔徑0.076mm,網口面積 0.1m2,網長2.8m),采樣方式為自底至表垂直拖網,網速約為0.5—0.8m/s。樣品采集后,立即于采樣瓶中加入終濃度為 5%的福爾馬林溶液進行固定。在采集浮游植物樣品的同時,由船載SBE911 CTD (Sea-Bird Electronics Inc.,美國)獲得各站位的溫度、鹽度和深度信息。在各站位,遵照《海洋調查規范第4部分: 海水化學要素調查》(GB/T12763.4-2007)的要求測定不同水層的營養鹽(硅酸鹽、磷酸鹽、銨鹽、硝酸鹽和亞硝酸鹽)。
1.3 浮游植物豐度與碳含量的獲得
用流式影像術(Flow cytometry and microscopy,FlowCAM) (Fluid Imaging Technologies Inc.,美國)對網采浮游植物樣品進行分析(álvarezet al,2011;Poulton,2016)。將 FlowCAM 與 BX-51顯微鏡(Olympus,美國)的計數和測量結果分別進行比較,表明FlowCAM的分析結果與傳統顯微鏡法無顯著差異(Yanget al,2016)。在自動模式下,FlowCAM的拍照系統可以自動捕捉流經流通池的顆粒,經FlowCAM內置軟件Visual Spreadsheet分析,獲得掃描樣品的細胞濃度及各個細胞圖像的尺寸信息。各細胞的碳含量根據下列公式進行換算(Eppleyet al,1970; Sunet al,2000):

公式(1)適用于硅藻細胞碳含量的轉換,公式(2)適用于其它藻細胞碳含量的轉換。其中,C為細胞的轉換碳含量值,單位為pg;V為細胞體積,由FlowCAM自動計算獲得的等效球直徑換算得出,單位為μm3。由于夜光藻屬(Noctiluca)的碳含量轉換不適用于上述公式,本文中浮游植物的豐度及碳含量數據均未涉及夜光藻屬。
1.4 數據的統計分析
各月份網采浮游植物各類群的碳含量優勢度Yc的計算公式為:
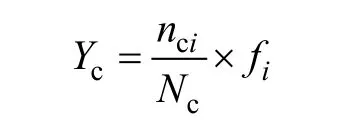
公式中,nci為第i屬的總碳含量,Nc為浮游植物總碳含量,fi為第i屬出現的頻率。
溫度、鹽度和營養鹽等環境因子與浮游植物碳含量的Pearson相關性分析利用SAS 9.1.3(SAS Institute Inc.,美國)軟件進行。其中,浮游植物碳含量數據經過對數(log10)正態性轉換、百分比數據經過平方根反正弦轉換以滿足相關分析的前提條件。
2 結果與討論
2.1 南黃海浮游植物碳含量的空間分布
南黃海各個季節網采浮游植物碳含量的分布如圖 2所示。春季(4月份),各站位浮游植物碳含量值在 43.77—1.53×104μgC/m3之間,碳含量的高值區域出現在調查海域東北部的個別站位及中部近岸站位。南黃海中部區域碳含量較低,浮游植物基本呈現由近岸到外海逐漸減少的趨勢。
夏季(6、8月份),各站位碳含量值在 30.37—5.05×105μgC/m3之間。夏季浮游植物碳含量的分布表現出與春季分布的明顯差異。此時,調查海域的不同區域之間分布差異明顯,最大值出現在海域南部,E、F斷面碳含量明顯高于其它斷面,其中8月份K2站位出現碳含量的最高值。6月份A斷面出現碳含量最低值,中部B、C、D斷面所在區域碳含量值較低,近岸站位與外海站位的差異不大。
秋季(10、11月份),各站位浮游植物碳含量值在0—6754.82μgC/m3之間。浮游植物碳含量在分布上沒有明顯的緯度間差異,而呈現出由近岸到外海顯著減少的趨勢。外海大部分站位的碳含量值在500μgC/m3以下。
南黃海區域的浮游植物分布在不同季節各有特點,春季時期分布較為均勻; 夏季時期區域差異明顯,在海域南部大量分布; 秋季時期浮游植物含量最低,區域差異不大,而呈現明顯的由近岸到外海降低的特點。中部海域浮游植物在春季最多,夏季次之,秋季最少。南部區域在夏季達到最大值。
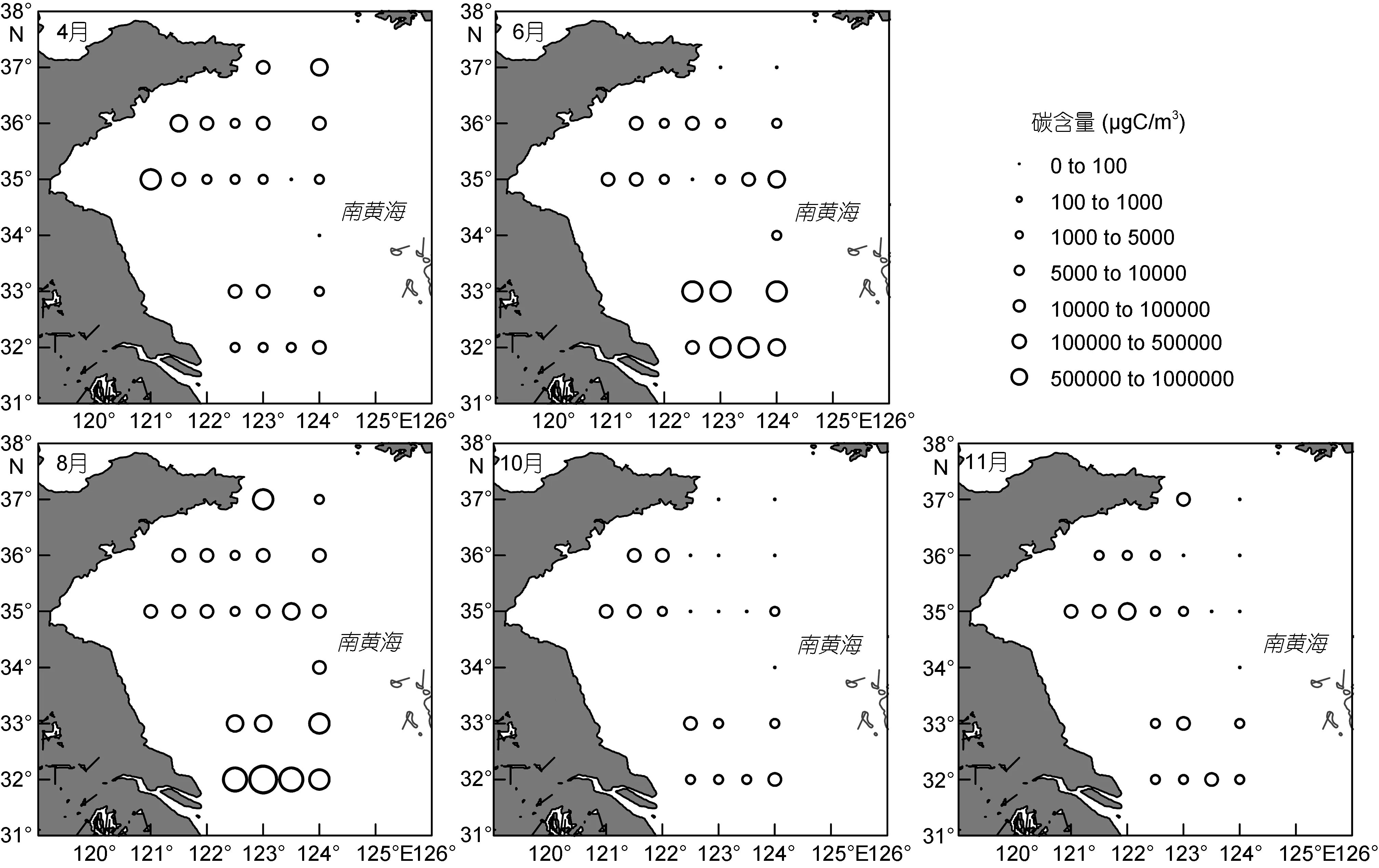
圖2 南黃海各月份網采浮游植物的碳含量分布圖Fig.2 The distribution pattern of net phytoplankton carbon biomass (μgC/m3) in each sampling month in the South Yellow Sea
2.2 南黃海浮游植物碳含量的季節變化
調查海域的浮游植物各月份平均碳含量如圖 3所示。不同季節浮游植物的平均碳含量差異明顯,由春季到夏季再到秋季呈現先增高再下降的趨勢,最低值出現在秋季,10月和11月的碳含量值均維持在1000μgC/m3以下。最高值出現在夏季,其中8月份碳含量的平均值最高,達到(4.62±11.79)×104μgC/m3。碳含量的季節變化趨勢與傳統豐度表征的變化趨勢大體一致(圖 4),春季和秋季的豐度也均處于較低水平,各站位平均豐度值在4月、10月和11月份均在100×104cell/m3及以下; 夏季的豐度值遠遠高于其它季節,其中8月份平均豐度達到最高值,為(20 433.3±69 466.1)×104cell/m3。
硅藻與甲藻碳含量的季節變化均與總碳含量的變化趨勢一致,呈現夏季>春季>秋季的特點。硅、甲藻碳含量的最大值出現在夏季8月份,平均值分別為(3.97±10.60)×104μgC/m3和(0.65±1.40)×104μgC/m3。相應地,硅藻與甲藻在8月份的平均豐度值均為最大。
碳含量和豐度所反映出的浮游植物現存量在季節的變化趨勢上是大體一致的,但兩種方法所反映的硅、甲藻在各月份的貢獻率卻存在明顯差異。從甲藻在群體中的組成比例上可以看出,甲藻碳含量對總碳含量具有明顯的貢獻(圖 3),調查中獲得的甲藻碳含量的比例最大值出現在春季4月份和秋季11月份,約為48%,與硅藻的碳含量相當;8月份甲藻碳含量的比例最低,為14.05%。然而,在豐度方面,甲藻對整體的貢獻作用不明顯(圖 4),甲藻所占比例在各個月份均低于5%。在浮游植物大量存在的8月份,甲藻豐度在總豐度中的比例僅為0.10%。以碳含量和以豐度衡量甲藻在群落中的比重具有明顯的差異,這一方面是由于硅藻細胞具有較大的液泡,其碳密度被認為低于同體積的其它浮游植物類群(Strathmann,1967),同體積的硅藻體內各組分(葉綠素a、蛋白質、糖類及脂肪)均小于甲藻(Hitchcock,1982); 另一方面,網采樣品中的小型鏈狀及以群體形態存在的小型硅藻往往在該海域占優勢,其對豐度的貢獻明顯大于對碳含量的貢獻,而網采樣品中小個體甲藻缺失,個體相對較大的角藻屬(Ceratium,依據 Gómez(2013),也作Tripos)對甲藻的生物量具有明顯貢獻。以4月份的數據為例,骨條藻屬和角毛藻屬在群落中所占的豐度比例分別為12.63%、6.29%,其碳含量比例均低于 1%; 角藻屬在群落中所占的豐度比例約為 1.86%,而其碳含量比例超過45%。由此表明,以碳含量和以豐度表征的甲藻生物量在浮游植物總生物量中的地位是不同的,以往從豐度角度研究浮游植物群落結構可能較大地低估了甲藻生物量在總生物量中的比重。
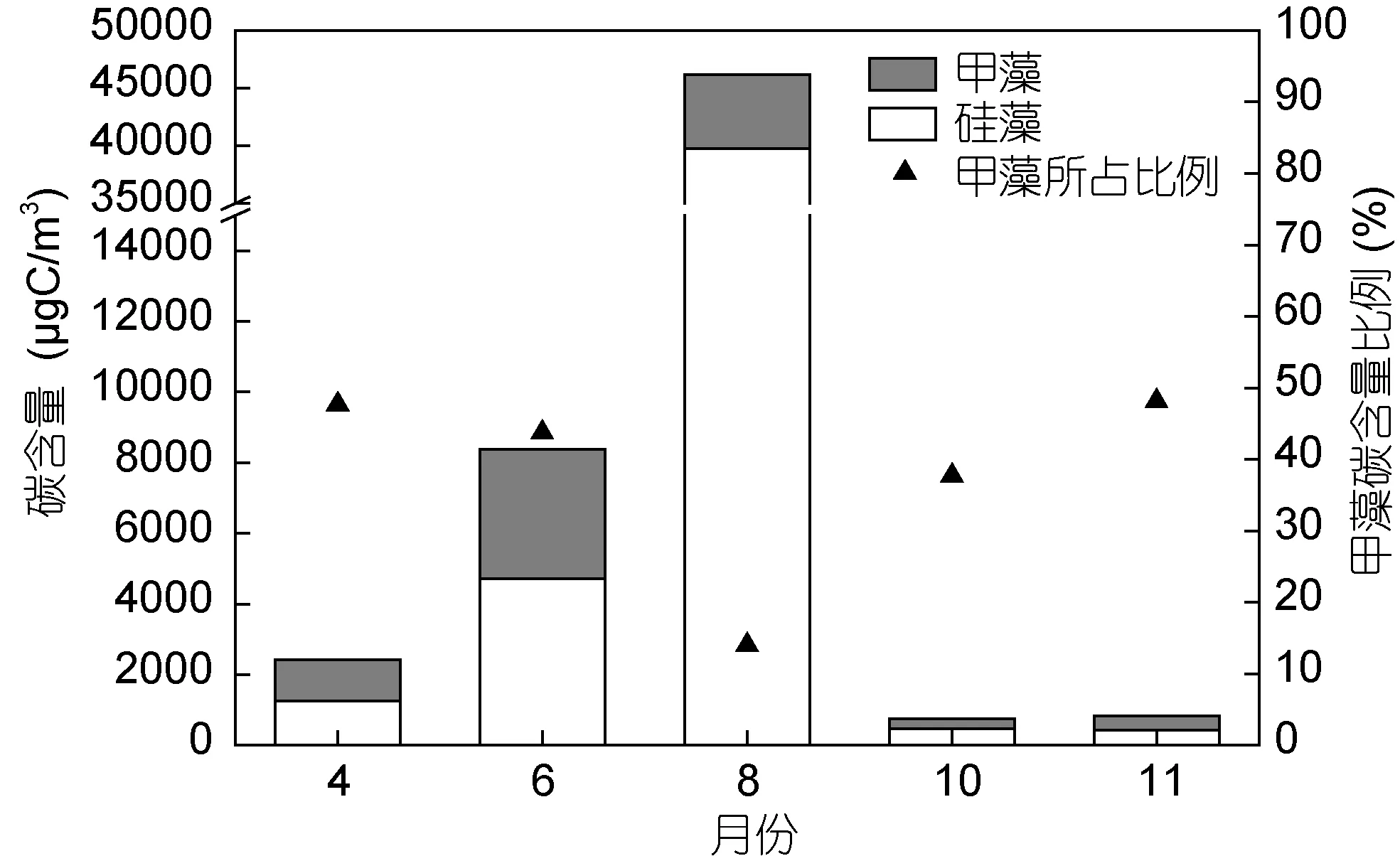
圖3 南黃海各月份浮游植物碳含量及甲藻所占比例Fig.3 The carbon biomass of phytoplankton and the proportion of dinoflagellates during different months in the South Yellow Sea
2.3 硅甲藻的相對含量的時空變化
整體上看,甲藻在浮游植物中所占比例的季節變化特點為夏季8月最低,初春和秋末較高(圖3,4)。本文選取了各采樣斷面的1號站位(近岸站位)與0號站位(外海站位)比較分析南黃海甲藻的相對含量在空間和時間的分布特點(圖 5)。由時間看,春季甲藻在南黃海中部B、C斷面的近岸站位比例最高,碳含量貢獻達到97.67%。外海站位由硅藻占絕對優勢,甲藻在外海站位及南部海域站位貢獻極低。夏季,6月份甲藻在中部斷面的貢獻較大,8月份在北部的貢獻最大,由北向南比例下降,F斷面由于硅藻的大量存在,甲藻貢獻不明顯。此外,近岸站位與外海站位的差別不明顯。秋季,近岸站位的甲藻碳含量比例均呈由北向南逐漸降低的趨勢。
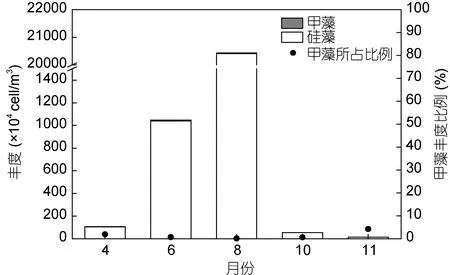
圖4 南黃海各月份浮游植物豐度及甲藻所占比例Fig.4 The abundance of phytoplankton and the proportion of dinoflagellates in different months in the South Yellow Sea
甲藻在南黃海海域對碳含量具有明顯的貢獻。各個斷面均出現甲藻貢獻高于硅藻的月份。相比之下,緯度較低的E、F斷面甲藻的比重明顯較低,在F斷面,僅在夏初 6月份甲藻比例超過 50%,其它月份均維持在15%以下。這是由于6月份該區域大量存在的小個體的偽菱形藻屬(Pseudonitzschia)、骨條藻屬(Skeletonema)和角毛藻屬(Chaetoceros)弱化了硅藻碳含量的比重,使得甲藻中的原多甲藻屬(Protoperidinium)和角藻屬在碳含量上的貢獻突顯出來。
2.4 優勢種屬的組成及季節變化
南黃海浮游植物各月份的優勢種屬及其優勢度如表 1所示。圓篩藻屬(Coscinodiscus)和角藻屬在各個調查月份均處于優勢地位。根管藻屬(Rhizosolenia)和雙尾藻屬(Ditylum)在春季和秋季占優勢,偽菱形藻屬、骨條藻屬和扁甲藻屬(Pyrophacus)為夏季優勢種屬,角毛藻屬是夏、秋季的優勢種屬。幾內亞藻屬(Guinardia)僅在秋季為優勢種屬。
夏季圓篩藻屬的含碳量明顯大于春季與秋季,其中8月份含碳量平均值最高,為(3.66±9.49)×103μgC/m3,春季略高于秋季,各個月份圓篩藻屬在站位間的出現頻率均在60%以上。圓篩藻屬與海水平均溫度呈顯著正相關(P<0.01),營養鹽方面,與硅酸鹽和亞硝酸鹽呈顯著正相關(P<0.05)。
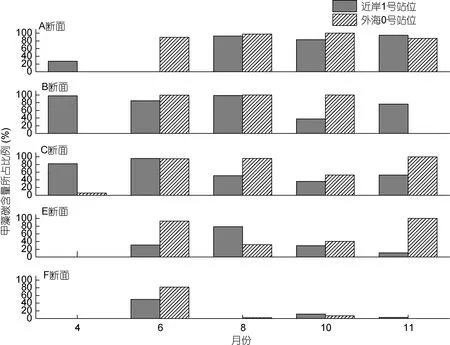
圖5 各斷面不同月份近岸1號站位與外海0號站位甲藻碳含量所占比例Fig.5 The carbon biomass proportion of dinoflagellates of Stations 1 and 0 in each section in different months注: 11月份B0 站位未檢出浮游植物
角藻屬在各個月份均有出現,含碳量呈現夏季>春季>秋季的特點,8月份平均碳含量為(5.50±14.09)×103μgC/m3,最大值區域出現在南部E、F斷面,F2站位最高為6.61×104μgC/m3。角藻屬在各站位的出現頻率較高,夏季達到100%,春季最低,為63.6%。角藻屬以梭角藻(Ceratium fusus)、三角角藻(Ceratium tripos)及叉角藻(Ceratium furca)為主。與環境因子的相關性分析表明,角藻屬碳含量與海水的表層溫度呈顯著正相關(P<0.05),與海水表層鹽度呈顯著負相關(P<0.01),而與水柱平均溫度、鹽度的相關性不明顯(P>0.05),表明梭角藻和叉角藻豐度高值區出現在海水的表層和次表層(Baeket al,2008a)。與營養鹽的相關性分析表明,角藻屬碳含量與硝酸鹽、亞硝酸鹽呈顯著正相關(P<0.05),與磷酸鹽呈顯著負相關(P<0.01)。梭角藻在春夏季的數目增長迅速,與其適應于該時期相對高溫低鹽的海洋環境有關,梭角藻對低營養環境,尤其是對低磷環境具有較強的適應能力(Baeket al,2007,2008b)。
根管藻屬和雙尾藻屬的碳含量均在春季較高,在夏季的浮游植物群落中所占比重極低。其中,根管藻屬與磷酸鹽呈顯著的負相關關系(P<0.01)。
偽菱形藻屬和骨條藻屬是南黃海夏季的優勢種屬,其高值區分布在海域南部的E、F斷面,8月份F斷面骨條藻屬的平均碳含量和豐度分別為(1.82±1.80)×105μgC/m3、(1.08±1.44)×109cell/m3,而南黃海北部及中部鮮有出現。這兩種藻為群體形態,單個細胞個體較小,當以豐度計數時,其在群落中的優勢度大大增加。偽菱形藻屬與海水平均溫度呈顯著正相關(P<0.01),營養鹽方面,與亞硝酸鹽呈顯著正相關(P<0.05)。骨條藻屬與環境因子的相關性不明顯。南黃海的偽菱形藻屬以尖刺偽菱形藻(Pseudonitzschia pungens)為主,在各種環境因子中,溫度是影響尖刺偽菱形藻豐度的重要因素(Lewiset al,1993; Huanget al,2009)。
與上述兩種藻相反,同樣在夏季占優勢的扁甲藻屬,在 E、F斷面未檢出,而在南黃海北部及中部有相對較高的生物量。扁甲藻屬與環境因子的相關性不顯著。
角毛藻屬在各個月份均有出現,碳含量呈現夏季>秋季>春季的特點,夏季高值區為海域南部 E、F斷面,秋季在各斷面近岸站位的碳含量值較高。角毛藻屬與溫度呈顯著正相關(P<0.01),營養鹽方面與硝酸鹽和亞硝酸鹽呈顯著正相關(P<0.05)。
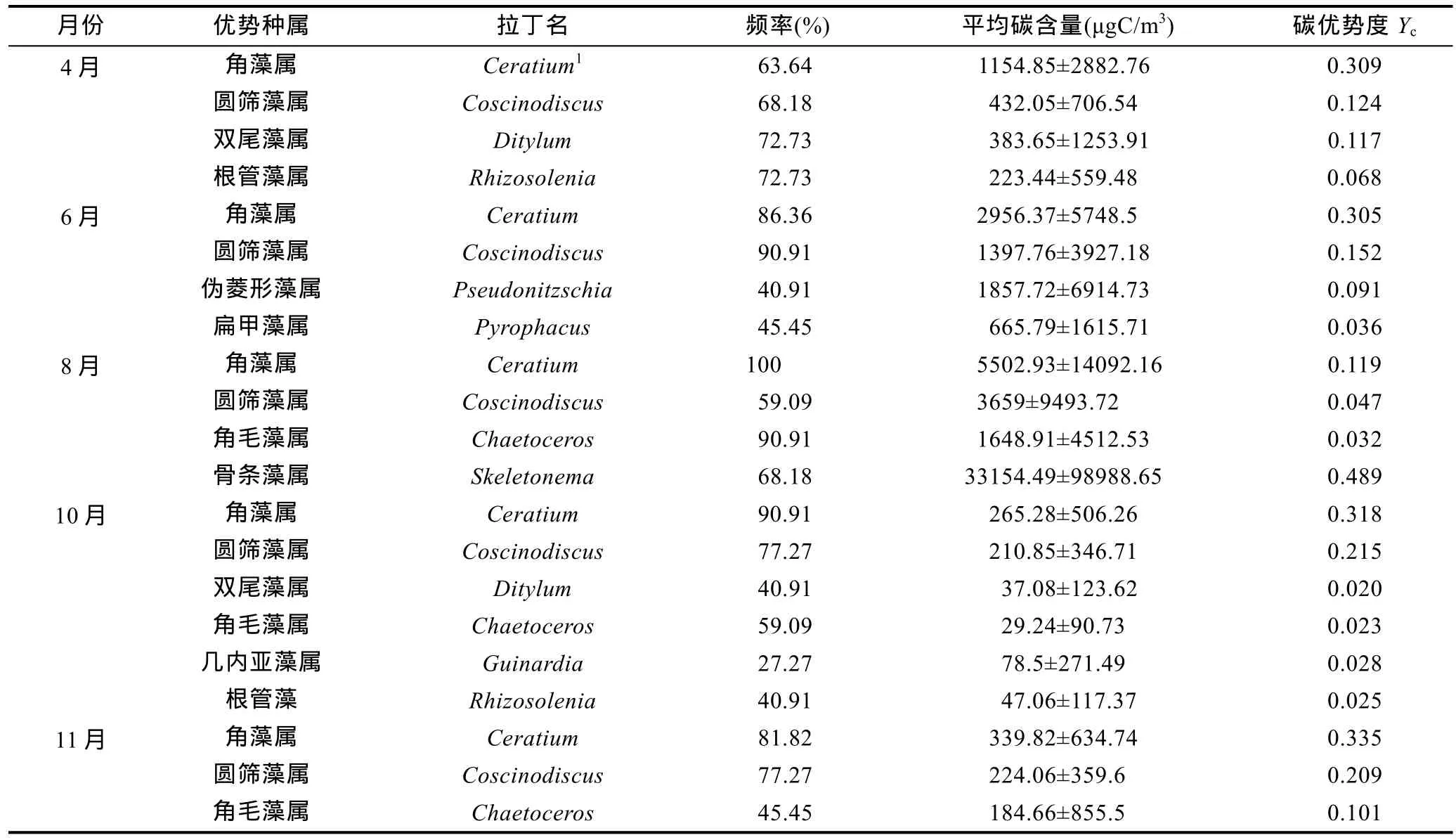
表1 各月份浮游植物的優勢種屬及其碳含量優勢度(Yc)Tab.1 Phytoplankton dominant genus and the carbon dominant index (Yc) in the survey areas in each month
2.5 浮游植物與環境因子的關系
對研究海域的浮游植物數據與溫度、鹽度因子進行Pearson相關性分析(表2)。溫度、鹽度值均為各站位的水柱平均值。由分析結果可以看出,在南黃海海域各調查月份,溫度和鹽度均為影響浮游植物生物量的重要環境因素。春季,根據4月份的相關性分析結果,浮游植物總生物量與溫度的相關關系不顯著,甲藻的碳含量與溫度呈顯著負相關; 夏季,浮游植物與溫度呈顯著正相關,硅藻、甲藻均受到溫度的顯著影響; 6月份,浮游植物與鹽度呈顯著負相關。秋季,浮游植物與溫度呈顯著正相關,受到溫度影響的類群主要為硅藻; 甲藻生物量與鹽度呈顯著負相關。由此,溫度是南黃海海域浮游植物生物量的重要影響因素,且除了4月份不顯著之外,各個時期的甲藻比例均與溫度呈顯著負相關,表明硅藻對該海域溫度的升高具有更高的適應能力。
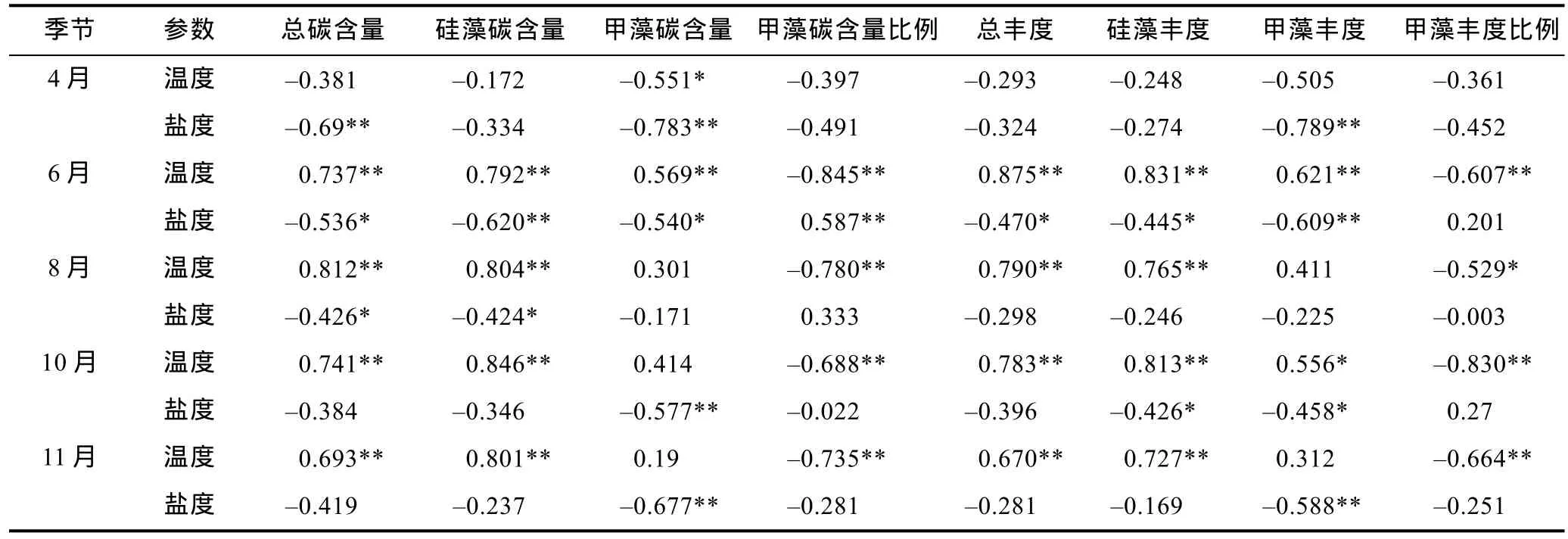
表2 浮游植物與溫度、鹽度參數的Pearson相關性分析Tab.2 Pearson correlation analysis between net phytoplankton and related temperature and salinity
對研究海域的浮游植物數據與五項營養鹽數據進行Pearson相關性分析(表3),結果表明不同季節浮游植物受營養鹽的影響存在明顯差異。春季,甲藻的含碳量及豐度均與磷酸鹽呈顯著的負相關,除此以外,浮游植物與其它營養鹽的相關性均不顯著。夏季,硅藻生物量與亞硝酸鹽及硝酸鹽的含量呈顯著正相關關系,甲藻生物量與銨鹽、硝酸鹽的含量呈顯著正相關關系,由此表明硅藻和甲藻對于溶解無機氮的利用具有一定的選擇偏向性。硅藻生物量與硅酸鹽的含量呈顯著的正相關關系,存在一定的硅限制; 相應地,甲藻在群落中所占的比例與硅酸鹽含量呈顯著負相關,表明環境中硅含量對夏季南黃海硅甲藻相對比例的大小具有重要影響。夏季生物因子與磷酸鹽含量的相關性不顯著,表明該時期不存在明顯的磷限制。夏季硅藻在浮游植物群落中占絕對優勢,因而浮游植物總生物量同環境因子的關系與硅藻一致。秋季,硅藻、甲藻的生物量均與磷酸鹽含量呈顯著正相關關系,海域存在磷限制。黃海海域的磷限制和硅限制是影響該海域浮游植物群落結構的重要原因(Linet al,2005)。
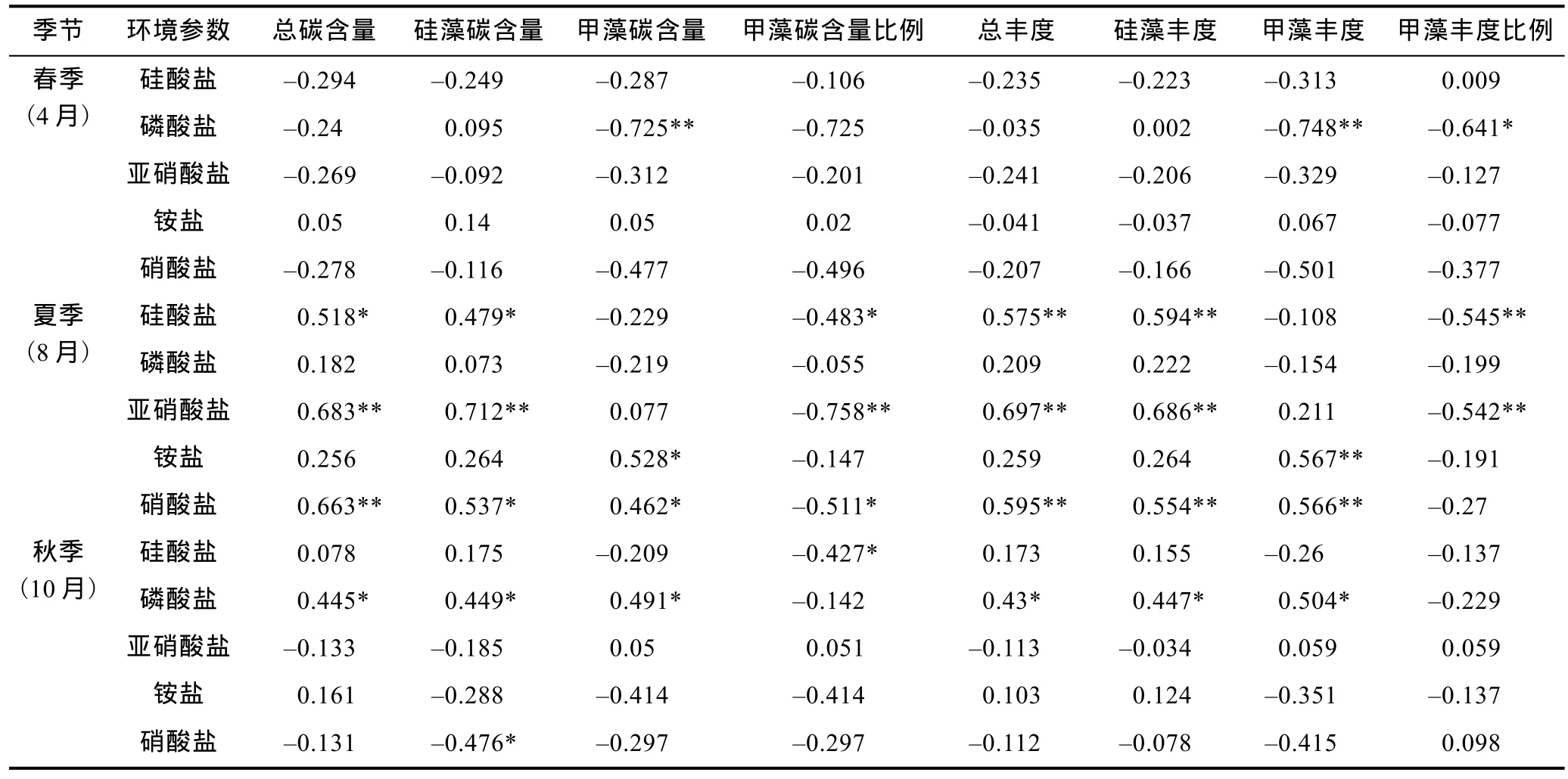
表3 浮游植物與營養鹽參數的Pearson相關性分析Tab.3 Pearson correlation analysis between net phytoplankton and nutrients
由上,浮游植物的多寡及分布受到溫度、鹽度及營養鹽共同作用的影響。春季和秋季,溫度、鹽度及磷酸鹽的影響明顯; 夏季,浮游植物的含量最高,這一時期受到溫度、鹽度及營養鹽綜合因素的影響。
3 結論
南黃海浮游植物碳含量存在明顯的季節變化特征,春季和秋季浮游植物的空間分布緯度差異較小,呈現由近岸到外海降低的特點; 夏季海域南部浮游植物大量分布,顯著高于南黃海北部及中部區域。浮游植物總碳含量在各季節差異較大,最高值出現在夏季,其中8月份碳含量的平均值為各月份最高,最低值出現在秋季。
硅藻與甲藻碳含量的季節變化均與總碳含量的變化趨勢一致。甲藻在浮游植物中所占比例在夏季最低,在初春和秋末較高。甲藻碳含量的比重明顯高于其豐度比重。空間分布上,海域南部 E、F斷面甲藻的比重明顯較低,主要由硅藻占優勢。
以碳含量為基礎獲得的浮游植物優勢種屬結果表明,圓篩藻屬和角藻屬在各調查月份均為優勢種屬; 根管藻屬和雙尾藻屬在春季和秋季均占優勢地位; 偽菱形藻屬、骨條藻屬和扁甲藻屬為夏季優勢種屬,且扁甲藻屬與前兩者分布于不同海區; 角毛藻屬是夏秋季的優勢種屬,幾內亞藻屬僅在秋季為優勢種屬。
溫度和鹽度是南黃海海域浮游植物生物量的重要影響因素,甲藻的比例與溫度呈顯著負相關,表明硅藻對該海域溫度的升高具有更高的適應能力。浮游植物與海水中營養鹽的關系呈現不同的季節特點,春季甲藻與磷酸鹽的含量呈負相關關系; 夏季,環境中硅含量對夏季南黃海硅甲藻相對比例具有重要影響,且硅藻和甲藻對于溶解無機氮的利用具有一定的選擇偏向性。秋季,南黃海海域存在一定的磷限制。
致謝本文中的營養鹽數據由中國海洋大學于志剛教授提供,CTD 數據由天津大學魏皓教授以及2011 年中國科學院海洋研究所中國近海海洋科學考察開放共享航次提供,謹致謝忱。同時感謝中國科學院海洋研究所浮游動物研究組的老師們以及黃海水產研究所“北斗”號考察船的工作人員在樣品采集過程中的大力協助。
馬威,2012. 南海北部浮游植物群落的生態學研究. 青島:中國海洋大學碩士學位論文,1—85
王俊,2003. 黃海秋、冬季浮游植物的調查研究. 海洋水產研究,24(1): 15—23
朱根海,寧修仁,蔡昱明等,2003. 南海浮游植物種類組成和豐度分布的研究. 海洋學報,25(S2): 8—23
劉述錫,樊景鳳,王真良,2013. 北黃海浮游植物群落季節變化. 生態環境學報,22(7): 1173—1181
劉海嬌,傅文誠,孫軍,2015. 2009—2011年東海陸架海域網采浮游植物群落的季節變化. 海洋學報,37(10):106—122
孫軍,劉東艷,錢樹本,2000. 浮游植物生物量研究Ⅱ. 膠州灣網采浮游植物細胞體積轉換生物量. 海洋學報,22(1):102—109
趙其彪,孫軍,李丹等,2015. 東海低氧區及鄰近水域浮游植物的季節變化. 生態學報,35(7): 2366—2379
álvarez E,López-Urrutia á,Nogueira Eet al,2011. How to effectively sample the plankton size spectrum? A case study using FlowCAM. Journal of Plankton Research,33(7):1119—1133
Baek S H,Shimode S,Han M Set al,2008a. Growth of dinoflagellates,Ceratium furcaandCeratium fususin Sagami Bay,Japan: the role of nutrients. Harmful algae,7(6):729—739
Baek S H,Shimode S,Han M Set al,2008b. Population development of the dinoflagellatesCeratium furcaandCeratium fususduring spring and early summer in Iwa harbor,Sagami Bay,Japan. Ocean Science Journal,43(1):49—59
Baek S H,Shimode S,Kikuchi T,2007. Reproductive ecology of the dominant dinoflagellate,Ceratium fusus,in coastal area of Sagami Bay,Japan. Journal of Oceanography,63(1):35—45
Eppley R W,Reid F M H,Strickland J D H,1970. Estimates of phytoplankton crop size,growth rate,and primary production. In: Strickland J D H ed. The Ecology of the Plankton off La Jolla,California,in the Period April through September,1967. California: Scripps Institution of Oceanography,33—42
Gao Y,Jiang Z B,Liu J Jet al,2013. Seasonal variations of net-phytoplankton community structure in the Southern Yellow Sea. Journal of Ocean University of China,12(4):557—567
Gómez F,2013. Reinstatement of the dinoflagellate genusTriposto replaceNeoceratium,marine species ofCeratium(Dinophyceae,Alveolata). CICIMAR Oceánides,28(1):1—22
Hitchcock G L,1982. A comparative study of the size-dependent organic composition of marine diatoms and dinoflagellates.Journal of Plankton Research,4(2): 363—377
Huang C J,Lin X P,Lin J Det al,2009. Population dynamics ofPseudo-nitzschia pungensin Zhelin Bay,China. Journal of the Marine Biological Association of the United Kingdom,89(4): 663—668
Irwin A J,Finkel Z V,Schofield O M Eet al,2006. Scaling-up from nutrient physiology to the size-structure of phytoplankton communities. Journal of Plankton Research,28(5): 459—471
Lewis N I,Bates S S,McLachlan J Let al,1993. Temperature effects on growth,domoic acid production,and morphology of the diatomNitzschia pungens f.multiseries. In: Smayda T J,Shimizu Y eds. Toxic Phytoplankton Blooms in the Sea.Chicago: The University of Chicago Press,601—606
Lin C,Ning X,Su Jet al,2005. Environmental changes and the responses of the ecosystems of the Yellow Sea during 1976-2000. Journal of Marine Systems,55(3—4): 223—234
Mullin M M,Sloan P R,Eppley R W,1966. Relationship between carbon content,cell volume,and area in phytoplankton.Limnology and Oceanography,11(2): 307—311
Nuccio C,Melillo C,Massi Let al,2003. Phytoplankton abundance,community structure and diversity in the eutrophicated Orbetello lagoon (Tuscany) from 1995 to 2001.Oceanologica Acta,26(1): 15—25
Poulton N J,2016. FlowCam: quantification and classification of phytoplankton by imaging flow cytometry. In: Barteneva N S,Vorobjev I A eds. Imaging Flow Cytometry: Methods and Protocols. New York: Springer,237—247
Strathmann R R,1967. Estimating the organic carbon content of phytoplankton from cell volume or plasma volume.Limnology and Oceanography,12(3): 411—418
Sun J,Liu D Y,Qian S B,2000. Estimating biomass of phytoplankton in the Jiaozhou Bay I. Phytoplankton biomass estimated from cell volume and plasma volume. Acta Oceanologica Sinica,19(2): 97—110
Verity P G,Robertson C Y,Tronzo C Ret al,1992. Relationships between cell volume and the carbon and nitrogen content of marine photosynthetic nanoplankton. Limnology and Oceanography,37(7): 1434—1446
Yang Y,Sun X X,Zhu M Let al,2016. Estimating the carbon biomass of marine net phytoplankton from abundance based on samples from China seas. Marine and Freshwater Research,http://dx.doi.org/10.1071/MF15928

