影響乙醛銀鏡反應效果的因素是什么?
丁利鑄
(南京市第十二中學 江蘇南京 210011)
?
影響乙醛銀鏡反應效果的因素是什么?
丁利鑄
(南京市第十二中學江蘇南京210011)
摘要:一次不成功的銀鏡反應實驗引發(fā)的思考,查閱資料、理論分析,結合實驗驗證,找出乙醛銀鏡反應最佳效果的實驗條件。
關鍵詞:銀鏡反應;分布分數;pH值
一、問題提出
按人教版高中化學選修5中“醛”中關于銀鏡反應實驗要求進行操作,卻沒有成功,這引起了我對銀鏡反應的思考,是什么原因有時成功,有時不成功?
1.教材內容重現
人教版高中化學選修5中“醛”中關于銀鏡反應是這樣描述的:在潔凈的試管中加入1 mL 2%的AgNO3溶液,然后邊振蕩試管邊逐滴加入2%的稀氨水,至最初產生的沉淀恰好溶解為止制得銀氨溶液,再滴入3滴乙醛,振蕩后將試管放在熱水浴中溫熱,觀察并記錄實驗現象。
2.問題提出
同樣的試劑,嚴格按照實驗要求操作,有時觀察到漂亮的銀鏡,有時沒有銀鏡,影響的因素是什么?如何保證成功率呢?
二、問題探究
1.查閱資料
通過查閱乙醛銀鏡反應的相關資料,對現象產生影響的因素主要有溫度、乙醛的濃度、銀氨溶液的配制。要使乙醛銀鏡實驗獲得較好的成鏡效果,最佳的實驗條件應該控制在:
①反應的溫度在65~70℃之間為宜,南方的春季或者冬季較冷,可以將水浴溫度控制在70℃,夏季或者秋季室溫較高,可以將水浴溫度控制在65℃。
②用乙醛作為還原劑做銀鏡反應時,對實驗影響最大的因素是乙醛的濃度。實驗的最佳條件是用40%的乙醛溶液,使用2%的硝酸銀溶液。
③最適合的pH在本實驗的條件下是11.4~10.8。
2.理論分析
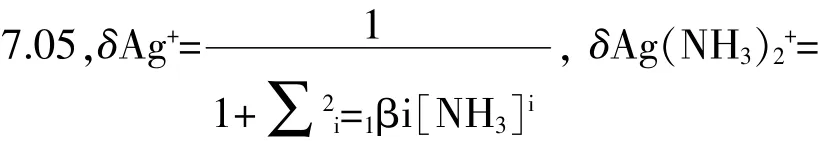
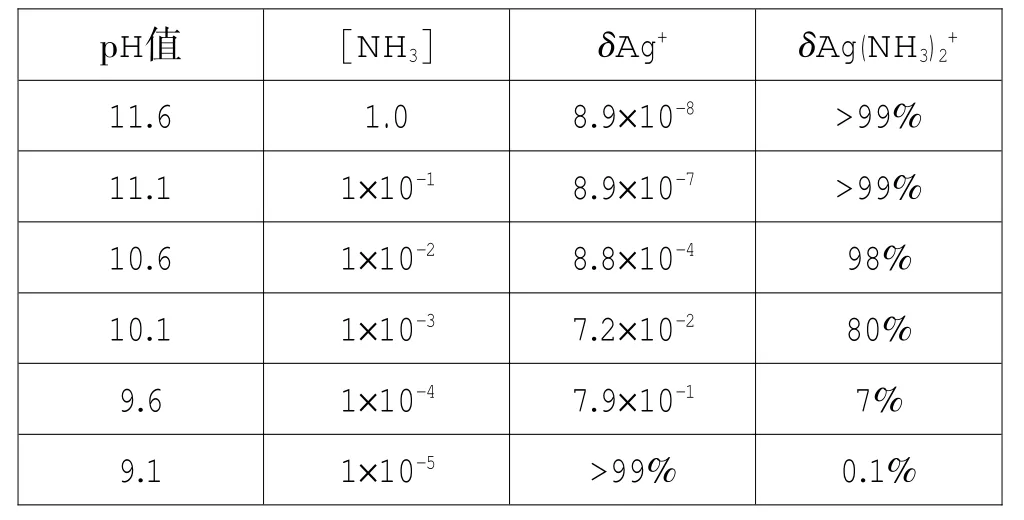
表1不同pH條件下銀氨溶液中Ag+的各種存在狀態(tài)的分布分數(略去βAg(NH3)+的分布數)
計算說明在氨性環(huán)境中pH≥10時,Ag(NH3)2+是銀離子的主要存在形式,也就是說銀氨溶液要在氨性環(huán)境中配制是因為其特殊的結構決定的,只有銀離子的存在狀態(tài)是Ag(NH3)2+時才是用于銀鏡反應的溶液;而不同的pH環(huán)境決定了銀氨溶液中銀離子的存在形式。
3.實驗驗證
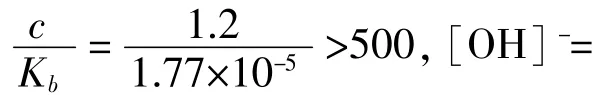
2%的稀氨水稀氨水的pH值約為11.7左右。用1 mL 2%的AgNO3溶液,然后邊振蕩試管邊逐滴加入2%的稀氨水配制6種同pH值銀氨溶液,再滴入3滴40%的乙醛溶液,溫度在65~70℃之間水浴加熱3-5分鐘,實驗結果如下。
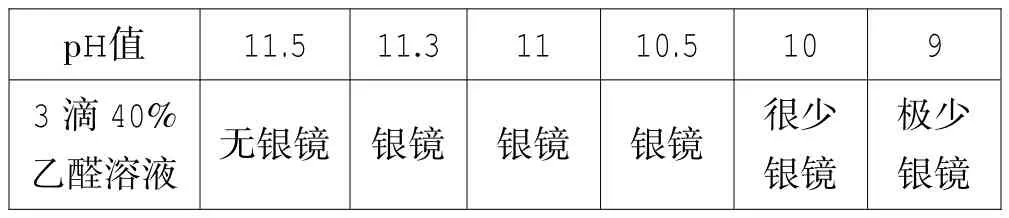
乙醛溶液 無銀鏡 銀鏡 銀鏡 銀鏡 很少銀鏡pH值 11.5 11.3 11 10.5 10 9 3滴40%極少銀鏡
三、結論和建議
上述實驗的結果說明了并不是銀氨溶液的pH越高,Ag(NH3)2+離子的存在狀態(tài)越多,銀鏡的效果越好,過低的pH值也不利于銀鏡反應發(fā)生,在本實驗的條件下最適合的pH值是11左右。在銀氨溶液中,銀離子和氨分子容易形成配離子,當Ag+和NH3形成穩(wěn)定的配離子Ag(NH3)2+時,會使游離的Ag+離子濃度大大降低。
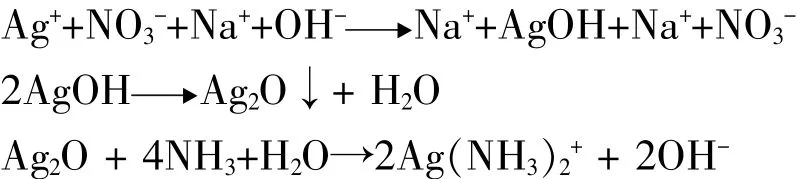
由于形成AgOH需要OH-,因此需要滴加1滴4%NaOH溶液,但是溶液的堿性過強,根據能斯特方程可知,其電極電勢會降低,即金屬離子的氧化能力會減弱。適當滴加堿性溶液,有利于乙醛的成鏡反應。
建議教材中銀鏡反應實驗:在潔凈的試管中加入1 mL 2%的AgNO3溶液,加1滴4%NaOH溶液,然后邊振蕩試管邊逐滴加入2%的稀氨水,至最初產生的沉淀恰好溶解為止制得銀氨溶液,再滴入3滴乙醛,振蕩后將試管放在熱水浴中溫熱,觀察并記錄實驗現象。
或在潔凈的試管中加入1 mL 2%的AgNO3溶液,然后邊振蕩試管邊逐滴加入2%的稀氨水,至最初產生的沉淀恰好溶解為止,調整pH值在11左右,制得銀氨溶液,再滴入3滴乙醛,振蕩后將試管放在熱水浴中溫熱,觀察并記錄實驗現象。
四、反思
1、在使用化學教材的過程中,遇到困惑時,不能放過,需要去質疑、去探索,去偽存真。通過對這次沒有成功的乙醛銀鏡反應實驗的探究,知道影響乙醛銀鏡反應效果的因素,NaOH溶液作用是形成AgOH需要OH-,明白了試驗不成功的原因,確保實驗效果明顯。
2、從教師專業(yè)成長的角度看,要善于及時記錄自已在教學中的新發(fā)現、新見解、新問題,通過分析、實驗探究、反思等方式不斷自我完善,提升自己的專業(yè)素養(yǎng),不斷發(fā)展和提高教學水平。
參考文獻
[1]宋心琦.普通高中課程標準實驗教科書·有機化學基礎[M].北京:人民教育出版社,2007,2
[2]武漢大學.分析化學(第四版)[M].北京:高等教育出版社,2000
[3]北京師范大學化學系有機教研室.有機化學實驗[M].北京:北京師范大學出版社,1993:77
doi:10.3969/j.issn.1008-0546.2016.02.031
文章編號:1008-0546(2016)02-0092-02
中圖分類號:G632.41
文獻標識碼:B

