千島湖島嶼社鼠的擴散特征
張新玉, 王 華, 鮑毅新, 王艷妮, 葉 彬
浙江師范大學生態研究所, 金華 321004
千島湖島嶼社鼠的擴散特征
張新玉, 王華, 鮑毅新*, 王艷妮, 葉彬
浙江師范大學生態研究所, 金華321004
摘要:2009年7月—11月,2010年3月—11月對千島湖兩個島嶼上的社鼠(Niviventer confucianus)種群進行標志重捕,通過分析擴散個體的性別、年齡及擴散距離等,探討陸橋島嶼環境下社鼠的擴散特征。研究結果顯示:島嶼環境下社鼠的擴散率為37.96%,不同季節社鼠的擴散率存在差異,社鼠傾向于在春季發生擴散,尤其是3月份,社鼠擴散個體數最多;對于整個捕獲史而言,雌雄擴散個體數存在極顯著的差異(2=12.542,df=1,P<0.001),雄性個體更傾向于發生擴散;而在繁殖高峰期,當懷孕鼠存在時,雄性擴散數亦大于雌性,兩者存在顯著差異(2=4.504,df=1,P=0.034)。擴散個體體重的季節差異不顯著;擴散與社鼠的年齡密切相關,社鼠更加傾向于在亞成年階段發生擴散;另外,家群大小對社鼠擴散個體數量也有顯著影響,家群越大,擴散個體越多;對擴散距離進行分析發現存在顯著的性別差異(t=-9.229,df=50,P<0.001),雌性個體的平均擴散距離為(282.97±16.14) m,顯著大于雄性的(146.70±6.80) m,而擴散距離與年齡、體重、最大活動距離均無顯著相關性。
關鍵詞:社鼠;擴散;婚配制度;千島湖島嶼
擴散是生物物種生活史中一個最基本的階段或過程[1],是指生物通過某種方式在某個時間尺度從一個地點向另一地點的被動或主動的運動,并在后一地點可能繁殖后代[2]。擴散不僅有利于生物個體擴展其分布區,還避免了近交、種內競爭以及近緣個體之間的競爭[3]。但也面臨著巨大的成本,如死亡率提高[4]、捕食風險增加和遭遇新的疾病的風險提高[5]等。在動物擴散過程中婚配制度與其擴散策略密切相關,在一夫多妻婚配制度中雌性往往表現為戀巢,雄性為尋找配偶資源更傾向于擴散即性別偏倚性擴散。在國內對開放生境或人為圍欄條件下的布氏田鼠(Microtusbrandti)[6]、東方田鼠(Microtusfortis)[7]、達烏爾鼠兔(Ochtonadaurica)[8]等小型獸類的擴散研究較多,但是在島嶼環境下的擴散研究較少。
社鼠(Niviventerconfucianus)隸屬哺乳綱(Mammalia)、嚙齒目(Rodentia)、鼠科(Muridae)、白腹鼠屬(Niviventer),為東洋界常見嚙齒動物,主要棲息環境包括灌木草叢、荒坡、農田等。在我國除寧夏、新疆、黑龍江外其他各省均有分布[9]。以往對社鼠的種群年齡結構[10- 12],種群數量和最大活動距離[13- 14]、繁殖生態、巢區和領域[15- 16]等進行了相關研究,但對該鼠的擴散問題尚未涉及。本文選取天然圍欄千島湖島嶼的社鼠為研究對象,對其擴散的性別差異、季節差異、年齡差異和擴散距離等進行分析,旨在驗證假設:(1)千島湖島嶼環境下的社鼠的擴散表現出偏雄性。(2)社鼠的擴散存在季節差異性。(3)社鼠更傾向于在未成年階段發生擴散。(4)社鼠的擴散距離與社鼠性別、體重、年齡及最大活動距離存在一定的相關性。
1研究地區概況及研究方法
1.1研究地區概況
研究樣地位于浙江省淳安縣千島湖境內,是因修建新安江水庫而形成的人工湖泊,面積為2500 m2以上的島嶼有1078個,是典型的陸橋島嶼化生境。研究樣地選取桐子塢鄉范圍內的A島(29°33′27.37″N,118°52′51.55″E)和B島(29°33′56.96″N,118°53′30.43″E),面積分別為55400 m2和58000 m2。兩島嶼上植被均由闊葉林、針葉林及灌木等組成[17- 18]。
1.2野外種群標志重捕
2009年7—11月及2010年3—11月進行了社鼠的標志重捕[13],使用捕鼠籠(24 cm×12 cm×12 cm)分別對A島、B島的社鼠個體進行標志重捕。每月標志重捕10 d,以足夠量的紅棗為餌料,當日下午將捕鼠籠按樁號放置,次日上午檢查捕獲狀況。對首次捕獲的社鼠個體采用改進的切趾法(Toe-clipping)進行標記并編號[19],作為鑒別每只社鼠個體的身份依據。將切趾肌肉樣本保存于無水乙醇,用于遺傳分析。同時記錄捕獲位置樁號、捕獲日期、社鼠切趾編號、性別、體重(精確到0.1 g)、雄鼠睪丸是否下降、雌鼠是否懷孕(檢查陰道開閉狀況、有無分泌物及乳頭特征)和其他形態特征(如體長、尾長、后足長以及受傷、體毛脫落等,可作為個體身份鑒別的輔助依據)[13, 17, 20]。根據社鼠的睪丸下降和懷孕等繁殖特征,判斷社鼠的繁殖狀況。
在A島共捕獲96只社鼠,其中在多個捕獲期被捕獲的有73只,已確定親緣關系的有71只,共分為12個家群;在B島共捕獲81只社鼠,多個捕獲期被捕獲的有64只,已確定親緣關系的有49只,共分為11個家群[19]。
1.3季節和年齡組劃分
根據千島湖地區氣候特點,將每年的3—5 月劃分為春季,6—8 月劃分為夏季,9—11 月劃分為秋季。將每月捕獲的社鼠個體按體重劃為幼年組、亞成年組、成年組和老年組[10],其中體重≤35.0 g為幼年組,35.0 g<體重≤50.0 g為亞成年組、50.0 g<體重≤80.0 g為成年組,體重>80.0 g為老年組[10- 11],參考后足長為第二指標進行糾正。
1.4數據處理及統計分析
擴散個體確定:當一個個體離開自己家群的巢區范圍,擴散到其它家群或在新地域建立自己的巢區,并在新的棲息地定居(在新棲息地連續2個或2個以上捕獲期捕獲)時,將其定義為擴散個體;根據所確定的親緣關系,若親本已確定為未擴散個體,而子代在重捕時未觀察到擴散行為,但在遠離母本的新棲息地連續2個或2個以上捕獲期被捕獲時,也將其定義為擴散個體。
各季節擴散個體的確定:當某個體在新棲息地首次捕獲時,則作為該季節的擴散個體,在下一季節該個體不作為擴散個體而作為定居個體。
擴散距離的確定:為擴散個體新巢區中心與原巢區中心之間的距離,并運用Biotas 2.0[21]中的標尺進行計算測量。由于所選島嶼形狀無規則并呈突出的半島狀,某些個體活動時會繞過半島水灣,因此島嶼內連續區域(新巢區中心與原巢區中心之間無水灣隔離),擴散距離為兩個巢區中心的直線距離;非連續區域(新巢區中心與原巢區中心之間有水灣隔離),擴散距離按折線距離[14]計算。
家群大小的確定:將在一個世代周期內,同一母本所產后代與其兩親本一并視為一個家群(family group)[22],家群大小按擴散前家群內個體數計算。
擴散的性別差異:整個捕獲史中雄性擴散個體數與雌性擴散個體數的差異。擴散的季節差異分析:擴散個體為發生在該季節擴散的個體,未擴散的個體為該季節中未發生擴散的個體;按月份進行作圖時,擴散個體數為在該月發生擴散的個體數。擴散的年齡差異:劃分為幼年、亞成年、成年3個年齡階段,由于老年個體發生擴散極少,差異分析時將其劃為成年。發生擴散的個體為社鼠在該年齡階段發生擴散的個體,未發生擴散的個體為整個捕獲史中經歷過該年齡階段而未發生擴散的社鼠。按月份進行作圖時,擴散個體比率為該月捕獲不同年齡階段發生擴散的個體數與該月捕獲不同年齡階段的個體數的比值。
采用SPSS 21.0數據分析軟件[23]對數據進行統計分析。其中擴散的性別差異,季節差異,年齡差異采用卡方檢驗進行分析。擴散個體體重的季節差異以及擴散距離與年齡組的差異采用單因素方差分析。兩島相同季節擴散個體的平均體重的差異以及擴散距離與性別的關系采用獨立樣本T檢驗分析。相關性分析均采用線性回歸分析;利用 Kolmogorov-Smirnov檢驗數據是否符合正態分布,若不符合,則對數據進行自然對數轉換進而使用獨立樣本T檢驗或單因素方差分析,若仍不符合方差分析條件,則使用 Mann-Whitney U test 進行非參數檢驗。顯著和極顯著水平分別為P≤0.05和P≤0.01。用Origin 9.0[24]進行作圖。
2結果2.1擴散個體的數量和性別差異
在A、B兩島共有多個捕獲期的社鼠137只,其中擴散個體為52只,擴散率為37.96%。其中A島為73只(♂40只,♀33只),擴散個體為32只,擴散率為43.84%;B島為64只(♂31,♀33),擴散個體為20只,擴散率為31.25%。
A島擴散的雄鼠占擴散個體數的71.88%(23/32),雌鼠占28.12%(9/32),雌雄擴散個體數存在極顯著差異(2=6.711,df=1,P=0.01);B島擴散的雄鼠占70.00%(14/20),雌鼠占30.00%(6/20),亦存在顯著差異(2=5.416,df=1,P=0.02)。將A、B島合并經卡方檢驗雌雄擴散個體數存在極顯著的差異(2=12.542,df=1,P<0.001)。
2.2擴散的季節差異
A,B兩島嶼的數據合并統計分析,春季捕獲90只,其中擴散個體38只;夏季捕獲68只,擴散個體9只;秋季捕獲37只,擴散個體5只。不同季節之間存在極顯著差異(2=20.683,df=2,P<0.001),其中春季與夏季(2=15.574,df=1,P=0.001)和春季與秋季之間(2=9.650,df=1,P=0.002) 存在極顯著差異,而夏季和秋季之間不存在差異(2=0.002,df=1,P=0.968)。
在A 島,春季捕獲52只,其中擴散個體23只;夏季捕獲43只,擴散個體6只;秋季捕獲23只,擴散個體3只。不同季節的擴散個體數之間存在極顯著差異(2=13.780,df=2,P=0.001),其中春夏兩季(2=10.174,df=1,P=0.001)和春秋兩季之間(2=6.848,df=1,P=0.009)均存在極顯著差異,而夏秋兩季之間無顯著差異(2=0.011,df=1,P=0.918)。
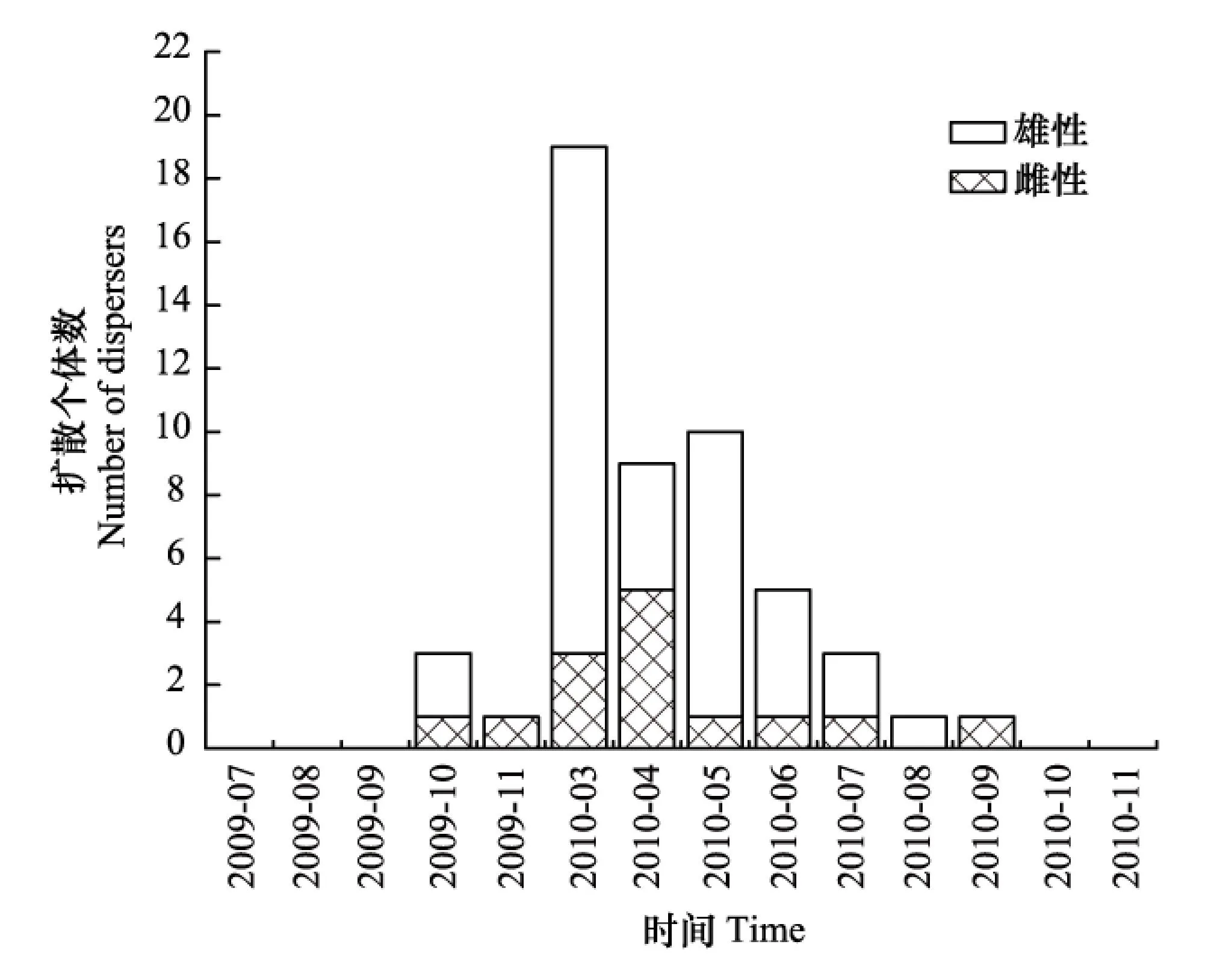
圖1 擴散個體數的季節變化Fig.1 Seasonal variation in number of dispersers
在B島,春季捕獲38只,擴散個體15只;夏季捕獲25只,擴散個體3只;秋季捕獲14只,擴散個體2只。不同季節間存在差異(2=7.135,df=2,P=0.028),其中春夏兩季存在極顯著差異(2=5.557,df=1,P=0.018),春秋兩季(2=2.950,df=1,P=0.086)和夏秋兩季之間(2=0.042,df=1,P=0.838)均無顯著差異。
分析結果可見,社鼠傾向于在春季發生擴散。將A,B兩島擴散數據合并后作圖,其中橫坐標為捕鼠月份,縱坐標為擴散個體數。由圖可知,尤其是3月份,社鼠擴散個體數最多(圖1)。
2.3擴散個體體重的季節差異
A島春、夏、秋3個季節擴散個體的平均體重分別為(44.24±2.04) g、(39.10±5.97) g和(41.90±6.26) g,單因素方差分析表明不同季節之間擴散個體的平均體重無顯著差異(F2,29=0.557,P=0.579),兩兩比較結果表明春夏季(P=0.308)、春秋季(P=0.726)和夏秋季之間(P=0.717)均無顯著差異。B島不同季節擴散個體的平均體重分別為(44.11±1.55) g、(47.65±3.02) g和(77.37±0.86) g,單因素方差分析表明季節之間擴散個體的平均體重存在差異(F2,17=5.226,P=0.017),兩兩比較結果表明春夏兩季之間不存在顯著差異(P=0.294),而在春秋兩季(P=0.006)和夏秋兩季之間(P=0.008)存在極顯著差異。
對A、B兩島相同季節擴散個體的平均體重進行獨立樣本t檢驗,結果顯示兩島之間春季(t=-0.584,df=36,P=0.563)、夏季(t=1.097,df=7,P=0.309)擴散個體的平均體重均無顯著差異,而在秋季有極顯著差異(t=-25.4,df=3,P<0.001)。秋季的體重差異可能受到A、B島擴散個體樣本數偏少的影響。
2.4擴散個體的年齡差異
將A,B兩島嶼的數據合并進行統計分析,歷經幼年階段的共有75只,其中擴散個體14只(♂9,♀5);歷經亞成年階段有97只,擴散個體30只(♂21,♀9);歷經成年階段有107只,其中擴散個體8只(成年♂7,老年♂1)。不同年齡階段之間存在極顯著差異(2=18.452,df=2,P<0.001),其中幼年與亞成年之間無差異(2=3.340,df=1,P=0.068),幼年與成年之間(2=5.196,df=1,P=0.023)具顯著差異,而亞成年和成年階段之間存在極顯著差異(2=18.460,df=1,P<0.001)。
A島捕獲的個體中歷經幼年階段共有36只,其中擴散個體7只(♂5,♀2);歷經亞成年階段有51只,擴散個體20只(♂13,♀7);歷經成年階段有55只,其中擴散個體5只(♂5)。不同年齡階段的擴散個體存在極顯著差異(2=14.020,df=2,P=0.001),其中幼年和亞成年之間有顯著差異(2=3.854,df=1,P=0.050),幼年和成年無顯著差異(2=2.037,df=1,P=0.153),亞成年和成年有極顯著差異(2=13.325,df=1,P<0.001)。
B島歷經幼年有39只,擴散個體7只(♂4,♀3);歷經亞成年有46只,擴散個體10只(♂8,♀2);歷經成年和老年52只,擴散個體3只(成年♂2,老年♂1)。不同年齡階段之間無差異(2=5.484,df=2,P=0.064),其中幼年與亞成年(2=0.190,df=1,P=0.663)和幼年與成年之間(2=3.380,df=1,P=0.066)無顯著差異,而亞成年和成年階段之間存在顯著差異(2=5.410,df=1,P=0.020)。
分析結果顯示,社鼠更加傾向于在未成年階段發生擴散,尤其是亞成年階段。將A,B兩島合并后作圖(圖 2)。由此可知,在大部分發生擴散的月份中亞成年個體擴散的比率要高于其他年齡階段的社鼠。
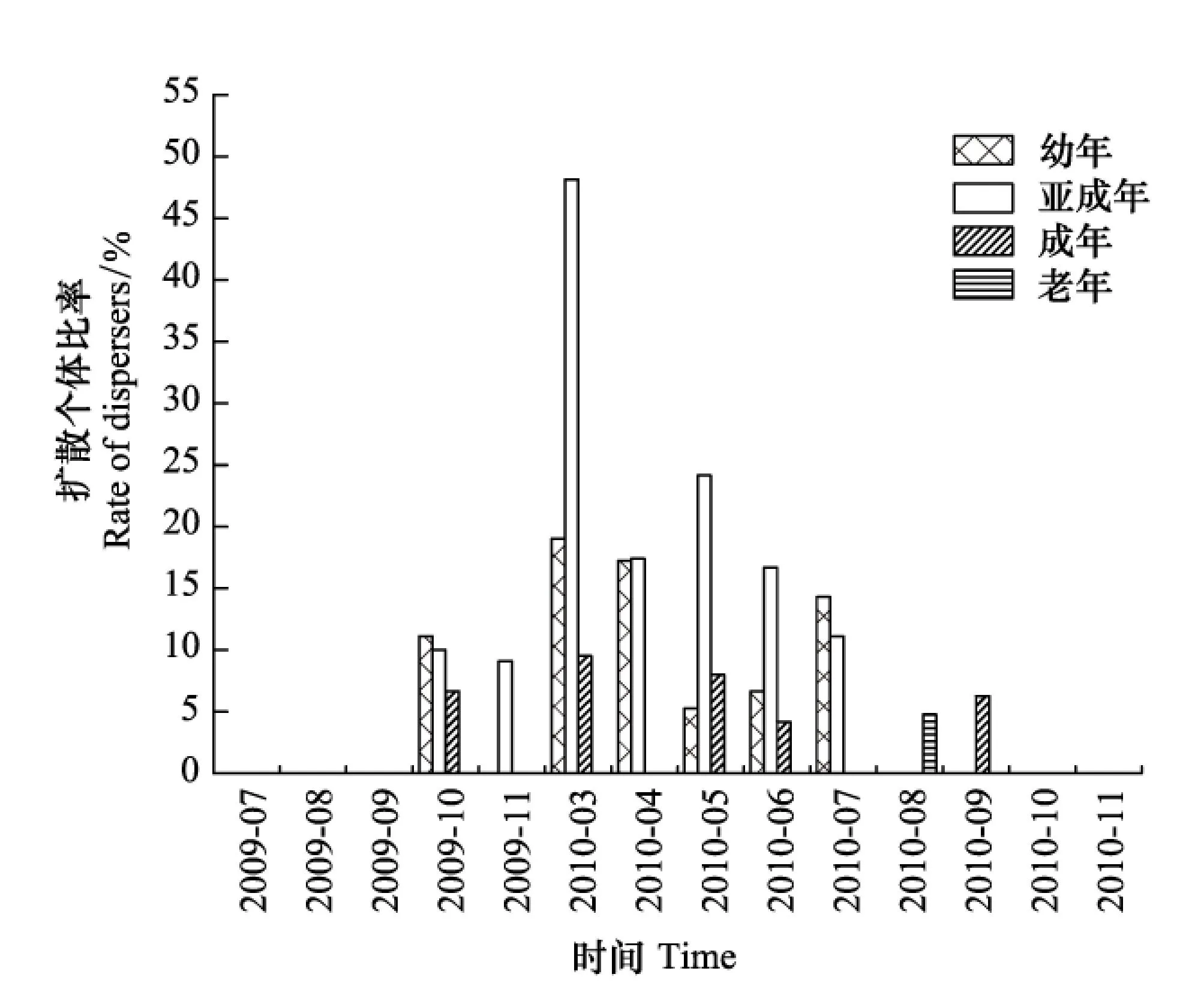
圖2 擴散個體的年齡差異Fig.2 Age variation in dispersers
2.5懷孕鼠的存在對擴散的影響
A島共記錄10只雌鼠具明顯的懷孕特征,其中6只懷孕發生在4—5月,1只發生在7月,3只發生在9—10月。B島共記錄了5只懷孕鼠,其中3只懷孕發生在4—5月,2只發生在9—10月。
2.5.1懷孕鼠的存在對整個捕獲史擴散的影響
A島的33只雌鼠中,捕獲史歷經懷孕階段的個體10只。其中3只為擴散個體,懷孕時已經完成定居,7只為未擴散個體。排除懷孕雌鼠后對A島擴散雌雄個體數進行卡方檢驗,結果發現A島雌雄個體擴散數存在顯著差異(2=5.801,df=1,P=0.016)。B島的33只雌鼠中,捕獲史歷經懷孕階段的個體5只。其中1只為擴散個體,懷孕時已經完成定居,4只為未擴散個體。排除懷孕雌鼠后對B島擴散雌雄個體數進行卡方檢驗,結果發現B島雌雄個體擴散數存在顯著差異(2=5.024,df=1,P=0.025)。A,B兩島數據合并后,發現雌雄擴散個體數存在極顯著差異(2=11.603,df=1,P=0.001)。
2.5.2懷孕鼠的存在對繁殖高峰期擴散的影響
A島4—5月份擴散13只(♂9,♀4),捕獲44只(♂21,♀23),其中懷孕鼠6只。B島擴散6只(♂4,♀2),捕獲32只(♂15,♀17),其中懷孕鼠3只。由于A,B兩島4—5月份擴散雌鼠均未達到統計要求,故將A,B兩島數據進行合并統計分析。結果顯示,懷孕鼠存在時,雄性擴散數大于雌性,兩者存在顯著差異(2=4.504,df=1,P=0.034),去除懷孕鼠后,雌雄社鼠的擴散個體數并不顯著(2=2.302,df=1,P=0.129)。
2.6雄性亞成年時期個體性成熟對擴散的影響
A島13只雄性亞成年擴散個體中,睪丸下垂的個體5只,未下垂的8只。未發生擴散的14只亞成年雄性個體中,睪丸下垂的2只,未下垂的12只。在擴散比例上,性成熟的個體(71.4%)明顯高于未成熟的個體(40%)。B島8只雄性亞成年擴散個體中,睪丸下垂的1只,未下垂的7只。未發生擴散的17只雄性個體中,睪丸下垂1只,未下垂16只。在擴散比例上,性成熟個體(50%)明顯高于未下垂個體(30.4%)。雖然數據達不到統計分析要求,但從比例上看雄性亞成年時期性成熟的個體更趨向于發生擴散。
2.7家群大小對擴散的影響
對A島的12個家群和B島的11個家群進行分析,結果表明家群大小與擴散的個體數呈極顯著的正相關性(A島:R2=0.847,F1,10=55.542,P<0.001;B島:R2=0.775,F1,9=31.032,P<0.001), 回歸方程分別為,A島y=0.456x-0.982,B島為y=0.395x-0.621, 其中y代表擴散個體數,x代表家群大小(圖3)。
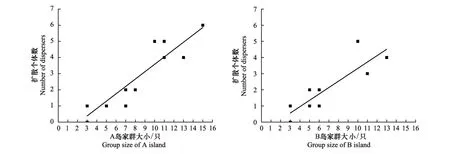
圖3 社鼠家群大小與擴散個體數的相關性Fig.3 Correlations between group size of Niviventer confucianus and number of total dispersers
2.8擴散距離2.8.1擴散距離與性別的關系
對A島32個及B島20個擴散個體計算擴散距離,結果表明,A島擴散個體的平均擴散距離為 (184.23±14.39) m,其中雄性為(141.37±5.67) m,雌性為(293.75±23.23) m,雌雄個體之間的擴散距離存在極顯著差異(t=-9.04,df=30,P<0.001)。B島擴散個體的平均擴散距離為(188.87±16.93) m,其中雄性為(155.47±15.48) m,雌性為(266.81±21.03) m,雌雄個體間存在極顯著的差異(t=-4.060,df=18,P<0.001)。分別對A、B兩島的雄鼠與雄鼠、雌鼠與雌鼠的擴散距離進行獨立樣本t檢驗,A、B兩島的雄鼠之間(t=1.006,df=35,P=0.322)和雌鼠之間(t=-0.807,df=13,P=0.434)的擴散距離均無顯著差異。
將A、B兩島數據合并后分析,雌性個體的平均擴散距離為(282.97±16.14) m,雄性為(146.70±6.80) m,獨立樣本t檢驗表明雌雄個體間存在極顯著差異(t=-9.229,df=50,P<0.001)。
2.8.2擴散距離與年齡組的關系
A島幼年組的平均擴散距離為(170.82±32.20) m,亞成年組為(193.60±20.17) m,成年組為(165.50±11.07) m,單因素方差分析結果顯示不同年齡組之間的擴散距離不存在顯著差異(F2,29=0.345,P=0.711)。B島幼年組的平均擴散距離為(212.80±30.22) m,亞成年組為(175.97±23.81) m,成年組為(187.70±79.16) m,老年組為152.63 m,不同年齡組之間的擴散距離亦無顯著差異(F3,16=0.366,P=0.779)。結果表明擴散距離與個體年齡無關。
2.8.3擴散距離與體重的關系
A島擴散個體發生擴散時平均體重為(42.93±1.87) g,B島為(47.30±4.24) g。將A、B兩島擴散個體的擴散期體重和擴散距離進行對數處理后再進行相關性分析,結果顯示兩者相關性不顯著(A島:R2=0.003,F1,30=0.082,P=0.776;B島:R2=0.005,F1,18=0.089,P=0.769)。
2.8.4擴散距離與最大活動距離的關系
A島擴散個體的平均最大活動距離為(118.55±10.77) m,B島為(84.31±9.13) m。統計分析表明,擴散個體的擴散距離與其最大活動距離相關性不顯著(A島:R2=0.005,F1,30=0.134,P=0.708;B島:R2=0.014,F1,18=0.253,P=0.621)。
3討論
3.1擴散個體的數量及性別差異
自然界中動物擴散的方式和原因較為復雜,種群密度[25]、食物[26]、棲息地質量[27]和生殖收益[28]等因素都會影響個體的擴散方式。發生擴散的個體數量與可利用的資源成反比,與種群內的壓力成正比。若能夠利用的食物及空間資源越少,則種群內個體間的競爭壓力越大,個體為了尋找更適合的生存領域,更傾向于發生擴散。對于島嶼而言,由于其與陸地交流基本隔絕,嚙齒類動物很難跨越水域障礙擴散到其他島嶼。對于島嶼上的優勢種社鼠來說,可利用的食物和空間資源量有限,導致了其種群內個體間的競爭壓力遠大于陸地種群。本研究發現島嶼生境中社鼠的擴散率遠高于陸地的長爪沙鼠(Merionesunguiculatus)[29]和東方田鼠[7]。
有研究表明不同家群間的擴散存在性別差異[30- 31]。如野外自然條件下小家鼠(Musmusculus)擴散的研究表明雌性比雄性更容易加入到其它群體中,雖然冒著環境資源的丟失或死亡的危險,但在到達一個新地方,可以獲得更多的繁殖機會[32]。資源競爭(resource competition hypothesis)和避免近交假設(inbreeding avoidance hypothesis)認為,由于雌雄個體競爭的關鍵性資源不同,不同性別擴散個體具有不同的風險與收益[33]。對53個根田鼠(Microtusoeconomus)家群的研究發現,雄性個體為避免近親繁殖,長距離擴散的個體多體現為雄性偏倚性擴散[34]。哺乳動物社群中,雌體競爭的主要資源是食物和空間,并具有較強的領域行為,而雄體競爭的主要資源是配偶。因此,雌體從戀巢行為中,較雄體能獲取更多的利益,而雄體通過擴散以避免近交繁殖[33]。本研究中社鼠的擴散從整個捕獲史而言表現出偏雄性擴散。雄鼠可能為了避免近親繁殖或獲得更多的繁殖機會而進行擴散,該點有待于進行進一步的遺傳學驗證。然而在繁殖高峰期擴散顯然受到懷孕雌鼠的影響。這種影響可能會導致兩種結果,一是懷孕鼠的存在可能導致了其他社鼠,尤其是雌性社鼠的擴散,因為4月份雌性社鼠的擴散個體數明顯高于其他各月(圖 2)。二是由于雌性社鼠的懷孕,導致雌性社鼠的擴散率降低,因為研究中并沒有發現社鼠在懷孕時發生擴散的現象。
3.2擴散發生的季節及年齡差異
擴散發生的季節不僅與種群的數量動態以及種群的結構特征密切相關,而且與該季節領域內的資源的豐富度等有關。研究長爪沙鼠的擴散行為時發現,擴散的季節性變化與其生活史特征密切相關,在繁殖期的擴散行為主要與繁殖活動有關,在貯食期越冬鼠擴散者可能是由于在家群中沒有繁殖機會而主動擴散[29]。野生小家鼠為獲得充足的食物資源其擴散情況也隨季節變化而不同[32]。已有研究表明千島湖島嶼環境下社鼠的繁殖高峰期為春季4—5月和秋季9—10月,且秋季繁殖在11月份基本結束[16]。本次研究發現擴散主要發生在春季,且3月份達到最高值,隨后逐漸下降。社鼠的擴散與種群的繁殖行為以及繁殖后種群數量增加有關,繁殖高峰前期親代或子代為了尋找配偶,避免近親繁殖,因此部分個體更傾向于發生擴散,擴散個體數也達到峰值。Begon 和 Motro 等[35- 38]認為, 近親繁殖導致動物后代發生近交衰退、后代畸形率和死亡率上升等不利的結果,是一些物種的亞成體發生擴散的選擇壓力。本研究中A島亞成年階段個體的擴散與其他年齡階段存在極顯著差異,B島亞成年階段雖然與幼年階段在統計上沒有顯著差異,但擴散數量上高于幼年個體。同時A、B(除秋季)兩島各個季節發生擴散的個體的平均體重均為45 g左右,說明擴散個體也傾向于在亞成年階段發生擴散。幼年個體由于其活動能力有限,只有少部分會發生擴散;成年個體因其處于群體中的優勢地位,對資源及配偶的競爭具有一定的優勢;而亞成年個體則迫于資源和生殖壓力,更傾向于發生擴散。
3.3家群大小對擴散的影響
對長爪沙鼠的研究表明,擴散前家群大小對家群中擴散個體數量有一定影響,擴散前集群數量大的家群,擴散個體數較多,反之則越少[29]。本研究中,島嶼社鼠的家群大小與擴散的個體數之間也呈極顯著正相關性(圖3)。家群越大對資源的競爭就越激烈,家群的大小一定程度上體現了配偶資源競爭壓力的大小,說明種群內的配偶資源的競爭壓力可能是導致種群內個體發生擴散的原因之一。
3.4擴散距離

參考文獻(References):
[1] Walters J R. Dispersal behavior: an ornithological frontier. The Condor, 2000, 102(3): 479- 481.
[2]Howard W E. Innate and environmental dispersal of individual vertebrates.The American Midland Naturalist, 1960, 63(1): 152- 161.
[3]Clobert J, Danchin E, Dhondt A A, Nichols J D. Dispersal.Oxford: Oxford University Press, 2001.
[4]Johnson M L, Gaines M S. Evolution of dispersal: theoretical models and empirical tests using birds and mammals. Annual Review of Ecology and Systematics, 1990, 21: 449- 480.
[5]肖治術, 張知彬. 小議生物擴散. 生物學通報, 2006, 41(7): 27- 28.
[6]胡曉鵬. 布氏田鼠擴散研究[D]. 北京: 中國農業大學, 2005.
[7]楊月偉, 劉季科, 劉震. 東方田鼠種群擴散及活動對外部因子的反應格局. 生態學報, 2005, 25(6): 1523- 1528.
[8]王夢軍, 鐘文勤, 宛新榮, 王廣和. 達烏爾鼠兔擴散過程中的生境選擇. 動物學報, 1998, 44(4): 398- 405.
[9]鮑毅新. 社鼠的研究概要. 浙江師范大學學報: 自然科學版, 1993, 16(2): 50- 54.
[10]鮑毅新, 諸葛陽. 社鼠的年齡鑒定與種群年齡組成. 獸類學報, 1984, 4(2): 127- 137.
[11]張潔. 社鼠種群生態研究. 獸類學報, 1993, 13(3): 198- 204.
[12]王淯, 胡錦矗, 諶利民. 社鼠種群年齡結構的回歸分析. 四川動物, 2003, 22(3): 159- 162.
[13]張旭, 鮑毅新, 劉軍, 林杰君, 沈良良, 王艷妮. 陸橋島嶼環境下社鼠種群數量的估算方法. 生態學報, 2012, 32(5): 1562- 1569.
[14]葉彬, 沈良良, 鮑毅新, 張旭. 年齡、性別及季節因素對千島湖島嶼社鼠最大活動距離的影響. 生態學報, 2013, 33(11): 3311- 3317.
[15]張美文, 黃璜, 王勇, 李波. 洞庭湖區社鼠的繁殖生態. 生態學報, 2006, 26(3): 884- 894.
[16]孫波, 鮑毅新, 張龍龍, 趙慶洋. 千島湖秋季社鼠種群年齡結構及繁殖狀況初探. 獸類學報, 2009, 29(3): 269- 276.
[17]沈良良, 鮑毅新, 張旭, 魏德重, 劉軍. 千島湖社鼠巢區面積的季節變化與性別差異. 浙江師范大學學報: 自然科學版, 2011, 34(3): 328- 332.
[18]沈良良. 千島湖島嶼社鼠的巢區和領域研究[D]. 金華: 浙江師范大學, 2011.
[19]Wan X R, Zhong W Q. A revised convenient toe-clipping system for rodent species. Chinese Journal of Zoology, 2000, 35(4): 22- 24.
[20]Wang Y N, Liu W, Wang G M, Wan X R, Zhong W Q. Home range sizes of social groups of Mongolian gerbilsMerionesunguiculatus. Journal of Arid Environments, 2011, 75(2): 132- 137.
[21]Vaughan C, Ramírez O, Herrera G, Guries R. Spatial ecology and conservation of two sloth species in a cacao landscape inLimón, Costa Rica. Biodiversity and Conservation, 2007, 16(8): 2293- 2310.
[22]葉彬. 千島湖島嶼社鼠的親權鑒定和家群分析[D]. 金華: 浙江師范大學, 2013.
[23]Statistics I B M S. IBM SPSS Statistics 21. 0 for Windows.Chicago: IBM, 2012.
[24]May R A, Stevenson K J. Software review of Origin 8. 0. Journal of the American Chemical Society, 2009, 131(2): 872- 872.
[25]Ergon T, Ergon R, Begon M, Telfer S, Lambin X. Delayed density-dependent onset of spring reproduction in a fluctuating population of field voles. Oikos, 2011, 120(6): 934- 940.
[26]周建偉, 花立民, 左松濤, 蘇軍虎, 王巧玲. 高原鼢鼠棲息地的選擇. 草業科學, 2013, 30(4): 647- 653.
[27]Haughland D L, Larsen K W. Exploration correlates with settlement: red squirrel dispersal in contrasting habitats. Journal of Animal Ecology, 2004, 73(6): 1024- 1034.
[28]Sterck E H M, Willems E P, Van Hooff J A R A M, Wich S A. Female dispersal, inbreeding avoidance and mate choice in Thomas langurs (Presbytisthomasi). Behaviour, 2005, 142(7): 845- 868.
[29]王艷妮. 長爪沙鼠巢區及擴散模式的研究[D]. 北京: 中國科學院動物研究所, 2008.
[30]Bowler D E, Benton T G. Causes and consequences of animal dispersal strategies: relating individual behaviour to spatial dynamics. Biological Reviews, 2005, 80(2): 205- 225.
[31]Pasch B, Koprowski J L. Sex differences in space use of Chiricahua fox squirrels. Journal of Mammalogy, 2006, 87(2): 380- 386.
[32]Pocock M J O, Hauffe H C, Searle J B. Dispersal in house mice. Biological Journal of the Linnean Society, 2005, 84(3): 565- 583.
[33]Perrin N, Mazalov V. Dispersal and inbreeding avoidance. The American Naturalist, 1999, 154(3): 282- 292.
[34]Gundersen G, Andreassen H P. Causes and consequences of natal dispersal in root voles,Microtusoeconomus. Animal Behaviour, 1998, 56(6): 1355- 1366.
[35]Bélichon S, Clobert J, Massot M. Are there differences in fitness components between philopatric and dispersing individuals? ActaOecologica, 1996, 17(6): 503- 517.
[36]Motro U. Avoiding inbreeding and sibling competition: the evolution of sexual dimorphism for dispersal. The American Naturalist, 1991, 137(1): 108- 115.
[37]Arcese P. Intrasexual competition, mating system and natal dispersal in song sparrows. Animal Behaviour, 1989, 38(6): 958- 979.
[38]Wolff J O. Why are female small mammals territorial? Oikos, 1993, 68(2): 364- 370.
[39]Sutherland G D, Harestad A S, Price K, Lertzman K P. Scaling of natal dispersal distances in terrestrial birds and mammals. Conservation Ecology, 2000, 4(1): 16- 16.
[40]Saitoh T. Sexual differences in natal dispersal and philopatry of the grey-sided vole. Researches on Population Ecology, 1995, 37(1): 49- 57.
[41]陳越華. 布氏田鼠婚配制度的研究進展. 生物學通報, 2004, 39(8): 7- 9.
[42]張建軍, 張知彬. 動物的婚配制度. 動物學雜志, 2003, 38(2): 84- 89.
Dispersal characteristics of populations of Chinese white-bellied rats (Niviventerconfucianus) in the Thousand Island Lake region
ZHANG Xinyu, WANG Hua, BAO Yixin*, WANG Yanni, YE Bin
InstituteofEcology,ZhejiangNormalUniversity,Jinhua321004,China
Abstract:We trapped two populations of Niviventer confucianus in the Thousand Island Lake region using the capture-mark-recapture (CMR) method from July to November 2009 and from March to September 2010, and explored the dispersal characteristics of the N. confucianus populations. The Biotas 2.0 software was used to calculate the dispersal distance. The 2 test was used to analyze the effects of sex, season, and age on the number of dispersers. One-way analysis of variance (ANOVA) was used to analyze the seasonal differences in body weight of the dispersers and the effects of age on the dispersal distance. The t test for independent samples was used to analyze the body weight differences between dispersers on two islands in the same season and the effect of sex on the dispersal distance. Linear regression analysis was used for correlation analysis. Our results showed that the dispersal ratio of N. confucianus was 37.96%, which is much higher than that of the Meriones unguiculatus and Microtus fortis that lived in the mainland. We considered the possibility that food and space limitations on the islands may lead to a dispersal ratio that is higher than that of mainland populations. The dispersal ratio showed significant differences among seasons, and the dispersal peak occurred in the spring, especially in March. Other studies showed that the peak breeding of N. confucianus occurs in April and May. We believe that the breeding behavior was fully active in the spring, contributing to the larger population size, and the breeding pressure led to the dispersal of some individuals. Sex-biased dispersal was detected, and the males were more likely to disperse (2= 12.542,df = 1,P < 0.001). We assumed that more males dispersed in order to avoid inbreeding or to get more breeding opportunities, but this notion still needs genetic verification. A significant difference was found in the breeding period (2= 4.504,df = 1,P = 0.034) when the pregnant rats were counted, which means that the pregnant females affected the dispersal model during the breeding period. Compared to the immature males at the subadult stage, sexually mature males were likely to disperse. The body weight showed no significant difference between the two sexes. The number of dispersers was related to their age, and more dispersers were found in the subadult group than in the other groups. The juvenile group was limited by their capacity for activity, and the adult group had enough food and spousal resources for their dominant positions in the population, but the subadult group exerted stronger pressure on food resources and reproductive opportunities. There was a significantly positive correlation between the number of dispersers and the size of social groups: the larger social group contained more dispersers. Social-group size reflected the level of competitive pressure on spouse resources, which meant that the social pressure may be the reason for dispersal of N. confucianus. The dispersal distance showed a highly significant difference between males and females: the dispersal distance of females ((282.97±16.14) m) was greater than that of males ((146.70±6.80) m). This phenomenon may be caused by the promiscuity system of N. confucianus or avoidance of inbreeding. Female offspring tended to disperse farther away from the maternal nest to claim a new territory in order to avoid resource competition, while reducing the inbreeding probability. The dispersal distance showed no significant relation with age, body weight, and the maximum movement distance.
Key Words:Niviventer confucianus; dispersal; mating system; thousand Island Lake
基金項目:浙江省自然科學基金(Y507080); 國家自然科學基金項目(31200323); 浙江省自然科學青年基金(LQ12C04001)
收稿日期:2014- 07- 06; 網絡出版日期:2015- 07- 22
DOI:10.5846/stxb201407061386
*通訊作者Corresponding author.E-mail: sky90@zjnu.cn
張新玉, 王華, 鮑毅新, 王艷妮, 葉彬.千島湖島嶼社鼠的擴散特征.生態學報,2016,36(5):1312- 1320.
Zhang X Y, Wang H, Bao Y X, Wang Y N, Ye B.Dispersal characteristics of populations of Chinese white-bellied rats (Niviventerconfucianus) in the Thousand Island Lake region.Acta Ecologica Sinica,2016,36(5):1312- 1320.

