可再生型有機胺脫除SO2的實驗研究
徐宏建, 金吉釗, 孫雅萍, 王美霞, 潘衛(wèi)國
(1. 上海電力學院 環(huán)境與化學工程學院, 上海 200090; 2. 華能山東石島灣核電有限
公司運行部, 山東榮成 264300; 3. 上海發(fā)電環(huán)保工程技術(shù)研究中心, 上海 200090)
?
可再生型有機胺脫除SO2的實驗研究
徐宏建1,3,金吉釗1,孫雅萍2,王美霞1,潘衛(wèi)國3
(1. 上海電力學院 環(huán)境與化學工程學院, 上海 200090; 2. 華能山東石島灣核電有限
公司運行部, 山東榮成 264300; 3. 上海發(fā)電環(huán)保工程技術(shù)研究中心, 上海 200090)
摘要:采用靜態(tài)鼓泡吸收法,對4種有機胺吸收模擬煙氣中SO2的脫硫性能進行了實驗研究,并采用油浴加熱裝置,對4種有機胺的解吸性能進行了研究.結(jié)果表明:有機胺溶液脫硫效率隨時間變化逐漸降低,不同有機胺吸收性能排序依次為哌嗪>乙二胺>DEA>MDEA;在相同解吸溫度下,解吸率隨反應進行逐漸升高;不同有機胺解吸性能優(yōu)劣排序為MDEA>乙二胺>DEA>哌嗪;通過熱力學參數(shù)計算得到MDEA吸收SO2的吉布斯自由能比石灰石吸收SO2的吉布斯自由能更小,說明MDEA吸收SO2的能力比石灰石更好,理論上是一種更合適的脫硫劑.
關(guān)鍵詞:有機胺; 煙氣脫硫; 解吸; 熱力學
為了保護環(huán)境,減少SO2的排放,石灰石石膏法脫硫是目前最為成熟的電廠煙氣脫硫工藝,但該工藝吸收劑原料消耗大,運行費用高,脫硫副產(chǎn)品利用率低,存在設(shè)備易積垢、堵塞、腐蝕和磨損等缺點[1].因此,尋求性能更優(yōu)越的脫硫劑替代品成為研究熱點.與傳統(tǒng)石灰石石膏法脫硫技術(shù)相比,有機胺脫硫技術(shù)可再生使用脫硫劑,回收高濃度SO2,且脫硫效率高,不產(chǎn)生二次污染,從環(huán)保和經(jīng)濟角度考慮都具有廣泛的應用前景[2-3].
國內(nèi)外學者針對有機胺脫硫的合適條件及相關(guān)動力學特征展開研究.Zahiri等[4]進行了有機胺吸收液選擇性吸收混合煙氣中SO2的實驗,研究了脫硫率隨pH、液氣比和進口SO2濃度的變化規(guī)律,確定了合適的反應條件;Tailor等[5]研究發(fā)現(xiàn),N,N-二甲基丙胺對SO2有著很好的吸收和解吸效果,且多次吸收和解吸之后性能仍然不變;Oh等[6]研究了1,8-二氨基-對-薄荷烷(DAM)對SO2的吸收動力學特征,測得其反應速率,發(fā)現(xiàn)該反應為瞬時反應,且在氣液相界面上,氣體的摩爾通量受溶解度和增強因子的影響.在工業(yè)上,加拿大聯(lián)合碳化公司已進行了Cansolv系統(tǒng)脫除SO2的技術(shù)開發(fā)[7],并將該技術(shù)運用于部分火力發(fā)電廠的SO2脫硫系統(tǒng)中,取得了良好的效果[8].
筆者采用靜態(tài)鼓泡吸收實驗裝置,針對不同有機胺吸收SO2的亞硫酸根濃度c(SO32-)、pH緩沖性能、吸收速率、脫硫效率和解吸效率等指標進行模擬研究,并結(jié)合解吸性能實驗對有機胺脫硫劑進行綜合評價.
1實驗部分
1.1有機胺脫硫原理[9]
在液相中,SO2會發(fā)生以下反應:
(1)
(2)
此時溶液中的有機胺可與SO2反應,使SO2在溶液中的溶解量增大,反應如下:
(3)
二元胺反應如下:
R1R2N—R3—NR4R5+2SO2+2H2O←→
(4)
對吸收液采用油浴控溫的方式加熱再生,可使反應式(3)和式(4)向逆方向進行,有機胺吸收劑從富液變回貧液,并得到高濃度的SO2氣體.
1.2實驗裝置與流程
1.2.1有機胺脫除SO2的吸收實驗裝置
有機胺脫除SO2的吸收實驗裝置如圖1所示.SO2的吸收流程為:將100 mL已配好的0.005 mol/L的吸收液放入水浴鍋內(nèi),待溫度保持在50 ℃時,將模擬煙氣(SO2、N2混合氣)通入到吸收液中.模擬煙氣的體積流量為0.2 L/min,間隔一定時間,使用氣相色譜法測量出口煙氣中的SO2濃度,計算吸收率.

1-減壓閥; 2-質(zhì)量流量計; 3-鼓泡吸收器; 4-三通閥; 5-氣相色譜儀; 6-氣體干燥瓶; 7-尾氣吸收瓶.
圖1吸收實驗裝置
Fig.1Experimental setup for the absorption test
1.2.2有機胺脫除SO2的解吸實驗裝置
圖2為有機胺脫除SO2的解吸實驗裝置.SO2的解吸流程為:將有機胺富液轉(zhuǎn)移到燒瓶內(nèi),通過油浴鍋控制溫度.解吸過程中從溶液蒸發(fā)出的水蒸氣經(jīng)過球形冷凝管時被冷卻成水滴,流回燒瓶內(nèi),解吸出的SO2被尾氣吸收瓶吸收,每隔幾分鐘,采用碘量法測定溶液中的c(SO32-),算得解吸率.

1-三口圓底燒瓶; 2-冷凝管; 3-油浴鍋; 4-尾氣吸收瓶.
1.2.3氣相色譜儀的使用
尾氣中SO2濃度的分析可以采用氣相色譜儀檢測,其型號為島津GC-2014,色譜柱為毛細管聚硅酮色譜柱,N2作為載氣,柱溫控制在170 ℃,檢測器是氫火焰離子化檢測器,測定樣品峰高通過外標法進行定量,最小檢測限為1×10-6.
1.2.4溶液中SO42-濃度的測定
溶液中的SO42-濃度采用戴安公司的ICS-90型離子色譜儀(DIONEX)進行檢測,其色譜工作站為Chrmeleon 6.5色譜工作站,抑制器為MMSⅢ型,色譜柱為分析柱AS14A,檢測器為DS5型電導檢測器.色譜中淋洗液體積流量為1.2 mL/min,進樣體積為10 μL,背景電導為20~24 μS,檢測限為0.1~200 mg/L.
1.3吸收和解吸評價指標
吸收和解吸評價主要有以下4個指標.
(1) 使用碘量法測定c(SO32-),按下式計算:
(5)
式中:V1為蒸餾水消耗的硫代硫酸鈉標準溶液量,mL;V2為試樣消耗的硫代硫酸鈉標準溶液量,mL;c(S2O32-)為滴定所用硫代硫酸鈉溶液濃度,mol/L;V(SO32-)為滴定所取試樣體積,mL.
根據(jù)離子色譜測得溶液中SO42-濃度.
(2) 吸收率NA的計算公式如下:
(6)
式中:NA為單位時間單位溶劑體積吸收氣相中SO2的量,mol/(m3·s);p為煙氣壓力,Pa;V為氣體體積流量,m3/s;R為理想氣體常數(shù),8.314 J/(mol·K);T為煙氣溫度,K ;φ1為進口氣體中的SO2體積分數(shù);φ0為出口氣體中SO2體積分數(shù);V吸收液為吸收液體積,L.
(3) 出口尾氣中SO2的含量用氣相色譜儀測定,按下式計算脫硫率ηa:
(7)
(4) 液相中的SO2濃度使用碘量法測定,按下式計算解吸率ηd:
(8)
式中:c(SO32-)0為解吸前溶液中的亞硫酸根濃度,mol/L;c(SO32-)1為解吸后溶液中的亞硫酸根濃度,mol/L.
2結(jié)果與討論
2.1不同濃度二乙醇胺(DEA)的脫硫性能比較
反應條件如下:模擬煙氣量為0.2 L/min,φ(SO2)為0.1%,N2作為平衡氣,吸收溫度為50 ℃.探討不同濃度DEA對SO2的吸收性能.
2.1.1不同濃度DEA溶液pH隨吸收時間的變化
圖3給出了不同濃度DEA溶液pH隨吸收時間t的變化規(guī)律.從圖3可以看出,不同濃度DEA溶液的pH值都是隨吸收時間的增加而下降的,在濃度為0.002 mol/L和0.005 mol/L時,pH值隨吸收時間增加呈現(xiàn)逐階段下降趨勢,初始反應時pH值下降較快,吸收后期趨于平緩.其原因是在反應開始階段,吸收液中水解的OH-被SO2消耗造成pH值急劇下降;反應一段時間后,溶液中的DEA被消耗殆盡,無法水解產(chǎn)生OH-與SO2反應,SO2的吸收得到抑制,溶液pH值下降趨緩.當DEA濃度為0.010 mol/L時,反應初期pH值下降緩慢,70 min后迅速下降,之后下降趨勢又變得緩慢.當DEA濃度為0.020 mol/L時,pH值下降緩慢.對比4條曲線可知,DEA溶液的濃度越高,pH曲線變化越為平緩,這是因為DEA溶液的濃度越高,水解產(chǎn)生的OH-量較多,就能越快補充被SO2消耗的有效活性組分,緩沖性能越好.

圖3 不同濃度DEA溶液pH隨吸收時間的變化
Fig.3pH values of DEA of different concentrations vs. absorption time
2.1.2不同濃度DEA溶液中c(SO32-)和c(SO42-)隨吸收時間的變化
從文獻[10]可知,高濃度的DEA溶液有著更好的吸收效果.圖4中,觀察c(SO32-)隨吸收時間變化的4條曲線可以發(fā)現(xiàn),在進行吸收反應的初始階段,在0.002~0.020 mol/L濃度范圍,c(SO32-)變化不大,這說明在這段時間內(nèi),DEA溶液對SO2的吸收率是相近的.隨著反應的進行,濃度較高(≥0.010 mol/L)的DEA溶液能持續(xù)吸收,吸收容量呈線性增加.而當DEA濃度<0.010 mol/L時,反應40 min后,c(SO32-)的增長趨于平緩,表明低濃度DEA溶液吸收容量有限.
吸收反應過程中,SO2被吸收后在溶液中生成SO32-,其中少量SO32-被溶液中的余氧氧化成SO42-.從圖4可以看出,溶液中的SO42-濃度大致隨吸收時間的增加呈上升趨勢,但90 min內(nèi)上升趨勢不大.這是因為隨著吸收時間的增加,c(SO32-)上升,從而使c(SO42-)上升,但溶液中溶解氧的含量有限,隨著吸收的進行SO32-轉(zhuǎn)化為SO42-的上升趨勢不大.以0.020 mol/L的DEA溶液為例,90 min時溶液中c(SO42-)為0.000 99 mol/L,c(SO32-)為0.013 41 mol/L,c(SO42-)占總硫含量的6.9%,可見溶液中的硫是以SO32-為主要存在形式的.
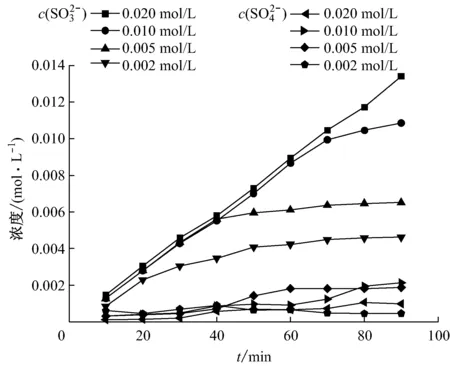
圖4 不同濃度DEA溶液中c(SO32-)和c(SO42-)隨吸收時間的變化
Fig.4c(SO32-) andc(SO42-) in DEA of different concentrations vs. absorption time
2.1.3不同濃度DEA溶液吸收率隨吸收時間的變化
圖5給出了不同濃度DEA溶液吸收率隨吸收時間的變化規(guī)律.從圖5可以看出,高濃度的DEA溶液可以更長時間地維持較高的吸收率.0.002 mol/L DEA溶液吸收SO2的速率從10 min開始低于其他3種濃度DEA溶液,為1.052 68×10-6mol/(L·s),至反應90min時的吸收率更是低至5.332 66×10-8mol/(L·s).而其他3種濃度DEA溶液在反應初始階段,吸收SO2的速率一直維持在1.257 13×10-6mol/(L·s).隨著反應的進行,低濃度的DEA溶液吸收率先開始下降,而高濃度溶液可以維持更長時間的高吸收率.這是因為反應開始階段溶液中OH-濃度遠高于SO2濃度,此時吸收率維持在較高水平,隨著反應的進行,OH-濃度降低,不能及時與SO2反應,表現(xiàn)為吸收率降低.
2.1.4不同濃度DEA溶液脫硫效率隨吸收時間的變化
圖6給出了不同濃度DEA溶液脫硫效率隨吸收時間的變化規(guī)律.與圖5類似,高濃度的DEA溶液可以更長時間地維持較高的脫硫效率.0.002 mol/L的DEA溶液在反應初期,其脫硫效率明顯低于其他3種DEA溶液的脫硫效率.反應至30 min時,其脫硫效率已低于50%.而其他3種濃度DEA溶液在反應初期的脫硫效率接近100%,但是隨著反應的進行,有機胺濃度不斷被消耗,且溶液pH亦下降較快,故脫硫效率迅速降低.由雙膜理論可知,初始吸收時,DEA在界面處具有較高濃度,其在界面處水解產(chǎn)生的OH-濃度遠高于SO2溶解濃度,使脫硫效率能保持在較高水平.但隨著吸收時間的增加,有機胺在界面處不斷被消耗,不能及時補充活性組分(即DEA水解產(chǎn)生OH-),從而脫硫效率又急劇下降.結(jié)果表明,濃度高的DEA溶液脫硫效率高,但濃度過高,脫硫劑原料成本消耗過大,整個系統(tǒng)的經(jīng)濟運行成本太大.因此,合理的吸收劑濃度選擇為0.005 mol/L.

圖5 不同濃度DEA溶液吸收率隨吸收時間的變化
Fig.5Absorption rate of DEA of different concentrations vs. absorption time

圖6 不同濃度DEA溶液脫硫效率隨吸收時間的變化
Fig.6Desulfurization rate of DEA of different concentrations vs. absorption time
2.2不同種類有機胺對煙氣中SO2吸收性能的比較
反應條件如下:模擬煙氣量為0.2 L/min,φ(SO2)為0.1%,N2作為平衡氣,吸收溫度為50 ℃.探討0.005 mol/L不同有機胺(如DEA、N-甲基二乙醇胺(MDEA)、乙二胺和哌嗪)對SO2的吸收性能.
2.2.1不同有機胺溶液pH隨反應時間的變化
圖7給出了不同有機胺溶液pH隨反應時間的變化曲線.從圖7可以看出,4種有機胺反應初期pH值下降較迅速,后期下降趨勢變緩.這是因為吸收反應開始階段,有機胺水解產(chǎn)生的OH-被SO2消耗造成pH值下降,一段時間后,溶液中的有機胺被消耗殆盡,無法水解產(chǎn)生OH-與SO2反應,使得溶液pH值急劇下降,此后SO2的吸收受到抑制,溶液pH值下降趨緩.哌嗪的pH值隨反應時間下降較勻速,其緩沖性能更好.pH緩沖性能排序依次為哌嗪>乙二胺>DEA>MDEA,這是因為多元胺的堿性較強,且與SO2的絡(luò)合吸收反應能力較強,故pH緩沖性能較好.

圖7 不同有機胺溶液pH隨反應時間的變化
Fig.7pH values of organic amine of different concentrations vs. reaction time
2.2.2不同有機胺溶液中c(SO32-)和c(SO42-)隨反應時間的變化
圖8給出了不同有機胺溶液中c(SO32-)和c(SO42-)隨反應時間的變化曲線.由圖8可知,4種吸收劑中c(SO32-)的變化趨勢基本相同,反應初期均表現(xiàn)為線性上升,反應后期上升趨勢減緩.對SO2的吸收能力從大到小為:哌嗪>乙二胺>DEA>MDEA.因此選擇乙二胺或哌嗪作為吸收劑.
乙二胺和哌嗪是二元胺,與一元胺相比,在相同濃度下可以水解出更多的OH-與溶液中的SO2反應,使吸收的SO2更多,因此脫硫容量更大.由于乙二胺揮發(fā)性較強,實驗中會有溶質(zhì)損失,所以其吸收容量略小于哌嗪.DEA和MDEA都是一元胺,所以對SO2的吸收容量小.MDEA是叔胺,DEA是仲胺,所以MDEA空間位阻大于DEA,導致其吸收性能不如DEA,DEA的脫硫容量更大.
從圖8可以看出,溶液中的c(SO42-)隨反應時間的增加呈上升趨勢,但90 min內(nèi)變化不大,且遠遠低于c(SO32-).這是因為隨著反應時間的增加,c(SO32-)上升,從而c(SO42-)上升,但溶液中的含氧量是一定的,故90 min內(nèi)c(SO42-)上升趨勢不大.以哌嗪溶液為例,90 min時溶液中c(SO42-)為0.001 87 mol/L,c(SO32-)為0.010 71 mol/L,c(SO42-)占總硫含量的14.9%,可見溶液中的硫是以SO32-為主要存在形式的.這也說明了在工業(yè)應用中,如果有機胺溶液中有大量余氧,會使溶液中的c(SO32-)降低,產(chǎn)生大量SO42-,而SO42-不可再生,不利于解吸反應的進行,使得有機胺溶液再生效率下降.因此在實際生產(chǎn)中,要注意控制溶液中的含氧量.

圖8 不同有機胺溶液中c(SO32-)和c(SO42-)隨反應時間的變化
Fig.8c(SO32-) andc(SO42-) in different organic amines vs. reaction time

圖9 不同有機胺溶液吸收率隨反應時間的變化
2.2.3不同有機胺溶液吸收率隨反應時間的變化
圖9給出了不同有機胺溶液吸收率隨反應時間的變化曲線.從圖9可以看出,4種有機胺溶液吸收率都是先維持在較高的水平,隨著反應的進行,吸收率下降.反應開始階段,4種有機胺溶液吸收率都達到了1.257 13×10-6mol/(L·s),但隨著反應的進行,30~70 min階段,MDEA和DEA溶液吸收率迅速下降,而乙二胺和哌嗪在70 min后吸收率才有明顯的下降.這是因為反應開始階段溶液中的OH-濃度遠高于溶液中SO2濃度,此時吸收率維持在較高水平,隨著反應的進行,OH-濃度降低,不能及時與SO2反應,表現(xiàn)為吸收率降低.乙二胺和哌嗪是二元胺,DEA和MDEA是一元胺,因此乙二胺和哌嗪能水解出更多的OH-,其溶液中OH-濃度遠大于被吸收的SO2濃度,表現(xiàn)為哌嗪和乙二胺能維持更長時間的高吸收率.
2.2.4不同有機胺溶液脫硫效率隨反應時間的變化
圖10給出了不同有機胺溶液脫硫效率隨反應時間的變化曲線.從圖10可以看出,4條脫硫效率隨反應時間的變化曲線是相似的.在吸收反應的前20 min,4種有機胺溶液脫硫效率幾乎達到100%.但隨著反應的進行,50 min時,MDEA和DEA脫硫效率迅速下降至50%以下.乙二胺在40~60 min內(nèi)脫硫效率高于哌嗪,二者脫硫效率均在95%以上.但此后乙二胺脫硫效率下降較快,低于相同時間內(nèi)哌嗪的脫硫效率.哌嗪脫硫效率自40 min時開始下降,但直至70 min,仍保持著較高的脫硫效率,出口氣體體積分數(shù)仍在3×10-4以內(nèi),直到100 min后出口氣體體積分數(shù)才稍稍超過3×10-4.因此,4種有機胺吸收性能排序為:哌嗪>乙二胺>DEA>MDEA.

圖10 不同有機胺溶液脫硫效率隨反應時間的變化
Fig.10Desulfurization rate of different organic amines vs. reaction time
在哌嗪吸收SO2的初始階段,其脫硫效率一直維持在較高的水平.由雙膜理論可知,此時在氣液兩相界面處哌嗪水解產(chǎn)生了足夠的OH-,其濃度遠高于水中溶解的SO2濃度,使得溶解于水中的SO2絕大部分被吸收,此時吸收反應受氣膜控制.在40~70 min內(nèi),哌嗪的脫硫效率依然維持在較高的水平,但比之前已有所下降,這是因為此時該反應雖然仍主要受氣膜控制,但液膜的影響也開始顯現(xiàn),界面處的OH-濃度與此處的SO2濃度差距逐漸減小,此時會在尾氣中檢測到少量的SO2,表現(xiàn)為脫硫效率下降,但仍在排放標準的范圍內(nèi),因此可繼續(xù)實驗.在反應后期,溶液中的哌嗪已快被消耗完,無法水解產(chǎn)生足夠的OH-與SO2反應,使得溶液pH值急劇下降,酸性環(huán)境使得吸收反應得到抑制,進氣中的SO2大部分無法被吸收,此時的吸收率主要受液膜一方控制,表現(xiàn)為脫硫效率急劇下降.其他3種有機胺與SO2的反應也類似,一開始是受氣膜控制,直至溶液中有機胺被消耗殆盡,無法繼續(xù)水解生成OH-與SO2反應,反應變?yōu)橹饕芤耗た刂疲憩F(xiàn)為脫硫效率一開始維持在較高水平,一段時間之后很快下降.
對比哌嗪和其他3種有機胺,雖然其他3種有機胺也能較長時間接近100%的脫硫效率,但相同濃度下哌嗪能夠維持更長的反應時間,使得排出煙氣濃度一直在標準排放范圍內(nèi),且保持脫硫效率緩慢下降,而不至于在實際運用中致使脫硫劑瞬間失效,造成不良后果.其緩沖性能更為優(yōu)越,易在實際運用中掌控失效終點.此外,相同濃度下哌嗪具有較高的吸收容量,故從吸收角度來看,最適宜的脫硫劑是哌嗪溶液.
2.3不同有機胺解吸性能比較
反應條件如下:反應溫度為100 ℃.探討已吸收飽和的4種0.005 mol/L有機胺溶液對SO2的解吸性能.
圖11為不同有機胺溶液解吸率隨解吸時間的變化曲線.圖11中,反應進行到90 min時,對4種有機胺溶液解吸率進行排序:MDEA>乙二胺>DEA>哌嗪.由此可知,在一定解吸能耗下MDEA的解吸性能最好,其解吸率為38.7%.
SO2與有機胺水解產(chǎn)物不穩(wěn)定,受熱會分解.該解吸反應是吸熱反應,隨著反應的進行,反應吸收的熱量增加,解吸的程度也會升高,表現(xiàn)為溶液中的c(SO32-)越來越低.乙二胺和哌嗪的2個胺基堿性不同,堿性較弱的胺基結(jié)合SO2的產(chǎn)物不穩(wěn)定,更容易解吸.乙二胺是一種堿性較強的二元胺,但其吸收能力弱于哌嗪,所以其解吸能力強于哌嗪弱于MDEA.DEA的胺基堿性強,其與SO2的結(jié)合產(chǎn)物更穩(wěn)定,更難解吸.MDEA的解吸性能強于DEA,從分子結(jié)構(gòu)分析,MDEA的空間位阻更大,其與SO2水解產(chǎn)生的H+絡(luò)合產(chǎn)物在受熱時反應向逆方向進行,表現(xiàn)為更容易解吸.

圖11 不同有機胺溶液解吸率隨解吸時間的變化
Fig.11Desorption rate of different organic amines vs. desorption time
綜上所述,從吸收角度來看,哌嗪的吸收性能最好,但在反應的前40 min,4種有機胺溶液的脫硫效率都接近于100%,有著極佳的吸收率.從解吸角度來看,相同反應時間內(nèi),MDEA的解吸率最高,即在外界提供相同多能量時,其解吸量最大.綜合考慮,最終選擇MDEA為吸收劑.
3熱力學分析
SO2吸收熱力學的研究對吸收劑的選擇、工藝過程的設(shè)計和優(yōu)化以及節(jié)能降耗具有重要意義.其中吸收反應的吉布斯自由能是評價吸收劑性能的重要參數(shù).
3.1MDEA吸收SO2的熱力學分析
3.1.1MDEA吸收SO2的化學反應
由上述實驗與文獻[11]可知,亞硫酸一級解離形成亞硫酸氫鹽為主要反應,即一個醇胺分子吸收一個SO2分子.MDEA吸收SO2的反應為

(9)
3.1.2MDEA吸收SO2反應的熱力學參數(shù)
MDEA吸收SO2反應中部分物質(zhì)的熱力學參數(shù)見表1.

表1 反應體系中部分物質(zhì)的熱力學參數(shù)[12]
3.1.3MDEA吸收SO2的焓變估算
已知在MDEA吸收CO2反應中,液相中陰離子以HCO3-為主,MDEA吸收CO2的焓變?yōu)?55 kJ/mol[13].計算式如下:

(10)
SO2與MDEA反應焓變計算式為

(11)
從上述計算可以看出,標準狀態(tài)下MDEA吸收SO2為放熱反應,低溫有利于吸收.一般來說,焓變越大,吸收能力越高,反之焓變越小,吸收能力越小.
3.1.4MDEA吸收SO2反應的熵變估算
MDEA的標準熵可由下式算得:
(12)
其中,
(13)
式中:A,B為經(jīng)驗常數(shù),根據(jù)文獻[14]可知MDEA沸點為520.15 K,胺類有機物A=43.17,B=-85.06;Tb為物質(zhì)常壓下沸點.
運用基團加合法估算MDEA溶液的標準熵:
(14)

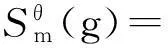
2Sθ[C-(N)(C)(H)2]+
2Sθ[C-(O)(C)(H)2]+
2Sθ[O-(C)(H)]-RlnNis+
RlnNoi=25.71 J/(mol·K).
MDEAH+的標準熵可由下式算得[13]:

19.5p1+26.5p2
(15)
式中:n為環(huán)以外的碳原子數(shù);p1為苯基數(shù);p2為飽和環(huán)(環(huán)戊烷或環(huán)己烷)數(shù);r為直鏈上的支鏈數(shù)或脂肪鏈任何碳原子上的烴基數(shù)減2.

表2 各種基團對(g)的貢獻值[14]

3.1.5MDEA吸收SO2的吉布斯自由能和反應平衡常數(shù)的計算

反應的吉布斯自由能為
(16)
化學反應平衡常數(shù)K為
(17)
標準狀態(tài)下(T=298.15 K)反應的吉布斯自由能為-12.616 kJ/mol,K=162.31,吉布斯自由能為負值,這說明反應是向正方向進行的.由式(16)可
知,若升高溫度,則會增加熵因素的影響,因此可以認為反應的吉布斯自由能隨溫度的升高而增大.從化學熱力學角度來看,升高溫度不利于SO2的吸收,有利于反應向逆方向進行,即解吸反應的發(fā)生.但實際生產(chǎn)中,吸收溫度過低需增加冷熱煙氣熱交換負荷;而且解吸過程所需能量是由蒸汽加熱提供的,因此過高的解吸溫度將使得系統(tǒng)能耗加劇.在實際生產(chǎn)中,需要確定合適的反應溫度.
3.2石灰石吸收SO2的熱力學分析
3.2.1化學反應機理
吸收反應:
(18)
溶解反應:
(19)
中和反應:

(20)
將以上反應式加和可得

(21)
3.2.2石灰石吸收SO2反應的熱力學參數(shù)及計算
石灰石吸收SO2反應的熱力學參數(shù)見表3.

表3 反應體系中部分物質(zhì)的熱力學參數(shù)[13]
與MDEA吸收SO2反應的分析步驟類似,石灰石吸收SO2的計算式如下:

(22)

(23)

3.3MDEA脫硫與傳統(tǒng)石灰石石膏法脫硫的熱力學比較

表4MDEA與石灰石吸收SO2熱力學參數(shù)的比較
Tab.4Comparison of thermodynamic parameters between MDEA and limestone in absorbing SO2

參數(shù)MDEA吸收SO2反應石灰石吸收SO2反應標準生成焓ΔrHθm/(kJ·mol-1)-85.916-67.974標準熵ΔrSθm/(J·mol-1·K-1)-245.848-205.556標準生成吉布斯自由能ΔrGθm/(kJ·mol-1)-12.616-6.687反應平衡常數(shù)K162.3114.84
4結(jié)論
(1) 通過不同濃度DEA溶液的對比實驗,確定了實驗所需有機胺溶液濃度為0.005 mol/L.
(2) 通過對不同吸收劑的篩選,發(fā)現(xiàn)哌嗪的吸收性能最好,MDEA的解吸性能最好,目前工業(yè)上MDEA吸收CO2技術(shù)比較成熟,MDEA吸收SO2與之類似,具有吸收容量大,最終解吸率高,且MDEA較易再生,綜合脫硫性能較好等優(yōu)點.
(3) 通過熱力學計算,比較了MDEA與石灰石吸收SO2的反應吉布斯自由能,發(fā)現(xiàn)MDEA吸收SO2反應體系的吉布斯自由能更小,說明其反應自發(fā)進行的程度更大,吸收性能更好.
參考文獻:
[1]潘衛(wèi)國,郭瑞堂,冷雪峰,等.大型燃煤電站鍋爐脫硫塔脫硫效率的數(shù)值模擬[J].動力工程學報,2011,31(4): 306-311.
PAN Weiguo, GUO Ruitang, LENG Xuefeng,etal. Numerical simulation on desulfurization efficiency of WFGD tower in a large coal-fired power plant boiler[J].Journal of Chinese Society of Power Engineering,2011,31(4):306-311.
[2]崔鵬,劉建芳,王琪,等.酸性組分對N,N′-二(2-羥丙基)哌嗪吸收/解吸SO2性能的影響[J].高校化學工程學報,2013,27(3): 399-405.
CUI Peng, LIU Jianfang, WANG Qi,etal. Effects of acidic compounds on SO2absorption and desorption property of 1,4-bis(2-hydroxypropy1)piperazine aqueous solution[J].Journal of Chemical Engineering of Chinese Universities,2013,27(3):399-405.
[3]CUI P, WANG T, CHEN Y,etal. Density, viscosity, and surface tension of aqueous solution of 1, 4-bis-(2-hydroxypropyl)-piperazine sulfate[J]. Journal of Chemical & Engineering Data,2013,58(12):3327-3331.
[4]ZAHIRI M R, MEHRARA H, ROUZBEHANI B. Investigation of parameters affecting a selective flue gas desulfurization with an amine base absorbent[J].Science International,2013,25(2):225-228.
[5]TAILOR R, AHMADALINEZHAD A, SAYARI A. Selective removal of SO2over tertiary amine-containing materials[J].Chemical Engineering Journal,2014, 240(6):462-468.
[6]OH K-J, MIN B-M, KIM S-W,etal. Simultaneous absorption of carbon dioxide,sulfur dioxide,and nitrogen dioxide into aqueous 1, 8-diamino-p-menthane[J].Korean Journal of Chemical Engineering,2011, 28(8): 1754-1760.
[7]HAKKA. Removal and recovery of sulphur dioxide from gas streams: USA, 5019361[P].1991-05-28.
[8]邱正秋,黎建明,任艷麗,等.煙氣脫硫溶液中硫酸根的去除[J].化工環(huán)保,2014,34(2):133-136.
QIU Zhengqiu,LI Jianming,REN Yanli,etal.Removal of SO42-from flue gas desulphurization solution[J].Environmental Protection of Chemical Industry,2014,34(2):133-136.
[9]HEYDARI-GORJI A, BELMABKHOUT Y, SAYARI A. Polyethylenimine-impregnated mesoporous silica:effect of amine loading and surface alkyl chains on CO2adsorption[J].Langmuir,2011,27(20): 12411-12416.
[10]許賢,蔡振云,梁坤.哌嗪水溶液脫硫性能的研究[J].環(huán)境化學,2010, 29(3): 450-454.
XU Xian, CAI Zhenyun, LIANG Kun. A study on flue gas desulfurization using aqueous piperazine[J].Environmental Chemistry,2010,29(3):450-454.
[11]陳健,羅偉亮,李晗.有機胺吸收二氧化碳的熱力學和動力學研究進展[J].化工學報,2014, 65(1):12-21.
CHEN Jian, LUO Weiliang, LI Han. A review for research on thermodynamics and kinetics of carbon dioxide absorption with organic amines[J].CIESC Journal,2014,65(1): 12-21.
[12]迪安,尚久方,辛無名.等.蘭氏化學手冊[M].北京:科學出版社,1991.
[13]SVENSSON H, HULTEBERG C, KARLSSON H T. Heat of absorption of CO2in aqueous solutions of N-methyldiethanolamine and piperazine[J].International Journal of Greenhouse Gas Control,2013,17(9): 89-98.
[14]POLING B E, PRAUSNITZ J M, JOHN P O C,etal.The properties of gases and liquids[M].New York,USA: McGraw-Hill,2001.
Experimental Study on SO2Removal with Renewable Organic Amines
XUHongjian1,3,JINJizhao1,SUNYaping2,WANGMeixia1,PANWeiguo3
(1. Department of Environmental and Chemical Engineering, Shanghai University of Electric Power,Shanghai 200090, China; 2. Operation Department, Huaneng Shandong Shidao Bay Nuclear Power Co., Ltd., Rongcheng 264300, Shandong Province, China; 3. Shanghai Power Environmental Protection Engineering Technology Research Center, Shanghai 200090, China)
Abstract:Absorption experiments were performed in a bubbling system to study the effects of four different organic amines on the wet flue gas desulfurization, while desorption experiments were conducted in an oil-bath heating device to analyze the desorption effects of the four organic amines. Results show that the desulfurization rate of above organic amines declines with the variation of time following the order below: piperazine>ethylenediamine>DEA>MDEA; whereas their desorption rate at same desorption temperatures increases with the variation of time, showing the desorption performance from strong to weak as follows: MDEA>ethylenediamine>DEA>piperazine. Through calculation with thermodynamic parameters, it is found that the Gibbs free energy of MDEA for absorption of SO2 is less than that of limestone, indicating that MDEA is a better desulfurizing agent, with stronger capability in SO2 absorption than limestone.
Key words:organic amine; flue gas desulfurization; desorption; thermodynamics
文章編號:1674-7607(2016)03-0227-09
中圖分類號:X701
文獻標志碼:A學科分類號:610.30
作者簡介:徐宏建(1971-),男,河南南陽人,副教授,博士,研究方向為電廠脫硫、工藝氣體凈化、氣液反應與反應器.
基金項目:上海發(fā)電環(huán)保工程技術(shù)研究中心資助項目(11dz2281700);上海研發(fā)基地資助項目(11DZ2281700);火電廠脫硫脫硝節(jié)能增效關(guān)鍵技術(shù)研究與應用資助項目(13dz1202703);基于高效脫硝、除塵和脫硫的燃煤電站鍋爐環(huán)保島集成技術(shù)開發(fā)與示范資助項目(14dz1200200)
收稿日期:2015-04-13
修訂日期:2015-06-30
電話(Tel.):021-35303902;E-mail: hongjian_xu@sina.com.

