新型Rh2(esp)2配體手性類似物的合成
黃澤傲, 盧崇道
(1. 中國科學院 新疆理化技術研究所,新疆 烏魯木齊 830011; 2. 中國科學院大學,北京 100049)
?
·快遞論文·
新型Rh2(esp)2配體手性類似物的合成
黃澤傲1,2, 盧崇道1*
(1. 中國科學院 新疆理化技術研究所,新疆 烏魯木齊830011; 2. 中國科學院大學,北京100049)
摘要:以(R)-叔丁基亞磺酰胺為手性助劑,與1,3-苯二甲醛經縮合反應制得關鍵中間體——(Rs,Rs)-雙叔丁基亞磺酰亞胺(7);鋰化的羧酸酯與7經不對稱加成反應合成了兩個新型的Rh2(esp)2配體類似物——(Rs,Rs′,R,R′)-β-胺基羧酸酯和(Rs,Rs′,R,R′,R,R′)-α,β-氮雜環丙烷羧酸酯,產率分別為96%和65%,非對映選擇性均大于20 ∶1。化合物的結構經1H NMR和(13)C NMR表征。
關鍵詞:Rh2(esp)2; 雙核銠(Ⅱ)催化劑; 叔丁基亞磺酰雙亞胺; (Rs,Rs′,R,R′)-β-胺基羧酸酯; (Rs,Rs′,R,R′,R,R′)-α,β-氮雜環丙烷羧酸酯; 手性修飾; 合成; 非對映立體選擇性
橋聯雙核銠(Ⅱ)催化劑是一類具有槳輪結構的化合物[1],其在催化C-H官能化等方面有廣泛用途[2-6]。2004年,斯坦福大學Du Bois J等[7]首次合成了配體Rh2(esp)2(1, Chart 1)。在隨后的多項研究中發現,1有著優越的催化C-H氨化的活性[7-11]。盡管如此,手性雙核銠催化劑催化的不對稱C-H氨化鮮見報道[12],人們更多地采用手性氮源作為控制C-H氨化立體選擇性的手段[13]。因而,開發用于催化C-H不對稱氨化的手性雙核銠催化劑值得期待。鑒于1在催化C-H氨化方面所表現出的優越性,在1的結構中引入手性中心便成為設計新的手性催化劑的可能途徑。到目前為止,基于配體α,α,α′,α′-四甲基-1,3-苯二丙酸(esp)(2)的手性修飾尚未見報道。我們曾對1的構效關系進行研究,從中發現間苯二甲基和羧基α-位的兩個甲基是使催化劑穩定并具有優越催化性能的重要因素[10-11,14]。因此,開發1類手性催化劑,在保留苯二烷基結構和保持羧基α-位為季碳原子同時,需在2的A或B位置構建結構如3或4的配體前體羧酸酯(Chart 1)。
近年來,手性叔丁基亞磺酰胺在合成含氮化合物方面表現出了優越的立體選擇性[15]。本課題組用其成功地發展了Brook重排介導的多組分反應[16-18]。本研究首次使用手性叔丁基亞磺酰胺對配體1進行手性修飾,逆合成分析如Chart 1所示。本文以(R)-叔丁基亞磺酰胺作為手性助劑,與1,3-苯二甲醛經縮合反應制得關鍵中間體——(Rs,Rs)-雙叔丁基亞磺酰亞胺(7);鋰化的羧酸酯與7經不對稱加成反應合成了兩個新型的Rh2(esp)2類似物——(Rs,Rs′,R,R′)-β-胺基羧酸酯(5)和(Rs,Rs′,R,R′,R,R′)-α,β-氮雜環丙烷羧酸酯(6, Scheme 1),產率分別為96%和65%,非對映選擇性均大于20 ∶1。并對5進一步衍生獲得了用于雙核銠配位的雙羧酸配體9。 5, 6和9均為新化合物,其結構經1H NMR和13C NMR表征。絕對構型根據文獻報道中的單亞胺的反應立體控制得出[19]。
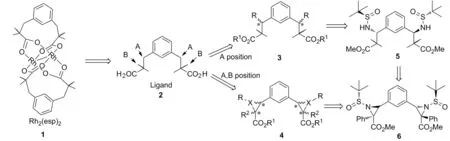
Chart 1
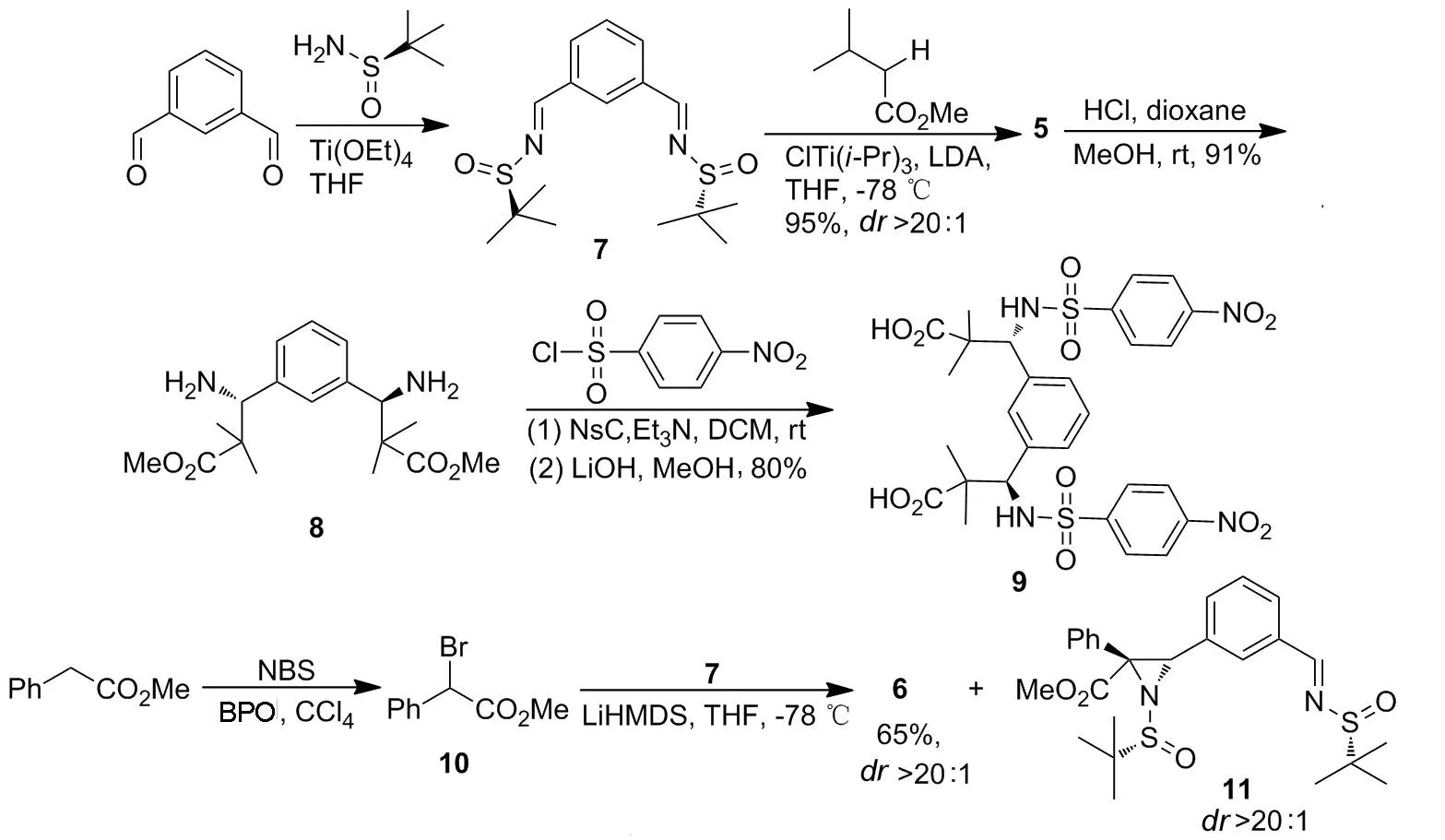
Scheme 1
1實驗部分
1.1儀器與試劑
Varian Inova-400 MHz型核磁共振儀。
四乙氧基鈦、(R)-叔丁基亞磺酰胺、對硝基苯磺酰氯、間苯二甲醛、苯乙酸甲酯,Alfa公司;無水THF,使用前用鈉進行無水無氧處理并新蒸;二異丙胺使用前與氫化鈣共熱回流并新蒸;其余所用試劑均為分析純。
1.2合成
(1) 7的合成
在干燥的圓底燒瓶中依次加入Ti(OEt)411.63 g,間苯二甲醛1.37 g(10.2 mmol)和無水THF 80 mL,攪拌使其溶解;于室溫反應30 min。加入 (R)-叔丁基亞磺酰胺2.73 g(22.5 mmol),回流反應5 h。冷卻至室溫,緩慢倒入冰水浴冷卻過的飽和氯化鈉溶液(80 mL)中,用硅藻土過濾,濾餅用乙酸乙酯(80 mL)洗滌,水相用乙酸乙酯(2×50 mL)萃取,合并濾液和萃取液,靜置,用無水K2CO3干燥,濃縮后經硅膠柱層析 [洗脫劑:A=V(石油醚) ∶V(乙酸乙酯)=5 ∶1]純化得黃色固體7 2.41 g,產率70%;1H NMRδ: 8.61(s, 2H), 8.28(s, 1H), 8.02~7.93(m, 2H), 7.60~7.56(m, 1H), 1.25(s, 18H);13C NMRδ: 161.9, 134.8, 132.8, 130.1, 129.7, 58.1, 22.7。
(2) 5的合成
氬氣氛圍下,在一干燥的Schlenk瓶中加入無水THF 360 mL,冰水浴冷卻下用注射器注入二異丙胺5.2 mL;攪拌下緩慢加入2.5 mol·L-1正丁基鋰溶液14.8 mL,反應30 min;于-78 ℃(浴溫)滴加異丁酸甲酯4.2 mL(37.1 mmol),滴畢,反應1 h。緩慢滴加ClTi(Oi-Pr)319.09 g的無水THF (120 mL)溶液,滴畢,反應10 min。滴加8 2.08 g(6.1 mmol)的無水THF(10 mL)溶液,滴畢,反應1.5 h。緩慢加入飽和氯化銨溶液60 mL淬滅反應。升至室溫,用硅藻土過濾,濾餅用氯仿100 mL洗滌;合并濾液與洗液,旋蒸除去THF,用氯仿(3×100 mL)萃取,合并有機相,用無水硫酸鈉干燥,過濾,旋蒸除溶,剩余物用氯仿溶解,經硅膠柱層析[洗脫劑:B=V(二氯甲烷) ∶V(甲醇)=30 ∶1]純化得淡黃色泥狀物5 3.19 g,產率96%,dr>20 ∶1;1H NMRδ: 7.30~7.27(m, 2H), 7.19(s, 1H), 7.17~7.16(m, 1H), 4.58(d,J= 3.3 Hz, 2H), 4.47(d,J=3.3 Hz, 2H), 3.75(s, 6H), 1.19(s, 18H), 1.18(s, 6H), 1.17(s, 6H);13C NMRδ: 177.1, 138.0, 130.3, 129.0, 127.7, 64.8, 55.9, 52.6, 47.2, 24.4, 22.7, 20.8。
(3) 8的合成
在圓底燒瓶中加入5 5.43 g(10.0 mmol)和無水甲醇138 mL,攪拌使其溶解;緩慢加入4 mol·L-1鹽酸二噁烷溶液25 mL,反應1.5 h。緩慢加入氨水80 mL淬滅反應;加水200 mL,用乙酸乙酯(2×250 mL)萃取,合并有機相,用飽和氯化鈉溶液洗滌,無水硫酸鈉干燥;旋蒸除溶后經硅膠柱層析(洗脫劑:B=30 ∶1)純化得無色油狀液體8 3.05 g,產率91%;1H NMRδ: 7.25~7.15(m, 4H), 4.22(s, 2H), 3.68(s, 6H), 1.71(br s, 2H), 1.12(s, 6H), 1.06(s, 6H);13C NMRδ: 177.8, 141.6, 128.3, 127.5, 127.3, 62.0, 52.0, 48.0, 23.9, 19.5。
(4) 9的合成
在一干燥反應茄形瓶中加入8 100 mg(0.30 mmol),對硝基苯磺酰氯166 mg(0.75 mmol)和無水二氯甲烷3.5 mL,攪拌使其溶解;滴加三乙胺109 μL,滴畢,于室溫反應1 h。加入乙酸乙酯20 mL,依次用水(20 mL)和飽和氯化鈉溶液(20 mL)洗滌,無水硫酸鈉干燥;旋蒸除溶后用混合溶劑[V(甲醇) ∶V(水)=4 ∶1, 4 mL]溶解;加入無水氫氧化鋰105 mg,回流反應18 h。冷卻至室溫,加水5 mL,用濃鹽酸酸化,用乙酸乙酯(3×10 mL)萃取,合并有機相,用飽和氯化鈉溶液(2×15 mL)洗滌,無水硫酸鈉干燥,旋蒸除溶后經柱層析(洗脫劑:A=1 ∶1)純化得白色固體9 163 mg,產率80%;1H NMRδ: 12.73(br s, 2H), 8.60(d,J=10.3 Hz, 2H), 7.99(d,J=8.7 Hz, 4H), 7.58(d,J=8.7 Hz, 4H), 6.79(s, 1H), 6.59(d,J=7.7 Hz, 2H), 6.40(t,J=7.7 Hz, 1H), 4.66(d,J=9.7 Hz, 2H), 1.02(s, 6H), 0.82(s, 6H);13C NMRδ:176.7, 148.7, 146.6, 135.9, 129.3, 127.9, 126.3, 126.0, 123.8, 62.9, 47.0, 21.9, 20.8。
(5) 10的合成
在圓底燒瓶中依次加入苯乙酸甲酯6.17 g(41.1 mmol),四氯化碳30 mL和過氧化苯甲酰(BPO)0.10 g,攪拌使其均勻;回流反應4 h。冷卻至室溫,過濾,濾餅用四氯化碳(30 mL)洗滌;合并濾液與洗液,旋蒸濃縮后經蒸餾(115 ℃/133 Pa)純化得無色油狀液體10 7.58 g,產率80%;1H NMRδ: 7.56~7.54(m, 2H), 7.40~7.34(m, 3H), 5.37(s, 1H), 3.79(s, 1H);13C NMRδ: 168.9, 135.8, 129.4, 128.9, 128.7, 53.5, 46.6。
(6) 6和11的合成
氬氣氛圍下,在干燥的Schlenk瓶中加入無水THF 65 mL和1.2 mol· L-1LiHMDS的THF溶液16.7 mL,攪拌下于-78 ℃加入7 4.58 g(20.0 mmol)的無水THF(5.0 mL)溶液,反應35 min。滴加7 0.68 g(2.0 mmol)的無水THF(20 mL)溶液,滴畢(30 min),反應1 h。緩慢加入飽和氯化銨溶液15 mL淬滅反應。升至室溫,靜置分層,水相用乙酸乙酯(2×100 mL)萃取,合并有機相和萃取液,用飽和氯化鈉溶液(100 mL)洗滌,無水硫酸鈉干燥,旋蒸除溶后經柱層析[梯度洗脫劑:A=3 ∶1~1 ∶1]純化得6和11。
6: 白色固體,產率65%,dr>20 ∶1;1H NMRδ: 7.23~7.10(m, 6H), 6.95(d,J=6.6 Hz, 4H), 6.84(t,J=8.0 Hz, 1H), 6.69(d,J=6.4 Hz, 3H), 4.43(s, 2H), 3.75(s, 6H), 1.27(s, 18H);13C NMRδ: 169.3, 133.2, 132.7, 129.7, 127.8, 127.79, 127.76, 127.4, 126.9, 57.1, 54.3, 53.8, 52.3, 22.0。
11: 淡黃色固體,產率7%,dr>20 ∶1;1H NMRδ: 8.39(s, 1H), 7.62(d,J=7.7 Hz, 1H), 7.46(s, 1H), 7.23~7.14(m, 6H), 7.03(d,J=7.8 Hz, 1H), 4.65(s, 1H), 3.79(s, 3H), 1.31(s, 9H), 1.23(s, 9H);13C NMRδ: 169.4, 162.3, 134.4, 134.1, 132.5, 131.5, 129.8, 129.1, 128.8, 128.7, 128.1, 128.0, 58.0, 57.3, 54.5, 54.0, 52.4, 22.7, 22.0。
2結果與討論
在5的合成中,ClTi(Oi-Pr)3影響反應過渡態的烯醇式構象以及烯醇鋰鹽對叔丁基亞磺酰亞胺的靠近方式[19],因而它的加入是獲得高非對映選擇性(dr>20 ∶1)反應產物的關鍵。原料最佳當量比為8∶(CH3)2CHCO2CH3∶LDA∶ClTi(i-Pr)3=1 ∶6 ∶6 ∶12。
在6的合成中,并不需要加入路易斯酸即可獲得高立體選擇性反應產物,但即便把10的用量提高到10 eq.以上,仍然有少量(7%)的11產生;繼續延長反應時間也并不能使11完全轉化為6。
此研究獲得的手性雙氨基酯存在亞磺酰基,硫上有一孤對電子,這對銠配位可能會造成不利的影響,諸如催化劑中毒等。為了避免這個問題的發生,我們對5進行了拓展衍生。用4 mol·L-1鹽酸在二噁烷/甲醇體系中高效率地脫除叔丁基亞磺酰基而獲得了雙氨基酯8。接著經胺基官能化和水解的分步連續反應獲得了雙氨基酸化合物9。該結構中氨基上的氫具有一定的酸性,Du Bois J[20]的研究表明在手性內酰胺雙核銠催化劑中,β-位磺酰胺基上的氫與酰胺的羰氧存在弱氫鍵作用,這個可能是使催化反應獲得高立體選擇性的關鍵。
手性叔丁基亞磺酰胺是合成含氮化合物的優良手性助劑,其與間苯二甲醛縮合所得的手性雙亞胺可簡便快捷地構建Rh2(esp)2配體的手性類似物,這一合成方法對于發展手性四羧酸雙核銠催化劑有潛在的應用價值。
參考文獻
[1]DeAngelis A, Boruta D T, Lubin J B,etal. The chiral in paddlewheel complexes[J].Chem Commun,2010,46:4541-4543.
[2]Doyle M P, McKervey M A, Ye T. Modern Catalytic Methods for Organic Synthesis with Diazo Compounds:From Cyclopropanes to Ylides[M].New York:John Wiley & Sons,Inc.,1998:1-46.
[3]Evans P A. Modern Rhodium-catalyzed Organic Reactions[M].Weinheim:Wiley-VCH,2005:341-353.
[4]Davies H M L, Manning J R. Catalytic C-H functionalization by metal carbenoid and nitrenoid insertion[J].Nature,2008,451:417-424.
[5]Crabtree R H. Introduction toselective functionalization of C-H bonds[J].Chem Rev,2010,110:575-575.
[6]Davies H M L, Du Bois J, Yu J Q. C-H functionalization in organic synthesis[J].Chem Soc Rev,2011,40:1855-1856.
[7]Espino C G, Fiori K W, Du Bois J,etal. Expanding thescope of C-H amination through catalyst design[J].J Am Chem Soc,2004,126:15378-15379.
[8]Bess E N, DeLuca R J, Tindall D J,etal. Analyzing site selectivity in Rh2(esp)2-catalyzed intermolecular C-H amination reactions[J].J Am Chem Soc,2014,136:5783-5789.
[9]Du Bois J. Rhodium-catalyzed C-H amination.An enabling method for chemical synthesis[J].Org Process Res Dev,2011,15:758-762.
[10]Zalatan D N, Du Bois J. Understanding the differential performance of Rh2(esp)2as a catalyst for C-H amination[J].J Am Chem Soc,2009,131:7558-7559.
[11]Fiori K W, Du Bois J. Catalytic intermolecular amination of C-H bonds:Method development and mechanistic insights[J].J Am Chem Soc,2007,129:562-568.
[12]Reddy R P, Davies H M L. Dirhodium tetracarboxylates derived from adamantylglycine as chiral catalysts for enantioselective C-H aminations[J].Org Lett,2006,8:5013-5016.
[13]Liang C, Collet F, Dauban P,etal. Toward a synthetically useful stereoselective C-H amination of hydrocarbons[J].J Am Chem Soc 2008,130:343-350.
[14]Bickley J, Bonar-Law R, Steiner A,etal. Dirhodium (Ⅱ) carboxylate complexes as building blocks.Cis-chelating dicarboxylic acids designed to bridge the dinuclear core[J].New J Chem,2004,28:425-433.
[15]Robak M T, Herbage M A, Ellman J A. Synthesis and applications of tert-butanesulfinamide[J].Chem Rev,2010,110:3600-3740.
[16]Bo L, Lu C D. Asymmetric synthesis ofcis-2-aminocyclopropanols by intramolecular mannich addition of silyloxy benzyl carbanions[J].J Org Chem,2011,76:4205-4209.
[17]Ming Y, Lu C D. Three-component reactions of sulfonylimidates,silyl glyoxylates andN-tert-butanesulfinyl aldimines:An efficient,diastereoselective,and enantioselective synthesis of cyclicN-sulfonylamidines[J].Org Lett,2011,13:2782-2785.
[18]JiangJ L, Ming Y, Lu C D. Efficient synthesis ofα-quaternaryα-hydroxy-β-amino esters via silyl glyoxylate-mediated three-component reactions[J].Org Lett,2013,16:318-321.
[19]Tang T P, Ellman J A. Asymmetric synthesis ofα-amino acid derivatives incorporating a broad range of substitution patterns by enolate additions to tert-butyl sulfinyl Imines[J].J Org Chem,2002,67:7819-7832.
[20]Zalatan D N, Du Bois J. A chiral rhodium carboxamidate catalyst for enantioselective C-H amination[J].J Am Chem Soc,2008,130:9220-9221.
Synthesis of Novel Enantioenriched Analogues of Rh2(esp)2Ligand
HUANG Ze-ao1,2,LU Chong-dao1*
(1. Xinjiang Technical Institute of Physics & Chemistry, Chinese Academy of Sciences, Urumqi 830011, China;2. University of Chinese Academy of Science, Beijing 100049, China)
Abstract:A synthetic approach toward the enantioenriched analogues of α,α,α′,α′-tetramethyl-1,3-benzenedipropionic acid which was the ligand of Rh2(esp)2 catalyst was reported. In this process, the chiral (R)-tert-butanesulnyl diimine derived from 1,3-benzenedialdehyde was used in the nucleophilic additions of lithium ester enolates to give two novel chiral analogues of the “esp” esters that are (Rs,Rs′,R,R′)-β-amino esters and (Rs,Rs′,R,R′,R,R′)-α,β- aziridinyl esters in yields of 96% and 65% with excellent diastereoselectivity(dr>20 ∶1). The structures were characterized by1H NMR and (13)C NMR.
Keywords:Rh2(esp)2; dirhodium catalyst; tert-butanesulnyl diimine; (Rs,Rs′,R,R′)-β-amino ester; (Rs,Rs′,R,R′,R,R′)-α,β- aziridinyl ester; synthesis; chiral modification; diastereoselectivity
中圖分類號:O621.3; O622.5
文獻標志碼:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.03.15115
作者簡介:黃澤傲(1987-),男,壯族,廣西武宣人,博士研究生,主要從事有機金屬催化劑的設計、合成及其催化C-H官能化的研究。 E-mail: huangzeao@yahoo.com通信聯系人: 盧崇道,博士,研究員,博士生導師, E-mail: clu@ms.xjb.ac.cn
基金項目:國家自然科學基金資助項目(21172251)
收稿日期:2015-04-16;
修訂日期:2016-01-28

