鳥胞內分枝桿菌mmpL11同源基因序列分析及功能預測
王文靖,孫 妍,王心倩,余曉麗*
(1.南陽市第二中學,河南 南陽 473000;
2. 武漢輕工大學生物與制藥工程學院,武漢 430023)
?
鳥胞內分枝桿菌mmpL11同源基因序列分析及功能預測
王文靖1,孫妍2,王心倩2,余曉麗2*
(1.南陽市第二中學,河南 南陽 473000;
2. 武漢輕工大學生物與制藥工程學院,武漢 430023)
摘要:以非結核分枝桿菌中的胞分枝桿菌、鳥分枝桿菌兩個標準株為研究對象,以恥垢分枝桿菌mc2 155和結核分枝桿菌H37Rv為對照,對其mmpL11同源基因進行序列分析,并對其蛋白質進行結構及功能預測,為后期的抗酸染色陽性菌診斷,藥物靶標的篩選提供理論基礎。根據同源比對找到兩個標準株的mmpL11同源基因;應用expasy工具預測MmpL11同源蛋白理化性質;蛋白質信號肽預測采用SignalP在線軟件進行預測;使用TMHMM在線工具進行拓撲結構預測;利用Interproscan工具對蛋白保守序列和功能進行預測;使用SSpro對蛋白二級結構進行預測。OCU48920蛋白的理化性質分析顯示:其氨基酸個數為1 018,分子量為108.4 kD,理論等電點為7.61,疏水指數為0.227;MAP3637c蛋白的理化性質分析顯示:其氨基酸個數為1 007,分子量為107.2 kD,理論等電點為8.59,疏水指數為0.231。信號肽預測發現兩個標準株的MmpL11均不存在信號肽切割位點,未發現信號肽存在。跨膜預測發現其跨膜次數分別為12和12肽鏈,N端均在膜內,二級結構以α-螺旋和β-片層為主。保守序列預測發現兩個標準株的MmpL11蛋白均有兩個MMPL跨膜結構域,一個固醇敏感多肽區。OCU48920、 MAP3637c為H37Rv的MmpL11同源蛋白,推測其功能同MmpL11相似,是分枝菌酸的轉運蛋白,參與胞內小分子的運輸和信號轉導。
關鍵詞:非結核分枝桿菌;MmpL11;序列分析;功能預測
鳥胞內分支桿菌復合體(Mycobacteriumavium-intracellularecomplex,MAC)是細胞內寄生的病原體,在吞噬細胞內增殖,并能引起AIDS病人的機會性感染。一般說來,目前市場上有效的藥物單用,甚至多藥聯合都難以根治MAC感染[1]。是非結核分枝桿菌(NontuberculosisMycobacteria,NTM)為抗酸染色陽性菌,臨床癥狀多與結核分枝桿菌感染相似,容易誤診為由結核分枝桿菌感染引起的結核病,且對多種抗結核藥物具有耐藥性[2-3]。
MmpL蛋白家族是分枝桿菌耐受-結節-分裂家族(Resistance-nodulation-cell division family,RND家族)超家族蛋白中的一種膜蛋白,是影響分枝桿菌的生存和毒力的關鍵因子之一,在結核分枝桿菌中包括MmpL1-13[4]。
RND家族中固醇敏感多肽區(SSD domain)在膽固醇自我平衡調節、物質運輸以及細胞信號轉導中發揮重要的作用[5]。此外,研究發現,在基因組中,有大約20%~30%的基因產物被預測為膜蛋白,在藥物研發過程中,膜蛋白偶聯受體是絕大多數藥物的作用靶點,跨膜蛋白在生物體中擔負著各種各樣的重要功能:細胞的運輸,細胞膜內外信號的傳遞及能量轉換等[6]。由于膜蛋白數量巨大而且功能多樣,因此通過跨膜蛋白的拓撲結構能對其功能進行初步預測。
以非結核分枝桿菌胞分枝桿菌、鳥分枝桿菌標準株為研究對象,恥垢分枝桿菌標準株和H37Rv為對照,對其MmpL11進行同源性分析、理化性質分析、信號肽預測、跨膜結構預測、保守序列和二級結構預測以及蛋白質功能預測,為進一步闡明抗酸染色陽性非結核分枝桿菌的毒力、致病機制和疾病研究提供理論依據。
1方法和步驟
1.1方法
運用生物信息學方法,通過序列對比,理化性質分析,信號肽預測,跨膜結構預測,保守序列,二級結構分析等生物信息學手段[7],對胞分枝桿菌(M.intracellulareATCC13950),鳥分枝桿菌(M.aviumsubsp.paratuberculosisK-10),恥垢分枝桿菌(M.smegmatistrmc2 155)的MmpL11進行同源序列分析及功能預測。
1.2步驟
1.2.1MmpL 11同源序列比對
在NCBI數據庫中查找結核分枝桿菌(MTB)H37Rv的MmpL11的氨基酸序列,在BLAST搜索兩個標準株的同源序列。
1.2.2MmpL11理化性質分析
用 ExPASy 在線序列分析工具,對MmpL11蛋白理化性質進行預測。
1.2.3MmpL 11信號肽預測
用SSpro(http://www.cbs.dtu.dk/services/SignalP/)在線軟件對MmpL11進信號肽預測。
1.2.4MmpL11跨膜結構、保守序列和二級結構分析
用TMHMM Server 2.0(http://www.cbs.dtu.dk/services/TMHMM/)在線軟件對MmpL11進行拓撲結構預測。用Interproscan(http://www.ebi.ac.uk/interpro/scan.html)對MmpL11同源序列進行保守序列和結構域分析。用SSpro對MmpL11同源序列進行二級結構預測。
2結果
2.1MmpL11同源序列比對
同源分析結果顯示:與H37Rv的MmpL 11比較,胞分枝桿菌同源序列為OCU48920 (Ident,72%),鳥分枝桿菌為MAP3637c (Ident,76%),恥垢分枝桿菌為MSMEG0241 (Ident,69%)。
2.2MmpL11理化性質分析
用 ExPASy 在線序列分析工具,對MmpL11蛋白理化性質進行預測,見表1。
2.3MmpL 11信號肽預測
用SSpro(http://www.cbs.dtu.dk/services/SignalP/)在線軟件對MmpL11進信號肽預測,信號肽分析顯示兩個標準株的MmpL11蛋白均不存在信號肽切割位點,未發現信號肽存在。
2.4MmpL11跨膜結構、保守序列和二級結構分析
用TMHMM 2.0軟件對MmpL11及其同源序列跨膜結構預測,胞分枝桿菌,鳥分枝桿菌,恥垢分枝桿菌的MmpL11同源蛋白跨膜次數分別為12、12、11,且同源蛋白的肽鏈N短都分布在膜內見圖1(a-d)。
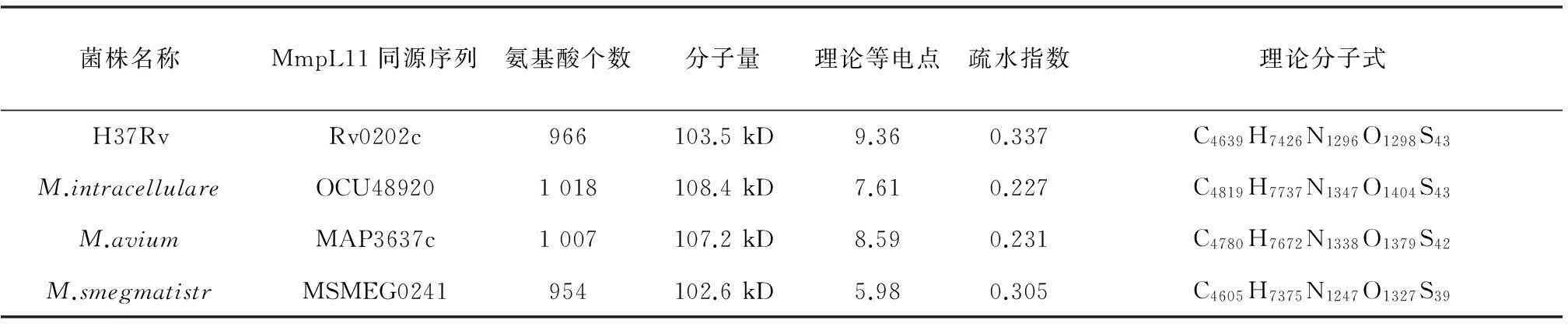
表1 MmpL11蛋白理化性質




圖1 MmpL11跨膜結構預測Fig.1 Transmembrane structure prediction of MmpL11
H37Rv的MmpL11結構域預測顯示具有兩個膜轉運蛋白(MMPL domain)結構域和一個固醇敏感多肽區(Sterol-sensing domain, SSD),兩個標準株的MmpL11同源蛋白均有兩個膜轉運蛋白結構域和一個 SSD結構域,說明該同源序列既有膜轉運功能又有 SSD結構域介導的膽固醇自我平衡調節、物質運輸以及細胞信號轉導功能見圖2(a-d)。
用SSpro對MmpL11同源序列進行二級結構預測,分析顯示兩個標準株的二級結構均以α-螺旋和β-片層為主。
3討論
MmpL家族蛋白是一組與結核分枝桿菌藥物外排有關的一個跨膜蛋白家族,可作為抗結核藥物或菌種鑒定藥物提供靶位點。研究發現在恥垢分枝桿菌中MmpL11具有攝取血紅素,轉運多分枝酰基二酰基甘油(MMDAG)和霉菌酸蠟脂(WE)的功能[8-13]。我們推測在恥垢分枝桿菌中MmpL11可能參與胞壁含分枝菌酸的脂類運輸和脂類代謝。胞壁分枝菌酸在結核分枝桿菌的抗酸染色、生長特性、致病性和抵抗力等密切相關[14]。
兩個標準株的MmpL11同源序列OCU48920、MAP3637c、MSMEG0241 與H37Rv的同源性分別為72%、76%、69%。通過理化性質、跨膜分析、信號肽預測和結構域分析顯示:兩個標準株的MmpL11同源序列具有疏水性,其跨膜蛋白不存在信號肽,具有一個SSD結構域等。




圖2 MmpL11跨膜結構Fig.2 Transmembrane domain of MmpL11
結構域分析發現兩個標準株的MmpL11蛋白均有兩個MMPL膜轉運功能區(MMPL domain)和一個固醇敏感多肽區(SSD domain),推測其可能不僅具有膜轉運功能也可能具有SSD結構域在膽固醇自我平衡調節、物質運輸以及細胞信號轉導中的作用。
4結論
通過對mmpL11基因的信息學預測,為后續深入研究MmpL11蛋白的生物學功能、驗證 MmpL11作為藥靶的候選蛋白的可行性提供基礎資料,并得出如下結論。
(1)通過生物信息學對鳥胞內分枝桿菌MmpL11的研究發現,兩個標準株中存在MmpL11的同源序列序列,這些同源序列可能在以后的研究中做為藥物標靶設計藥物達到診斷或治療結核病的目的。
(2)在確定兩個標準株的MmpL11的同源序列的過程中跨膜次數與肽鏈N端在膜內外的分布情況作為輔助條件進行分析的方法未見報道。
(3)通過生物信息學篩選出一些MmpL11的同源序列,并通過生物信息學分析對其理化性質、二級結構、結構域等進行分析,為下一步對該蛋白功能的研究提供理論支持。
(4)通過生物信息學對MmpL11蛋白進行分析是一種合理的方法,為結核分枝桿菌保守序列和靶位點的研究提供了新的研究思路。
參考文獻
[1]ONYEJI C,NIGHTINGALE C,NICOLAU D,et al. Efficaciesof avium-M. liposome-encapsulate clarithromycin and ofloxacin againstmycobacteriumintracellulare complex in human macophages[J]. Antimicrob Agents Chemother,1994,38(3):523.
[2]綦迎成,李君蓮,陳美娟.實用結核病實驗室診斷[M].北京:人民軍醫出版社,2012.
QI Yingcheng,LI Junlian,CHEN Meijuan. The practical diagnose of TB in laboratory[M].Beijing:People’s Military Medical Press,2012.
[3]王琰.耐藥結核分枝桿菌基因突變熱點篩查與檢測技術平臺的建立[D].西安:第四軍醫大學,2004.
WANG Yan.The new technique platforms for screening and detecting the mutational hot spots of genes associated withM.tuberculosisDrug Resistance[D].Xi’an :The Fourth Military Medical Universitym,2004.
[4]張賀秋,趙雁林.現代結核病診斷技術[M].北京:人民衛生出版社,2013.
ZHANG Heqiu,ZHAO Yanlin.Modern TB diagnosis techniques[M].Beijing:People’s Medical Publishing House,2013.
[5]胡廣安. 固醇敏感多肽區(Sterol-sensing domain)的分子進化[J]. 河南師范大學學報(自然科學版),2003,31(1):88-92,109.
HU Guangan.The molecular evolution of Sterol-sensing domain[J].Journal of Henan Normal University (Natural Science),2003,31(1):88-92,109.
[6]裔東亮.蛋白質跨膜結構與二硫鍵連接模式研究[D].上海:上海交通大學,2009.
YI Dongliang.The research upon prediction methods of Transmembrane[D].Shanghai:Shanghai Jiao Tong University,2009.
[7]吳祖建,高芳鑾,沈建國.生物信息學分析實踐[M].北京:科學出版社,2010.
WU Zujian,GAO Fangluan,SHEN Jianguo.Bioinformatics analysis practice[M].Beijing:Beijing Science Press,2010.
[8]GIOVANNA P,BATES R H,SALVATORE A,et al.Improved BM212 MmpL3 inhibitor analogue shows efficacy in acute murine model ofTuberculosisinfection[J] . PLoS One,2013,8(2):396.
[9]PACHECO S,BRAND J ,ZAVERTON M,et al.Sensitivity analysis and optimization method for the fabrication of one-dimensional beam-splitting phase gratings[J]. Optics Express, 2015,23(9):11771-11782.
[10]OWENS.MmpL11 protein transports mycolic acid-containing lipids to theMycobacterialcell wall and contributes to biofilm formation in Mycobacterium smegmatis[J].Journal of Biological Chemistry,2013,288(33): 213-222.
[11]CHIM N , TORRES R, LIU Yuqi,et al.The structure and interactions of periplasmic domains of crucial mmpL membrane proteins frommycobacteriumtuberculosis[J].Chemistry Biology,2015,22(8): 1098-1107.
[12]PACHECO S,HSU F F,POWERSET K M ,et al. MmpL11 protein transports mycolic acid-containing lipids to the mycobacterial cell wall and contributes to biofilm formation inMycobacteriumsmegmatis[J].Journal of Biological Chemistry, 2013,288(33): 24213-24222.
[13]PILAR D, REED M B, BARRY C E. Contribution of theMycobacteriumtuberculosisMmpL protein family to virulence and drug resistance[J].Infection and Immunity,2005,73(6):92-101.
[14]全國衛生專業技術資格考試專家委員會.臨床醫學檢驗技術師[M].北京:人民衛生出版社,2010.
The national health professional and technical qualifications examination committee of experts.Clinical medical inspection technology[M].Beijing:People’s Medical Publishing House,2010.
Sequence analysis and function prediction ofMycobacteriumaviumintracellularemmpL11 gene
WANG Wenjing1, SUN Yan2, WANG Xinqian2, YU Xiaoli2*
(1.TheSecondMiddleSchoolNanyang,Nanyang473000,China;2.SchoolofBiologyandPharmaceuticalEngineering,WuhanPolytechnicUniversity,Wuhan430023,China)
Abstract:To provide evidence for future research on the structures and function of mmpL11(Rv0202c) in Mycobacterium, we analyzed homologous sequences, predicted topological structures and conservative domain structures of two Nontuberculous Mycobacterions named M. Intracellulare and M.avium, both of which were compared with M.Smegmatisstr MC2155 and H37Rv. According to the homologous comparison,we found two standard strains of mmpL11 homologous genes. The physicochemical properties and con-served domain of MmpL11 in M. tuberculosis were predicted by ExPASy online tools. Online tool TMHMM Server 2.0 was used to predicted the topological structure.Interproscan was used to predict conservative domain structure. SSpro was used to predict the secondary structure. According to the physical and chemical properties of protein, the amino acid number of OCU48920 was 1 018, molecular weight was 108.4 kD, theoretical isoelectric point was 7.61,hydrophobic index was 0.227, the amino acid number of MAP3637c was 1 007, the molecular weight was 107.2 kD, theoretical isoelectric point was 8.59, hydrophobic index was 0.231,the amino acid number of MSMEG0241 was 954, the molecular weight was 102.6 kD, theoretical isoelectric point was 5.98 and hydrophobic index was 0.305.By SignalP’s predicting,we found MmpL11 didn’t have signal peptide cutting locus in its three standard strains and signal peptide.The forecast of transmembrane showed that it crossed membrane 12 times and 12 peptides.N-terminal was within the membrane.Secondary structure was given priority to with alpha helix and beta patches.The prediction of conservative sequence and MmpL11 protein’s function showed two MMPL transmembrane domain (MMPL domain) structure, a sterol sensitive polypeptide area (SSD domain). OCU48920, MAP3637c were homologous proteins of H37Rv MmpL11.We speculate that their functions were similar with MmpL11, and they were transcators of mycolic-acid.These two proteins participated in transporting intracellular small molecules and signal transduction.
Keywords:Nontuberculous Mycobacterion;MmpL11 ;Sequential analysis;Function prediction
中圖分類號:Q 93
文獻標志碼:A
文章編號:1672-5565(2016)01-007-06
doi:10.3969/j.issn.1672-5565.2016.01.02
作者簡介:王文靖,女,研究方向:微生物;E-mail:2504692896@qq.com.*通信作者:余曉麗,女,教授,研究方向:細胞生物學;E-mail:yxll268@126.com.
基金項目:武漢輕工大學研究生創新基金項目(2014cx019)。
收稿日期:2015-11-12;修回日期:2015-12-15.

