染料木素磺酸鈉對去卵巢大鼠骨代謝相關指標的影響*
朱文清,陳金財,姬廣林,黃志華
(贛南醫學院a.第一附屬醫院骨科; b.機能實驗室,江西 贛州 341000)
?
染料木素磺酸鈉對去卵巢大鼠骨代謝相關指標的影響*
朱文清a,陳金財a,姬廣林a,黃志華b
(贛南醫學院a.第一附屬醫院骨科; b.機能實驗室,江西贛州341000)
摘要:目的:研究染料木素磺酸鈉對去卵巢模型大鼠骨代謝的影響。方法:用去卵巢方法建立大鼠骨代謝紊亂動物模型,選擇48只雌鼠,隨機分為6組:正常對照組、骨質疏松模型組、陽性藥物組、低劑量GSS組(0.1 mg· kg(-1))、中劑量GSS組(0.3 mg·kg(-1))、高劑量GSS組(1.0 mg·kg(-1))。建模1周后,分別給予生理鹽水、雌激素和不同劑量的染料木素磺酸鈉,給藥6周后,檢測大鼠骨長度和骨重量指數,同時檢測血清電解質、堿性磷酸酶(AKP)、骨鈣素(BGP)和肝組織抗酒石酸酸性磷酸酶(TrACP-5b)等生化指標。結果:與模型組相比(1) GSS可以增高腰椎、股骨及脛腓骨重量指數,同時增大股骨和脛骨長度指數(P<0.001) ; (2) GSS可降低血清中骨鈣素的含量,提高降鈣素的含量(P<0.001) ; (3) GSS能升高血清AKP,降低TrACP-5b的含量(P<0.01)。結論: GSS可通過調節骨形成和骨吸收途徑,從而改善去卵巢大鼠骨代謝的紊亂,對絕經后骨質疏松癥可能起治療作用。
關鍵詞:染料木素磺酸鈉;去卵巢大鼠;骨代謝
染料木素磺酸鈉(Genistein Sulfonate Sodium,GSS)是染料木素磺化后合成的衍生物,相對于其母體不僅保留弱雌激素樣作用等藥理作用,同時由于GSS水溶性好,更易于人體吸收。前期研究發現GSS可以提高去卵巢大鼠的LEE’S指數并改善脂代謝情況[1],本研究擬通過建立去卵巢大鼠的骨質疏松模型,觀察骨代謝的相關指標,進一步明確GSS對去卵巢大鼠骨代謝影響。
1 材料與方法
1.1實驗動物3月齡SPF級SD大鼠,雌性,由湖南斯萊克景達實驗動物有限公司提供(動物合格證號: HNASLK20120825),每日均給予普通全價飼料(購自贛南醫學動物實驗室)喂養,自由飲水。
1.2試劑、藥物、材料GSS購自上海天習化工有限公司,分子量為372,用生理鹽水溶解配制成所需濃度;戊酸雌二醇由拜耳公司生產,生產批號030A;血清骨鈣素(bone gla protein,BGP)和降鈣素(calcitonin,CT)試劑盒(北京普爾偉業生物科技有限公司) ;血清堿性磷酸酶(alkaline aphosphatase,AKP)和抗酒石酸性磷酸酶(tartrate-resistant acid phosphatase,TrACP-5b)測試盒(南京建成生物工程研究所)。
1.3主要實驗儀器MIKRO22R臺式冷凍離心機(德國Hittch公司) ; Model 680全自動酶標儀(美國Bio-Rad公司) ; SN-695型智能放免γ測量儀(上海核輻光電儀器有限公司)。
1.4方法
1.4.1實驗分組及動物模型制備選擇體質量為160~200 g的健康SD雌鼠48只,隨機分為6組,每組8只: (A)正常對照組,(B)骨質疏松模型組,(C)陽性藥物組,(D) 0.1 mg·kg-1GSS組,(E) 0.3 mg ·kg-1GSS組,(F) 1.0 mg·kg-1GSS組。大鼠用10%的水合氯醛麻醉大鼠后,于平臥位消毒,打開腹腔,行雙側卵巢切除;正常對照組僅探查卵巢,不切除,余操作同模型組。術后1周各組行陰道脫落細胞檢查,以明確卵巢切除成功。陽性藥物組按80 mg·kg-1戊酸雌二醇混懸液灌胃,GSS治療組分別按0.1 mg·kg-1、0.3 mg·kg-1和1.0 mg·kg-1劑量灌胃,給藥體積為0.5 mL·100 g-1體重,對照組及骨質疏松模型組大鼠給予等體積的生理鹽水,每天1次,連續6周。
1.4.2血清血生化檢測電解質和AKP、TrACP-5b的活性給藥6周后,麻醉大鼠,腹腔動脈取血,2 000 rpm·min-1,4℃,離心15 min,分離血清,于-80℃冰箱保存。電解質儀檢測血清鈣、鎂和磷的水平;酶分析方法檢測血清AKP和TrACP-5b活性。
1.4.3放射免疫學方法檢測血清BGP和CT指標
取血清,解凍后,3 000 rpm·min-1,離心10 min,取上清100 μL于已編寫號碼的放免專用試管中,加入相應的抗血清100 μL,混勻,再分別加入125I標記的BGP、CT,混勻,另設總放射值管、非特異反應管(不加入抗血清)及標準管(S0~S5),4℃孵育24 h。除總放射管值外,每管加入免疫分離劑500 μL,充分混勻,室溫放置20 min后,4℃,3 000 rpm· min-1,離心10 min,棄上清,在SN-695型智能放免γ測量儀上測定cpm值,半對數繪制標準曲線,分別計算每管血清BGP、CT的含量。
1.4.4骨重量及長度指數檢測分別稱量腰椎、股骨和脛腓骨重量,測量股骨和脛腓骨長度,計算腰椎、股骨和脛腓骨重量指數(骨質重量/大鼠重量),股骨和脛腓骨長度指數(骨質重量/骨質長度)。
1.5統計學分析應用prism 5.0統計學軟件進行統計學分析。各測量指標的數據資料以±s表示,組間各測定指標的總體比較采用單因素方差分析,組內各指標的多重比較采用SNK檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 GSS對血清Ca2 +、Mg2 +、P含量的影響結果顯示,與對照組相比,模型組大鼠血清Ca2 +和Mg2 +含量降低、P含量升高(P<0.05) ;與模型組相比,陽性藥物組血鈣水平升高,血磷下降(P<0.05),GSS各組血Ca2 +含量升高(P<0.05),血P含量與模型組無明顯差異(表1)。
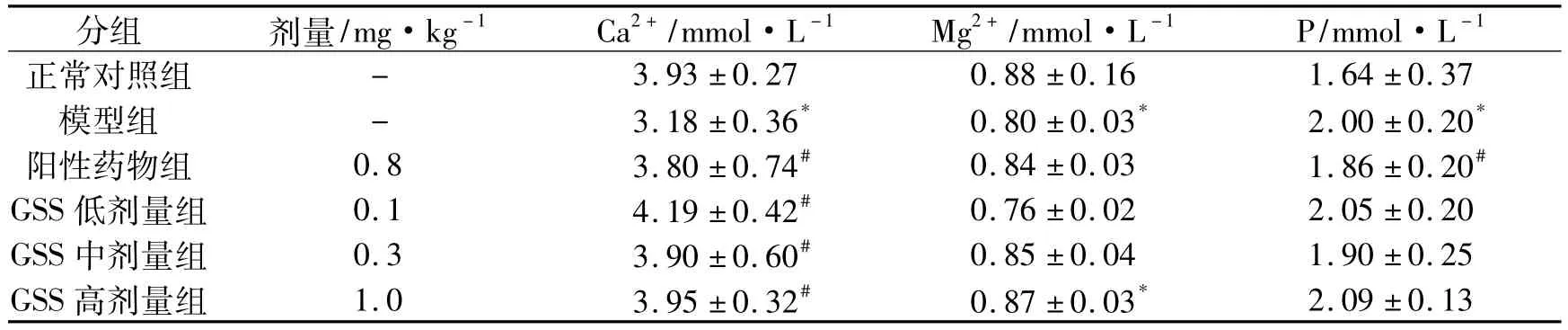
表1 GSS去卵巢大鼠血清電解質含量的影響Table 1 GSS serum electrolytes to influence the content of ovariectomized rats
2.2 GSS對血清AKP活性和肝組織STrACP活性的影響AKP結果表明,與對照組相比,模型組大鼠血清AKP活性降低(P<0.05),肝組織STrACP-5b活性升高(P<0.01) ;與模型組相比,陽性藥物組肝組織STrACP-5b活性降低(P<0.01),GSS治療組AKP活性升高(P<0.05),肝組織STrACP-5b活性降低(P<0.01) (表2)。

表2 GSS對血清AKP及肝臟STrACP-5b活性的影響Table 2 GSS on serum AKP and liver STrACP-5b activity
2.3 GSS對血清BGP和CT含量的影響結果顯示,與對照組相比,模型組大鼠血清BGP水平升高(P<0.001)、CT含量降低(P<0.05) ;與模型對照組相比,陽性藥物組血清BGP水平降低(P< 0.001)、CT含量升高(P<0.05),GSS各治療組BGP含量降低(P<0.05,P<0.01,P<0.001)、CT含量升高(P<0.05) (表3)。

表3 GSS對血清骨鈣素(BGP)、降鈣素(CT)的影響Table 3 GSS influence on serum osteocalcin (BGP) and calcitonin (CT)
2.4 GSS對骨密度、骨長度和骨重量指數的影響
結果顯示,與對照組相比,模型組大鼠的股骨和脛骨長度指數(P<0.05,P<0.001)和腰椎、股骨及脛腓骨重量指數均減小; GSS治療6周后,股骨、脛骨長度指數和腰椎、股骨、脛腓骨重量指數均提高(P<0.05,P<0.01) (表4)。
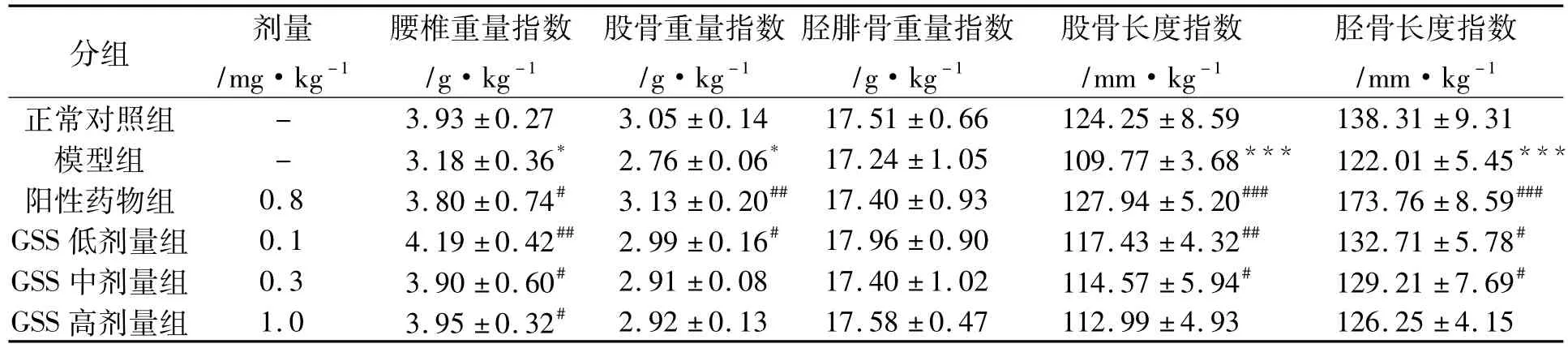
表4 GSS對去卵巢大鼠骨長度和骨重量指數的影響
3 討論
目前包括兔子、狗、猴等許多物種用于制作動物骨質疏松模型,其中實驗鼠因操作簡單,成本低,實驗要求差異性最少所以成為最常用的模型動物。實驗鼠模型制作方法很多,有卵巢、睪丸、垂體切除,也有使用激素類藥物,且最終都能達到骨丟失的目的,但是最終仍然是通過生化檢查、骨形態計量學等方法監測和評價該動物模型在預防或治療骨質疏松癥的效果[2]。
正常情況下,骨形成和骨吸收通過各種調節信號緊密相連。當骨吸收越活躍并引起骨密度降低和骨組織微結構破壞時,就會導致骨質疏松癥的發生,隨之而來就是骨脆性增加和骨折風險增加。骨質疏松癥并發癥脆性骨折可使病人致殘,嚴重危及病人生活質量[3]。盡管骨質疏松癥已經是嚴重威脅老年人健康的疾病,但是如何診斷和評估骨質疏松癥危害性卻一直沒有定論。國內外比較常用是通過雙能X線進行骨密度檢測,因為其直接有效的檢測和診斷方法,所以在臨床上已廣泛的使用[4],但是最近研究認為它僅僅能檢測受測部位的骨代謝,不能做全身骨質情況評估,更不能很好的預測患者骨折的風險,因此評估骨質疏松的風險往往需要綜合個體情況及生化指標來完成[5]。骨轉換指標(bone turnover markers,BTMs)雖然不是診斷骨質疏松的標準,臨床效用有限,但是抗骨質疏松治療后,可以通過骨轉換指標全面評價人體骨的代謝情況,從而間接判斷抗骨質疏松效果并預測骨折的風險,因此得到不少學者高度重視[6]。
成骨細胞(Osteoblast,OB)和破骨細胞(Osteoclast,OC)是骨代謝最重要的核心細胞,骨代謝的關鍵就是這兩種細胞代謝變化的結果[7-8]。目前反應成骨細胞標志物較多,其中包括AKP,BGP,I型前膠原羧基末端肽(PICP)等。其中AKP和BGP因擁有較好的生物穩定性、較低的個體差異性而且檢測方法簡單已經成為評估成骨細胞活性的重要手段[9],PICP同樣作為成骨代謝產物也是反應成骨細胞活性的重要指標,但是其結果易受干擾,如半衰期只有6~8分鐘[10],且體內受不同時間變化而變化,研究發現PICP凌晨比中午人體含量高20%,Vasikaran S等人研究認為PICP來源可能不僅僅于骨代謝,因此沒有很好的特異性,因此一定程度上限制其實踐運用[11]。TrACP是目前臨床上判斷成骨細胞和破骨細胞活性的重要的生化標志物,也是骨質疏松癥重要監測指標之一。體外實驗證明,在骨吸收過程中,破骨細胞活躍,同時大量分泌TrACP,因此TrACP水平可反映破骨細胞活性和骨吸收狀態。絕經期后的女性因為內源性雌激素減少,骨重建失衡,骨吸收大于骨形成,會出現TrACP顯著增加。在正常人血清中,TrACP以兩種基化形式存在: TrACP-5a和TrACP-5b。其中TrACP-5b則主要由破骨細胞分泌。故測定血清中的TrACP-5b活性,可以反映體內OC活性和骨吸收狀態。目前研究認為TrACP-5b的活性直接反應了OC在骨組織中的數量,是反映OC活性的特異性指標,目前已經成為第二代骨吸收生化標志[12-13]。試驗中GSS組尤其是中劑量組可以提高AKP活性,降低肝組織STrACP-5b活性,側面反映其可以提高成骨細胞活性,抑制破骨細胞活性,達到改善骨代謝作用。
通過實驗我們發現,GSS能提高成骨細胞數量和功能,同時產生類雌激素對破骨細胞的抑制作用,而且綜合各項指標,中劑量組更為明顯,符合不少學者認為類雌激素藥物效果并非量大為好的觀點。綜上,GSS通過對成骨細胞和破骨細胞的作用,在整體上對絕經后的高轉換型骨質疏松癥進行改善,降低骨折風險,為進一步臨床運用提供理論基礎。
參考文獻:
[1]朱文清,李增明,李紅燕,等.染料木素磺酸鈉對去卵巢大鼠甘油三酯和膽固醇代謝的調節作用[J].贛南醫學院學報,2013,33(2) : 167-169.
[2]Lelovas PP,Xanthos TT,Thoma SE,et al.The Laboratory Rat as an Animal Model for Osteoporosis Research[J].Comp Med,2008,58: 424-430.
[3]張智海,劉忠厚,李娜.中國人骨質疏松癥診斷標準專家共識[J].中國骨質疏松雜志,2014,20(9) :1007-1010.
[4]Lorentzon M,Cummings SR.Osteoporosis: the evolution of a diagnosis[J].J Intern Med,2015,277(6) :650-661.
[5]Edwards MH,Dennison EM,Aihie Sayer A,et al.Osteoporosis and Sarcopenia in Older Age[J].Bone,2015,80: 126-130.
[6]張萌萌.中國老年學學會骨質疏松委員會骨代謝生化指標臨床應用專家共識[J].中國骨質疏松雜志,2014,20(11) : 1263-1272.
[7]Albert JS,Bhattacharyya N,Wolfe LA,et al.Impaired osteoblast and osteoclast function characterize the osteoporosis of Snyder-Robinson syndrome[J].Orphanet J Rare Dis,2015,10(1) : 27.
[8]Tang P,Xiong Q,Zhang L,et al.The role of microRNAs in osteoclasts and osteoporosis[J].RNA Biol,2014,11 (11) : 1355-1363.
[9]Brown JP,Albert C,Nassar BA,et al.Bone turnover markers in the management of osteoporosis[J].Clin Biochem,2009,42: 929-942.
[10]Seibel MJ.Biochemical markers of bone turnover: part 1: biochemistry and variability[J].Clin Biochem Rev,2005,26: 97-122.
[11]Vasikaran S,Eastell R,Bruyère O,et al.Markers of bone turnover for the IOF-IFCC Bone Marker Standards Working Group.Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: a need for international reference standards [J].Osteoporos Int,2011,22: 391-420.
[12]Gillian Wheater,Mohsen Elshahaly,Stephen P Tuck.The clinical utility of bone marker measurements in osteoporosis[J].J Transl Med,2013,11: 201.
[13]方玲娜,鐘紹,戴如春.染料木素對去卵巢大鼠骨代謝標志物和松質骨微結構的作用[J].中國慢性病預防與控制,2010,12(18) : 615-616.
Effects of Genistein Sulfonate Sodium on Related Indexes of Bone Metabolism in Ovariectomized Rats
ZHU Wen-qing1,CHEN Jin-cai1,JI Guang-lin1,HUANG Zhi-hua2
(1.Dept.of Orthopedics,the First Affiliated Hospital of Gannan Medical University; 2.Research Center of Gannan Medical University,Ganzhou,Jiangxi 341000)
Abstract:Objective: To observe the effect of Genistein Sulfonate Sodium(GSS) on bone metabolism in ovariectomized rat.Methods: 48 female SD rats were randomly divided into 6 groups: control group,ovariectomized model group,positive drug group,and difference dose of GSS groups (0.1,0.3,1.0 mg·kg(-1)).After one week following ovariectomy,the rats were administrated saline,estradiol valerate or GSS by ig once a day.Six weeks later,the rats were sacrificed,their serum was taken to detect electrolytes,bone gla protein (BGP),calcitonin (CT) and alkaline aphosphatase (AKP),and their liver tissues were make to observe tartrate-resistant acid phosphatase (TrACP-5b).Then the rats were detected bone length and mass index.Results: Compared with the model group,(1) GSS can increase lumbar spine,femur,tibia and fibula weight index,and increase the length index of the femur and tibia(P<0.001) ; (2) GSS can reduce serum BGP,and improve the content of calcitonin(P<0.001) ; (3) GSS can elevate serum AKP level and reduce liver TrACP-5b content(P<0.01).Conclusion: GSS can improve bone metabolism in ovariectomized rats by regulating bone formation and resorption way,and provide a potential therapeutic approach for postmenopausal osteoporosis.
Key words:Genistein Sulfonate Sodium; ovariectomized rats; bone metabolism
(收稿日期:2015-08-24) (責任編輯:敖慧斌)
通訊作者:黃志華,女,教授,碩士研究生導師,主要從事心腦血管疾病研究。E-mail: gnyxyhzh@163.com
*基金項目:國家自然科學基金(NO.31360250) ;江西省衛計委(NO.20155465) ;贛州市科技局(NO.GZ2014ZSF025)
DOI:10.3969/j.issn.1001-5779.2016.01.003
中圖分類號:R285.5
文獻標志碼:A
文章編號:1001-5779(2016) 01-0013-04

