不同發育階段棉纖維中木質素的沉積變化
胡文冉,范 玲,謝麗霞,王樂樂
(1.新疆農業科學院核技術生物技術研究所,烏魯木齊 830091;2. 新疆農業大學農學院,烏魯木齊 830052;
3.新疆農業大學科學技術學院,烏魯木齊 830052)
?
不同發育階段棉纖維中木質素的沉積變化
胡文冉1,范 玲1,謝麗霞2,王樂樂3
(1.新疆農業科學院核技術生物技術研究所,烏魯木齊830091;2. 新疆農業大學農學院,烏魯木齊830052;
3.新疆農業大學科學技術學院,烏魯木齊830052)
摘要:【目的】研究棉纖維不同發育階段木質素的沉積變化,為纖維品質改良提供理論依據。【方法】利用硫酸法分析棉纖維中木質素的含量,結合組織化學染色法觀察木質素在棉纖維中的沉積。【結果】發育20 DPA時單位重量棉纖維中硫酸木質素的積累速率最大,隨著棉纖維的發育,單位重量棉纖維中硫酸木質素的積累速率呈下降趨勢,成熟后纖維中硫酸木質素積累速率最低;單位重量的棉纖維在發育20 DPA時染色最深,隨著纖維的發育,染色越來越淺,與酸性木質素含量積累速率的測定結果相一致。根據組織化學染色結果推測棉花纖維中可能存在G、S兩種木質素單體。【結論】在發育20 DPA時相同重量的棉纖維中木質素的沉積速率最大,隨著纖維發育木質素的沉積速率越來越低。
關鍵詞:棉纖維;木質素;組織化學染色
0引 言
【研究意義】棉纖維是單細胞結構,其細胞壁的結構物質生化組分含量直接關系棉纖維的產量、品質及其利用。明確棉纖維的結構物質生化組分對于了解棉纖維的品質形成機理具有重要的意義。苯丙烷類化合物可能對棉纖維細胞壁的性質、纖維細胞的生長發育有著重要影響。了解棉纖維不同發育階段苯丙烷類化合物的動態積累變化對于明確苯丙烷類化合物在棉纖維發育過程中的作用具有重要的意義。【前人研究進展】隨著研究手段的不斷改進,近年來的部分研究發現并報道了發育中的棉纖維存在著包括苯丙烷代謝途徑的細胞次生壁發育的代謝途徑[1-7],而且是棉纖維發育中僅次于纖維素代謝途徑的第二大代謝途徑[4],其上揚表達與棉纖維次生壁發育同步[6]。Fan等[7]通過多種分析手段都表明,棉纖維中含有苯丙烷代謝產物-苯丙烷類化合物,苯丙烷代謝和棉纖維細胞壁發育密切相關,苯丙烷代謝產物和棉纖維品質的形成密切相關,并被得到進一步的驗證[8]。在自然界中苯丙烷類化合物是僅次于碳水化合物的碳源,包括木質素、木聚素、羥基肉桂酸共軛物、黃酮類化合物、木栓質、角質等[9-11],與細胞壁的纖維素與半纖維素相連接。形成植物細胞壁內交聯結構的苯丙烷類化合物可分為兩組:(1) 通過氧化連接形成木質素的單體木質素;(2) 交聯于細胞壁上不同化合物的低分子的羥基肉桂酸[12-14]。木質素是由苯丙烷類結構單元(phenylpropane unit)通過 C-C 鍵(1/3-1/4)和醚鍵(2/3-3/4)連接形成的交聯的無定型三維聚合物。木質素結構單元包括對羥基苯丙烷(p-hydroxyl phenyl propane, H)、愈瘡木基丙烷(guaiacyl propane, G)、紫丁香基丙烷(syringyl propane, S) 3種[15],這三種單體在植物體內通過多種鍵型連接在一起,形成復雜的木質素聚合體。【本研究切入點】苯丙烷類化合物可能對棉纖維細胞壁的性質、纖維細胞的生長發育有著重要影響。因此,了解棉纖維不同發育階段苯丙烷類化合物的動態積累變化對于明確苯丙烷類化合物在棉纖維發育過程中的作用具有重要的意義。【擬解決的關鍵問題】利用硫酸法分析陸地棉TM-1不同發育階段棉纖維中木質素的含量的動態積累,結合組織化學染色法研究木質素在棉纖維發育過程中的沉積,為棉纖維的品質改良奠定基礎。
1材料與方法
1.1材 料
1.1.1陸地棉
陸地棉TM-1種植于新疆農業科學院瑪納斯試驗站,在盛花期開花當天掛牌標記,并以此為基點,分別取20、30、40、50 DPA (Day Postanthesis)棉鈴,在每株棉花外圍果枝中部選取中等大小、果形端正、無病蟲害、無機械損傷的棉鈴各5個,去除棉殼等,存儲于-20oC冰箱中備用;同時取自然成熟棉鈴,存儲于室溫備用。
1.1.2主要試劑
H-buffer (50 mmol/L Tris-HCl, 10 g/L Triton X-100, 1 mol/L NaCl; pH 8.3);間苯三酚;高錳酸鉀;氨水;鹽酸;酒精;水為蒸餾水。
1.2方 法
1.2.1獲得不同發育階段棉纖維
從-20oC冰箱取出前期存放的去殼棉鈴,置于均一化緩沖溶液中浸泡,用鑷子將棉纖維與棉籽分離,注意分離的纖維不可帶有種皮等雜質。將分離的棉纖維浸泡在均一化緩沖溶液中,避免產生棉酚褐化現象,并立即進行清洗。對于脫水成熟棉纖維用小型的軋花機脫籽后回收纖維備用。
1.2.2 清洗不同發育階段棉纖維
棉纖維分別用均一化緩沖液清洗兩次,80%丙酮洗兩次,純丙酮洗一次[16],每次都用金屬夾蒜器將纖維中的溶液擠干。之后將洗好的棉纖維置于濾紙上,45oC烘干備用。
1.2.3木質素含量
硫酸法測定不同發育階段TM-1棉纖維中Klason木質素的含量[17,18]。
1.2.4 組織化學染色1.2.4.1 Wiesner染色[19]
分別稱取0.01 g清洗干燥后不同發育階段的棉纖維置于2 mL離心管中,加0.5 mL濃鹽酸,混勻放置10 min后,分別滴加1 M NaOH溶液至中性,倒去反應液,用蒸餾水清洗棉纖維3次,再向離心管中分別加1 mL 5% 間苯三酚溶液(95%酒精配制),染色10 min后拍照。
1.2.4.2 M?ule染色[20-22]
分別稱取0.01 g清洗干燥后不同發育階段的棉纖維置于2 mL離心管中,加1 mL 1%高錳酸鉀溶液,混勻后染色5 min,用蒸餾水沖洗 3 遍后在3% HCl 中浸泡 1 min,蒸餾水洗滌后加1 mL 29% 氨水,放置10 min后拍照。
同時分別稱取0.01 g清洗干燥后不同發育階段的棉纖維置于2 mL離心管中,加1 mL 蒸餾水將棉纖維完全浸潤后作為對照。
2 結果與分析
2.1 不同發育階段棉花纖維中硫酸木質素含量的沉積動態
研究表明,發育20 DPA時單位重量棉纖維中硫酸木質素的積累速率最大,隨著棉纖維的發育,單位重量棉纖維中硫酸木質素的積累速率呈下降趨勢,成熟后纖維中硫酸木質素積累速率最慢。圖1
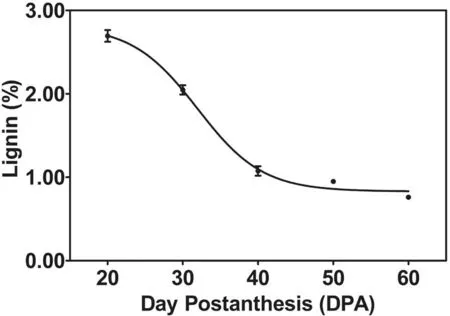
圖1 TM-1不同發育階段纖維中硫酸木質素積累變化
Fig.1 Dynamic changes of the Klason lignin deposition during cotton fiber developmental stages
2.2 不同發育階段棉花纖維組織化學染色
研究表明,Wiesner染色時間苯三酚將棉花纖維染成紅色,間苯三酚對愈創木基(G) 和紫丁香基(S)木質素產生顏色反應,由此推測棉花纖維中可能存在S和G兩種結構單元。研究表明,在發育20 DPA時相同重量的棉花纖維中愈創木基(G) 和紫丁香基(S)木質素已在棉纖維中沉積(圖2:6~10),隨著纖維發育紅色越來越淺,直至纖維成熟后染色顏色最淺,說明隨著棉纖維的發育,在相同重量的棉纖維中愈創木基(G) 和紫丁香基(S)木質素的積累速率越來越少。在M?ule反應中高錳酸鉀可以將棉纖維染成棕色(圖2:11~15),推測棉纖維中含有紫丁香基(S)結構單元。在發育20 DPA時相同重量的棉花纖維中紫丁香基(S)木質素已在棉纖維中沉積,隨著纖維發育棕色越來越淺,直至纖維成熟后染色顏色最淺,也說明在相同重量的棉纖維中隨著棉纖維的發育,纖維中紫丁香基(S)木質素的積累速率越來越少。兩種染色結果顯示隨著棉纖維的發育,纖維中木質素的變化趨勢和棉纖維發育過程中硫

注:離心管1~5號分別是未染色的發育20, 30, 40, 50 DPA和自然成熟的棉纖維(CK);離心管6~10號分別是間苯三酚染色后的發育20, 30, 40, 50 DPA和自然成熟的棉纖維;離心管11~15號分別是高錳酸鉀染色后的發育20, 30, 40, 50 DPA和自然成熟的棉纖維
Note: 1-5 showed respectively undyed 20, 30, 40, 50 DPA and mature cotton fiber (CK); 6-10 showed 20, 30, 40, 50 DPA and mature cotton fiber dyed by phloroglucinol; 11-15 showed 20, 30, 40, 50 DPA and mature cotton fiber dyed by potassium permanganate
圖2 發育過程中棉纖維組織化學染色
Fig.2 Histochemical staining of cotton fiber in development
酸木質素的測定結果相吻合。根據組織化學染色結果可以推測出棉花纖維中可能存在著愈創木基(G)和紫丁香基(S)兩種木質素單體。圖2
3討 論
分析植物細胞壁中木質素含量的方法很多,其中硫酸法提取植物細胞壁中的木質素原理是硫酸將木質素以外的成分溶解除去,木質素作為不溶性成分被過濾分離出來,得到的木質素即為硫酸木質素,也叫Klason木質素。研究表明該方法得到的棉纖維中的硫酸木質素與棉纖維品質中的長度和比強度呈負相關關系,并且該方法測定程序簡單,精確度較高[23],所以常用來衡量棉花纖維中的木質素含量。20 DPA時木質素沉積速率最大,隨著纖維發育木質素沉積速率越來越小。與棉纖維發育過程中硫酸木質素含量的測定結果一致[18]。
組織化學染色是檢測木質素分布的一種簡單有效的方法,染色包括Wiesner和M?ule兩個反應,其中Wiesner反應中間苯三酚在酸性條件下可以與木質素中的肉桂醛基團發生顯色反應,使其變成紅色或粉紅色化合物[19];M?ule反應中由于紫丁香基中游離的酚羥基的存在,染色劑高錳酸鉀與酚羥基反應成紫紅色或棕色,可以有效地鑒別S基木質素的存在[20-22]。根據實驗對棉纖維進行組織化學染色結果推測棉纖維中可能存在著愈創木基(G)和紫丁香基(S)木質素,和棉花莖稈中存在的木質素單體類似[24]。對不同發育階段棉纖維的染色結果表明20 DPA時木質素沉積速率最大,隨著纖維發育木質素沉積速率越來越小。染色結果和棉纖維發育過程中硫酸木質素沉積速率的測定結果相吻合。
棉纖維是由胚珠外珠被的一部分單個表皮細胞在受精前后經分化突起、伸長、次生壁增厚和脫水成熟而形成的[25]。其中棉纖維次生壁的合成與增厚開始于16~19 DPA。該時期棉纖維細胞壁中通過一系列生理生化代謝形成次生壁物質。纖維素也在該時期以結晶態形式每天向內淀積一層。實驗結果表明在纖維發育20 DPA時木質素也已在棉纖維中沉積,并且木質素的沉積速率在纖維發育20 DPA時纖維中較高,隨著棉花纖維的發育木質素的沉積速率減少。但單個棉鈴纖維質量是構成皮棉產量的基礎,是體現棉花庫質量最直觀的指標[26]。棉纖維次生壁發育初始期單個棉鈴中木質素與纖維素間的比例相對較高,隨著次生壁發育,纖維素快速積累,木質素的積累速度遠低于纖維素的積累速度,從而導致相同重量棉纖維中木質素的含量出現降低趨勢,事實上,隨著單位棉鈴的重量增加,單位棉鈴纖維中纖維素、木質素的積累量也在逐漸增加,與棉纖維次生壁的發育趨勢一致。有研究表明單鈴中纖維素的積累[26-28]和木質素的積累[18]都符合“S” 型曲線。
4結 論
發育20 DPA時相同重量棉纖維中硫酸木質素的積累速率最大,隨著棉纖維的發育,相同重量棉纖維中硫酸木質素的積累速率呈下降趨勢,成熟后纖維中硫酸木質素積累速率最慢。發育20 DPA時相同重量的棉纖維染色最深,隨著棉纖維的發育,相同重量棉纖維染色越來越淺,直至纖維成熟后染色顏色最淺。說明相同重量棉纖維20 DPA時木質素積累速率最大,隨著棉纖維發育而下降,根據組織化學染色結果推測棉纖維中可能存在G、S兩種木質素單體。
參考文獻(References)
[1] Samuel Yang, S., Cheung, F., Lee, J. J., Ha, M., Wei, N. E., Sze, S. H., ... & Jeffrey Chen, Z. (2006). Accumulation of genome‐specific transcripts, transcription factors and phytohormonal regulators during early stages of fiber cell development in allotetraploid cotton.ThePlantJournal, 47(5):761-775.
[2] Yao, Y., Yang, Y. W., & Liu, J. Y. (2006). An efficient protein preparation for proteomic analysis of developing cotton fibers by 2‐DE.Electrophoresis, 27(22): 4,559-4,569.
[3] Shi, Y. H., Zhu, S. W., Mao, X. Z., Feng, J. X., Qin, Y. M., Zhang, L., ... & Zhu, Y. X. (2006). Transcriptome profiling, molecular biological, and physiological studies reveal a major role for ethylene in cotton fiber cell elongation.ThePlantCell, 18(3): 651-664.
[4] Gou, J. Y., Wang, L. J., Chen, S. P., Hu, W. L., & Chen, X. Y. (2007). Gene expression and metabolite profiles of cotton fiber during cell elongation and secondary cell wall synthesis.Cellresearch, 17(5):422-434.
[5] Wu, Y., Llewellyn, D. J., White, R., Ruggiero, K., Al-Ghazi, Y., & Dennis, E. S. (2007). Laser capture microdissection and cDNA microarrays used to generate gene expression profiles of the rapidly expanding fibre initial cells on the surface of cotton ovules.Planta, 226(6):1,475-1,490.
[6] Hovav, R., Udall, J. A., Hovav, E., Rapp, R., Flagel, L., & Wendel, J. F. (2008). A majority of cotton genes are expressed in single-celled fiber.Planta, 227(2):319-329.
[7] Fan, L., Shi, W. J., Hu, W. R., Hao, X. Y., Wang, D. M., Yuan, H., & Yan, H. Y. (2009). Molecular and Biochemical Evidence for Phenylpropanoid Synthesis and Presence of Wall‐linked Phenolics in Cotton Fibers.Journalofintegrativeplantbiology, 51(7):626-637.
[8] Han, L. B., Li, Y. B., Wang, H. Y., Wu, X. M., Li, C. L., Luo, M., ... & Xia, G. X. (2013). The dual functions of WLIM1a in cell elongation and secondary wall formation in developing cotton fibers.ThePlantCellOnline, 25(11):4,421-4,438.
[9] Anterola, A. M., & Lewis, N. G. (2002). Trends in lignin modification: a comprehensive analysis of the effects of genetic manipulations/mutations on lignification and vascular integrity.Phytochemistry, 61(3):221-294.
[10] Humphreys, J. M., & Chapple, C. (2002). Rewriting the lignin roadmap.Currentopinioninplantbiology, 5(3):224-229.
[11] Boerjan, W., Ralph, J., & Baucher, M. (2003). Lignin biosynthesis.Annualreviewofplantbiology, 54(1):519-546.
[12] Iiyama, K., Lam, T. B. T., & Stone, B. A. (1994). Covalent cross-links in the cell wall.PlantPhysiology, 104(2): 315.
[13] Wallace, G., & Fry, S. C. (1994). Phenolic components of the plant cell wall.Internationalreviewofcytology, 151(229267):2007.
[14] Rubin, E. M. (2008). Genomics of cellulosic biofuels.Nature, 454(7206):841-845.
[15] Ralph, J., Lundquist, K., Brunow, G., Lu, F., Kim, H., Schatz, P. F., ... & Boerjan, W. (2004). Lignins: natural polymers from oxidative coupling of 4-hydroxyphenyl-propanoids.PhytochemistryReviews, 3(1-2):29-60.
[16] Müse, G., Schindler, T., Bergfeld, R., Ruel, K., Jacquet, G., Lapierre, C., ... & Schopfer, P. (1997). Structure and distribution of lignin in primary and secondary cell walls of maize coleoptiles analyzed by chemical and immunological probes.Planta, 201(2):146-159.
[17] Hu, W. R., Fan, L., Tian, X. L., & Xie, L. X. (2015). Modified Methods For The Analysis Of The Lignin-Like Phenolic Polymer Contents Of Cotton Fibers.JournalofAnimalandPlantSciences, 25(3): 232-239.
[18] 曹雙瑜,胡文冉,范玲.發育中棉纖維硫酸木質素含量的動態變化[J].新疆農業科學, 2012, 49(7): 1 184-1 189.
CAO Shuang-yu, HU Wen-ran, FANG Ling. (2012). The dynamic changes of Klason contents during cotton fiber development [J].XinjiangAgriculturalSciences, 49(7): 1,184-1,189. (in Chinese)
[19] Vallet, C., Chabbert, B., Czaninski, Y., & Monties, B. (1996). Histochemistry of lignin deposition during sclerenchyma differentiation in alfalfa stems.AnnalsofBotany:625-632.
[20] Suzuki, K., & Itoh, T. (2001). The changes in cell wall architecture during lignification of bamboo, Phyllostachys aurea Carr.Trees,15(3): 137-147.
[21] Watanabe, Y., Fukazawa, K., Kojima, Y., Funada, R., Ona, T., & Asada, T. (1997). Histochemical study on heterogeneity of lignin in Eucalyptus species, 1: Effects of polyphenols.JournaloftheJapanWoodResearchSociety(Japan), 43(1): 102-107.
[22] Watanabe, Y., Kojima, Y., Ona, T., Asada, T., Sano, Y., Fukazawa, K., & Funada, R. (2004). Histochemical study on heterogeneity of lignin in Eucalyptus species II. The distribution of lignins and polyphenols in the walls of various cell types.IAWAJournal, 25(3):283-295.
[23] ZL201010143263.X,2011.一種確立棉花纖維中木質素含量和纖維品質相關關系的方法[P].
ZL201010143263.X, 2011.Methodfordeterminingcorrelationshipoflignincontentsandfiberqualityincottonfiber[P]. (in Chinese)
[24] Kang, S., Xiao, L., Meng, L., Zhang, X., & Sun, R. (2012). Isolation and structural characterization of lignin from cotton stalk treated in an ammonia hydrothermal system.InternationalJournalofMolecularSciences, 13(11):15,209-15,226.
[25] Basra, A. S., & Malik, C. P. (1984). Development of the cotton fiber.IntRevCytol, 89(1):65-113.
[26] 張文靜,王偉,羅松松,等.棉纖維發育相關糖類物質轉化與纖維產量形成的關系[J].棉花學報, 2013, 25(2): 103-109.
ZHANG Wen-jing, WANG Wei, LUO Song-song, et al. (2013). Relationship between carbohydrates transforming and fiber dry weight formation during cotton fiber development [J].CottonScience, 25(2): 103-109. (in Chinese)
[27] 張文靜,胡宏標,陳兵林,等.棉鈴對位葉生理特性的基因型差異及其與鈴重形成的關系[J]. 棉花學報, 2007, 19(4): 296-303.
ZHANG Wen-jing, HU Hong-biao, CHEN Bing-lin, et al. (2007). Relationship between genotypic difference of physiological characteristics in leaf subtending boll and boll weight forming [J].CottonScience, 19(4): 296-303. (in Chinese)
[28] 高云光,饒翠婷,賀海燕,等.鈴期溫度對不同棉花品種棉鈴發育過程及纖維比強度的影響[J].棉花學報,2010,22(6):580-585.
GAO Yun-guang, RAO Cui-ting, HE Hai-yan, et al. (2010). Regulation effect of temperature on the boll dates for boll development and fibre strength [J].CottonScience, 22(6): 580-585. (in Chinese)
Dynamic Changes of Lignin Deposition during Cotton Fiber Development Stage
HU Wen-ran1, FAN Ling1, XIE Li-xia2, WANG Le-le2
(1.ResearchInstituteofNuclearandBiotechnologies,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China; 2.CollegeofAgronomy,XinjiangAgriculturalUniversity,Urumqi830052; 3.CollegeofScienceandTechnology,XinjiangAgriculturalUnicersity,Urumqi830052)
Abstract:【Objective】 To study the changes of lignin deposition during different developmental stages of cotton fiber and provide a theoretical basis for improving fiber quality. 【Method】In this study, the content of lignin was analyzed by Klason method and lignin deposition observed by histochemical staining. 【Result】The accumulation rate of Klason lignin was the largest per unit weight of cotton fiber at 20 DPA (Day Postanthesis), the accumulation rate showed a decreasing trend with the development of cotton fiber and mature fiber with the slowest rate. The result of histochemical staining showed the deepest color dyeing as the per unit weight of cotton fiber at 20 DPA and the color became shallow with the development of cotton fiber, which was in consistent with the result of the accumulation rate of Klason lignin. Presumably, there may be G (guaiacyl propane) and S (syringyl propane) lignin monomer existing in cotton fiber according to the results of the histochemical staining. 【Conclusion】The deposition rate was the highest when the same weight of cotton fiber in the development of 20 DPA and the rate of lignin in same weight of cotton fiber became less with the cotton fiber development.
Key words:cotton fiber; lignin; histochemical staining
中圖分類號:S562;Q946
文獻標識碼:A
文章編號:1001-4330(2016)03-0467-06
作者簡介:胡文冉(1974-),女,河南人,副研究員,研究方向為棉纖維品質生化機理,(E-mail)huwran@126.com通訊作者:范玲(1958-),女,新疆人,研究員,研究方向為棉花纖維分子機理與改良,(E-mail)fanlin@xaas.ac.cn
基金項目:自治區創新人才項目“陸地棉和海島棉纖維不同發育階段細胞壁超微結構和苯丙烷類化合物的比較”(2014721025)
收稿日期:2015-07-20
doi:10.6048/j.issn.1001-4330.2016.03.011
Fund project:The Talents Engaging in Scientific and Technological Innovations of Xinjiang, China “Comparison of cell wall ultrastructure and phenylpropanoid compounds in developing fibers of upland cotton and sea-island cotton”(No. 2014721025)

