共表達HAC1基因對重組畢赤酵母分泌表達葡萄糖氧化酶的影響
顧 磊, 張 娟, 堵國成, 陳 堅(1.江南大學生物工程學院,江蘇無錫214122;2.糧食發酵工藝與技術國家工程實驗室,江南大學,江蘇無錫214122;3.江南大學工業生物技術教育部重點實驗室,江蘇無錫214122)
?
共表達HAC1基因對重組畢赤酵母分泌表達葡萄糖氧化酶的影響
顧磊1,3,張娟1,3,堵國成1,3,陳堅*2,3
(1.江南大學生物工程學院,江蘇無錫214122;2.糧食發酵工藝與技術國家工程實驗室,江南大學,江蘇無錫214122;3.江南大學工業生物技術教育部重點實驗室,江蘇無錫214122)
摘要:通過增強不可折疊蛋白質響應(UPR)信號途徑以及研究不同培養溫度下的影響,來提高重組葡萄糖氧化酶在畢赤酵母中的分泌表達。影響畢赤酵母外源蛋白表達的因素,主要為內質網中的折疊速率以及不可折疊蛋白積累造成的胞內脅迫壓力。通過共表達HAC1基因對不可折疊蛋白信號通路進行調控,搖瓶中改造菌株PP-G-HAC1胞外酶活達到161 U/mL,相比于原始重組葡萄糖氧化酶菌株提高了34%。進一步研究不同溫度下過量表達HAC1基因對菌株的生長和分泌外源蛋白的影響,菌株PP-G-HAC1在3 L發酵罐中28℃培養,酶活達到1 008 U/mL,胞外重組蛋白質達到14.43 g/L,相比原始菌株在相同條件下提高了3.12倍。
關鍵詞:重組畢赤酵母;葡萄糖氧化酶;不可折疊蛋白響應;HAC1基因
葡萄糖氧化酶(EC 1.1.3.4,簡稱GOD)是生物領域中重要的工具酶。它是一種黃素蛋白,可以將β-D-葡萄糖通過分子氧傳遞電子轉化為葡萄糖酸和過氧化氫。葡萄糖氧化酶被廣泛應用于食品、飼料、醫藥等行業[1]。其中在醫藥和食品領域中的作用尤為重要。在醫藥領域中,可制成試劑盒及電極,用于血漿、尿液及腦脊液中葡萄糖的定量檢測[2]。在食品領域中,可用于去除食品和飲料中殘留的葡萄糖和氧,從而提高貨架期和保質期,同時也是生產葡萄糖酸及其衍生物的重要轉化用酶[3]。葡萄糖氧化酶及其產物和產物衍生物均具有廣泛的市場和應用前景。大規模生產菌株常采用黑曲霉或者青霉,然而采用霉菌生產有其弊端,大量的雜蛋白質和伴生產物造成下游提取的困難,同時產酶量不高也成為大規模生產的主要瓶頸[4-6]。為了解決這些問題,近年來使用基因工程改造方法進行異源表達受到關注。其中酵母表達系統相較于大腸桿菌等原核表達系統能夠較好地異源表達葡萄糖氧化酶[7-11]。釀酒酵母表達系統由于過糖基化修飾,使得重組葡萄糖氧化酶過糖基化情況嚴重,限制了葡萄糖氧化酶的應用[12]。畢赤酵母表達系統在這方面展現出優勢,但國內外相關報導中,黑曲霉來源基因重組葡萄糖氧化酶在畢赤酵母中的最高產率為40 U/mL,仍然不能滿足大規模生產的要求[11]。因此,如何提高重組葡萄糖氧化酶的產量成為十分重要的研究方向。
畢赤酵母(Pichia pastoris)是一種廣泛應用于分泌表達外源蛋白的真核系統。盡管已有多種外源蛋白質在該系統中成功表達,但不意味著所有的案例都達到預期的效果,畢赤酵母系統中表達外源源蛋白存在著很大的差異。最近的研究發現,在畢赤酵母表達系統中,內質網中未折疊蛋白或錯誤折疊蛋白的積聚對于外源蛋白的分泌表達量有很大的影響[13-14]。經常采用的更換強啟動子或者增加外源蛋白基因拷貝數的策略,使得大量屬于外源蛋白質的初生肽鏈在內質網中滯留,不能成功分泌表達,甚至影響了宿主菌株的生長[15-17]。HAC1基因編碼的Hac1p是酵母內質網中不可折疊蛋白響應(UPR)機制的激活調控因子,能夠調控分泌表達途徑中的下游靶基因,這些基因包含了各種分子伴侶,折疊因子,內質網中參與糖基化控制,以及其他胞內脅迫條件下調控因子的編碼基因[18-19]。在作者所在研究室前期的研究中,篩選得到的高產葡萄糖氧化酶黑曲霉菌株Aspergillus niger BBE11721,擴增其葡萄糖氧化酶基因,構建了畢赤酵母基因工程菌株Pichia pastoris GS115-pPIC9K-GOD(保藏編號為CCTCC NO:M 2012266)。作者在此基礎上,共表達了HAC1基因,并且進一步研究不同培養溫度下共表達HAC1基因對菌株的生長和分泌外源蛋白質的影響。
1 材料與方法
1.1材料
1.1.1菌株與質粒菌株與質粒:均為作者所在實驗室購買及保存。研究中使用及構建所得菌株和質粒見表1。
1.1.2試劑PrimeSTAR HS DNA聚合酶、T4連接酶、PCR產物純化試劑盒、限制性內切酶等:大連寶生物公司;SDS-PAGE凝膠試劑盒、蛋白質電泳marker:購自碧云天公司;培養基所用酵母膏、蛋白胨:Oxoid公司;引物及測序:均由上海生工有限公司完成。其他常規試劑為國產分析純。
1.2培養基
1.2.1 LB培養基葡萄糖20 g/L,蛋白胨20 g/L,酵母膏10 g/L。
1.2.2畢赤酵母培養基畢赤酵母培養用的培養基(YPD、MD、BMGY和BMMY)配方參照Invitrogen公司操作手冊。
1.2.3分批發酵BSM培養基85%磷酸26.7 mL/L,CaSO4·H2O 0.93 g/L,K2SO418.2 g/L,MgSO4·7H2O 14.9 g/L,KOH 4.13 g/L,甘油40.0 g/L,PTM1 4.35 mL/L(PTM1配方參照Invitrogen公司操作手冊)。
1.2.4補料培養基50%甘油(含12 mL/L PTM1)。

表1 本研究中所使用的菌株和質粒Table 1 Strains and plasmids used in this study
1.2.5誘導培養基100%甲醇(含12 mL/L PTM1)。
1.3培養方法
1.3.1搖瓶發酵大腸桿菌采用LB培養基培養。畢赤酵母采用YPD、BMGY和BMMY等培養。其中畢赤酵母誘導培養,在BMGY中培養至OD值為1.2~1.5時,將酵母細胞轉入BMMY培養基中誘導,每12小時加入總體積1%的甲醇進行持續誘導。
1.3.2 3 L發酵罐高密度發酵將YPD中菌液按10%接種體積分數接入3 L全自動發酵罐(LiFlus GM BioTRON,Korea)中。以50%氨水和磷酸溶液控制pH 5.5,溫度30℃,調節攪拌轉速(500~1 000 r/min)和通氣量(2~5 L/min)維持溶氧30%以上。當甘油耗盡(DO迅速上升,且DO>60%時)開始流加補料培養基。當菌體達到一定質量濃度后(60、80、100 g/L),停止補料。待甘油再次耗盡,繼續保持基質匱乏狀態1 h,DO>60%后,開始流加誘導培養基,并把誘導溫度降低至22℃或者28℃誘導表達外源蛋白質。甲醇濃度控制在2%,使用FC2002華東理工大學在線甲醇在線檢測與控制器控制。
1.4方法
1.4.1基因PCR擴增葡萄糖氧化酶GOD基因通過GeneBank登錄號ACB30370.1設計引物:GODF:TCCTACGTAAATGGCATTGAAGCCAGCCT;GODR:TTGCGGCCGCTCACTGCATGGAA GCATAATCT TC(下劃線處堿基為酶切位點)。以黑曲霉A. niger BBE11721的cDNA為模版。PCR擴增條件:95℃預變性5 min;98℃變性10 s,57℃退火30 s,72℃延伸2 min(30個循環);72℃延伸10 min。
HAC1基因以GeneBank公布的基因編號8196642設計引物:HAC1 -F:GGGTTCGAAAT GCCCGTAGATTCTTCTC;HAC1-R:TTGCGGCCGCC TATTCCTGGAAGAATACAAAGTC(下劃線處堿基為酶切位點)。以畢赤酵母P. pastoris GS115的cDNA為模版。PCR擴增條件:95℃預變性5 min;98℃變性10 s,55℃退火30 s,72℃延伸1 min(30個循環);72℃延伸10 min。PCR擴增產物純化參照試劑盒說明書。
1.4.2重組質粒構建將上述PCR片斷純化后連接到pMD19-T克隆載體上,轉化E. coli DH5α,提取質粒,將篩選得到的陽性克隆子進行測序鑒定。葡萄糖氧化酶GOD克隆載體采用SnaBI和NotI進行雙酶切,其產物純化后與表達載體pPIC9k相連接,篩選陽性克隆驗證,獲得重組質粒pPIC9k/ GOD。HAC1基因克隆載體采用AsuII和NotI進行雙酶切,其產物純化后與表達載體pGAPZ相連接,篩選陽性克隆驗證,獲得重組質粒pGAPZ/HAC1。
1.4.3酵母轉化和重組子篩選將構建的表達載體pPIC9k/GOD使用BglII進行酶切線性化,pGAPZ/HAC1使用SacI進行酶切線性化。pPIC9k/ GOD線性化質粒電轉入畢赤酵母GS115感受態細胞,使用電轉儀(Gene Pulser electroporator,Bio-Rad),電轉條件:2000 V,200 Ω,25 μF。使用RT-qPCR方法測定挑選出的陽性克隆中的GOD拷貝數,獲得PP-GOD重組菌株。將pGAPZ/HAC1線性化質粒電轉入畢赤酵母PP-GOD感受態細胞,使用RT-qPCR方法測定挑選出的陽性克隆中的HAC1基因拷貝數,獲得PP-G-HAC1重組菌株。
1.4.4 TRIzol法提取RNA離心收集菌體并置于液氮終止反應,RNA的抽提使用RNA抽提試劑盒(Trizol regent),參照試劑盒說明書進行。
1.4.5 RT -qPCR將獲得的RNA使用cDNA Synthesis kit(Takara)進行反轉錄,然后將反轉錄cDNA作為模版。熒光定量PCR所用試劑盒為SYBR○R
Premix Ex TaqTMkit(Takara),反應儀器為LightCycler 480 II Real-time PCR instrument(Roche Applied Science,Mannheim,Germany)。反應條件為95℃30 s,40個循環。95℃5 s,60℃20 s最后50 ℃30 s冷卻。基因轉錄變化計算方法為2-△△CT,內參基因為GAPDH。選取3個生物學平行樣,取平均值,所用定量PCR引物見表2。

表2 本研究中所使用定量引物Table 2 Oligonucleotides used in this study
1.4.6葡萄糖氧化酶活性測定測定方法參照文獻[6]。活力定義單位:每分鐘轉化1 μmol葡萄糖為葡萄糖酸和過氧化氫所需的酶量為一個單位,以U/mL表示。
1.4.7 AOX氧化酶活性測定測定方法參照文獻[20]。活力定義單位:相同菌濃下,每分鐘產生1 μmol過氧化氫所需的酶量為一個單位,以U/gDCW表示。
2 結果與討論
2.1葡萄糖氧化酶重組菌株及HAC1共表達重組菌株的構建
分別以A. niger BBE11721為模版,配合以GOD-F/GOD-R為引物;以畢赤酵母P. pastoris GS115的cDNA為模版,配合以HAC1-F/HAC1-R和為引物,按照方法1.4.1進行基因克隆,分別PCR擴增得到1 800左右和1 000左右的特異性條帶,見圖1。測序結果表明,PCR擴增所得GOD基因全長1 749 bp,編碼583個氨基酸;PCR擴增所得HAC1基因全長996 bp,編碼332個氨基酸,兩段基因大小和序列均與預期相符。
為在畢赤酵母表達體系中順利將GOD表達并分泌至胞外,采用畢赤酵母表達載體上的信號肽αfactor以實現在畢赤酵母表達體系中的分泌。并使用帶有AOX1強啟動子的pPIC9k表達載體,按照方法1.4.2構建得到pPIC9k/GOD重組載體。同時,為在畢赤酵母表達體系中胞內表達調控子Hac1p,作者采用了帶有GAP啟動子的表達載體pGAPZα,并通過使用AsuII和NotI雙酶切方式去除了質粒上的信號肽α-factor,按照方法1.4.2構建得到了pGAPZ/HAC1重組載體。此后,將pPIC9k/GOD線性化質粒電轉入畢赤酵母GS115感受態細胞,獲得PP-GOD重組菌株。將pGAPZ/HAC1線性化質粒電轉入畢赤酵母PP-GOD感受態細胞,獲得PP-GHAC1重組菌株。重組菌中的葡萄糖氧化酶基因GOD和HAC1基因拷貝數使用RT-qPCR的方法測定,參照文獻[21]。本研究中所使用菌株中基因拷貝數見表3。因為AOX1與GAP基因同時存在于轉化的質粒和畢赤酵母的基因組中,因此表中所示拷貝數為測得拷貝數減去基因組中已存在的一個拷貝數。
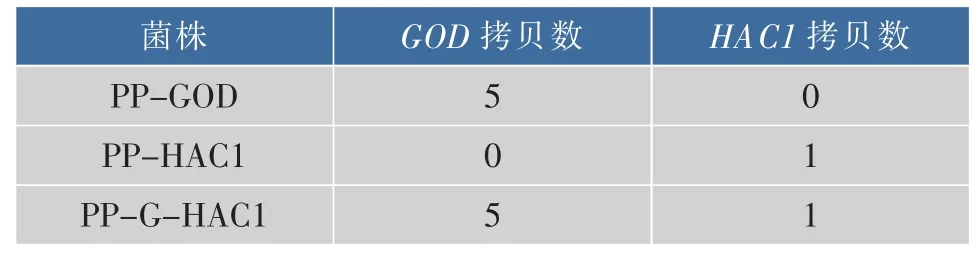
菌株 GOD拷貝數 HAC1拷貝數PP-GOD 5 0 PP-HAC1 0 1 PP-G-HAC1 5 1
2.2共表達HAC1基因對葡萄糖氧化酶GOD表達的影響
在畢赤酵母中過量表達外源蛋白質會帶給分泌途徑負擔,大量的未折疊肽鏈或錯誤折疊蛋白質是影響外源分泌表達的主要原因[22]。在本研究中,作為UPR效應的激活因子Hac1p的編碼基因HAC1,通過過量共表達HAC1基因考察了該基因對葡萄糖氧化酶GOD在P. pastoris中表達的影響。如圖2所示,改造重組菌株PP-G-HAC1在搖瓶中能夠分泌更多的胞外GOD,培養120 h后胞外GOD活性達到161 U/mL,相比于原始菌株PP-GOD提高了37%。同時通過過量共表達HAC1基因,使得GOD的單位生產率從PP-GOD菌株的0.42 mg/(g·h)提高到PP-G-HAC1菌株的0.52 mg/(g·h)。如表4所示,改造重組菌PP-G-HAC1在胞外GOD蛋白質質量濃度和GOD酶得率(重組酶量/細胞干質量DCW)均有所提高,分別從原始菌株的1 059 mg/L 與60.2 mg/g提高到1 439 mg/L與74.2 mg/g。結果表明,共表達調控因子編碼HAC1基因能夠有效的改善GOD在畢赤酵母中的分泌表達。
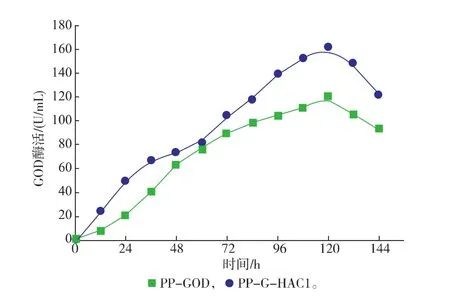
圖2 搖瓶中過量表達HAC1對發酵生產葡萄糖氧化酶的發酵過程曲線Fig. 2 Effects of Co-Expression of HAC1 on the GOD secretion in P. pastoris in shake flasks
2.3 3 L發酵罐中不同培養溫度下共表達HAC1基因對發酵產GOD的影響
外源蛋白質表達分泌的過程中,環境因素對宿主的生理和蛋白質的生產率有重要影響。在畢赤酵母表達體系中,溫度被認為直接影響蛋白質生產能力和宿主代謝功能。不同的培養溫度能夠改變蛋白質的合成、折疊和分泌速率,同時對宿主內部蛋白質分泌途徑中造成脅迫應激反應也有重要的影響。溫度對蛋白質分泌的影響是基于宿主生長情況,蛋白質合成和蛋白質在胞內積聚造成的脅迫壓力等各因素的綜合體現[23]。畢赤酵母的最適生長溫度為28~30℃,而研究表明,降低培養溫度有利于提高部分外源蛋白質的分泌[24]。雖然溫度的降低使得畢赤酵母細胞的生長代謝速率降低,但能夠減少由于蛋白質過量合成分泌過程引起的細胞衰亡,見表4。作者采用3 L發酵罐進行培養,進一步對不同改造菌株在不同培養溫度下的發酵情況進行研究。目的在于研究共表達HAC1基因在不同溫度下對外源分泌蛋白質的影響,以及在改進培養溫度的發酵條件下進一步提高葡萄糖氧化酶GOD的酶活。
2.3.1重組菌PP-GOD在3 L發酵罐中不同培養溫度下對發酵產GOD的影響考察了3 L發酵罐中不同培養溫度(22℃和28℃)、不同重組菌發酵產GOD的影響。如圖3所示,重組菌PP-GOD在22℃時DCW最高達到179 g/L,然而在28℃DCW最高僅能達到134 g/L。同時,重組菌PP-GOD在22℃最高GOD活性達到427.6 U/mL,相較于28℃培養條件GOD活性323 U/mL提高了25%。這些結果表明,甲醇誘導期的低溫誘導能夠有效提高重組菌PP-GOD的GOD產量。
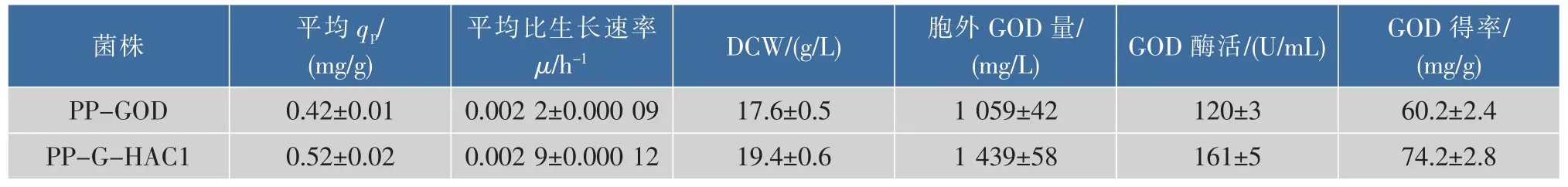
表4 搖瓶中過量表達HAC1對工程菌發酵參數的影響Table 4 Effects of co-expression of HAC1 on heterologous protein production of GOD in shake flasks
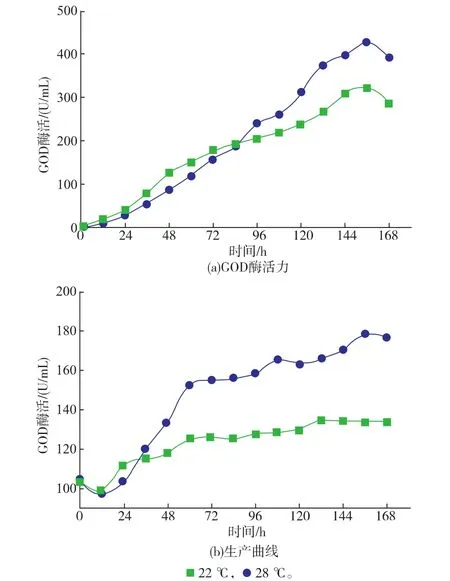
圖3 3 L發酵罐中不同培養溫度下重組菌PP-GOD產GOD的發酵曲線Fig. 3 Fermentation properties of the GOD over -expressing strain PP-GOD in 3 L fermentor
2.3.2重組菌PP-G-HAC1在3 L發酵罐中不同培養溫度下對發酵產GOD的影響考察3 L發酵罐中改造重組菌PP-G-HAC1菌株在過量共表達HAC1基因發酵產GOD的影響,在22℃培養條件下,產GOD的能力并沒有因為降低溫度而有所提高。如圖4所示,經過156 h的誘導,改造重組菌PP-G-HAC1在28℃時胞外GOD酶活能夠達到1 008 U/mL,同時比酶活70 kU/g,菌體干重DCW最高達到300 g/L。而在3 L發酵罐中,22℃下GOD酶活最高達到699 U/mL,胞外GOD酶量12.02 g/L,比28℃培養條件下有所降低。

圖4 3 L發酵罐中不同溫度下重組菌PP-G-HAC1產GOD的發酵曲線Fig. 4 Effect of different cultivation temperatures on GOD secretion in engineered secretion strain PPG-HAC1 in 3 L fermentor
進一步考察了3 L發酵罐中不同培養溫度對不同重組菌PP-GOD與PP-G-HAC1發酵產GOD的影響。綜合各情況下發酵參數的比較,如表5所示,重組菌PP-G-HAC1在28℃下對產GOD更有利,比酶活69 854 U/g,GOD生產率6.46 U/(mL·h),胞外GOD酶量14.43 g/L,均相較于22℃培養條件下有明顯的提高(比酶活58 153 U/g,GOD生產率4.48 U/(mL·h),胞外GOD酶量12.02 g/L)。如圖5所示,PP-G-HAC1菌株在不同溫度下,誘導156 h胞外蛋白SDS-PAGE圖,顯示28℃條件下的GOD條帶要較22℃更為明顯。
同時,從表5中發酵參數發現,重組菌PP-GOD在28℃下的發酵參數要明顯低于重組菌PP-GHAC1的發酵參數。通過對AOX醇氧化酶活性的檢測,發現在相同條件下不同的改造菌株中差異較大。P. pastoris對外源蛋白質的表達受到AOX1啟動子調控,AOX醇氧化酶是甲醇代謝途徑中第一個關鍵酶,受甲醇的誘導啟動[25]。如圖6所示,PP-GHAC1菌株中的AOX活性曲線高于PP-GOD菌株,并且最大AOX活性達到8.8 U/g,相較于PP-GOD菌株中的5.1 U/g有明顯提高。
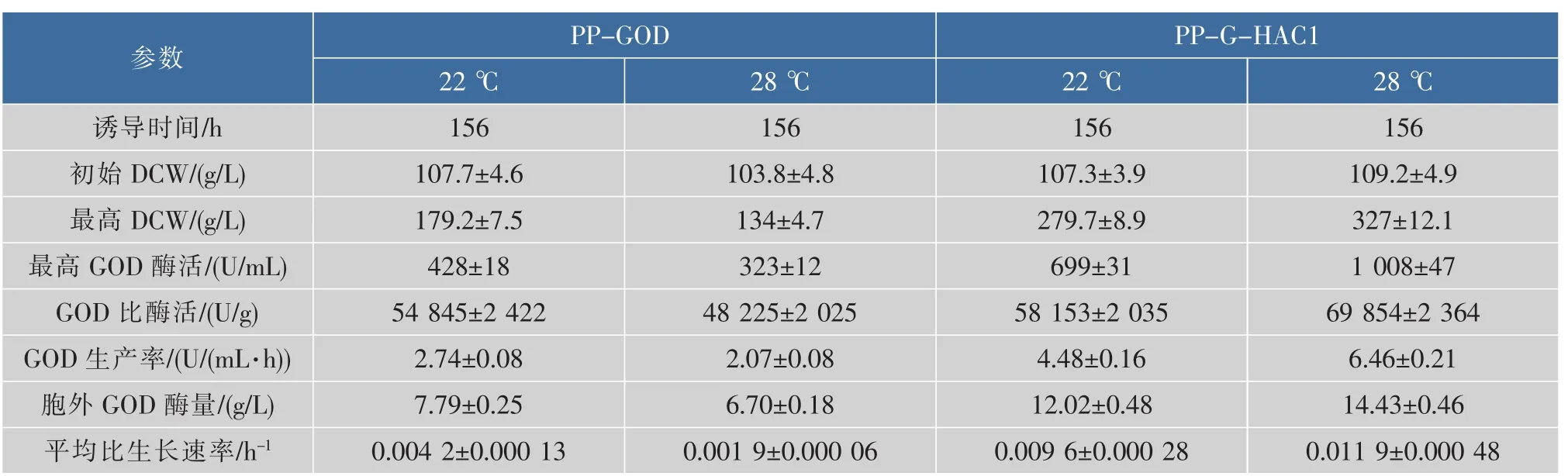
表5 不同重組菌在不同培養溫度下發酵產GOD的參數Table 5 Comparison of parameters for GOD production under different cultivation temperatures
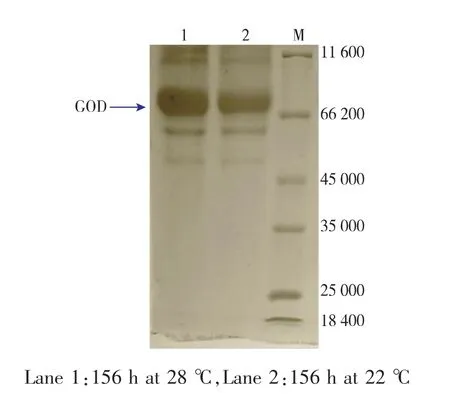
圖5 不同培養溫度下PP-G-HAC1菌株156 h時胞外蛋白SDS-PAGE圖Fig. 5 SDS -PAGE of fermentation supernatant of the engineered secretion strain PP-G-HAC1 in 3 L fermentor at different temperatures.
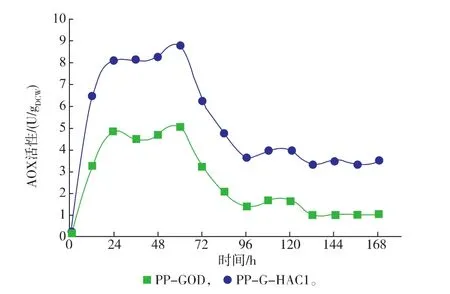
圖6 3 L發酵罐中28℃下重組菌PP-G-HAC1與PPGOD產GOD的AOX活性曲線Fig. 6 Effects of co-expression of HAC1 on AOX activity in 3 L fermentor at 28℃
通過在不同溫度下不同重組菌株發酵GOD影響的研究,發現在原始菌株PP-GOD中,降低誘導期培養溫度至22℃能夠有效地提高GOD的產量,菌體生長較28℃時有明顯提高,說明較高的培養溫度使得蛋白質過量合成分泌過程引起的脅迫反應影響了細胞的生長,導致GOD產量的降低。而在共表達HAC1基因的菌株PP-G-HAC1中,28℃培養條件較22℃培養條件下GOD的產量有進一步的提高,兩種菌株在22、28℃下的產外源蛋白質差異,說明了共表達HAC1基因能夠有效減緩蛋白質過量表達情況下胞內的脅迫壓力,增強宿主細胞的生長情況,在畢赤酵母最適生長溫度28℃下進一步提高GOD的產量。
2.4 28℃培養溫度下UPR下游靶基因基因轉錄水平變化
HAC1基因編碼的Hac1p作為UPR途徑的激活調節因子,能夠調控UPR途徑中的許多功能基因。畢赤酵母內的UPR典型下游靶基因包含了折疊基因(ERO1,KAR2),轉運基因(SEC18,SEC53,SSA4,VPS17),ERAD基因(HRD1,UBC1)和脅迫調控基因(GCN4,MSN2)等典型編碼基因。為了進一步考察這些編碼基因在28℃培養條件下不同菌株中的轉錄水平變化,作者采用RT-qPCR技術對這些基因的表達量進行了進一步分析,結果見圖7。
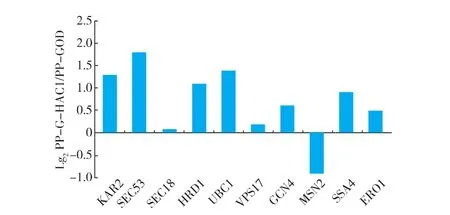
圖7 28℃培養溫度下UPR下游靶基因基因轉錄水平變化Fig. 7 Comparison of marker genes transcriptional levels
PP-G-HAC1菌株相較于PP-GOD菌株明顯上調的基因包括:內質網折疊基因KAR2,上調1.3倍;參與內質網蛋白修飾與糖基化與轉運基因SEC53,上調1.7倍;參與內質網蛋白降解基因HRD1,上調1.1倍;調節選擇性降解非正確折疊蛋白基因UBC1,上調1.4倍。這些直接參與分泌途徑的基因的上調有效地說明了PP-G-HAC1菌株在過量共表達HAC1基因的情況下胞內轉運分泌外源蛋白GOD的能力更強。然而脅迫調控基因MSN2有所下調,同樣屬于脅迫調控基因GCN4基因卻較PP-GOD菌種有所上調。GCN4基因編碼的調控因子能夠調控一些與氨基酸合成相關基因的表達。GCN4編碼蛋白由內質網上脅迫環境激活,被認為是由HAC1基因調控的UPR應答機制中關鍵下游調控蛋白。GCN4的同源基因作為內質網脅迫與氧化脅迫的調控橋梁,能夠調節還原型谷胱甘肽的生物合成,用來改善細胞由于內質網和內質網降解蛋白機制中造成的氧化蛋白折疊積累的活性氧形成的活性降低現象[26]。PP-G-HAC1菌株中GCN4基因的上調說明了胞內由于外源蛋白GOD大量分泌表達的情況下,為抵御活性氧(ROS)的形成進行了更有效的抵御。
在前期的實驗中,發現PP-GOD菌株28℃培養的GOD產量較22℃下有明顯的降低,造成這一現象的原因是胞內脅迫壓力引起宿主細胞生長能力和蛋白質合成速率的下降。脅迫壓力由內質網中未折疊和錯誤折疊蛋白質的大量積累造成,一旦發生這種情況會造成3種常見的結果[27]:1)新生肽鏈向內質網的轉運減少;2)內質網折疊能力的加強;3)當前兩者不能解決脅迫壓力,就會造成宿主功能性失常,宿主菌體就會死亡。宿主細胞對應過量表達蛋白質的脅迫情況下,自身的UPR途徑會被激活,作為一種防御機制來抵御胞內的非正常脅迫環境。通過對UPR途徑下游典型編碼基因的轉錄水平考察,發現在PP-G-HAC1中過量共表達HAC1基因能夠顯著增強UPR信號途徑的操縱能力。在相同培養條件下,同原始菌株PP-GOD相比,內質網中處理新生肽鏈折疊的編碼基因明顯上調,并且內質網降解途徑ERAD等功能基因也顯著上調,這些功能基因轉錄水平的增強減輕了內質網脅迫壓力。同時調節胞內ROS水平的氧化脅迫調控基因GCN4的轉錄水平也明顯上調。這說明了在28℃培養溫度條件下共表達HAC1基因,能夠有效地提高宿主細胞的蛋白質折疊和分泌能力,同時增強胞內脅迫壓力的抵御能力,從而提高外源GOD的產量。
3 結語
作者分析了畢赤酵母共表達中UPR中關鍵基因HAC1對于GS115菌株發酵產葡萄糖氧化酶GOD的影響,改造菌株PP-G-HAC1在3 L發酵罐中28℃培養,酶活達到1 008 U/mL,胞外重組蛋白質達到14.43 g/L,相比原始菌株在相同條件下提高了3.12倍。為了進一步提高葡萄糖氧化酶在畢赤酵母中的發酵生產,解析畢赤酵母系統中合成分泌外源蛋白質通路的代謝網絡,以及通過代謝工程改造增強原生肽鏈修飾折疊,降低未折疊蛋白質對內質網的脅迫,減少細胞負擔的同時增強外源蛋白質分泌,將成為我們日后繼續深入研究的重點。
參考文獻:
[ 1 ] Bankar S B,Bule M V,Singhal R S,et al. Glucose oxidase-an overview[J]. Biotechnol Adv,2009,27:489-501.
[ 2 ] Kim S H,Lee S M,Kim D U,et al. Enzyme-based glucose biosensor using a dye couple system [J]. Dyes Pigments,2001,49:103-108.
[ 3 ] Klein J,Rosenberg M,Marko? J,et al. Biotransformation of glucose to gluconic acid by Aspergillus niger-study of mass transfer in an airlift bioreactor[J]. Biochem Eng J,2002,10:197-205.
[ 4 ] Petruccioli M,Federici F,Bucke C,et al. Enhancement of glucose oxidase production by Penicillium variabile P16 [J]. Enzyme Microb Tech,1999,24:397-401.
[ 5 ] Fiedurek J,Gromada A. Production of catalase and glucose oxidase by Aspergillus niger using unconventional oxygenation of culture[J]. J Appl Microbiol,2000,89:85-89.
[ 6 ] Bankar S B,Bule M V,Singhal R S,et al. Optimization of Aspergillus niger fermentation for the production of glucose oxidase[J]. Food Bioprocess Technol,2009,2:344-352.
[ 7 ] Malherbe D,Du Toit M,Otero RC,et al. Expression of the Aspergillus niger glucose oxidase gene in Saccharomyces cerevisiae and its potential applications in wine production[J]. Appl Microbiol Biotechnol,2003,61:502-511.
[ 8 ] Rocha SN,Abrah?o-Neto J,Cerdán ME,et al. Heterologous expression of glucose oxidase in the yeast Kluyveromyces marxianus [J]. Microb Cell Fact,2010,9:4-12.
[ 9 ] Yamaguchi M,Tahara Y,Nakano A,et al. Secretory and continuous expression of Aspergillus niger glucose oxidase gene in Pichia pastoris[J]. Protein Expr Purif,2007,55:273-278.
[10] Crognale S,Pulci V,Brozzoli V,et al. Expression of Penicillium variabile P16 glucose oxidase gene in Pichia pastoris and characterization of the recombinant enzyme[J]. Enzyme Microb Tech,2006,39:1230-1235.
[11] Guo Y,Lu F,Zhao H,et al. Cloning and heterologous expression of glucose oxidase gene from Aspergillus niger Z-25 in Pichia pastoris[J]. Appl Biochem Biotech,2010,162:498-509.
[12] Frederick K,Tung J,Emerick R,et al. Glucose oxidase from Aspergillus niger. Cloning,gene sequence,secretion from Saccharomyces cerevisiae and kinetic analysis of a yeast-derived enzyme[J]. J Biol Chem,1990,265:3793-802.
[13] Sitia R,Braakman I. Quality control in the endoplasmic reticulum protein factory[J]. Nature,2003,426:891-894.
[14] Damasceno LM,Huang C-J,Batt CA. Protein secretion in Pichia pastoris and advances in protein production[J]. Appl Microbiol Biotechnol,2012,93:31-39.
[15] Hohenblum H,Gasser B,Maurer M,et al. Effects of gene dosage,promoters,and substrates on unfolded protein stress of recombinant Pichia pastoris[J]. Biotechnol Bioeng,2004,85:367-375.
[16] Li Z,Moy A,Gomez SR,et al. An improved method for enhanced production and biological activity of human secretory leukocyte protease inhibitor(SLPI)in Pichia pastoris[J]. Biochem Bioph Res Co,2010,402:519- 524.
[17] Shen Q,Wu M,Wang H-B,et al. The effect of gene copy number and co-expression of chaperone on production of albumin fusion proteins in Pichia pastoris[J]. Appl Microbiol Biotechnol,2012,96:763-772.
[18] Valkonen M,Penttil? M,Saloheimo M. Effects of inactivation and constitutive expression of the unfolded-protein response pathway on protein production in the yeast Saccharomyces cerevisiae[J]. Appl Environ Microbiol,2003,69:2065-2072.
[19] Guerfal M,Ryckaert S,Jacobs PP,et al. The HAC1 gene from Pichia pastoris:characterization and effect of its overexpression on the production of secreted,surface displayed and membrane proteins[J]. Microb Cell Fact,2010,9:49-12.
[20] Suye SI,Ogawa A,Yokoyama S,et al. Screening and identification of Candida methanosorbosa as alcohol oxidase producing methanol using yeast[J]. Agric Biol Chem,1990,54:1297-1298.
[21] Sha C,Yu X-W,Li F,et al. Impact of gene dosage on the production of lipase from Rhizopus chinensis CCTCC M201021 in Pichia pastoris[J]. Appl Biochem Biotech,2013,169:1160-1172.
[22] Hohenblum H,Gasser B,Maurer M,et al. Effects of gene dosage,promoters,and substrates on unfolded protein stress of recombinant Pichia pastoris[J]. Biotechnol Bioeng,2004,85:367-375.
[23] Gasser B,Maurer M,Rautio J,et al. Monitoring of transcriptional regulation in Pichia pastoris under protein production conditions[J]. BMC Genomics,2007,8:179.
[24] Wang Y,Wang Z H,Xu Q L,et al. Lowering induction temperature for enhanced production of polygalacturonate lyase inrecombinant Pichia pastoris[J]. Process Biochem,2009,44:949-954.
[25] Jungo C,Rerat C,Marison IM,et al. Quantitative characterization of the regulation of the synthesis of alcohol oxidase and of the expression of recombinant avidin in a Pichia pastoris Mut+strain[J]. Enzyme Microb Technol,2006,39:936-944.
[26] Harding H P,Zhang Y,Zeng,et al. An integrated stress response regulates amino acid metabolism and resistance to oxidative stress[J]. Mol Cell,2003,11:619-633.
[27] Ron D,Walter P. Signal integration in the endoplasmic reticulum unfolded protein response[J]. Nat Rev Mol Cell Bio,2007,8:519-529.
Effects of Co-Expression of HAC1 on Glucose Oxidase Production in Recombinant Pichia pastoris
GU Lei1,3,ZHANG Juan1,3,DU Guocheng1,3,CHEN Jian*2,3
(1. School of Biotechnology,Jiangnan University,Wuxi 214122,China;2. National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122,China;3. Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
Abstract:In this work,the enhancement of unfolded protein response transcription pathway at different cultivation temperatures were integrated as a novel protein secretion strategy to improve extracellular enzyme concentration and specific productivity of heterologous glucose oxidase(GOD)in Pichia pastoris. Efficient production of heterologous proteins in P. pastoris was often limited by metabolic and intrinsic stresses such as folding rate and ER stress by accumulation of unfolded protein. The results showed that enzymatic activity of engineered secretion strain PP-G-HAC1,co-expression of UPR activating transcription factor Hac1p from P. pastoris,was up 161 U/mL in shake flasks,34% higher compared to control strain. Furthermore,the effects of different cultivation
E-mail:jchen@jiangnan.edu.cntemperatures(22、28℃)were also investigated. The highest GOD activity and extracellular concentration at 28℃in PP-G-HAC1 were 1,008 U/mL and 14.43 g/L,respectively,3.12-fold increase than that of control strain.
Keywords:Pichia pastoris,glucose oxidase,unfolded protein response,HAC1
*通信作者:陳堅(1962—),男,江蘇無錫人,工學博士,教授,博士研究生導師,主要從事發酵工程和食品生物技術方面的研究。
基金項目:國家自然科學基金重大項目(31470160);國家863計劃項目(2011AA100905);國家973計劃項目(2013CB733902);博士后科學基金項目(114957,2013M540538);江蘇省自然科學基金項目(BK2012553)。
收稿日期:2014-08-29
中圖分類號:Q 555
文獻標志碼:A
文章編號:1673—1689(2016)02—0113—10

