NO對采后小白菜品質的影響
黃凱美,顏韶兵,劉霽虹,羅自生,鄒宜靜,岳 陽,褚萍麗,李楚羚
(1.杭州市種子總站,浙江杭州 310029; 2.浙江大學生物系統工程與食品科學學院,浙江杭州 310058)
?
NO對采后小白菜品質的影響
黃凱美1,顏韶兵1,劉霽虹1,羅自生2,鄒宜靜1,岳 陽2,褚萍麗2,李楚羚1
(1.杭州市種子總站,浙江杭州 310029; 2.浙江大學生物系統工程與食品科學學院,浙江杭州 310058)
摘 要:為探索小白菜保鮮方法,研究了2℃貯藏條件下,NO處理對小白菜品質的影響。結果表明,NO處理不僅可以有效延緩小白菜低溫貯藏期間可溶性固形物和VC含量下降,還可抑制葉綠素酶活性,從而抑制葉綠素的降解,貯藏20 d時葉綠素含量為對照的1.3倍,保持小白菜的色澤。NO處理還可以延緩小白菜SOD活性的下降,促進CAT活性的增強,抑制小白菜丙二醛含量和相對電導率的增加,處理20 d時,丙二醛含量和相對電導率分別為對照的84%和81%,延緩了小白菜的衰老。
關鍵詞:小白菜; NO;葉綠素; SOD
文獻著錄格式:黃凱美,顏韶兵,劉霽虹,等.NO對采后小白菜品質的影響[J].浙江農業科學,2016,57 (4):523-525,541.
小白菜(Brassica campestris L.)為十字花科蕓薹屬草本植物,又稱青菜,原產于中國,在中國南北方廣泛種植。其營養豐富,富含維生素、礦物質等營養物質,深受消費者喜愛。小白菜為幼嫩葉菜,表面積大、含水量高、組織脆嫩,采后呼吸作用強,水分蒸發快,極易受機械損傷。在貯運和銷售過程中常發生黃化、脫幫和腐爛,導致品質下降。小白菜貨架期短,常溫下僅3 d左右,因此小白菜保鮮是一大難題。
一氧化氮(NO)是一種小分子氣體,作為一種關鍵的生物信號分子,最先在哺乳動物中報道,隨著研究的深入,NO在高等植物體中的信號分子作用逐步受到重視。NO參與了植物生長發育中的一系列生理過程,包括種子萌發、根系生長、開花、花粉管生長調節、果實成熟衰老以及生物和非生物脅迫響應等[1]。近年來,NO在果蔬采后生理過程中的作用受到越來越多的關注[2-3]。目前,有關NO對小白菜的研究還未見報道。本文研究了低溫條件下NO對小白菜品質的影響,以期為小白菜保鮮提供參考。
1 材料與方法
1.1材料
供試小白菜采自浙江省杭州市余杭區,采后立即運回實驗室,去除老葉、黃葉后選擇無病蟲和機械傷害的小白菜為供試材料。
1.2處理設計
首先進行預試驗,分別用0.01,0.05,0.10,0.15和0.20 mmol·L-1硝普納(NO供體)溶液處理小白菜,確定0.10 mmol·L-1為硝普納溶液的適宜處理濃度。然后將小白菜隨機分為2組,在0.10 mmol·L-1硝普納溶液浸泡10 min,并用蒸餾水作對照(CK)。處理后冷風吹干放入恒溫箱中,貯藏溫度為2℃,貯藏20 d。每5 d取樣1次,從每組處理中隨機取9株小白菜,測定各項指標,試驗重復3次。
1.3測定項目與方法
采用稱重法測定失重率,失重率/% = (貯前重量-貯后重量)/貯前重量×100。色澤采用全自動色差計測定( CR-400,CONICA MINOTA,Japan),采用L*C*H*模式,葉片色澤用色度角H*(hue angle)表示。可溶性固形物采用手持折光儀測定。VC含量測定采用2,6-二氯靛酚法[4]。葉綠素含量測定按照潘增光等[5]的方法。葉綠素酶活性測定參照Mosquera 等[6]的方法。丙二醛(Malondialdehyde,MDA)含量和相對電導率參照朱廣廉[7]的方法測定。超氧化物岐化酶( Superoxide dismutase,SOD)和過氧化氫酶(Catalase,CAT)活性參照何宇炯等[8]方法測定。
2 結果與分析
2.1NO對小白菜失重率和色澤的影響
從圖1中A可知,低溫貯藏期間,隨著貯藏時間的延長小白菜失重率隨呈上升趨勢,其中對照失重最明顯,20 d時高達8.67%,而NO處理可明顯抑制小白菜貯藏期間的失水,20 d時僅為5.32%,二者間差異達顯著水平(P<0.05)。色澤是反應葉菜品質好壞和成熟度的重要指標。從圖1中B可知,采后小白菜H值呈下降趨勢,20 d時對照組H值下降了25.3%,處理組H值為對照的1.2倍,二者間差異達顯著水平(P<0.05),表明NO處理可以抑制小白菜H值的下降。

圖1 NO對小白菜失重率和色澤的影響
2.2NO對小白菜可溶性固形物和VC含量的影響
從圖2中A可知,小白菜貯藏過程中,可溶性固形物含量緩慢下降。20 d時對照組可溶性固形物含量為0 d的86%,處理組可溶性固形物含量為對照的1.1倍,二者間差異達顯著水平(P<0.05),表明NO處理可抑制小白菜可溶性固形物的下降。VC是果蔬品質的主要指標,VC含量與果蔬的抗氧化特性密切相關[9]。小白菜貯藏過程中VC含量逐漸下降(圖2中B),其中對照下降最明顯,20 d時下降了38.9%,而NO處理可明顯抑制小白菜貯藏期間VC含量的下降,20 d時為對照的1.3倍,二者間差異達顯著水平(P<0.05)。
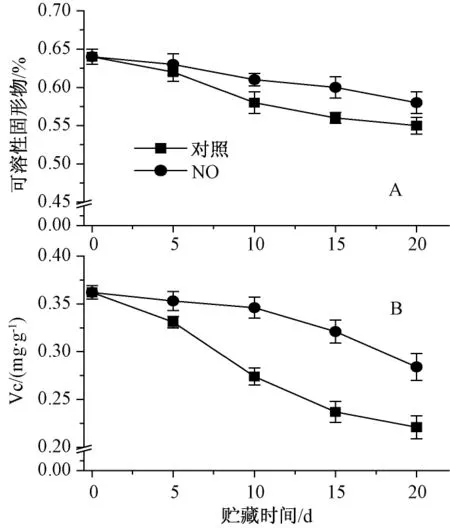
圖2 NO對小白菜可溶性固形物和VC含量的影響
2.3NO對小白菜葉綠素含量和葉綠素酶活性的影響
果蔬的色澤與色素含量密切相關,葉綠素含量是使果蔬呈現綠色的重要組成部分[10]。從圖3中A可知,小白菜葉綠素含量隨貯藏時間的增加而下降,20 d時對照組葉綠素含量下降了35%,而NO處理可抑制葉綠素的降解,20 d時葉綠素含量為對照的1.3倍,二者間差異達顯著水平(P<0.05)。葉綠素酶被認為是參與降解葉綠素的酶,它促使葉綠素脫去植醇形成脫植基葉綠酸,因此葉綠素酶在植物葉綠素降解過程中發揮重要作用[11]。從圖3中B可知,采后小白菜貯藏過程中綠素酶活性逐漸下降,而NO處理促進了葉綠素酶活性的下降,20 d時的葉綠素酶活性僅為對照的73%,二者間差異達顯著水平(P<0.05)。NO處理20℃貯藏的西蘭花,延緩了其黃化和葉綠素降解的發生[12]。而在由黑暗誘發葉片衰老的擬南芥中,NO作為葉綠素代謝途徑的一種負調節因子,在維持葉片衰老期間類囊體膜穩定性方面發揮了積極作用[13]。表明NO在調控葉綠素代謝方面發揮著重要作用。
2.4NO對小白菜相對電導率和MDA含量的影響
隨著植物的衰老,細胞膜透性逐漸增大,膜內可溶性物質和電解質向膜外滲漏,導致組織的相對電導率增加,因此相對電導率是評價植物組織衰老的重要指標[14]。從圖4中A可知,采后小白菜相對電導率持續上升,20 d時對照組相對電導率是0 d的1.8倍; NO抑制了小白菜組織相對電導率的上升,20 d時相對電導率為對照的81%,二者間差異達顯著水平(P<0.05)。MDA是膜脂過氧化的產物,是衡量細胞膜損傷程度的常用指標。從圖4中B可知,小白菜貯藏過程中的MDA含量逐漸增加,20 d時對照組的相對電導率為0 d的2.3 倍; NO抑制了小白菜MDA含量的增加,20 d時為對照的84%,二者間差異達顯著水平(P<0.05)。

圖3 NO對小白菜葉綠素含量和葉綠素酶活性的影響

圖4 NO對小白菜電導率和MDA含量的影響
2.5NO對小白菜SOD和CAT活性的影響
自由基衰老學說認為,組織中產生的活性氧不能及時清除是造成衰老的主要原因,而活性氧清除能力的大小主要決定于保護酶活性的高低,所以保護酶的活性一定程度上可以反映植物的衰老程度,一旦這些清除活性氧的防御系統平衡受到破壞,組織內的活性氧濃度就會升高,從而加劇脂質過氧化程度,使膜結構及其功能受到破壞[15]。SOD和CAT是果實抗氧化系統中的主要抗氧化酶,在清除H2O2和O-2等自由基、延緩植物衰老方面發揮著重要作用[8]。從圖5中A可知,采后小白菜低溫貯藏期間SOD活性逐漸下降,NO抑制了小白菜組織SOD活性的下降,20 d時處理組SOD活性為對照的1.8倍,二者間差異達顯著水平(P<0.05)。從圖5中B可知,采后小白菜CAT活性持續上升,20 d時對照組CAT活性是0 d的2.2倍; NO處理促進了小白菜組織CAT活性的上升,20 d時活性為對照的1.3倍,二者間差異達顯著水平(P<0.05)。

圖5 NO對小白菜SOD和CAT活性的影響
3 小結
本研究表明,NO處理能減少小白菜的質量損失,有效延緩小白菜低溫貯藏期間可溶性固形物和VC含量下降,抑制葉綠素酶活性,延緩葉綠素的降解,保持小白菜的色澤。NO處理也延緩了小白菜SOD活性的下降,促進了CAT活性的增加,延緩了小白菜的衰老。表明NO處理對小白菜保鮮具有潛在的應用價值。
參考文獻:
[1]CORPAS F J,LETERRIER M,VALDERRAMA R,et al.Nitric oxide imbalance provokes a nitrosative response in plants under abiotic stress[J].Plant Science An International Journal of Experimental Plant Biology,2011,181 (5):604-611.
[2]劉孟臣,朱樹華,周杰.植物體內一氧化氮生理作用研究進展[J].山東農業大學學報(自然科學版),2007,38 (3):487-492.
[3]朱樹華,周杰,束懷瑞.植物中一氧化氮與園藝產品的成熟和衰老[J].植物生理學報,2004,40 (6):733-740.
[4]韓雅珊.食品化學實驗指導[M].北京:中國農業大學出版社,1996.
[5]潘增光,王國賓,束懷瑞.新紅星蘋果果實著色期幾種色素含量變化及其相關性(簡報)[J].植物生理學通訊,1996,32 (5):347-349.
[6]MINGUEZ-MOSQUERA M I,GANDUL-ROJAS B,GALLARDOGUERRERO L.Measurement of chlorophyllase activity in olive fruit (Olea europaea)[J].Journal of Biochemistry,1994,116 (2):263-268.
[7]朱廣廉.植物生理學實驗[M].北京:北京大學出版社,1990:56-57.
[8]何宇炯,徐如涓,趙毓橘.表油菜素內酯對綠豆幼葉衰老的促進作用[J].植物生理學報,1996 (1):58-62.
[9]DU G,LI M,MA F,et al.Antioxidant capacity and the relationship with polyphenol and Vitamin C in Actinidia fruits[J].Food Chemistry,2009,113 (2):557-562.
[10]楊曉棠,張昭其,龐學群.果蔬采后葉綠素降解與品質變化的關系[J].果樹學報,2005,22 (6):691-696.
[11]SABATER B,RODRIGUEZ M T.Control of chlorophyll degradation in detached leaves of barley and oat through effect of kinetin on chlorophyllase levels[J].Physiologia Plantarum,2006,43 (3):274-276.
[12]HYANGLAN E,DAEKEUN H,SEUNGKOO L.Nitric oxide reduced chlorophyll degradation in Broccoli (Brassica oleracea L.var.italica) florets during senescence[J].Food Science and Technology International,2009,15 (3):223-228.
[13]LIU F,GUO F Q.Nitric oxide deficiency accelerates chlorophyll breakdown and stability loss of thylakoid membranes during dark-induced leaf senescence in Arabidopsis[J].Plos One,2013,8 (2):e56345.
[14]MARANGONI A G,PALMA T,STANLEY D W.Membrane effects in postharvest physiology[J].Postharvest Biology and Technology,1996,7 (3):193-217.
[15]AIRAKI M,LETERRIER M,MATEOS R M,et al.Metabolism of reactive oxygen species and reactive nitrogen species in pepper ( Capsicum annuum L.) plants under low temperature stress[J].Plant Cell and Environment,2012,35 (2):281-295.
(責任編輯:侯春曉)
中圖分類號:S634.3
文獻標志碼:A
文章編號:0528-9017(2016)04-0523-03
DOI10.16178/j.issn.0528-9017.20160423
收稿日期:2016-01-12
基金項目:杭州市科學技術委員會種子種苗專項(20140932H07)
作者簡介:黃凱美(1973—),女,浙江嵊州人,高級農藝師,本科,主要從事蔬菜新品種推廣工作,E-mail:huangkm@163.com。

