近年我國藥品不良反應報告與監測總體情況分析
楊 悅
(西安交通大學第一附屬醫院藥學部,西安 710061)
?
近年我國藥品不良反應報告與監測總體情況分析
楊悅
(西安交通大學第一附屬醫院藥學部,西安710061)
摘要:目的了解我國近年來藥品不良反應報告的現狀,找出存在的問題,為加強藥品不良反應報告和監測管理提出建議。方法收集2010~2014年連續5年國家藥品不良反應監測年度報告,采用內容分析、二次分析、對比分析等方法對藥品不良反應報告情況進行了探討。結果我國藥品不良反應報告的數量逐年增加,新的和嚴重的藥品不良反應數量較少;藥品不良反應報告主體是醫療機構,藥品生產經營企業的報告比例較低,抗感染藥品的藥品不良反應仍居首位。結論加強藥品不良反應報告管理依然是業內關注的重要問題之一。建議:提高新的、嚴重的不良反應報告率;強化藥品生產、經營企業藥品不良反應報告工作;重視抗感染藥品的不良反應;促進藥品不良反應的信息共享。
關鍵詞:藥品不良反應;監測;合理用藥
藥品不良反應監測和報告制度是藥品監督管理部門為保障用藥安全而設立的一項制度。為加強藥品上市后的監管,規范藥品不良反應報告和監測,依據《藥品管理法》等有關法律法規,衛生行政部門和藥品監督管理部門聯合制定了《藥品不良反應報告和監測管理辦法》,要求藥品生產企業(包括進口藥品的境外制藥廠商)、藥品經營企業和醫療機構應當按照規定報告所發現的藥品不良反應[1-2]。1999~2014年,全國藥品不良反應監測網絡累計收到藥品不良反應(adverse drug reaction,ADR)/藥品不良事件(adverse drug event,ADE)報告表近790萬份。2014年,全國已有24萬余個醫療機構、藥品生產和經營企業注冊為藥品不良反應監測網絡用戶,并通過該網絡報送藥品不良反應報告,全國94.4%的縣報送了藥品不良反應報告,每百萬人口報告數量達到991份,本文對近年來我國藥品不良反應報告與監測的總體情況進行了分析。
1資料與方法
收集2010~2014年連續5年國家藥品不良反應監測年度報告[3-7],采用文獻研究、內容分析、二次分析、對比分析等方法進行研究。
2結果與分析
2.1ADR報告數量逐年增加,新的和嚴重的ADR報告數量較少國家藥品不良反應監測中心2010年收到ADR/ADE報告69.2萬份,其中新的和嚴重的ADR/ADE報告占15.9%[3];2014年,收到ADR/ADE報告132.8萬余份,其中新的和嚴重的ADR/ADE報告占25.37%[7]。見表1。
2.2ADR報告主體是醫療機構,藥品生產、經營企業報告占比例較低2010年,來自醫療機構的ADR/ADE報告占84.7%,藥品生產、經營企業的報告占12.7%[3];2014年,來自醫療機構的報告占82.2%,藥品生產企業的報告占1.4%,藥品經營企業的報告占16.0%[7]。見表1。
表12010~2014年我國藥品不良反應/事件報告情況
Tab.1 ADRs/events reports during 2010-2014 in China
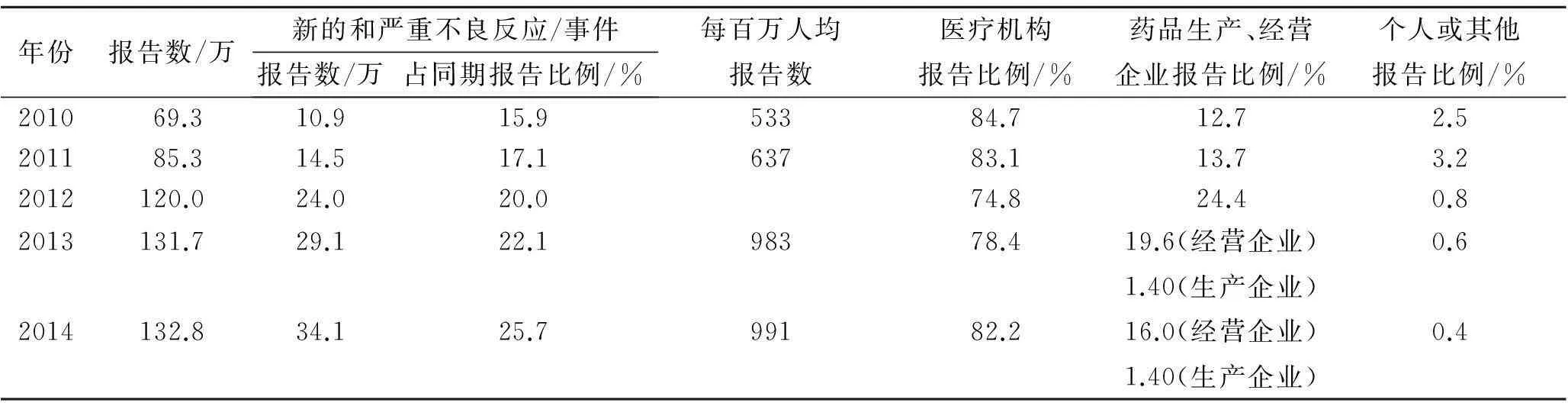
年份報告數/萬新的和嚴重不良反應/事件報告數/萬占同期報告比例/%每百萬人均報告數醫療機構報告比例/%藥品生產、經營企業報告比例/%個人或其他報告比例/%201069.310.915.953384.712.72.5201185.314.517.163783.113.73.22012120.024.020.074.824.40.82013131.729.122.198378.419.6(經營企業)1.40(生產企業)0.62014132.834.125.799182.216.0(經營企業)1.40(生產企業)0.4
2.3藥品類別及劑型分析在ADR/ADE報告中,2010,2012,2013和2014年涉及化學藥品的報告數量均超過了80%;生物制品的病例報告數量最小。從藥品劑型分析,注射劑發生不良反應的比例最大,其次為口服制劑。如2012年全國藥品不良反應監測網絡收到的嚴重的不良反應報告中,中成藥例次數排名前20位的均為中藥注射劑。中藥注射劑嚴重的不良反應報告例次數排名前10位的品種依次為:清開靈注射液、參麥注射液、雙黃連注射液、血塞通注射液、丹參注射液、香丹注射液、生脈注射液、血栓通注射液、脈絡寧注射液和黃芪注射液[5]。見表2。
2.4抗感染藥物不合理使用現象仍然嚴重在全國藥品不良反應監測網絡信息中,2012年涉及抗感染藥ADR/ADE報告48萬余份,其中嚴重ADR/ADE報告有1.8萬余份;2014年抗感染藥物ADR/ADE報告有50.6萬例,占化學藥ADR/ADE報告的46.2%,其中嚴重的不良反應報告有2.4萬余例[5-7]。2012年抗感染嚴重的不良反應報告例次數排名前10位的品種依次為:頭孢曲松、左氧氟沙星、青霉素G、頭孢哌酮舒巴坦、克林霉素、頭孢呋辛、阿奇霉素、頭孢噻肟、利福平和炎琥寧[5]。2014年抗感染ADR/ADE報告數量排名前10位的品種為左氧氟沙星、阿奇霉素、頭孢曲松、頭孢呋辛、克林霉素、頭孢哌酮舒巴坦、阿莫西林克拉維酸、阿莫西林、頭孢噻肟和甲硝唑[7]。見表3。
表2藥品不良反應/事件報告涉及藥品類別及劑型情況
Tab.2 The drug category and formula ADRs/events reports (%)
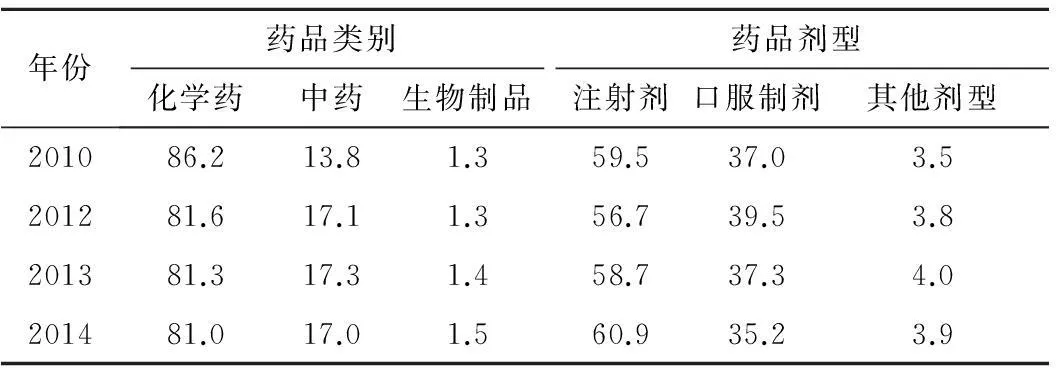
年份藥品類別藥品劑型化學藥中藥生物制品注射劑口服制劑其他劑型201086.213.81.359.537.03.5201281.617.11.356.739.53.8201381.317.31.458.737.34.0201481.017.01.560.935.23.9
表32012~2014年度抗感染藥物不良反應報告情況
Tab.3 Annul anti-infective drugs ADRs during 2012-2014
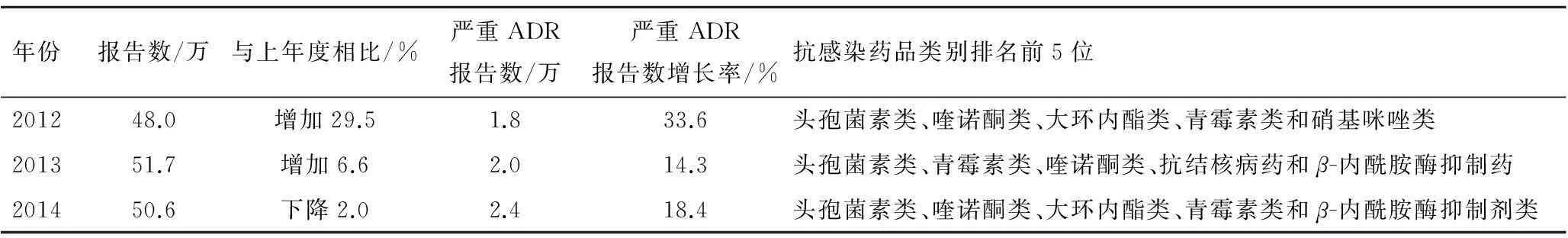
年份報告數/萬與上年度相比/%嚴重ADR報告數/萬嚴重ADR報告數增長率/%抗感染藥品類別排名前5位201248.0增加29.51.833.6頭孢菌素類、喹諾酮類、大環內酯類、青霉素類和硝基咪唑類201351.7增加6.62.014.3頭孢菌素類、青霉素類、喹諾酮類、抗結核病藥和β-內酰胺酶抑制藥201450.6下降2.02.418.4頭孢菌素類、喹諾酮類、大環內酯類、青霉素類和β-內酰胺酶抑制劑類
3建議
3.1提高新的和嚴重的ADR/ADE報告率新的和嚴重的ADR/ADE是影響公眾用藥安全的兩類最重要的信息,通過對此類藥品不良事件的監測發現安全性信息,并通過安全性評估后及時采取風險控制措施,對保障公眾用藥安全具有重要意義。從我國近年來藥品不良反應報告情況看,新的和嚴重的ADR/ADE報告數量較少。今后,應重點關注這兩類藥品不良反應報告的信息,鼓勵藥品生產、經營企業和醫療機構上報新的和嚴重的不良反應。
3.2 強化藥品生產、經營企業藥品不良反應報告工作我國近年來藥品不良反應報告情況顯示:藥品生產、經營企業的報告比例較低,尤其是藥品生產企業,2013~2014年報告數量僅占總數的1.4%。可見,藥品生產企業對此項工作重視不夠。我國《藥品不良反應報告和監測管理辦法》第十三條規定:藥品生產企業應當設立專門機構并配備專職人員,藥品經營企業和醫療機構應當設立或者指定專門機構并配備兼職人員,承擔本單位的藥品不良反應報告和監測工作[1]。建議藥品監管部門加大對生產、經營企業的監管,修改《藥品不良反應報告和監測管理辦法》,要求藥品生產、經營企業每年就本單位藥品不良反應報告監測情況向所在地藥品管理部門專項報告一次,藥品監管部門將其納入企業檢查和考評指標體系,將藥品不良反應報告情況作為企業認證和評價的重要考核指標。對于那些知情不報的企業,藥品監督管理部門應視情節輕重予以處罰。
3.3 重視抗感染藥品的不良反應2013~2014年抗感染藥品報告數量居首位,顯示抗感染藥物不合理使用現象仍然嚴重,有關醫療機構藥品不良反應報告情況也證實了這一點[8-9]。臨床醫師應按照《抗菌藥物臨床應用管理辦法》,遵循安全、有效、經濟的原則,按照分級管理的要求,合理使用抗感染藥,并加強不良反應監測和救治,降低使用風險。建議醫療機構加大抗感染藥物使用的考評,并作為考核醫務人員的條件之一;建議管理部門加大對醫療機構抗感染藥物使用的考評。
3.4 促進藥品不良反應通報信息的共享我國在藥品不良反應的信息共享上做得還不夠,自2012年起,每年我國藥品不良反應報告數量均超過百萬,根據藥品不良反應監測數據和評估結果,國家食品藥品監督管理總局對發現存在安全隱患的藥品及時采取相應的管理措施,以保障公眾用藥安全。2013年發布了《藥品不良反應信息通報》7期,通報了碘普羅胺注射液、紅花注射液、珍菊降壓片、別嘌醇片、氟喹諾酮類藥品、復方青黛丸(膠丸、膠囊、片)、質子泵抑制劑和左氧氟沙星注射劑等的嚴重不良反應。2014年發布了《藥品不良反應信息通報》7期,通報了頭孢唑林注射劑、含羥乙基淀粉類藥品、口服何首烏及其成方制劑、曲美他嗪、丙硫氧嘧啶、阿德福韋酯、苯溴馬隆等嚴重不良反應。但是,很多醫師、藥師和護士對此重視不夠,因為工作較忙很少關注這些信息,還按照以前的處方開藥、發藥、用藥。建議今后藥師要多關注、宣傳和介紹藥品不良反應,充分利用信息,減少用藥風險。
參考文獻:
[1]衛生部.藥品不良反應報告和監測管理辦法[S].衛生部令第81號.
[2]楊世民.藥事管理學[M].5版.北京:人民衛生出版社,2011:43.
[3]國家食品藥品監督管理局. 2010年國家藥品不良反應監測年度報告[EB/ol].[2011-04-25].http://www.sda.gov.cn/WS01/CL0051/60952.html.
[4]國家食品藥品監督管理局. 2011年國家藥品不良反應監測年度報告 [EB/OL].[2012-05-31].http://www.sda.gov.cn/WS01/CL0051/72190.html.
[5]國家食品藥品監督管理局. 2012年國家藥品不良反應監測年度報告 [EB/OL].[2013-03-14].http://www.sda.gov.cn/WS01/CL0026/79058.html.
[6]國家食品藥品監督管理總局. 2013年國家藥品不良反應監測年度報告 [EB/OL].[2014-05-14].http://www.sda.gov.cn/WS01/CL0051/99774.html.
[7]國家食品藥品監督管理總局. 2014年國家藥品不良反應監測年度報告 [EB/OL].[2015-07-17].http://www.sda.gov.cn/WS01/CL0051/124405.html.
[8]劉江紅,余瑞蓮,郭曉霞.我院2004~2012年藥品不良反應報告分析[J].西北藥學雜志,2013,28(4):423-425.
[9]錢先中,金惠靜,楊娟,等.我院128例抗菌藥物不良反應報告分析[J].西北藥學雜志,2015,30(2):197-201.
Analysis of the current situation of adverse drug reaction reporting and monitoring in China
YANG Yue
(Department of Pharmacy,the First Affiliated Hospital of Xi′an Jiaotong University,Xi′an 710061,China)
Abstract:ObjectiveTo analyze the current situation of adverse drug reaction(ADR)reporting in China,to find out the existing problems,and to proposed suggestions on ADR reporting and monitoring management. MethodsThe 2010-2014 national ADR monitoring annual reports were collected. The content analysis,secondary analysis and comparative analysis methods were adopted to evaluate the reports. ResultsThe annual number of ADR reports was increased year by year. Nevertheless, new and serious ADRs were still accounted for a small proportion. Reports were mainly from medical institutions,with low proportion from drug manufacturers. Adverse anti-infection reaction reports always top in quantity among various drugs. ConclusionsIt is still an essential issue to strengthen the management of ADRs reports. Our suggestions are as follows: the new and serious ADR reporting rate should be increased. Reports from the drug manufacturers and trading enterprises should be encouraged. Anti-infective drugs ADRs should be used with care. Information sharing of ADRs should be promoted.
Key words:adverse drug reaction;monitoring;rational use of drugs
(收稿日期:2016-01-12)
中圖分類號:969.3
文獻標志碼:A
文章編號:1004-2407(2016)03-0323-04
doi:10.3969/j.issn.1004-2407.2016.03.031

