魯棗3號莖段不定芽誘導研究
孫清榮 孫洪雁 周廣芳

摘要:為了建立棗優良新品種魯棗3號的莖段不定芽再生體系,以其幼嫩莖段為外植體,研究了不同基本培養基和植物生長調節劑對莖段愈傷組織誘導及不定芽再生的影響。結果表明:基本培養基WPM比MS顯著提高了愈傷組織誘導率,WPM上的愈傷組織誘導率達100%,但不能誘導愈傷組織產生不定芽。TDZ對不定芽的再生比6-BA更有效,成功誘導愈傷組織獲得了14.9%的不定芽再生率,而6-BA未能誘導愈傷組織產生不定芽。魯棗3號莖段適宜的不定芽再生培養基為:MS+lmg/L TDZ+0.2mg/L IBA。
關鍵詞:魯棗3號;莖段;愈傷組織;不定芽
中圖分類號:S665.101
文獻標識號:A 文章編號:1001-4942(2016)02-0012-03
棗(Zizyphus juijuba Mill.)是鼠李科棗屬多年生落葉木本果樹,原產地中國。紅棗營養豐富、富含維生素,深受廣大消費者喜愛,但由于棗樹在生長過程中經常受到一些病蟲害危害,制約了紅棗產量。通過育種方法可以進行棗樹品種的抗性改良,但由于棗胚敗育率高及落花落果嚴重等,利用常規雜交育種方法很難達到品種改良的目的。基因工程的外源基因遺傳轉化技術及植物體細胞誘變技術等現代生物技術方法的發展為植物新品種的選育和改良提供了育種新途徑,該技術的成功應用主要依賴于植物高效再生體系的建立。因此,建立棗樹的高效再生體系是利用現代生物技術手段改良品種的首要步驟。
棗離體葉片不定梢誘導研究報道較多,但以棗嫩莖切段為外植體進行不定芽誘導的研究尚未見報道。魯棗3號是2010年山東省審定的極早熟鮮食棗新品種,為了更好地利用、保存和改良這一品種,本試驗研究了其莖段不定芽再生技術,為種苗的無性快繁、品種資源的離體保存及利用現代生物技術改良品種奠定基礎,同時也為其他品種莖段不定芽再生誘導研究提供參考。
1 材料與方法
1.1 試驗材料
山東省果樹研究所棗樹資源圃種植的棗樹新品種魯棗3號成年大樹。
1.2 培養基
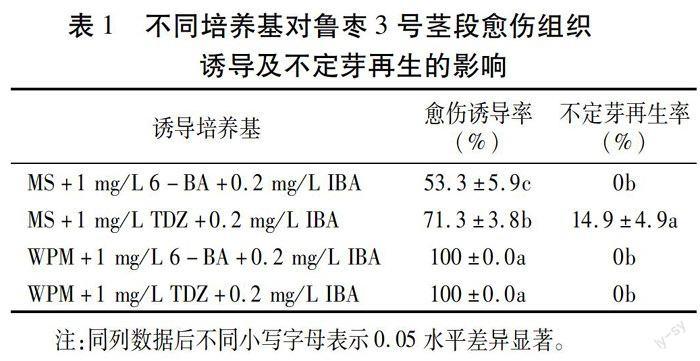
愈傷組織及不定芽誘導培養基:以MS和WPM為基本培養基,添加不同濃度的6-芐基氨基嘌呤(6-BA)、噻苯隆(TDZ)及3-吲哚丁酸(IBA),設置4種不同培養基處理(表1)。
不定芽的增殖培養基:WPM+2mg/L6-BA+1mg/LKT+0.5mg/L IBA。
生根培養基:1/4MS+1mg/L IBA。
所有培養基均添加蔗糖3%,瓊脂0.6%,在滅菌前調節pH值為5.8。
1.3 試驗方法
1.3.1 愈傷組織誘導及不定芽分化培養 從生長健壯的魯棗3號樹上剪取半木質化棗頭嫩枝,去掉葉片,帶回實驗室,剪取去掉兩端腋芽的節間莖段,用洗衣粉水清洗,再用自來水沖洗30min以上,控凈水,置于超凈工作臺上的無菌燒杯內。先用70%酒精殺菌1min,再用5%次氯酸鈉殺菌8min,期間搖動3-5次,用無菌水洗4~5次,將材料置于無菌培養皿內橫切成0.2cm左右的小段,橫切面向下接種到不定芽誘導培養基上(表1)。每個處理接種3瓶,每瓶接種10個,重復3次。接種后置于光周期為16h/8h(光/暗)、光強為40μmol·m-2·S-l、溫度為(25+2)℃的條件下培養,7周后,統計愈傷組織誘導率及不定芽再生率。
愈傷組織誘導率(%)=產生愈傷組織的莖段數/接種總莖段數xl00
不定芽再生率(%)=產生不定芽的莖段數/接種總莖段數×100
1.3.2 不定芽伸長、增殖和生根培養將不定芽轉移到增殖培養基進行繼代增殖和伸長培養。選取1.0cm以上的健康綠梢,轉移到生根培養基進行生根誘導,置黑暗條件下培養1周,然后轉到光周期為16h/8h(光/暗)的光培養條件下培養,4周后統計生根率。
生根率(%)=生根株數/接種總梢數×100
1.4 數據分析
試驗數據采用DPS 7.5軟件進行統計分析,不同處理平均值用LSD法進行差異比較分析,檢驗0.05水平下差異顯著性。
2 結果與分析
2.1 培養基組成對愈傷組織誘導率的影響
由表1可知,4種培養基均可誘導魯棗3號莖段產生愈傷組織,其中WPM基本培養基處理的愈傷組織誘導率可達100%,顯著高于MS基本培養基。
外源植物生長調節劑對愈傷組織的誘導作用因基本培養基的不同而表現不同。在WPM培養基上,TDZ和6-BA對愈傷組織的誘導作用無明顯差異;在MS培養基上,TDZ比6-BA對愈傷組織的誘導更有效,二者的愈傷組織誘導率差異顯著(表1)。
2.2 培養基組成對不定芽分化的影響
由表1可知,WPM培養基上的愈傷組織均未能分化不定芽。在MS基本培養基上添加1mg/LTDZ和0.2mg/L IBA時,可成功誘導愈傷組織分化不定芽(圖1A),不定芽再生率為14.9%;而添加6-BA的MS培養基未能誘導愈傷分化不定芽。由此可見,不定芽的分化受基本培養基和外源植物生長調節劑相互作用的影響。盡管WPM能高效誘導愈傷組織的產生,但不能誘導愈傷組織產生不定芽。結果表明,誘導魯棗3號莖段不定芽再生的適宜培養基為MS+lmg/L TDZ+0.2mg/L IBA。
2.3 不定芽的生長與增殖
將不定芽轉移至培養基WPM+2mg/L 6-BA+1mg/L KT+O.5mg/L IBA培養基上,表現為既有伸長生長也有增殖生長(圖1B)。
2.4 生根誘導
伸長生長的不定梢在生根培養基上獲得了生根小植株(圖1C),生根率為85.4%。
3 結論與討論
以棗樹葉片為外植體進行不定梢誘導的研究報道較多,但因基因型不同,其獲得的再生率也不同。莖段不定芽再生的研究雖也有報道,但所用外植體為帶芽莖段,表現為在切口處產生不定芽。本研究是以節間(去掉兩端芽)莖段為外植體,首次成功獲得了再生不定芽。
本研究中,基本培養基WPM比MS雖然顯著提高愈傷組織誘導率,但WPM培養基上添加TDZ或6-BA均未獲得不定芽再生,而在MS培養基上添加TDZ成功獲得了不定芽,這與前人在MS培養基上獲得帶芽棗莖段不定芽再生的結論相一致,但所添加的植物生長調節劑不同,表明外植體或基因型不同,不定芽再生所需的植物生長調節劑不同。
TDZ是比6-BA細胞分裂素活性更強的類細胞分裂素物質,更有利于誘導木本植物不定芽的再生。本研究結果表明:TDZ對于誘導魯棗3號莖段的不定芽再生比6-BA更有效,這與誘導棗葉片不定芽再生時TDZ比6-BA有效的研究結果一致。
本研究雖成功獲得了魯棗3號莖段不定芽的再生,但再生率低,不能有效應用于生物技術育種研究,如何進一步提高再生率還需深入研究。

