巴西橡膠樹鎂離子轉運蛋白基因HbMGT10的克隆及表達分析
陽江華 秦云霞 方永軍 唐朝榮


摘 要 Mg2+是植物細胞中含量最高的二價陽離子,是多種酶活性調控的輔因子,在植物的生長發育過程中發揮重要作用;同時,作為葉綠素分子的中心原子,在植物光合作用中起著至關重要的作用,但目前有關高大喬木葉片中Mg2+跨膜運輸的研究還很少。MGT/MRS2類型的鎂離子轉運蛋白在植物鎂離子的跨膜運輸過程中起著重要的作用,本文克隆研究了一個巴西橡膠樹MGT基因,HbMGT10。亞細胞定位顯示,HbMGT10定位于葉綠體膜上;酵母互補實驗表明,HbMGT10具有鎂離子轉運功能;qRT-PCR分析結果顯示,HbMGT10主要在橡膠樹葉片中表達,且是葉片中表達豐度最高的HbMGT基因;HbMGT10在葉片中的表達存在明顯的發育調控,隨葉片發育進程表達量明顯增加,在淡綠期和穩定期表達量最大;HbMGT10在成熟葉片中的表達呈現明顯的日變化,在光強度最大的12 : 00~16 : 00的表達量最大。由此推測,HbMGT10在橡膠樹葉片葉綠體膜的鎂離子跨膜轉運過程中起著重要的作用,參與了橡膠樹葉片葉綠體的發育,以及葉綠體中鎂離子濃度的調控,以適應橡膠樹葉片的光合作用。
關鍵詞 巴西橡膠樹;鎂離子轉運蛋白;鎂離子;HbMGT10;葉綠體
中圖分類號 S794.1 文獻標識碼 A
Mg2+是植物細胞質中僅次于鉀離子、含量第二的陽離子,參與多種生理生化過程[1]。Mg2+位于葉綠素中央,是植物光合作用的關鍵陽離子,當鎂離子缺乏時,葉綠素濃度降低、光合效率下降,葉片發黃,產生萎黃病[2]。
高等植物中,鎂離子轉運蛋白的研究主要集中在MGT(Magnesium Transporter)/MRS2(Mitochondrial RNA Splicing2)鎂離子轉運蛋白[3-4]和一種質子依賴性轉運蛋白Mg2+/H+交換體[5-6]。其它轉運蛋白和離子通道也具有一定的鎂離子轉運功能,比如大豆的SV通道[7],水稻的OsHKT2;4[8],擬南芥的AtCNGC10[9]。MGT/MSR2類型的鎂離子轉運蛋白是基因數量最多的,目前研究最廣泛的鎂離子轉運蛋白基因家族,位于植物細胞的細胞膜和液泡膜、葉綠體膜、線粒體膜等亞細胞器膜上,在維持細胞質和亞細胞器Mg2+濃度動態平衡起著重要作用[3-4,10-11]。通過研究擬南芥突變體,發現AtMGT有著多種不同的功能。在蛇紋巖土中培養時,atmgt2和atmgt3突變體葉肉細胞中的Mg2+濃度明顯低于野生型植株[12]。AtMGT5定位于線粒體上,在雄配子的細胞質和線粒體間的Mg2+運輸過程中起著關鍵作用,atmgt5突變體的雄配子發育存在缺陷,不能獲得AtMGT5突變體的純合子[13]。當Mg2+濃度低至50 μmol/L時,mrs2-7(atmgt7)突變體的生長受到明顯抑制,而在突變體中過表達atmrs2-7(AtMGT7)后植株的生長速度恢復到野生型的水平[14]。AtMGT9主要在成熟花藥和維管組織中表達,在雄配子發育和雄性育性上起著關鍵的作用;AtMGT9基因T-DNA插入雜合體突變體擬南芥+/mgt9中,有一半的突變體植株花粉敗育,且突變體自交不能產生同樣的雜合體+/mgt9子代[15]。在擬南芥中過表達AtMRS2-11(AtMGT10)基因,雖然會增加AtMRS2-11的蛋白表達水平,但未產生可觀察到的表型變化[17]。
目前,MGT/CoA鎂離子轉運蛋白的研究主要集中在模式植物擬南芥,以及糧食作物水稻和玉米等草本植物中[3-4,10,16],在高大喬木中的研究報道很少。巴西橡膠樹是一種來源于巴西熱帶雨林的高大喬木,其葉片中鎂離子的運輸可能有其自身獨特的特點。前期研究中,已從橡膠樹轉錄組和基因組數據中獲得了11個鎂離子轉運蛋白基因(HbMGTs)(未發表文獻)。本研究成功克隆了主要在葉片中表達的HbMGT10基因的全長cDNA序列,并進行了相關功能研究。
1 材料與方法
1.1 材料
1.1.1 實驗材料 實驗用樹為巴西橡膠樹,品系為熱研7-33-97,采自中國熱帶農業科學院試驗場3隊。
1.1.2 實驗試劑和菌種 克隆載體pMD-18T載體為大連寶生物公司產品,DNA Polymerase High Fidelity和熒光定量試劑為北京全式金生物技術有限公司產品,DNA限制性內切酶、反轉錄試劑盒和T4 DNA連接酶為美國Thermo Fisher公司產品。DNA凝膠回收試劑盒和質粒提取試劑盒為美國Omega公司產品。通用植物總RNA提取試劑盒為北京百泰克生物技術有限公司產品。大腸桿菌菌種DH5α,釀酒酵母菌種SEY6210(MATα leu2-3,112 ura3-52 hisΔ200 trp-Δ901 lys2-801 suc2-Δ9),酵母表達載體pDR196和pGBKT7,亞細胞定位載體HBT95-sGFPS65T-NOS,均為本實驗室保存。引物合成和DNA測序均由上海英俊生物技術公司完成。
1.2 方法
1.2.1 材料處理 不同組織和器官的實驗材料采自10年生、開割3 a的未進行乙烯利刺激割膠的橡膠樹。同一天不同時間點的葉片,以及不同發育時期的葉片,采自定植4 a的幼齡樹。3株橡膠樹為1個實驗重復,共3個實驗重復。
1.2.2 總RNA的提取及cDNA第一鏈的合成 巴西橡膠樹膠乳總RNA的提取參照Tang等[18]的辦法。除膠乳外其它材料的總RNA提取使用百泰克公司的通用植物總RNA提取試劑盒,使用方法參照試劑盒說明書。cDNA第一鏈的合成使用Thermo Fisher公司的cDNA第一鏈合成試劑盒,操作步驟按照說明書進行。
1.2.3 HbMGT10基因的克隆 以擬南芥的AtMRS2-11(AtMGT10)[17]的氨基酸序列為搜索序列,通過搜索巴西橡膠樹的轉錄組數據庫,拼接得到HbMGT10的cDNA序列。以葉片cDNA為模板,使用引物HbMGT10-F和HbMGT10-R 進行PCR擴增,產物經瓊脂糖凝膠回收后,連接到pMD-18T載體中,陽性克隆送上海英俊生物技術公司測序。最終得到HbMGT10的全長cDNA序列。所用引物序列見表1。
1.2.4 實時熒光定量表達分析 使用實時熒光定量PCR技術,分析HbMGT10基因在不同組織、葉片不同發育時期、葉片一天內不同時間的表達變化。不同組織和葉片不同發育分析時使用的內參基因是RH2b,葉片一天不同時間點分析時使用的內參基因為UBC2a,內參基因的引物序列和實時熒光定量PCR方法參照Li等的論文[19]。
1.2.5 酵母互補實驗分析 酵母菌種SEY6210為野生菌種,線粒體膜上有ScMRS2基因,能夠有效利用甘油等非發酵碳源,維持正常生長。以pGBKT7質粒為模板,兩端分別帶有ScMRS2基因同源臂的引物mrs2-Trp-F和mrs2-Trp-R,擴增TRP1基因,通過同源重組的方法[20],以TRP1基因替換掉ScMRS2基因,這樣SEY6210能夠在Trp缺陷型酵母培養基上生長。成功敲除了ScMRS2基因,獲得的突變體酵母SEY-mrs2不能在只添加非發酵碳源的YPdG培養基上正常生長,但在添加發酵碳源的YPD培養基上能正常生長。YPdG培養基配方為:1% Yeast Extract,2% Peptone,3%甘油,0.05%葡萄糖,2%瓊脂粉。YPD培養基配方:1% Yeast Extract,2% Peptone,2%葡萄糖,2%瓊脂粉。
為了使得HbMGT10能夠準確定位到酵母的線粒體內膜上,以互補ScMRS2的功能。用引物對ScMRS2-pro和ScMsr2+95AA擴增酵母ScMRS2的啟動子和前95個氨基酸,連接到pDR196載體。使用引物對HbMGT10-143aa和HbMGT10-Pst擴增除去了前5'端143個氨基酸的HbMGT10,再連接到ScMRS2的第95個氨基酸后,組成了一個ScMRS2和HbMGT10的融合蛋白。構建完成的HbMGT10酵母表達載體196-HbMGT10轉化突變體酵母SEY-mrs2,分別在YPdG和YPD培養基上生長。使用同樣的方法,構建了去除5′端107個氨基酸的HbMGT6的酵母表達載體196-HbMGT6。
1.2.6 亞細胞定位分析 使用引物對HbMGT10-SF和HbMGT10-SR擴增HbMGT10基因的去除了終止密碼子TAA的編碼區。然后連接到HBT95-sGFPS65T-NOS載體的綠色熒光蛋白基因GFP的前面,構建HbMGT10的亞細胞定位分析載體HBT-HbMGT10。HbMGT10的亞細胞定位分析使用水稻原生質體,方法參照Chen等[21],略有改動。其中GFP綠色熒光使用的激發光波長為480 nm,發射光波長為510 nm,葉綠體自發紅光的激發光波長為560 nm,發射光波長為650 nm。
2 結果與分析
2.1 HbMGT10基因全長cDNA序列的獲得
通過RT-PCR獲得了HbMGT10的全長cDNA序列,全長1 757 bp,其中編碼區長1 329 bp,5′非編碼區長99 bp,3′非編碼區長329 bp,編碼442個氨基酸序列。與擬南芥定位于葉片葉綠體的鎂離子轉運蛋白AtMRS2-11[17]的氨基酸序列同源性為71.3%。ChloroP 1.1預測HbMGT10定位于葉綠體,信號肽長53個氨基酸。
2.2 HbMGT10基因的表達分析
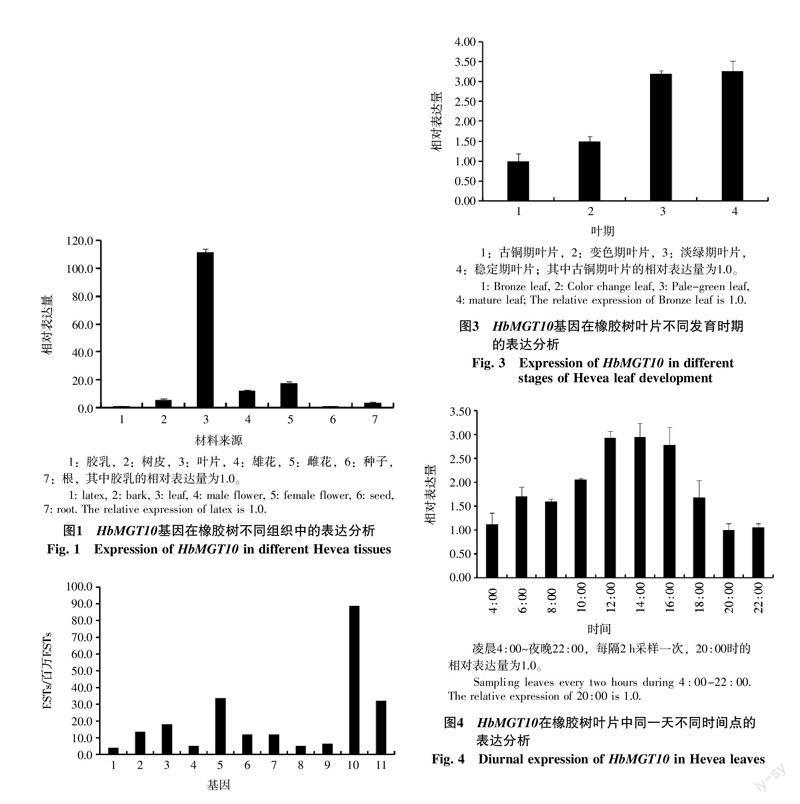
實時熒光定量PCR分析結果顯示,HbMGT10基因主要在巴西橡膠樹的葉片中表達,花中次之,膠乳和種子的表達量極低,尚不足葉片表達量的百分之一(圖1)。利用巴西橡膠樹的Solexa高通量轉錄組數據分析橡膠樹HbMGT家族全部11個基因在葉片中的相對表達水平,結果表明,HbMGT10在葉片中的表達豐度顯著高于其它10個家族基因,是橡膠樹葉片中表達豐度最高的HbMGT基因(圖2)。分析巴西橡膠樹不同發育時期葉片中HbMGT10的表達水平,結果表明該基因隨葉片發育進程表達量不斷增加,在淡綠和穩定期葉片中表達量最高(圖3)。在同一天不同時間點葉片中的表達分析表明,HbMGT10在光強度大的12 : 00~16 : 00期間的表達量最大(圖4)。
2.3 HbMGT10酵母互補實驗
ScMRS2是酵母線粒體中II類內含子自我剪接缺陷的抑制基因,定位于線粒體內膜上,也參與了線粒體鎂離子的跨膜運輸,ScMRS2的缺失會造成酵母不能在非發酵碳源的培養基上正常生長[22-23]。本研究成功獲得了敲除ScMRS2基因的酵母突變體SEY-mrs2,該突變體不能在添加非發酵碳源的YPdG培養基上正常生長(圖5),表達了HbMGT10的SEY-mrs2的生長明顯好于SEY-mrs2,但仍比野生型酵母差,表明HbMGT10能夠部分互補ScMRS2的功能,而HbMGT6則完全不能互補ScMRS2的功能。
2.4 HbMGT10的亞細胞定位分析
HbMGT10-GFP表達載體轉化水稻原生質體后暗培養24~48 h,使用激光共聚焦顯微鏡Olympus FV1000觀察轉化效果。結果表明,HbMGT10-GFP融合蛋白在水稻原生質體中激發的綠色熒光和原生質體葉綠體的自發紅光大部分能夠重疊在一起,產生黃色熒光,說明HbMGT10定位于葉綠體上(圖6)。
3 討論與結論
Mg2+是葉綠素的中心原子,Mg2+的缺乏,會造成葉片中淀粉和蔗糖的過度積累,產生萎黃病[11]。同時,地上部分比根更容易受到鎂缺乏的影響,擬南芥的28Mg同位素示蹤實驗顯示,鎂離子主要集中在地上部分較低的位置,難以到達地上部分的頂端[11,24-25]。鎂離子轉運蛋白可能在植物葉片Mg2+的跨膜運輸和維持葉片Mg2+濃度的動態平衡過程中發揮了重要作用。
MGT/MSR2基因家族編碼有功能的鎂離子轉運蛋白,在擬南芥中有10個基因[3-4],水稻中有9個[10],玉米中有12個[16]。前期研究發現巴西橡膠樹中有11個MGT/MRS2基因(未發表文獻)。本結果顯示這些HbMGT基因都在橡膠樹葉片中有表達,其中HbMGT10是葉片主要表達的HbMGT基因。酵母突變體互補實驗顯示HbMGT10是一個有功能的鎂離子轉運蛋白,它能夠部分互補敲除了ScMRS2基因的酵母突變體SEY-mrs2;亞細胞定位顯示,HbMGT10定于葉綠體上,可能參與了橡膠樹葉綠體中鎂離子的跨膜運輸。表達分析結果表明,HbMGT10主要在橡膠樹成熟期的葉片中表達,而且在一天中光照最強的12 : 00~16 : 00的表達量最強,是晚上和凌晨表達量的3倍,而擬南芥光照4和8 h后,AtMRS2-11基因的表達量是夜晚表達量的2倍[17],HbMGT10基因和擬南芥AtMRS2-11基因一樣,其表達受到光的調控。用PlantCARE數據庫[26]分析HbMGT10基因的啟動子,發現其含有多個光調控的順式作用元件。研究說明HbMGT10在巴西橡膠樹葉片中葉綠體的Mg2+跨膜運輸起著重要作用,還可能參與了葉綠體的發育,以及葉綠體不同光照強度下Mg2+濃度的調控,以適應葉片不同的光合作用強度。
本研究首次從巴西橡膠樹中克隆了在葉片中主要表達的鎂離子轉運蛋白基因HbMGT10,通過酵母互補和亞細胞定位分析明確其編碼一個有功能的鎂離子轉運蛋白,并從組織特異性、葉片發育階段和日變化等方面研究了該基因的表達特性,為深入揭示其生理功能奠定了良好基礎。
參考文獻
[1] Fox C, Ramsoomair D, Carter C. Magnesium: its proven and potential clinical significance[J]. Southern Medical Journal, 2001, 94(12): 1 195-1 201.
[2] Hermans C, Verbruggen N. Physiological characterization of Mg deficiency in Arabidopsis thaliana[J]. Journal of Experimental Botany, 2005, 56(418): 2 153-2 161.
[3] Li L, Tutone A F, Drummond R S, et al. A novel family of magnesium transport genes in Arabidopsis[J]. The Plant Cell, 2001, 13(12): 2 761-2 775.
[4] Schock I, Gregan J, Steinhauser S, et al. A member of a novel Arabidopsis thaliana gene family of candidate Mg2+ ion transporters complements a yeast mitochondrial group II intron-splicing mutant[J]. The Plant Journal, 2000, 24(4): 489-501.
[5] Gaash R, Elazar M, Mizrahi K, et al. Phylogeny and a structural model of plant MHX transporters[J]. BMC Plant Biology, 2013, 13: 75.
[6] Shaul O, Hilgemann D W, DE-ALMEIDA-ENGLER J, et al. Cloning and characterization of a novel Mg(2+)/H(+) exchanger[J]. The EMBO Journal, 1999, 18(14): 3 973-3 980.
[7] Pottonsin I I, Tikhonova L I, Hedrich R, et al. Slowly activating vacuolar channels can not mediate Ca2+-induced Ca2+ release[J]. The Plant Journal, 1997, 12(6): 1 387-1 398.
[8] Horie T, Brodsky D E, Costa A, et al. K+ transport by the OsHKT2;4 transporter from rice with atypical Na+ transport properties and competition in permeation of K+ over Mg2+ and Ca2+ ions[J]. Plant Physiology, 2011, 156(3): 1 493-1 507.
[9] Guo K M, Babourina O, Christopher D A, et al. The cyclic nucleotide-gated channel AtCNGC10 transports Ca2+ and Mg2+ in Arabidopsis[J]. Physiologia Plantarum, 2010, 139(3): 303-312.
[10] Saito T, Kobayashi N I, Tanoi K, et al. Expression and functional analysis of the CorA-MRS2-ALR-type magnesium transporter family in rice[J]. Plant & Cell Physiology, 2013, 54(10): 1 673-1 683.
[11] Kobayashi N I, Tanoi K. Critical Issues in the Study of Magnesium Transport Systems and Magnesium Deficiency Symptoms in Plants[J]. International Journal of Molecular Sciences, 2015, 16(9): 23 076-23 093.
[12] Conn S J, Conn V, Terman S D, et al. Magnesium transporters, MGT2/MRS2-1 and MGT3/MRS2-5, are important for magnesium partitioning within Arabidopsis thaliana mesophyll vacuoles[J]. The New Phytologist, 2011, 190(3): 583-594.
[13] Li L G, Sokolov L N, Yang Y H, et al. A mitochondrial magnesium transporter functions in Arabidopsis pollen development[J]. Molecular Plant, 2008, 1(4): 675-685.
[14] Gebert M, Meschenmoser K, Svidova S, et al. A root-expressed magnesium transporter of the MRS2/MGT gene family in Arabidopsis thaliana allows for growth in low-Mg2+ environments[J]. The Plant Cell, 2009, 21(12): 4 018-4 030.
[15] Chen J, LI L G, Liu Z H, et al. Magnesium transporter AtMGT9 is essential for pollen development in Arabidopsis[J]. Cell Research, 2009, 19(7): 887-898.
[16] Li H, Du H, Huang K, et al. Identification, and Functional and Expression Analyses of the CorA/MRS2/MGT-Type Magnesium Transporter Family in Maize[J]. Plant & Cell Physiology, 2016, 57(6): 1 153-1 168.
[17] Drummond R S M, Tutone A, Li Y C, et al. A putative magnesium transporter AtMRS2-11 is localized to the plant chloroplast envelope membrane system[J]. Plant Science, 2006, 170(1): 78-89.
[18] Tang C, Qi J, Li H, et al. A convenient and efficient protocol for isolating high-quality RNA from latex of Hevea brasiliensis (para rubber tree)[J]. Journal of Biochemical and Biophysical Methods, 2007, 70(5): 749-54.
[19] Li H, Qin Y, Xiao X, et al. Screening of valid reference genes for real-time RT-PCR data normalization in Hevea brasiliensis and expression validation of a sucrose transporter gene HbSUT3[J]. Plant Science: an International Journal of Experimental Plant Biology, 2011, 181(2): 132-1399.
[20] Ma H, Kunes S, Schatz P J, et al. Plasmid construction by homologous recombination in yeast[J]. Gene, 1987, 58(2-3): 201-216.
[21] Chen S, Tao L, Zeng L, et al. A highly efficient transient protoplast system for analyzing defence gene expression and protein-protein interactions in rice[J]. Mol Plant Pathol, 2006, 7: 417-427.
[22] Wiesenberger G, Waldherr M, Schweyen R J. The nuclear gene MRS2 is essential for the excision of group II introns from yeast mitochondrial transcripts in vivo[J]. The Journal of Biological Chemistry, 1992, 267(10): 6 963-6 969.
[23] Bui D M, Gregan J, Jarosch E, et al. The bacterial magnesium transporter CorA can functionally substitute for its putative homologue Mrs2p in the yeast inner mitochondrial membrane[J]. The Journal of Biological Chemistry, 1999, 274(29): 20 438-20 443.
[24] Tanoi K, Kobayashi N I, Saito T, et al. Effects of magnesium deficiency on magnesium uptake activity of rice root, evaluated using 28Mg as a tracer[J]. Plant and Soil, 2014, 384(1): 69-77.
[25] Sugita R, Kobayashi N I, Saito T, et al. Quantitative Analysis of 28Mg in Arabidopsis using Real-time Radioisotope Imaging System(RRIS)[J]. RADIOISOTOPES, 2014, 63(5): 227-237.
[26] Lescot M, Dehais P, Thijs G, et al. PlantCARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research, 2002, 30(1): 325-327.

