苦瓜McAPX2基因及其啟動子的克隆與表達分析
高山 許端祥 陳中釤 杜文麗 傅睿清 溫慶放

摘 要 基于苦瓜葉片均一化文庫克隆得到McAPX2基因的cDNA全長序列(GenBank登錄號:KJ722767.1),采用染色體步移法獲得該基因的啟動子序列,實時熒光定量PCR技術檢測該基因在不同器官中的表達量及低溫脅迫對McAPX2表達量的影響。結果表明:McAPX2基因全長1 086 bp,開放閱讀框747 bp,編碼249個氨基酸;McAPX2屬于過氧化物酶家族ClassⅠ的成員,其脂肪族氨基酸指數為83.90,是一個親水性蛋白,可推測定位于細胞質中;與甜瓜(NP_001284378.1)、黃瓜(ACO90193.1)、南瓜(AHF27424.1)、苦瓜(AGJ72851.1)同源性較高,分別為95%,94%,94%和93%;qRT-PCR結果顯示,在苦瓜的根、莖、葉、雌花和幼果等組織器官中McAPX2的表達量存在顯著差異,其中根的表達量最大,而在葉片中的表達量最低;在低溫脅迫下,隨著脅迫時間的延長,McAPX2表達量逐漸上調,處理12 h時達到最大,隨后下降,說明該基因的表達與苦瓜耐低溫脅迫相關。分離得到McAPX2基因上游調控序列1 267 bp,其啟動子含有與GA、ABA、CTK、乙烯等激素和病原菌等生物脅迫以及熱激、干旱、低溫、光等非生物脅迫的相關元件。
關鍵詞 苦瓜;McAPX2基因;啟動子;表達分析
中圖分類號 S642.5 文獻標識碼 A
低溫脅迫打破植物細胞內活性氧(active oxygen, ROS)產生和消除的平衡機制,造成活性氧含量大幅增加,引發氧化脅迫,致使植物生長發育受阻,甚至死亡[1]。H2O2是一種較穩定的ROS物質,可以輕易地穿過植物細胞膜,生成最活躍的ROS物質——羥自由基(·OH-),進而干擾植物細胞光電子傳遞,影響膜系統穩定性,氧化大分子物質,造成細胞程序性死亡[2-4]。因此,及時清除過多H2O2對維持植物正常生理功能起重要作用。
抗壞血酸-谷胱甘肽循環(ascorbate-glutathione cycle, AGC)是高等植物長期進化產生的有效清除活性氧的保護機制之一[5],抗壞血酸過氧化物酶(APX, ascorbate peroxidase)是AGC清除H2O2的關鍵酶,其以抗壞血酸(AsA)為特殊電子供體(AH2),催化H2O2還原成H2O[6-7]。目前已從多種作物克隆出APX基因,許多研究發現APX基因參與植物響應氧化脅迫應答[8-14]。
中國南方冬春持續低溫是影響設施大棚苦瓜(Momordica charantia L.)生長、發育、產量與品質形成的主要限制因子,但有關苦瓜低溫脅迫分子機制研究尚未見報道。本試驗從前期構建的苦瓜葉片均一化cDNA文庫中獲得一個EST序列,發現其與抗壞血酸過氧化酶基因高度同源。本研究以該序列設計特定引物,利用RACE技術克隆出苦瓜APX基因全長序列,分析其特征特性和在低溫脅迫下時空表達模式,分離并分析McAPX基因的啟動子,為進一步研究苦瓜APX在低溫脅迫下的功能奠定基礎,以期為苦瓜耐低溫育種提供理論依據。
1 材料與方法
1.1 材料
供試材料為苦瓜強雌系‘24-K(Subgynoecious line,24-K),由福州市蔬菜科學研究所苦瓜課題組提供,參照高山等[14]方法,采用DSN與SMARTTM技術相結合構建苦瓜葉片均一化全長cDNA文庫,基因克隆與表達在福建省農業科學院作物研究所內完成。
1.2 方法
1.2.1 初花期苦瓜低溫處理 試驗于2013年9月中旬進行,將供試‘24-K的苦瓜種子用60 ℃溫水處理30 min,常溫浸種12 h后,播種于10 cm×15 cm的營養缽中,營養基質為泥炭土 ∶ 珍珠巖 ∶ 蛭石=7 ∶ 1 ∶ 2(體積比),每個營養缽中保按照常規方法管理。待苦瓜長至9葉1心,出現雌蕊時,選擇生長勢一致的植株分別移置2臺智能型人工氣候箱(MGC-350HP-2)進行處理。(1)處理組A:溫度8 ℃,濕度為60%,光強為200 μmol/(m2·s),光周期12 h/12 h;(2)處理組B或對照組:溫度25 ℃,其它條件相同。在0~24 h內分別于0、1、3、6、12、
24 h定時取各處理單株第5片功能葉,經液氮速凍后,置于-80 ℃冰箱備用,進行基因表達分析。每個處理隨機取6株,設3次重復。
1.2.2 苦瓜基因組DNA和總RNA提取純化 采用改良CTAB法提取苦瓜強雌系24-K的基因組DNA[15];采用改良Trizol RNA提取試劑盒(Invitrogen)方法,分別提取苦瓜強雌系24-K開花初期(9葉1心)根、莖、葉、雌花和授粉5 d幼果的總RNA,用于McAPX2在苦瓜不同部位的表達分析。采用上述方法分別提取經不同時間低溫處理和對照處理的苦瓜葉片總RNA,用于McAPX2表達模式分析。用1%瓊脂糖凝膠電泳檢測基因組DNA、總RNA 完整性,用紫外分光光度計檢測基因組DNA、總RNA的濃度和純度。
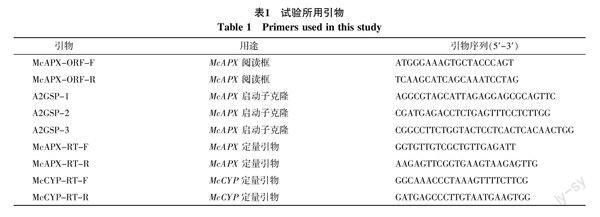
1.2.3 McAPX2基因的克隆 在已構建苦瓜葉片均一化cDNA文庫基礎上,測序后去除引物和載體片段,在Blast(http://blast.ncbi.nlm.nih.gov/)進行序列同源性比對分析,獲得一個與多種植物APX基因有很高同源性的EST序列,該基因cDNA全長1 086 bp。利用軟件Primer 5.0 設計ORF上下游引物McAPX-ORF-F/R(見表1),以稀釋100倍文庫為模板進行PCR擴增,回收的目的條帶,克隆到TaKaRa的pMD18-T載體上,轉化感受態細胞DH5α,篩選出陽性克隆,委托上海英駿生物技術公司測序,進行新基因驗證。
1.2.4 McAPX2啟動子的分離 根據苦瓜McAPX2的全長cDNA序列,從起始密碼子下游200 bp內設計巢式引物A2GSP-1,A2GSP-2和A2GSP-3。參照劉志欽等[16]方法和Genome Walking kit試劑盒說明書,以純化的苦瓜‘24-K基因組DNA為模板,進行3輪巢式PCR,分離克隆McAPX2上游調控區域的啟動子序列。PCR產物純化回收并克隆至pMD18-T載體上,委托上海英駿生物技術公司測序。
1.2.5 McAPX2生物信息學分析 由在線軟件ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)尋找McAPX2最大開放閱讀框,使用Blastn(http://blast.ncbi.nlm.nih.gov/Blast.cgi)進行同源性分析;采用Maga5.01軟件繪制系統進化樹;利用在線軟件Blastp、SOSUI、Signal3.0、TMHMM、TargetP1.1、SOPMA等(http://www.expasy.org/tools)分析McAPX2編碼的氨基酸序列、蛋白結構、疏水性、跨膜結構、磷酸化位點等。利用在線軟件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)預測其順式作用元件。
1.2.6 熒光定量PCR分析 以稀釋10倍的反轉錄cDNA為模板,根據McAPX2基因序列設計熒光定量引物McAPX2-RT-F/R,以苦瓜環素基因(GenBank:HQ171897)作為內參基因[15],以McCYP-RT-F/R為熒光定量引物(表1),RT-qPCR分析在ABI7500熒光定量PCR儀上進行,每個樣品進行3次重復。20 μL PCR擴增體系為:10 μL 2×Real Master Mix混合液、5~10 ng cDNA、上下游引物各0.5 μL,補ddH2O至20 μL。反應程序為:95 ℃預變性10 min;94 ℃ 15 s,60 ℃ 34 s,40次循環,清水模板為陰性對照。采用2-△△Ct法計算相對表達量。原始數據用Excel2007軟件處理,用SPSS10.0軟件進行相關分析。
2 結果與分析
2.1 McAPX2基因全長的克隆
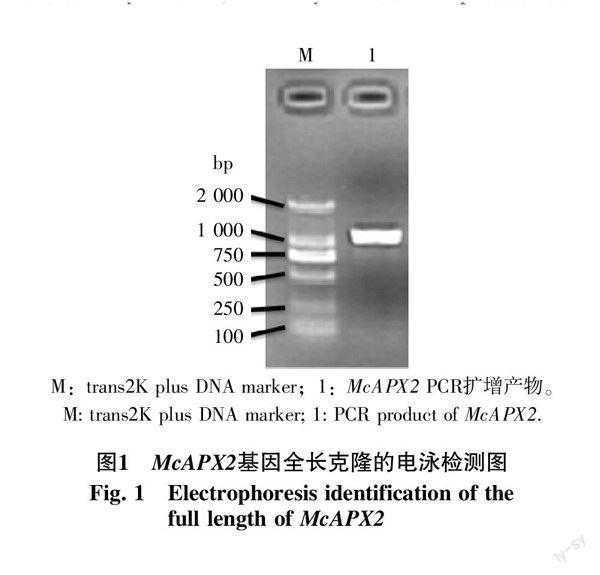
從苦瓜葉片均一化文庫中克隆得到1個APX相關的EST片段,去除引物和載體片段,經blastn比對分析,發現與黃瓜L-ascorbate peroxidase(NM_001280706.1)的cDNA序列相似性為67.5%,經測序及序列分析,得到APX基因cDNA全長序列(圖1、2),該序列全長為1 086 bp,包括89 bp的5′-UTR,250 bp的3′-UTR。起始密碼子ATG附近有Kozak保守序列“A/GCCATGG”,cDNA末端含有PolyA序列,在PolyA之前20 bp含保守加尾信號“TGTAA”序列,這些均符合能有效翻譯基因的全長cDNA特征,命名為McAPX2,GenBank登錄號為KJ722767.1。
2.2 McAPX2基因推導氨基酸序列的生物信息學分析
經ORF Finder分析,McAPX2的開放閱讀框為747 bp,編碼249個氨基酸。ProtParam軟件分析表明,McAPX2蛋白分子式為C1 236H1 912N326O365S5,相對分子量27.34 ku,理論等電點pI為5.43;負電荷殘基(Asp+Glu)為36個,正電荷殘基(Arg+Lys)為28個;脂肪系數為83.90,平均熟疏水性為-0.280;不穩定指數為34.80,屬于穩定蛋白。經ProtScale軟件推測該蛋白為親水性蛋白。
采用TargetP1.1對McAPX2蛋白進行細胞內定位預測,結果顯示定位在線粒體內(mTP值為0.131)或分泌到胞外(SP值為0.047)的可能性較小,極有可能在其它部位(other值為0.906)。經SignalP 4.1 Server軟件分析,McAPX2蛋白不含信號肽,不是分泌蛋白。經TMpred程序分析,McAPX2蛋白不含跨膜區域。結果推測McAPX2蛋白定位在細胞質中。
經SOPMA預測McAPX蛋白二級結構顯示,McAPX蛋白包含有104處α-螺旋(Alpha helix),占41.77%;22處β-轉角(beta-turn),占8.84%;25處延伸鏈(Extended strand),占10.04%;98處無規則卷曲(Random coil),占39.36%。
通過NCBI的CDS軟件分析,McAPX2蛋白屬于植物來源的過氧化物酶超家族,該蛋白含有1個過氧化物酶活性位點或底物結合位點(33-44: APLMLRLAWHSA)區域,1個亞鐵血紅素配基結合區域或血紅素結合位點(155-165:DIVALSGAHTL),發現7個與形成二聚體靜電作用相關的保守氨基酸。利用DNAMAN軟件進行氨基酸同源比對(圖3),發現APX蛋白序列C-端高度保守,N-端相對不保守,與同屬的甜瓜(Cucumis melo NP_001284378.1)、黃瓜(Cucumis sativus ACO90193.1)、南瓜(Cucurbia moschata AHF27424.1)、苦瓜(Momordica charantia AGJ72851.1)同源性分別為95%,94%,94%,93%,說明葫蘆科APX氨基酸序列具有較高的保守性。
利用MEGA5.0軟件,將McAPX2蛋白與其他27種植物的APX蛋白進行系統發育樹構建(圖4),參與構建進化樹的27個APX蛋白已被證明或預測定位于細胞質中。結果顯示,苦瓜McAPX蛋白與葫蘆科植物甜瓜(NP_001284378.1)、黃瓜(ACO90193.1)的APX蛋白親緣關系最近,與茄科的番茄(NP_001234782.1)、煙草(AAA86689.1)和辣椒(CAA57140.1)的APX具有相對較近的親緣關系,與豆科的大豆(NP_001237785.1)、苜蓿(AES88707.1)、豇豆(AAB03844.1)等的APX蛋白親緣關系相對較遠,而與無患子科植物柚(ACM17463.1)和龍眼(ABS50864.1)的APX親緣關系最遠。結果表明,苦瓜McAPX2基因與其它植物的APX具有較高的保守性,這些APX蛋白功能在進行化上保守,推測McAPX2蛋白定位于細胞質中。
2.3 McAPX2在苦瓜不同器官表達
采用實時定量PCR技術分別檢測McAPX2在苦瓜開花初期不同組織器官的表達情況,以葉片中相對表達量為1。從圖5可見,McAPX2在根、莖、葉、雌花和授粉5 d幼果等器官中的表達量存在極顯著的差異。在根、莖、幼果中大量表達,其中根的表達量最大,而在葉片中的表達量最低。
2.4 低溫脅迫下McAPX2的表達模式
采用實時定量PCR技術檢測在低溫脅迫下苦瓜初花期葉片中McAPX2表達情況,以對照處理McAPX2相對表達量為1。結果發現,低溫脅迫處理1 h時,苦瓜葉片McAPX2表達量與對照處理McAPX2表達量無顯著差異;低溫處理3 h時McAPX2表達量有顯著的上調趨勢;低溫處理6 h時,McAPX2表達量是對照處理的16倍;低溫處理12 h時McAPX2表達量達到最大,是對照處理表達量的23倍;低溫處理24 h時,McAPX2表達量降低,仍比對照處理的表達量高17倍(圖6)。
2.5 McAPX2啟動子分離與序列分析
將啟動子PCR擴增產物克隆到pMD18-T載體上,經酶切鑒定、測序,獲得序列片段長為1 276 bp(圖7)。結果發現,所獲得的序列3′端116 bp序列與McAPX2 cDNA的5′端序列比對一致,表明所得序列為McAPX2基因上游的啟動子區域。
使用在線neural network promoter prediction軟件預測出轉錄起始點為T,位于起始密碼子上游214 bp處;采用在線軟件PlantCare分析,在轉錄起始位置上游30 bp位置預測到1個TATA-BOX,在上游68 bp位置預測到1個CAAT-BOX。發現該段序列上含有植物激素響應元件,如赤霉素響應元件GARE1OSREP1、赤霉素反應瞬時作用元件PYRIMIDINEBOXOSRAMY1A、脫落酸響應元件ABRE、乙烯響應元件ERELEE4和細胞分裂素響應元件ARR1AT;器官特異表達元件,如根器官特異表達元件ROOTMOTIFTAPOX1、花粉特異表達元件POLLEN1LELAT52;病原菌響應元件,如ASF1MOTIFCAMV、ELRECOREPCRP1、WBOXATNPR1;防御與脅迫響應元件,如DOFCOREZM、WBBOXPCWRKY1;光調控元件BOX4;逆境響應元件,如干旱誘導元件,如MYB1AT、MYB2CONSENSUSAT、MYBCORE,干旱和黑暗響應元件ACGTATERD1,熱激鹽誘導表達GT1GMSCAM4,低溫誘導響應元件LTRE1HVBLT49(圖8)。
3 討論
本試驗從苦瓜葉片均一化文庫中克隆出1 086 bp的McAPX2全長cDNA序列,該基因編碼含有249個氨基酸的完整開放閱讀框。保守區分析發現該基因所編碼的蛋白屬于植物POD超家族,具有過氧化物酶活性位點和亞鐵血紅素配基結合區等與其他物種APX相同的保守域。在高等植物中APX是編碼多基因家族,APX蛋白根據不同細胞定位可劃分4種同工酶:葉綠體基質(sAPX)及類囊體膜APX(tAPX),線粒體膜APX(mitAPX)、過氧化物酶體(pAPX)和胞質APX(cAPX)[17]。4種APX同工酶的分子量、亞細胞定位、結構和序列存在差異。McAPX2蛋白分子量為27.43 ku,與擬南芥胞質型AtAPX1/2分子量27.5 ku相當。該蛋白含有7個參與二聚體界面靜電作用的保守帶電殘基,說明McAPX2可能和擬南芥胞質型AtAPX1/2一樣以二聚體結構存在[18]。亞細胞定位預測發現該蛋白序列的N-端不含信號肽,表明該蛋白不定位葉綠體或線粒體上,C-端不含跨膜區域,表明不定位在過氧化物酶體上,推測可能定位在細胞質。同源比對發現,該蛋白與同科植物甜瓜(95%),黃瓜(94%)和南瓜(94%)的cAPX有很高的同源性;系統聚類樹分析顯示,McAPX2與其它27種植物的cAPX具有較高的同源性,說明該基因家族在進化上十分保守。由此可以推斷獲得的苦瓜McAPX2基因屬于APX基因家族的cAPX基因亞族[7]。
目前許多高等植物中不同類型的APX基因被克隆出來,有研究表明,APX基因的表達受各種環境脅迫因子的誘導。APXs,尤其是cAPX更有助于使植物免受氧化應激作用[17]。Park等[19]研究發現,甘薯受傷害脅迫誘導后APX表達量明顯上調;Koussevitzky等[20]發現干旱和熱激脅迫后擬南芥APX1的mRNA和蛋白質表達量達到最高;王超等[21]發現鹽脅迫處理誘導白樺APX基因顯著表達;Lu等[22]發現2種水稻cAPXs(OsAPXa和OsAPXb)基因均可以且在不同程度上提高轉基因煙草的耐鹽性,其中OsAPXb基因對鹽脅迫更敏感。曾秀存等[23]發現低溫脅迫誘導白菜型冬油菜cAPX基因上調表達,超強抗寒性品種‘隴油7號APX基因表達量高于抗寒性弱的品種‘天油4號;本研究表明低溫脅迫下苦瓜McAPX表達量上調,與曾秀存等[23]研究結果相一致;另外,低溫脅迫誘導植株體內的APX活性上調在水稻[24],咖啡[25],山楂[26]和辣椒[27]中也得到了證實。然而,有研究表明,低溫脅迫可誘導cAPX下調表達,Morita等[28]發現低溫處理水稻胞質型OsAPX2的表達量下調;Funatsuki等[29]發現大豆cAPX1缺失突變株比野生型更為耐寒。cAPX基因的表達差異可能與試驗材料對低溫的敏感程度、試驗條件和脅迫強度等相關。對于低溫敏感性植物而言,低溫脅迫下植物主要遭受氧化脅迫,植株體內APX活性上調,清除過量的H2O2,以利于植物在更低溫度或長時間低溫下生存。對于特定處理條件下,低溫脅迫可誘導cAPX下調表達積累H2O2,H2O2作為低溫脅迫信號因子觸發誘導下游防御基因的表達,表現出耐寒性[30]。
啟動子作為一種順式作用元件,是研究基因表達調控的重要因素之一。本研究通過染色體步移法從苦瓜果實中分離得到McAPX2基因上游1 276 bp的啟動子序列。通過在線軟件PLACE和PlantCare分析,該序列具有啟動子的普遍特征,在轉錄起始位置有基因轉錄必須的與RNA聚合酶結合或互作的保守元件TATA-BOX和CAAT-BOX,含有與GA、ABA、CTK、乙烯等激素和病原菌等生物脅迫以及熱激、干旱、低溫、光等非生物脅迫的相關元件,這些元件的發現說明McAPX2基因可能在轉錄水平上受到激素、生物脅迫和非生物脅迫等多種因素的調節。該序列上的低溫誘導響應順式元件LTRE1HVBLT49[31-34]可能與低溫脅迫下APX基因的差異表達有著重要關系;3個增強子元件CAATBOX、EECCRCAH1、GATABOX可能與增強啟動子驅動下游McAPX2基因的表達相關。同時該序列中發現了器官特異表達元件,說明McAPX2在植物體內的表達可能具有器官特異性。McAPX2啟動子各元件的具體功能還有待進一步研究驗證。
參考文獻
[1] 王國驕, 王嘉宇, 馬殿榮, 等. 不同耐冷性雜草稻和栽培稻抗氧化系統對冷水脅迫的響應[J]. 中國農業科學, 2015(8): 1 660-1 668.
[2] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction.[J]. Annual Review of Plant Biology, 2004, 55(1): 728-749.
[3] 王春麗, 梁宗鎖. 外源刺激對植物次生代謝的調節及其信號轉導途徑研究進展[J]. 西北植物學報, 2009, 29(5): 1 055-1 065.
[4] Sharma P, Jha A B, Dubey R S, et al. Reactive Oxygen Species, Oxidative Damage, and Antioxidative Defense Mechanism in Plants under Stressful Conditions[J]. Journal of Botany, 2012:1-26. doi: 10.1155/2012/217037.
[5] 羅 婭, 湯浩茹, 張 勇. 低溫脅迫對草莓葉片SOD和AsA-GSH循環酶系統的影響[J]. 園藝學報, 2007, 34(6): 1 405-1 410.
[6] Pal R S, Bisht M. Antioxidative metabolites and enzymes: an overview[M]// Newer Approaches to Biotechnology, 2013: 595-601.
[7] 李澤琴, 李靜曉, 張根發. 植物抗壞血酸過氧化物酶的表達調控以及對非生物脅迫的耐受作用[J]. 遺傳, 2013, 35(1): 45-54.
[8] Karpinski S, Reynolds H, Karpinska B, et al. Systemic signaling and acclimation in response to excess excitation energy in Arabidopsis.[J]. Science, 1999, 284(5414): 654-657.
[9] Yabuta Y, Motoki T, Yoshimura K, et al. Thylakoid membrane-bound ascorbate peroxidase is a limiting factor of antioxidative systems under photo-oxidative stress[J]. Plant Journal, 2003, 32(6): 915-25.
[10] Murgia I, Tarantino D, Vannini C, et al. Arabidopsis thaliana, plants overexpressing thylakoidal ascorbate peroxidase show increased resistance to Paraquat-induced photooxidative stress and to nitric oxide-induced cell death[J]. Plant Journal, 2004, 38(6): 940-953.
[11] Davletova S, Rizhsky L, Liang H, et al. Cytosolic ascorbate peroxidase 1 is a central component of the reactive oxygen gene network of Arabidopsis[J]. Plant Cell, 2005, 17(1): 268-281.
[12] Kangasjarvi S, Lepisto A, Hannikainen K, et al. Diverse roles for chloroplast stromal and thylakoid-bound ascorbate peroxidases in plant stress responses[J]. Biochemical Journal, 2008, 412(2): 275-285.
[13] Wu G, Wang G, Ji J, et al. Cloning of a cytosolic ascorbate peroxidase gene from Lycium chinense, Mill. and enhanced salt tolerance by overexpressing in tobacco[J]. Gene, 2014, 543(1): 85-92.
[14] 高 山, 陳桂信, 許端祥, 等. 成熟軟化期苦瓜果實均一化全長cDNA文庫的構建與EST分析[J].分子植物育種, 2013(2): 211-216.
[15] 高 山, 陳桂信, 許端祥, 等. 苦瓜果實β-半乳糖苷酶基因的克隆、 表達及亞細胞定位[J]. 植物遺傳資源學報, 2013, 14(6): 1 124-1 129.
[16] 劉志欽, 楊 晟, 蔡金森, 等. 辣椒CaWRKY5啟動子的分離及其調控元件分析[J]. 應用與環境生物學報, 2013(3): 389-394.
[17] Shigeoka S, Ishikawa T, Tamoi M, et al. Regulation and function of ascorbate peroxidase isoenzymes[J]. Journal of Experimental Botany, 2002, 53(372): 1 305-1 319.
[18] Dabrowska G, Katai A, Goc A H M, et al. Characteristics of the plant ascorbate peroxidase family[J]. Acta Biologica Cracoviensia, 2007, 49(1): 7-17.
[19] Park S Y, Ryu S H, Jang I C, et al. Molecular cloning of a cytosolic ascorbate peroxidase cDNA from cell cultures of sweet potato and its expression in response to stress[J]. Molecular Genetics & Genomics, 2004, 271(3): 339-346.
[20] Koussevitzky S, Suzuki N, Huntington S, et al. Ascorbate peroxidase 1 plays a key role in the response of Arabidopsis thaliana to stress combination[J]. Journal of Biological Chemistry, 2008, 283(49): 34 197-34 203.
[21] 王 超, 楊傳平, 王玉成. 白樺抗壞血酸過氧化物酶(APX)基因克隆及表達分析[J]. 東北林業大學學報, 2009, 37(3): 79-81.
[22] Lu Z Q, Liu D L, Liu S K. Two rice cytosolic ascorbate peroxidases differentially improve salt tolerance in transgenic Arabidopsis[J]. Plant Cell Reports, 2007, 26(10): 1 909-1 917.
[23] 曾秀存, 孫萬倉, 方 彥, 等. 白菜型冬油菜抗壞血酸過氧化物酶(APX)基因的克隆、 表達及其活性分析[J]. 作物學報, 2013, 39(8): 1 400-1 408.
[24] Oidaira H, Sano S, Koshiba T, et al. Enhancement of antioxidative enzyme activities in chilled rice seedlings[J]. Journal of Plant Physiology, 2000, 156(5-6): 811-813.
[25] Fortunato A S, Lidon F C, Batista-Santos P, et al. Biochemical and molecular characterization of the antioxidative system of Coffea sp. under cold conditions in genotypes with contrasting tolerance[J]. Journal of Plant Physiology, 2009, 167(5): 333-342.
[26] Eltelib H A, Badejo A A, Fujikawa Y, et al. Gene expression of monodehydroascorbate reductase and dehydroascorbate reductase during fruit ripening and in response to environmental stresses in acerola(Malpighia glabra).[J]. Journal of Plant Physiology, 2011, 168(168): 619-627.
[27] Airaki M, Leterrier M, Rosa M, et al. Metabolism of reactive oxygen species and reactive nitrogen species in pepper(Capsicum annuum, L.)plants under low temperature stress[J]. Plant Cell & Environment, 2012, 35(2): 281-295.
[28] Morita S, Nakatani S, Koshiba T, et al. Differential expressions of two cytosolic ascorbate peroxidase and two superoxide dismutase genes in response to abiotic stress in rice[J]. Rice Science, 2011, 18(3): 157-166.
[29] Funatsuki H, Kurosaki H, Murakami T, et al. Deficiency of a cytosolic ascorbate peroxidase associated with chilling tolerance in soybean[J]. Theoretical & Applied Genetics, 2003, 106(3): 494-502.
[30] Prasad T K, Anderson M D, Martin B A, et al. Evidence for Chilling-Induced Oxidative Stress in Maize Seedlings and a Regulatory Role for Hydrogen Peroxide.[J]. Plant Cell, 1994, 6(1): 65-74.
[31] 陰 霞, 陳 雯, 王 磊, 等. 激素和非生物脅迫對月季RhPIP1;1啟動子活性的調節作用[J].園藝學報, 2014, 41(1): 107-117.
[32] 徐孟亮, 李落葉, 陳榮軍, 等. 一個新的水稻低溫應答類糖基轉移酶基因(OsCrGtl)的表達分析與克隆[J]. 農業生物技術學報, 2010, 18(4): 663-669.
[33] 張愛華. 西瓜玉米黃質環氧化酶基因及啟動子的克隆與分析[D]. 保定: 河北農業大學, 2011.
[34] Md Abdul Kayum, Jong-In Park, Nasar Uddin Ahmed, et al. Alfin-like transcription factor family: characterization and expression profiling against stresses in Brassica oleracea[J]. Acta Physiologiae Plantarum, 2016, 38(5): 1-14.

