山東小麥蠕孢根腐病病原鑒定及致病力分析
張眉 姜珊珊 吳斌 王升吉 趙玖華 辛相啟

摘要:本研究首先利用形態學和分子生物學方法,對25株在山東采集分離的小麥根腐病菌進行了鑒定,后采用刺傷接種法對菌株的致病性進行了測定。鑒定結果表明,25個菌株均為麥根腐離蠕孢[Bipolaris sorokiniana (Sacc.) Shoemaker],屬半知菌亞門離蠕孢屬真菌。接種試驗表明,25個麥根腐離蠕孢菌株均具有致病性,但從系統聚類圖可以看出,不同菌株間存在致病力分化,可分為強、中、弱3種致病力類型,其中,中等致病力菌株為優勢菌株。同時,菌株的致病力強弱與其地理來源沒有相關性。
關鍵詞:小麥根腐病;麥根腐離蠕孢;病原鑒定;致病力分析
中圖分類號:S435.121.4+7文獻標識號:A文章編號:1001-4942(2016)10-0117-04
小麥根腐病(Wheat common rot)是小麥生產上的重要病害之一,可造成小麥苗枯、葉枯、穗枯,給小麥產量帶來重大損失。該病害在我國各麥區均有發生,近年來在山東有逐年加重的趨勢。20世紀70年代之前,人們認為小麥根腐病病原物是單一病菌長蠕孢[1],之后國內外研究卻發現,該病是由多種病原物混合侵染引起的,主要病原物有蠕孢菌、鐮孢菌、絲核菌、鏈格孢菌等[1-4]。張德珍等[5]研究結果表明,山東小麥根腐病病原物主要為麥根腐離蠕孢[Bipolaris sorokiniana (Sacc.) Shoemaker]和鐮孢屬(Fusarium sp.)真菌,其中,B.sorokiniana為優勢菌群。真菌的致病性研究為病菌遺傳變異、病菌致病機理、病害防治等方面提供理論依據,但從現有報道來看,有關山東地區小麥根腐病蠕孢菌的致病性研究較少,而能夠準確鑒定得到蠕孢菌株是研究其致病性的關鍵。真核生物的核糖體內轉錄間隔區(Internal transcribed space, ITS)在種內相對保守,在科、屬、種水平上具有序列特異性,已被廣泛用于病原診斷、微生物分類鑒定、系統發育等研究[5,6]。因此,本研究利用傳統形態學與rDNA-ITS序列分析相結合的方法,鑒定得到了25個小麥根腐病離蠕孢菌株,通過苗期小麥接種,明確了山東小麥根腐離蠕孢菌的致病性特點,以期為探明該菌的致病機理、培育抗病品種等研究奠定理論基礎,為山東地區小麥品種布局和根腐病防治提供參考。
1材料與方法
1.1供試菌株
在山東不同地區采集小麥根腐病病樣,分離純化得到25個菌株,見表1。
1.2病原菌鑒定
1.2.1形態學鑒定將25株供試菌株接種于PDA培養基平板,28℃黑暗培養,觀察菌落形態。用接種針挑取菌體,在光學顯微鏡下觀察分生孢子梗和分生孢子形態。
1.2.2分子鑒定收集25株菌株菌絲體,用美國Omega Bio-Tek公司的HP Fungal DNA Kit試劑盒提取菌株基因組作為模板,用通用引物ITS1F(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4R(5′-TCCTCCGCTTATTGATATGC-3′)擴增rDNA-ITS序列。PCR擴增條件為:94℃預變性4 min;94℃變性30 s,56℃退火30 s,72℃延伸33 s,30個熱循環;72℃終延伸10 min。用上海生工公司的SanPrep柱式DNA膠回收試劑盒回收目的片段,連接T載體轉化大腸桿菌感受態DH5α,送由上海博尚公司完成測序。通過NCBI對ITS序列進行Blast分析。
1.3菌株致病性測定
將25株菌株分別接種于PDA培養基,28℃黑暗培養15 d。選用小麥濟南15作為接種寄主,待小麥長至4葉1心期,用接種針挑取離蠕孢菌,然后在小麥莖部刺傷接種。每個菌株接種20株小麥,不帶菌刺傷接種作負對照。接種后傷口處噴水以利于病菌侵染。將接種小麥放置于塑料箱體中,箱體頂部覆蓋塑料膜。光照條件為8 h光照16 h黑暗,相對濕度控制在80%左右。接種7 d后,統計發病植株數量,測量病斑長度,計算發病率和平均病斑長度。發病率(%)=發病植株數量/總接種植株數量×100,平均病斑長度=∑(每個接種植株的病斑長度)/總接種植株數量。
利用DPS 7.05軟件中的Duncans新復極差法對不同菌株的平均病斑長度進行顯著性差異分析,并采用UPGMA法對菌株致病力進行系統聚類分析。
2結果與分析
2.1菌株的形態學鑒定
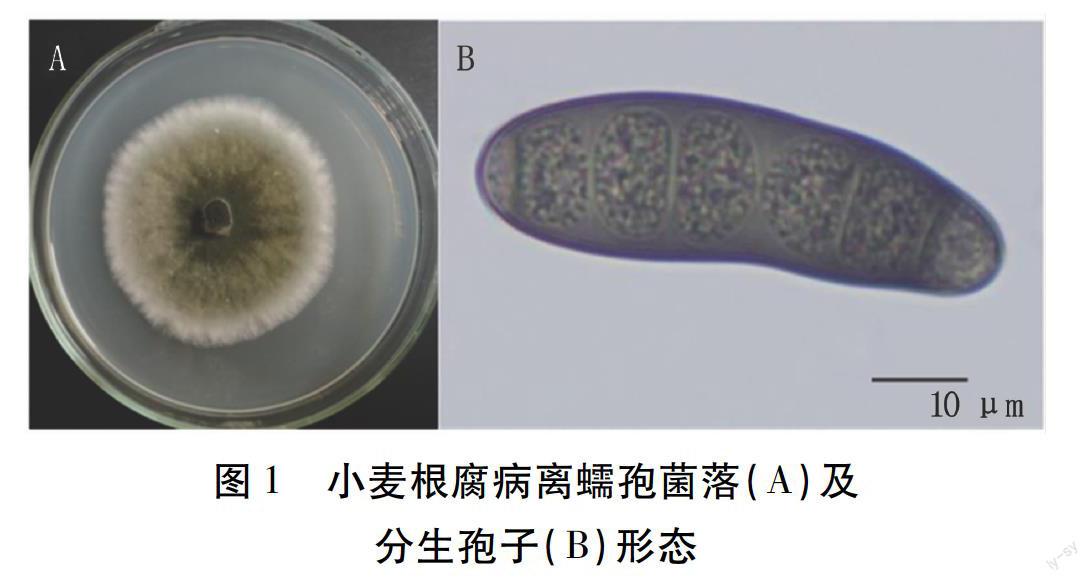
供試菌株在PDA培養基上28℃培養,菌落近圓形,深欖褐色,菌落邊緣菌絲白色,氣生菌絲生長繁茂,白色(圖1A)。鏡檢觀察,分生孢子梗細長,多隔膜,無分支,上部呈屈膝狀彎曲。分生孢子多細胞,具假隔膜,黑褐色,長梭形或紡錘形,直或彎曲,兩端漸細(圖1B)。初步確定,供試25個菌株為麥根腐離蠕孢[Bipolaris sorokiniana(Sacc.)Shoemaker],屬半知菌亞門離蠕孢屬真菌。
2.2菌株的分子鑒定
用通用引物ITS1F/ITS4R擴增得到一條約600 bp的條帶(圖2),測序結果顯示供試25個菌株的rDNA-ITS序列均為586 bp。在NCBI上進行Blast分析,結果表明,所有菌株的ITS序列均與GenBank中登錄號為KM066949.1的Bipolaris sorokiniana高度同源,同源性在99%以上。說明,25個菌株均為小麥根腐離蠕孢菌。同時,菌株間比對發現,ITS序列有99%以上都是一致的,由此看來,山東省不同地理來源的小麥根腐病離蠕孢菌在種內遺傳上是高度保守的。
2.3菌株致病力
供試麥根腐離蠕孢菌株接種7 d后調查發現,所有菌株接種發病率均為100%,說明25個菌株均有致病性。由圖3可以看出,這些菌株雖然都有致病性,但平均病斑長度有所不同,其中LL1菌株平均病斑長度最長,可達4.37 cm,而HY3菌株最小,僅為0.4 cm。顯著性水平分析結果表明,25個菌株致病力存在差異,說明,山東不同小麥根腐病離蠕孢菌株存在致病力分化現象。
對25個麥根腐離蠕孢菌株的致病力進行聚類分析,由圖4可以看出,大致可聚類為3個分支。第Ⅰ分支有CQ1、CQ2、HY1、HY3、HY6、CY2、CY4、HM3和ZF2共9個菌株,均為弱致病力菌株,占供試菌株的36%;第Ⅱ分支有6個菌株,分別是LL1、HY2、HY4、HY5、CY6和HM2,均為強致病力菌株,占供試菌株的24%;第Ⅲ分支為中等致病力菌株,共10個菌株,占供試菌株的40%。因此,山東小麥根腐病離蠕孢菌可分為強、中、弱3種致病力類型菌株,其中,中等致病力菌株占優勢。
此外,由圖4還可以看出,濰坊昌邑(CY)、德州惠民(HM)和煙臺海陽(HY)均有強、中、弱3種致病力類型的菌株,也就是說,同一地理來源的不同菌株致病力存在分化。同時,在同一致病力類型中,包含有來自不同地理來源的菌株。由此說明,小麥根腐病離蠕孢菌株的致病力強弱與菌株的地理來源沒有相關性。
3討論與結論
真核生物rDNA的18S、5.8S和28S序列高度保守,ITS是位于18S-5.8S-28S之間的非編碼轉錄間隔區,其在進化過程中承受的選擇壓力較小,相對進化速度較快,因此,ITS序列既具有保守性,又具有序列多態性,能夠有效地用于病原微生物的分類鑒定。本研究首先通過傳統形態學鑒定,對25個小麥根腐病菌株的菌落、分生孢子梗及分生孢子的形態進行觀察,初步確定均為麥根腐離蠕孢。進一步利用分子鑒定方法擴增其rDNA-ITS序列進行Blast比對分析,結果表明,所有菌株的ITS序列與登錄號為KM066949.1的Bipolaris sorokiniana同源性在99%以上,因此,這25個菌株被鑒定為小麥根腐離蠕孢菌,與形態學鑒定結果一致。張德珍等[5]也利用形態學鑒定方法和擴增ITS序列的分子鑒定方法,成功地對山東省小麥根腐病病原蠕孢菌進行了鑒定。
本研究通過刺傷接種法,將麥根腐離蠕孢接種于小麥幼苗,結果表明,25個小麥根腐病離蠕孢菌都有致病性,但存在致病力差異,可分為強、中、弱3種致病力類型,其中,中等致病力菌株為優勢菌,占總菌株數的40%。目前,普遍認為Bipolaris sorokiniana是一種致病性具有較高變異水平的真菌[7,8]。Jaiswal[7]、Aggarwal[9]等在研究中都發現,供試B.sorokiniana菌株均有致病性,但致病力有所不同,這與本研究結果一致。對于麥根腐離蠕孢易于變異的特點,Tinline[10]認為這是由B.sorokiniana的異核現象和準性循環造成的,同時,Chand等[8]研究還發現,有兩個細胞核的菌株致病力較強,其他致病力程度的菌株多為3~4個細胞核,因此他們認為,B.sorokiniana表現出的致病力多樣性可能與細胞核的不同組合有關。本研究還可以看出,在25個小麥根腐病離蠕孢菌株中,HY3菌株的致病力最弱,其侵染后的平均病斑長度僅有0.4 cm。因此,我們可以將該菌株作為一個抗性評價菌株,用于小麥根腐病的抗病育種研究。此外,我們還發現,采自同一地區的不同菌株的致病力存在差異,而屬于同一致病力類型的菌株也可以是來自不同地區,由此說明,山東省不同小麥根腐病離蠕孢菌株的致病力差異與其地理來源沒有相關性。又因麥根腐離蠕孢菌在致病性上有較高的變異性,故而增加了小麥根腐病的防治困難,因此,在生產上選用抗病品種、定期輪換品種是防治小麥根腐病的有效手段。
參考文獻:
[1]張慶平,李子欽,張建平,等. 國內外小麥根腐病研究概況[J]. 內蒙古農業科技,1996(4):7-11.
[2]Hill J P, Fernandez J A, McShane, M S. Fungi associated with common root rot of winter wheat in Colorado and Wyoming[J]. Plant Disease, 1983, 67: 795-797.
[3]袁淑芳. 小麥根腐病蠕形菌寄主范圍試驗[J]. 植物保護,1983(2):19.
[4]馮之杰,郭會芳,徐瑞福. 高產麥區小麥根腐病病原菌鑒定及綜合防治技術[C]//馬萬杰,原國輝,李洪連. 河南省植保學會第十次、河南省昆蟲學會第九次、河南省植病學會第四次會員代表大會暨學術討論會論文集. 洛陽:河南省植物保護學學會、河南省昆蟲學會、河南省植物病理學會出版,2013:12-14.
[5]張德珍,李鵬昌,陳曉霞,等.山東省小麥根腐病病原菌的分離鑒定[J]. 植物保護學報,2016,43(2):233-240.
[6]徐麗,陳新,魏海蓉,等. 核桃種質資源rDNA-ITS 序列分析[J]. 山東農業科學,2016,48(3):1-4.
[7]Jaiswal S K,Sweta, Prasad L C, et al.Identification of molecular marker and aggressiveness for different groups of Bipolaris sorokiniana isolates causing spot blotch disease in wheat (Triticumaestivum L.)[J]. Current Microbiology, 2007, 55: 135-141.
[8]Chand R, Pandey S P, Singh H V, et al. Variability and its probable cause in the natural populations of spot blotch pathogen Bipolaris sorokiniana of wheat (T.aestivum L.)in India[J]. Journal of Plant Diseases and Protection, 2003, 110: 27-35.
[9]Aggarwal R, Singh V B, Gurjar M S, et al. Intraspecific variations in Indian isolates of Bipolaris sorokiniana infecting wheat based on morphological,pathogenic and molecular characters[J]. Indian Phytopath, 2009, 62(4): 449-460.
[10]Tinline R D.Cochliobolus sativus: V. heterokayosis and parasexualtity[J]. Canadian Journal of Botany, 1962, 40: 425-437.

