直腸腺瘤性息肉混合神經(jīng)內(nèi)分泌癌1例報(bào)道
王 薇,付肖巖
福建省第二人民醫(yī)院內(nèi)鏡室,福建 福州 350003
個(gè)案報(bào)道
直腸腺瘤性息肉混合神經(jīng)內(nèi)分泌癌1例報(bào)道
王 薇,付肖巖
福建省第二人民醫(yī)院內(nèi)鏡室,福建 福州 350003
大腸息肉是大腸黏膜的常見(jiàn)病變,腺瘤性息肉被看作是癌前病變。結(jié)直腸神經(jīng)內(nèi)分泌癌是一類以神經(jīng)內(nèi)分泌細(xì)胞構(gòu)成的惡性腫瘤,臨床表現(xiàn)和生物學(xué)特性顯示高度惡性行為。腺瘤性息肉內(nèi)同時(shí)發(fā)現(xiàn)神經(jīng)內(nèi)分泌癌非常少見(jiàn)。應(yīng)根據(jù)腫瘤大小及生物學(xué)特性來(lái)選擇不同的治療方案。
腺瘤性息肉;神經(jīng)內(nèi)分泌癌;電子結(jié)腸鏡
病例 患者,男,61歲,農(nóng)民。既往史無(wú)特殊。因常規(guī)體檢于我院腸鏡檢查發(fā)現(xiàn):直腸距肛門(mén)10 cm見(jiàn)一大小約2.5 cm寬基息肉樣病變,表面呈分葉狀(見(jiàn)圖1),遂于腸鏡下行直腸息肉內(nèi)鏡下黏膜切除術(shù)(endoscopic mucosal resection,EMR),術(shù)后收住消化內(nèi)科。入院后查癌胚抗原定量:14.41 ng/ml,余正常。術(shù)后病理(我院及福建省腫瘤醫(yī)院病理會(huì)診):(距肛門(mén)10 cm)管狀腺瘤,灶性高級(jí)別上皮內(nèi)瘤變(黏膜內(nèi)癌變)。另見(jiàn)小塊腫瘤組織示神經(jīng)內(nèi)分泌癌改變,侵犯黏膜下層(見(jiàn)圖2)。IHC:CK7-,CK20-/+,CDX-/+(neuroendocrine carinama,NEC),CgA-,Syn+,CD56+,Ki67 70%陽(yáng)性(見(jiàn)圖3~4)。
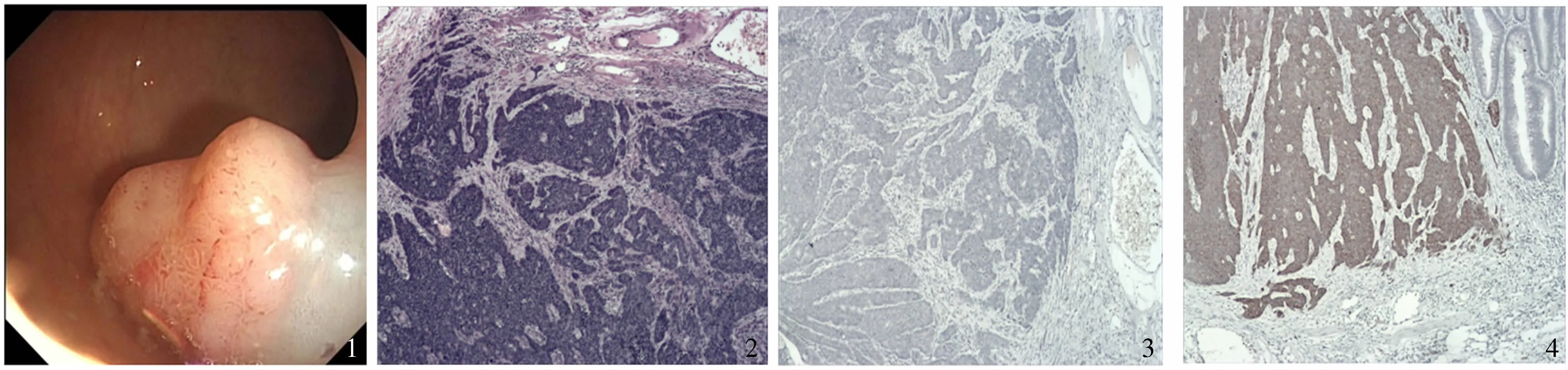
圖1 內(nèi)鏡下所見(jiàn);圖2 NEC(HE 10×);圖3 CgA-(10×);圖4 Syn+(10×)Fig 1 Endoscopic view; Fig 2 Neuroendocrine carcinoma; Fig 3 CgA-(10×);Fig 4 Syn+(10×)
雖然病理報(bào)告切緣未見(jiàn)癌細(xì)胞,且尚未突破黏膜下層。但考慮該病變>2 cm,且NEC常顯示高度惡性的生物學(xué)行為,經(jīng)患者及其家屬同意后轉(zhuǎn)外科行直腸癌根治術(shù)。術(shù)前查全腹CT平掃后多期增強(qiáng)掃描+多平面重建:(1)直腸未見(jiàn)明顯充盈,多期增強(qiáng)。直腸壁左側(cè)壁見(jiàn)局灶性強(qiáng)化灶,大小約2.2 cm×1.6 cm,CT值45~75 Hu,管周未見(jiàn)明顯腫大淋巴結(jié)影。直腸征象符合直腸癌。(2)肝內(nèi)多發(fā)異常強(qiáng)化灶(肝動(dòng)脈期)擬良性病灶-小血管瘤可能。
患者在氣管插管全身麻醉下行“腹腔鏡下直腸癌根治術(shù)+預(yù)防性回腸造瘺術(shù)”。術(shù)中見(jiàn):腹腔內(nèi)無(wú)腹水,肝臟暗紅色,無(wú)明顯硬化表現(xiàn),盆腔、腸系膜未見(jiàn)明顯轉(zhuǎn)移結(jié)節(jié)。直腸距肛門(mén)口約10 cm處見(jiàn)一大小約1 cm×1 cm×1 cm病變向腸腔生長(zhǎng),質(zhì)硬,邊界尚清楚,未侵及漿膜層,腸周未觸及腫大淋巴結(jié),術(shù)中診斷:直腸類癌(見(jiàn)圖5)。
術(shù)后病理:“直腸切除標(biāo)本”示:大腸管狀腺瘤伴高級(jí)別上皮內(nèi)癌變,局部見(jiàn)大細(xì)胞NEC(腫物大小0.33 cm×0.25 cm),侵及黏膜下層。上、下切端未見(jiàn)癌細(xì)胞浸潤(rùn)。腸周系膜內(nèi)淋巴結(jié)(0/2)見(jiàn)癌細(xì)胞轉(zhuǎn)移(見(jiàn)圖6)。PTNM分期:T1aN0Mx。根據(jù)術(shù)后病理結(jié)果,目前診斷:(1)大腸管狀腺瘤伴高級(jí)別上皮內(nèi)癌變(T1aN0Mx);(2)大細(xì)胞NEC明確。建議患者出院后進(jìn)行定期隨訪。
討論 大腸息肉是大腸黏膜的常見(jiàn)病變,好發(fā)部位以直腸、乙狀結(jié)腸為最多。一般認(rèn)為絕大部分大腸癌起源于腺瘤,故將大腸腺瘤性息肉看作是癌前病變。腺瘤發(fā)生癌變的概率與腺瘤大小、病理類型、不典型增生程度及大體形狀有關(guān)。一般>2 cm、絨毛狀腺瘤、高級(jí)別上皮內(nèi)瘤變、廣基腺瘤癌變的概率較大。大腸腺瘤屬于上皮內(nèi)瘤變,以細(xì)胞的不典型增生為特征,依據(jù)組織結(jié)構(gòu)和細(xì)胞學(xué)的異型性可分為低級(jí)別上皮內(nèi)瘤變(Ⅰ級(jí)腺瘤和Ⅱ級(jí)腺瘤)和高級(jí)別上皮內(nèi)瘤變(Ⅲ級(jí)腺瘤和“原位癌”)。本例患者腸鏡下EMR切除后病理報(bào)告“管狀腺瘤,灶性高級(jí)別上皮內(nèi)瘤變(黏膜內(nèi)癌變)”,屬于TNM分級(jí)中的Tis(原位癌)。而手術(shù)后病理報(bào)告為T(mén)1aN0M0(黏膜下層癌)。二者均屬于早期結(jié)直腸癌。臨床上大腸息肉為常見(jiàn)病及多發(fā)病變,而在腺瘤性息肉內(nèi)同時(shí)發(fā)現(xiàn)NEC則非常少見(jiàn)。
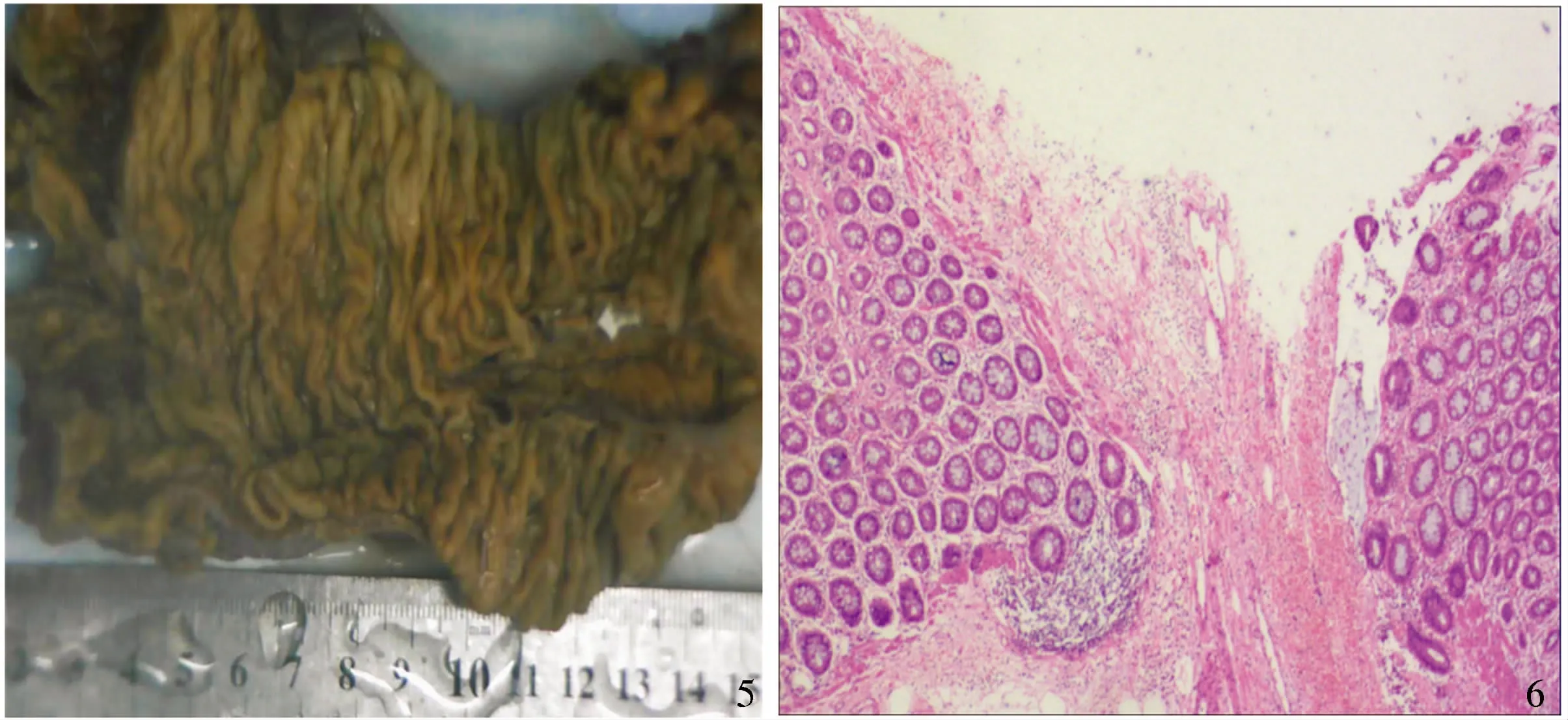
注:白色箭頭所示為病灶。圖5 手術(shù)大體標(biāo)本;圖6 術(shù)后病理(HE 10×)Fig 5 Surgical gross; Fig 6 Postoperative pathology (HE 10×)
世界衛(wèi)生組織WHO(2010)消化系統(tǒng)腫瘤分類[1]認(rèn)為神經(jīng)內(nèi)分泌腫瘤為高分化腫瘤,組織學(xué)分級(jí)為G1或G2,其中G1相當(dāng)于以前的類癌;NEC組織學(xué)分級(jí)為G3,屬于低分化高級(jí)別惡性腫瘤,包括小細(xì)胞NEC、大細(xì)胞NEC和低分化NEC;混合性腺神經(jīng)內(nèi)分泌癌(mixed adeno-neuroendocrine carcinoma,MANEC)可見(jiàn)腺上皮和神經(jīng)內(nèi)分泌成分,每種成分均>30%,相當(dāng)于之前的混合性外分泌-內(nèi)分泌癌,具有神經(jīng)內(nèi)分泌分化和腸道腺癌的免疫表型。按上述分類標(biāo)準(zhǔn),本病例屬于上述分類中的G3大細(xì)胞NEC。結(jié)直腸NEC是一類以神經(jīng)內(nèi)分泌細(xì)胞構(gòu)成的惡性腫瘤,以具有獨(dú)特的激素合成和分泌功能以其分化差、侵襲性強(qiáng)、轉(zhuǎn)移早等惡性潛能而逐漸為人們所重視[2]。消化道NEC在臨床表現(xiàn)和生物學(xué)特性顯示高度惡性行為,常有局部或全身轉(zhuǎn)移,即使經(jīng)過(guò)化療預(yù)后也不佳。結(jié)腸鏡檢查對(duì)于結(jié)直腸NEC患者非常重要。不僅可以明確腫瘤部位、大小、形狀,還可以進(jìn)行活組織檢查定性診斷。Bernick等[3]報(bào)道術(shù)前活檢可以對(duì)59.3%的患者做出正確診斷。
與上皮性起源的消化道癌一樣,消化道NEC預(yù)后的根本問(wèn)題在于早期診斷與早期治療。除了常規(guī)檢查以外,內(nèi)鏡檢查是消化道NEC首選,可定位又可活檢做定性診斷。血清學(xué)上可查腫瘤標(biāo)記物如癌胚抗原(CEA)、甲胎蛋白(AFP)、糖類抗原(CA199)等作為篩查消化道NEC的診斷和隨訪評(píng)估手段。神經(jīng)內(nèi)分泌細(xì)胞及腫瘤中已證實(shí)廣泛存在嗜鉻素(CgA)和突觸素(Syn),是目前診斷NEC最常用的特異性標(biāo)志物[4]。免疫組化如CgA染色、Syn染色、神經(jīng)元特異性烯醇化酶(NSE)染色等是最常用的方法。本例患者CgA陰性,Syn陽(yáng)性。
Kim等[5]指出內(nèi)鏡切除小類癌(<1.0 cm)是有效的,且即使切緣陽(yáng)性也可繼續(xù)行直腸切除術(shù),而對(duì)于直徑為1.0~2.0 cm的腫瘤推薦行直腸切除術(shù)。本例對(duì)腫瘤進(jìn)行了EMR治療,病理報(bào)告可見(jiàn)NEC組織,追加了外科手術(shù)治療。治療消化系NEC最理想的方法是根治性手術(shù)。依據(jù)腫瘤的大小、部位、浸潤(rùn)深度、有無(wú)淋巴結(jié)和遠(yuǎn)處轉(zhuǎn)移等情況而選擇手術(shù)方法。術(shù)后輔助化療是控制和消滅殘存及微小轉(zhuǎn)移灶的重要措施。生物治療能夠有效改善NEC癥狀。其中放射性核素標(biāo)記生長(zhǎng)抑素類似物治療是進(jìn)行定向治療的新方法。該方法利用治療劑量的放射性核素與腫瘤表面特異性受體相結(jié)合,到達(dá)導(dǎo)向腫瘤部位從而達(dá)到治療目的[6]。
[1]Bosman FT,Cameiro F,Hruban RH,et al.WHO classification of tumours of the digestive system [M].Lyon:IARC Press,2010: 126-128.
[2]Staten ED,Gould VE,Warren WH,et al. Neuroendocrine carcinomas of the colon and rectum: a clinicopathologic evaluation [J]. Surgery,1988,104(6): 1080-1089.
[3]Bernick PE,Klimstra DS,Staren ED,et al. Neuroendocrine carcinomas of the colon and rectum [J]. Dis Colon Rectum,2004,47(2): 163-169.
[4]Ferolla P,Faggiano A,Mansueto G,et al. The biological characterization of neuroendocrine tumors: the role of neuroendocrine markers [J]. J Endoerinol Invest,2008,31(3): 277-286.
[5]Kim YJ,Lee SK,Cheon JH,et al. Efficacy of endoscopic resection for small rectal carcinoid: a retrospective study [J]. Korean J Gastroenterol,2008,51(3): 174-180.
[6]Modlin IM,Kidd M,Drozdov I,et al. Pharmacotherapy of neuroendocrine callcers [J]. Expert Opin Pharmacother,2008,9(15): 2617-2626.
(責(zé)任編輯:王豪勛)
Mixed neuroendocrine carcinoma and rectal adenoma polyps: one case report
WANG Wei,FU Xiaoyan
Department of Endoscopy,the Second People’s Hospital of Fujian Province,Fuzhou 350003,China
Colorectal polyps are the common pathological changes in the large intestine mucosa,and adenoma polyp is considered as a precancerous lesion. Colorectal neuroendocrine carcinoma is malignant tumor composed of neuroendocrine cells,which show a high degree of malignant behavior in clinical expression and biological characteristics. It’s rare to find neuroendocrine carcinoma expression and adenoma polyp at the same time. Different treatments should be selected according to tumor size and biological characteristics.
Adenoma polyp; Neuroendocrine carcinoma; Electronic colonoscopy
10.3969/j.issn.1006-5709.2016.02.033
王薇,副主任醫(yī)師,E-mail: 50525475@qq.com
R735.3
B
1006-5709(2016)02-0239-02
2014-03-18

