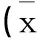ABCC2-24C>T基因多態性對中國癲癇患者卡馬西平劑量和血藥濃度的影響
李銀英 張濤志
鄭州大學第二附屬醫院 鄭州 450014
?
ABCC2-24C>T基因多態性對中國癲癇患者卡馬西平劑量和血藥濃度的影響
李銀英張濤志
鄭州大學第二附屬醫院鄭州450014
【摘要】目的觀察ABCC2-24C>T基因多態性對中國漢族癲癇患者卡馬西平維持劑量和血藥濃度的影響。方法以179例卡馬西平單藥治療3月以上的中國漢族癲癇患者為研究對象,應用聚合酶鏈反應-限制性片段長度多態性(PCR-RFLP )方法分析患者的-24C>T多態性;同時應用HPLC法測定卡馬西平的穩態血藥濃度。結果ABCC2-24C>T 三種基因型卡馬西平的維持劑量有顯著性差異,CC基因型攜帶者明顯高于TT基因型攜帶者(P<0.05)。-24C>T變異后血藥濃度有增加的趨勢,即CC
【關鍵詞】卡馬西平;癲癇;ABCC2;單核苷酸多態性
卡馬西平(carbamazepine,CBZ)是臨床上常用的一線抗癲癇藥物,應用廣泛。但其治療窗窄且機體對該藥物的反應個體差異大。基因多態性可導致藥物療效產生個體差異,是實現個體化治療的基礎核心要素。目前,公認藥物轉運體P-gp和MRP2在抗癲癇藥物的體內轉運中發揮重要作用,能夠組成血腦屏障,限制藥物或異物通過血腦屏障[1]。已有實驗證實,大鼠體內MRP2被抑制后,其腦內卡馬西平血藥濃度顯著增加,而MRP2編碼基因ABCC2的多態性亦可影響MRP2的表達和功能[2-3]。近年來的研究發現,ABCC2基因存在眾多單核苷酸多態性位點,其中,C-24T(啟動子區)在中國人群中的變異頻率較高,且與MRP2的轉運功能相關[4]。目前,尚未見C-24T多態性對卡馬西平血藥濃度和療效相關性的研究報道。本研究探討ABCC2-24C>T基因多態性對中國癲癇患者卡馬西平血藥濃度的影響,以期為臨床個體化用藥提供依據。
1資料與方法
1.1研究對象179例患者均來自2010-11—2014-12鄭州大學第二附屬醫院神經內科門診,男97例,女82例;平均年齡(32.2±15.7)歲;平均體質量(56.04±11.39)kg;平均病程(3.65±7.31)a。入組標準:經臨床醫生結合患者的臨床表現、腦電圖和影像學檢查(MRI或CT)確診為癲癇,并按照1981年國際抗癲癇聯盟(International League Against Epilepsy,ILAE)關于發作分類診斷標準確定發作類型;正規、單用抗癲癇藥物卡馬西平,并使用該劑量維持3個月以上;自愿參加實驗并簽署知情同意書。排除標準:嚴重不良反應;藥物依從性差;患進行性或退行性全身性疾病或中樞神經系統疾病;患器質性腦病,如腦部腫瘤;服用以下任何藥物之一:抗腫瘤藥物、細胞毒性藥物、類固醇化合物、鈣離子拮抗劑、酚噻嗪類藥物、抗生素等;有酒精或藥物濫用史;嚴重肝、腎功能不全患者。
1.2方法
1.2.1血樣采集:所有患者早上服藥前采集外周靜脈血2份,每份2 mL,1份檢測血藥濃度,另1份EDTA抗凝,用于基因組DNA提取。
1.2.2卡馬西平血藥濃度的測定:血樣離心后取上層血漿,采用HPLC法測定卡馬西平血藥濃度。為消除劑量、體質量對血藥濃度的影響,將測定的穩態血藥濃度除以患者每日每公斤體質量的藥量(血藥濃度/體質量劑量)使血藥濃度標準化。
1.2.3基因組DNA 提取:應用血液基因組DNA提取試劑盒(北京天根科技有限公司),根據說明書步驟提取血液基因組DNA,-20℃冰箱保存備用。
1.2.4ABCC2-24C>T多態性分析:該位點多態性的分析采用限制性酶切片段長度多態性(PCR-RFLP)技術。 PCR擴增反應引物序列:上游引物5′- CTG TTC CAC TTT CTT TGA TGA -3′,下游引物 5′- TCT TGT TGG TGA CCA CCC TAA-3′。PCR反應體系:DNA模板2 μL,2×Taq PCR Master Mix 聚合酶12.5 μL,上下游引物各加入2 μL(10 pmol),最后加超純水至25 μL。PCR反應條件為95 ℃預變性12 min,然后93 ℃變性30 s,55 ℃退火35 s,72 ℃延伸30 s,循環35次,最后72 ℃延伸5 min,4 ℃保存。PCR擴增的目的片段長度為211 bp。PCR產物用限制性內切酶BpiI進行酶切,酶切反應體系:1 μL內切酶BpiI,2 μL 10×Buffer,7 μL PCR產物和10 μL超純水,置37 ℃水浴4~16 h。
1.2.5瓊脂糖凝膠電泳:取7 μL酶切產物加入4%的瓊脂糖凝膠負極加樣孔,以gene finder為染色劑, 0.5×TBE液為電泳液,在100 V電壓下電泳30 min,于凝膠成像系統中觀察條帶。
1.3統計分析應用SPSS 16.0軟件進行統計分析,計量資料均采用均數±標準差表示,比較前先進行正態分布和方差齊性檢驗。2組計量資料間比較采用t檢驗,3組計量資料間比較采用方差分析,組內兩兩比較采用LSD法。以χ2檢驗檢測等位基因和基因型分布是否符合Hardy-Weinberg平衡。P<0.05為差異有統計學意義。
2結果
2.1基因型分析采用DNA 限制性片段長度多態性(RFLP)分析基因型,其中,ABCC2 -24C/C基因型樣本應該觀察到56 bp和155 bp 2個條帶;而T/C基因型樣本則應該觀察到211 bp、56 bp和155 bp 3條帶;T/T基因型樣本只能觀察到211 bp 1個條帶。判斷基因型的電泳圖見圖1。此外,通過擴增產物直接測序驗證分析方法的可靠性,測序圖見圖2。

條帶L為DNA maker,條帶1.2表示T/T基因型,條帶3.4表示C/C基因型,條帶5.6表示T/C基因型
圖1ABCC2-24C>T基因多態性分型結果
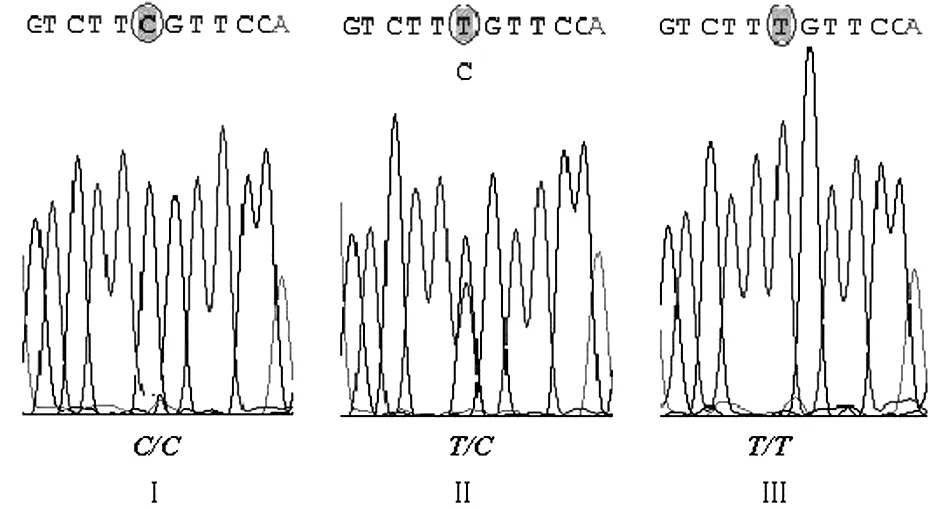
圖Ⅰ:C/C基因型測序圖圖Ⅱ:T/C基因型測序圖圖Ⅲ:T/T基因型測序圖
圖2ABCC2基因-24C>T多態性位點測序圖
2.2等位基因和基因型分布ABCC2-24C>T分型成功的179例,C/C型108例,C/T型65例,T/T型6例,T等位基因的頻率為21.5%。經χ2檢驗,ABCC2-24C>T等位基因和基因型分布符合Hardy-Weinberg平衡(P>0.05)
2.3血藥濃度與基因型的關系179例患者卡馬西平的平均服藥劑量為(551±171)mg/d,平均血藥濃度為(5.94±1.61)mg·L-1。校正后的平均標準化濃度為(0.24±0.056) kg/L。血藥濃度和維持劑量/體質量(Dose/Weight)無相關性(r=0.583,P>0.05)。
ABCC2-24C>T 三種基因型卡馬西平的維持劑量有顯著性差異(P<0.05),TT>CT> CC,且CC基因型攜帶者明顯高于TT基因型攜帶者(P<0.05)。-24C>T變異后血藥濃度有增加的趨勢,即CC 表1 ABCC2-24C>T各基因型癲癇患者間卡馬西平的維持劑量、血藥濃度比較±s) 3討論 癲癇是一種常見的多病因引起的反復發作性的慢性腦部疾患,在神經科的發病率僅次于腦血管疾病,既是常見病,更是我國目前的重大疾病之一。臨床上主要通過規范服用抗癲癇藥物控制發作。其中卡馬西平是目前使用率最高的抗癲癇藥物,可作為首選藥物用于多種癲癇發作類型。雖然卡馬西平療效肯定、應用廣泛,但其治療窗窄且血藥濃度、療效存在明顯的個體化差異。遺傳藥理學研究表明,藥物代謝酶或轉運體編碼基因的變異可能是造成藥物療效產生個體差異的原因之一。 國外研究表明,卡馬西平為MRP2的轉運底物,而MRP2編碼基因ABCC2單核苷酸多態性能夠影響卡馬西平在體內的轉運[5-7]。研究顯示,ABCC2 c.1249G>A (417V>I)突變能夠減少CBZ在細胞膜上的轉運,最終導致CBZ中樞神經系統的不良反應發生增多[6]。另一項研究也證實,417I攜帶者卡馬西平的轉運能力低于野生型攜帶者[7]。而ABCC2 c.-24C>T(rs717620) 是近年來發現的在中國人群中變異頻率較高的位點。研究表明,ABCC2-24C>T變異后MRP2的轉運活性降低,CT或TT型基因攜帶者依立替康的AUC0-∞略高于野生型基因攜帶者[8]。最近的研究顯示,ABCC2-24C>T能顯著增加甲氨喋呤的血藥濃度,T 等位基因攜帶者甲氨喋呤的血藥濃度明顯高于是CC型基因攜帶者,甚至引起患者出現毒性反應[9]。本研究顯示,-24C>T變異后血藥濃度有增加的趨勢,即CC 總之,本研究首次在中國漢族癲癇患者中研究了ABCC2-24C>T單核苷酸多態性對卡馬西平維持劑量和藥物濃度的影響,為卡馬西平治療方案優化和癲癇患者個體化給藥提供了有價值的信息。但如其他藥物基因組學的研究一樣,由于不同研究者入選患者和樣本量的不同,研究結果常常不一致,因此本研究需要更大的樣本量驗證研究結果。 4參考文獻 [1]Miller DS,Graeff C,Droulle L,et al.Xenobiotic efflux pumps in isolated fish brain capillaries[J].Am J Physiol,2002,282(1):R191-198. [2]Potschka,PedrowitznM,Loscher W.P-glycoprotein and multidrug resistance- associated protein are involved in the regulation of extracellular levels of the major antiepileptic drug carbamazepine in brain [J].N euroreport,2001,12(16):3 557-3 560. [3]Loscher W,Potschka H.Role of multidrug transporters in pharmacoresistance to antiepileptic drugs[J].J Pharmacol Exp Ther,2002,301(1):7-14. [4]Qu J,Zhou BT,Yin JY,et al.ABCC2 polymorphisms and haplotype are associated with drug resistance in Chinese epileptic patients[J].CNS Neurosci Ther, 2012,18(8):647-651. [5]Schmidt D,Loscher W.Drug resistance in epilepsy:putative neurobiologic and clinical mechanisms[J].Epilepsia,2005,46(6):858-877. [6]Kim WJ,Lee JH,Yi J,et al.A nonsynonymous variation in MRP2/ABCC2 is associated with neurological adverse drug reactions of carbamazepine in patients with epilepsy[J].Pharmacogenet Genomics,2010,20(4):249-256. [7]Puranik YG,Birnbaum AK,Marin SE,et al.Association of carbamazepine major metabolism and transport pathway gene polymorphisms and pharmacokinetics in patients with epilepsy[J].Pharmacogenomics,2013,14(1):35-45. [8]Zhou Q,Sparreboom A,Tan EH,et al.Pharmacogenetic profiling across the irinotecan pathway in Asian patients with cancer[J].Br J Clin Pharmacol,2005,59(4):415-424. [9]Liu Y,Yin Y,Sheng Q,et al.Association of ABCC2-24C>T Polymorphism with High-Dose Methotrexate Plasma Concentrations and Toxicities in Childhood Acute Lymphoblastic Leukemia[J].PLoS One,2014,9(1):e82681. [10]Subenthiran S,Abdullah NR,Joseph JP,et al.Linkage Disequilibrium between Polymorphisms of ABCB1 and ABCC2 to Predict the Treatment Outcome of Malaysians with Complex Partial Seizures on Treatment with Carbamazepine Mono-Therapy at the Kuala Lumpur Hospital[J].PLoS One,2013,8(5):e64827. [11]Ufer M,Mosyagin I,Muhle H,et al.Non-response to antiepileptic pharmacotherapy is associated with the ABCC2 -24C>T polymorphism in young and adult patients with epilepsy[J].Pharmacogenet Genomics,2009,19(5):353-362. (收稿 2015-07-14) 【中圖分類號】R742.1 【文獻標識碼】A 【文章編號】1673-5110(2016)08-0075-03