HPGPC檢測固定化腸膜明串珠菌產葡聚糖的研究
王清,劉濤,陳山(.信陽農林學院食品學院,河南信陽464000;2.廣西大學糖業工程技術研究中心,廣西南寧530004)
?
HPGPC檢測固定化腸膜明串珠菌產葡聚糖的研究
王清1,劉濤1,陳山2,*
(1.信陽農林學院食品學院,河南信陽464000;2.廣西大學糖業工程技術研究中心,廣西南寧530004)
摘要:葡聚糖是蔗糖經腸膜明串珠菌發酵所得產物,經水解純化處理后具有一定分子量且均一度較高的小分子葡聚糖(又叫右旋糖酐)是國際公認的優質代用血漿。然而現行右旋糖酐制備工藝較難達到醫藥臨床的相關要求,因此,探索能定向合成特定分子量分布右旋糖酐的新途徑,具有十分明顯的現實意義和理論價值。通過HPGPC在線檢測固定化腸膜明串珠菌發酵產物——葡聚糖的重均分子量,發現可通過固定化技術實現對腸膜明串珠菌發酵產物的分子量控制;并且發現在相同發酵時間內,固定化菌發酵產生的葡聚糖含量比游離菌發酵略多;固定化菌發酵產生的葡聚糖重均分子量比游離菌發酵產生的葡聚糖重均分子量低。
關鍵詞:固定化;腸膜明串珠菌;葡聚糖;HPGPC
低分子量的右旋糖酐具有較優良的藥用價值,具有一定分子量分布且均一度較高的右旋糖酐是國際公認的優質人工血漿制品及器官保護劑[1],右旋糖酐40、右旋糖酐70已被收入到我國農村牧區合作醫療基本藥物目錄[2],右旋糖酐70在臨床上常被用作代用血漿[3]。目前,葡聚糖的制備多是通過含高濃度蔗糖的培養基經微生物發酵而成,由于發酵過程難以控制,所得產物分子量很大,需再采用酸水解和乙醇分級沉淀的方法來實現葡聚糖的分離提純[4]。該方法不僅乙醇用量大,而且耗時長、難控制,并且由于菌體與產物的纏繞,使菌體產物分離不徹底,從而降低了葡聚糖的質量[5]。在制備過程中引入固定化技術,能使菌體和產物得以有效分離,因此,固定化技術成為當前葡聚糖生產的熱點。
本試驗通過使用HPGPC(高效凝膠過濾色譜)在線檢測培養基中固定化腸膜明串珠菌的發酵產物——葡聚糖的分子量分布情況,并與游離菌發酵產物的HPGPC譜圖對比,找出兩者異同點,探索固定化腸膜明串珠菌生物合成葡聚糖過程的一些規律,為發酵合成葡聚糖過程的控制及定向合成特定分子量分布的右旋糖酐的研究提供基礎數據。
1 材料與方法
1.1試劑與設備
海藻酸鈉、CaCl2、NaCl、葡聚糖標準品(Mw范圍為667~778 000)、超純水、蔗糖、KH2PO4、Na2HPO4、蛋白胨、5 mL無菌注射器、超凈工作臺、恒溫培養振蕩器、蒸汽滅菌器、離心機、TSK凝膠柱、Agilent G1362A示差折光檢測器。
1.2方法
1.2.1培養基
培養基為蔗糖130 g、KH2PO40.3 g、Na2HPO41.4 g、蛋白胨2.0 g、蒸餾水1 000 mL、pH 7.0~7.2。
1.2.2HPGPC色譜條件
Agilent 1100液相系統;示差折光檢測器(Agilent G1362A);色譜柱為TSK-4000PW凝膠柱,TSK-3000SW凝膠柱,TSK-Guard SW保護柱;以超純水作為流動相,流速為0.8 mL/min;檢測溫度為25℃。
Hello Time 2 sec Max Age 20 sec Forward Delay 15 sec
1.2.3標準曲線的繪制
準確稱取一定量的葡聚糖標準品,配制成系列標準溶液,每個標準品的進樣量為10 μL,測得每個標準品譜圖的最高峰的洗脫體積,記為Vp,繪制Vp-lgMw曲線。
1.2.4HPGPC檢測固定化菌發酵的過程研究
于冰箱中取出斜面一支,平板劃線,挑取長勢好的單菌落,接入種子培養液,種子培養20 h后按2%接種量接入增殖培養基進行擴大培養,培養24 h后,10 000 r/min離心20 min,獲得離心管底部菌體,將菌體懸浮于100 mL生理鹽水,吸取5 mL生理鹽水菌懸液,與一定濃度海藻酸鈉充分混勻后滴制成固定化菌,接種于液體培養基,于恒溫培養振蕩器中25℃,150 r/min培養。
每隔一定時間,用無菌槍頭取樣,10 000 r/min離心10 min,吸取上清液,稀釋至20倍,過0.45微濾膜,制成待測樣品,用HPGPC檢測其體系分子量變化情況,以反映固定化菌的發酵過程。
1.2.5固定化菌發酵與游離菌發酵的對比
在其他條件完全相同的條件下,按5%的接種量分別接種固定化菌和游離菌到100 mL相同的發酵培養基中,于恒溫培養振蕩器中25℃,150 r/min培養。
2 結果與分析
2.1標準曲線的繪制
通過HPGPC數據分析軟件進行數據分析,繪制標準曲線,以lgMw為縱坐標,以Vp為橫坐標,如圖1所示。
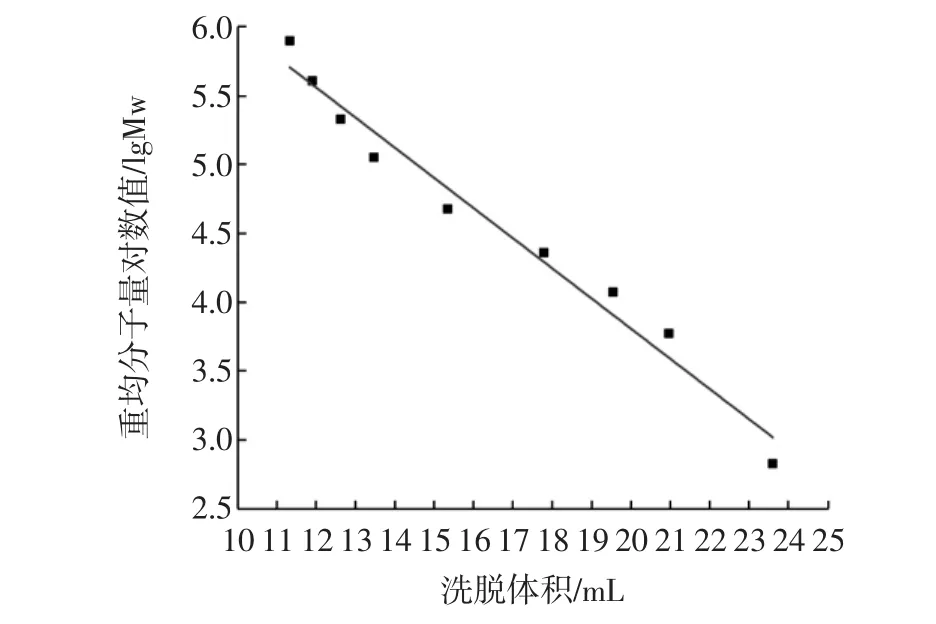
圖1 葡聚糖分子量標準曲線Fig.1 Standard calibration of dextran with molecular weight
其線性回歸方程為:
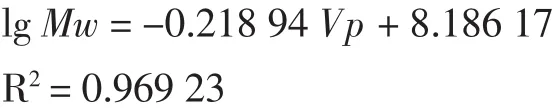
2.2固定化菌在液體培養基中發酵產物的HPGPC檢測
將未接種菌體的液體培養基按照上述方法制成HPGPC進樣樣品,作為空白對照,其譜圖如圖2所示。
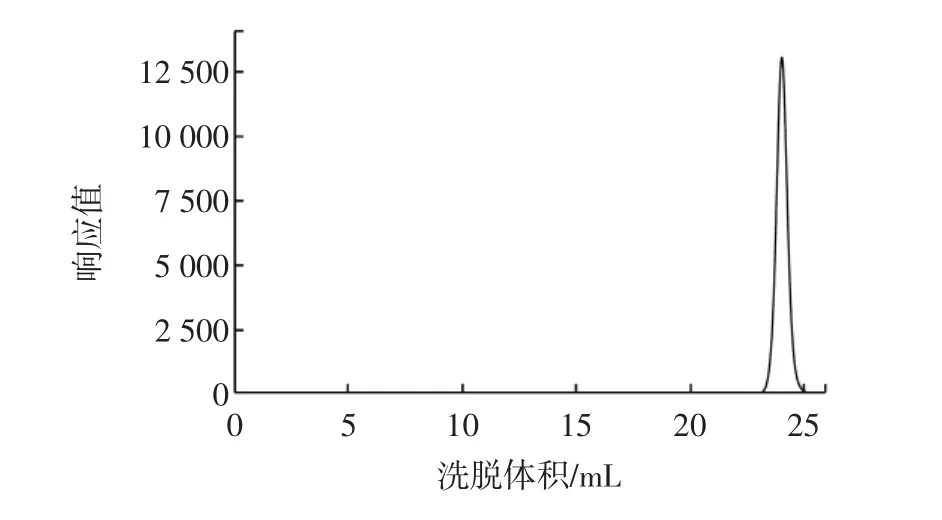
圖2 空白樣的HPGPC譜圖Fig.2 The HPGPC chromatogram of the blank
根據蔗糖純品出峰位置判斷,在該處出峰的物質為體系中所含的蔗糖。空白樣中其他物質在此柱條件下未被檢出,可排除液體培養基本身所含物質對出峰體系的干擾。
制作固定化菌,按5%接種量接種于培養基,分別于19、31、144 h取樣后制成HPGPC進樣樣品,其HPGPC譜圖疊加圖如圖3所示。
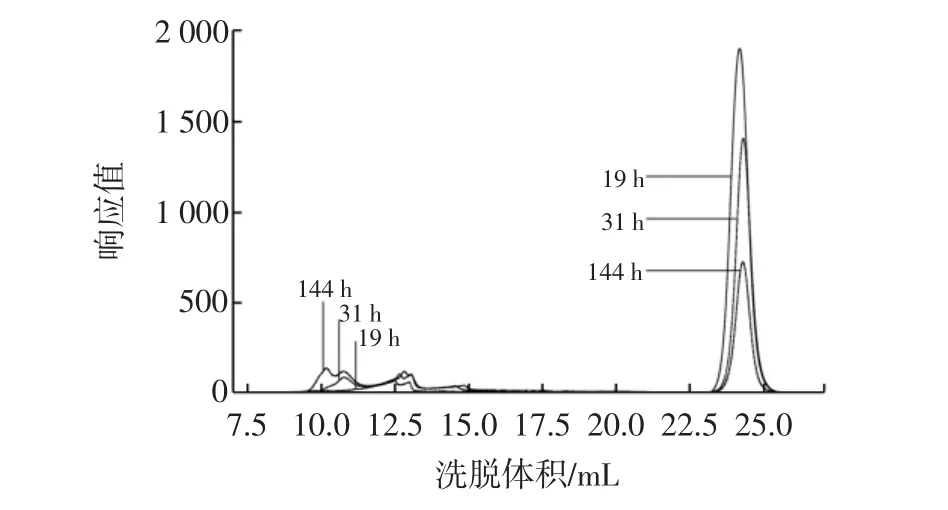
圖3 固定化菌發酵19、31、144 h樣品的HPGPC譜圖疊加圖Fig.3 The overlay HPGPC chromatogram of fermentation of immobilized bacteria after 19,31 h and 144 h
由圖3可以看出,隨著發酵時間的延長,后面的蔗糖峰峰高和峰面積在逐漸減小,前面的大分子峰在逐漸前移,說明在反應過程中,蔗糖被逐漸消耗,葡聚糖產物逐漸合成。
考慮到每個樣品的葡聚糖出峰的洗脫體積都落在8mL~16mL區間范圍內,故對出峰洗脫體積在8mL~16 mL之間的葡聚糖峰疊加部分著重研究,通過GPC分析軟件及標準曲線對其進行分子量分析可知:
19h時體系中葡聚糖的平均出峰時間為16.165min,平均峰高為122.9,重均分子量為578 920;31 h時體系中葡聚糖的平均出峰時間為15.210 min,平均峰高為99.07,重均分子量為780 990;144 h時葡聚糖出峰的平均出峰時間為14.507 min,平均峰高為99.35,重均分子量為1 720 000。由此可以看出,通過控制發酵時間可以在一定程度上控制葡聚糖合成產物的重均分子量。
2.3固定化菌發酵和游離菌發酵的HPGPC檢測與對比
將固定化菌按5%接種量接種于培養基,分別于31、55、120 h取樣,制成HPGPC進樣樣品,其HPGPC譜圖疊加圖如圖4所示。
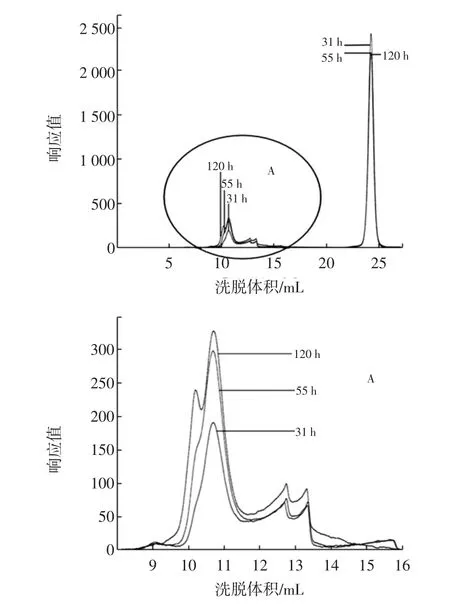
圖4 固定化菌在培養基中發酵31、55 h和120 h的HPGPC譜圖疊加圖Fig. 4 The overlay HPGPC chromatogram of fermentation of immobilized bacteria after 31,55 h and 120 h in culture medium
對出峰洗脫體積在8 mL~16 mL之間的葡聚糖峰疊加部分著重研究,見圖4中的A圖。通過GPC分析軟件及標準曲線對其進行分子量分析可知,31、55、120 h體系中產生的葡聚糖的出峰時間分別為:13.374、13.367、13.070 min,峰高分別為:196.5、302.9、336.9,重均分子量分別為:1 419 500、1 575 600、1 651 800。
將游離菌按5%接種量接種于液體培養基,分別于31、55、120 h取樣,制成HPGPC進樣樣品,圖5為其HPGPC譜圖疊加圖。
對出峰洗脫體積在8 mL~16 mL之間的葡聚糖峰疊加部分著重研究,見圖5中的B圖。通過GPC分析軟件及標準曲線對其進行分子量分析可知,31、55、120 h體系中產生的葡聚糖的出峰時間分別為:14.049、12.744、12.679 min,峰高分別為:268.0、153.8、139.2,重均分子量分別為:1 020 900、1 960 300、2 456 500。
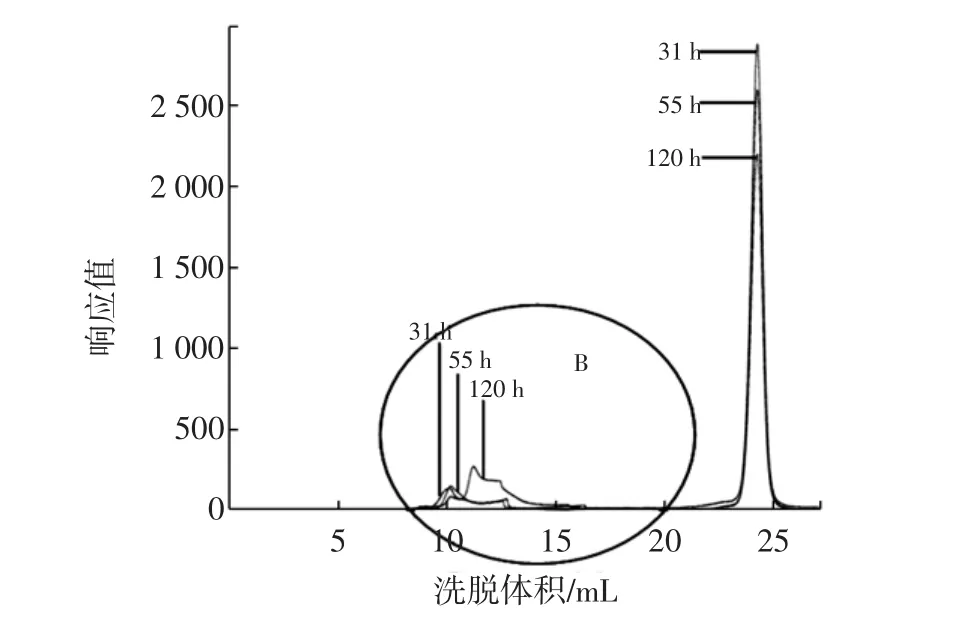
將圖4和圖5對比可以發現:相同培養基條件,相同的發酵時間內,固定化菌發酵與游離菌發酵在培養基中產生的葡聚糖產物的分子量大體一致,只是在發酵中后期(55、120 h),游離菌發酵產生的葡聚糖產物分子量稍高于固定化菌發酵;而且從峰高可以大致看出,固定化菌發酵的葡聚糖產量比相同時間內游離菌發酵的葡聚糖產量略多。
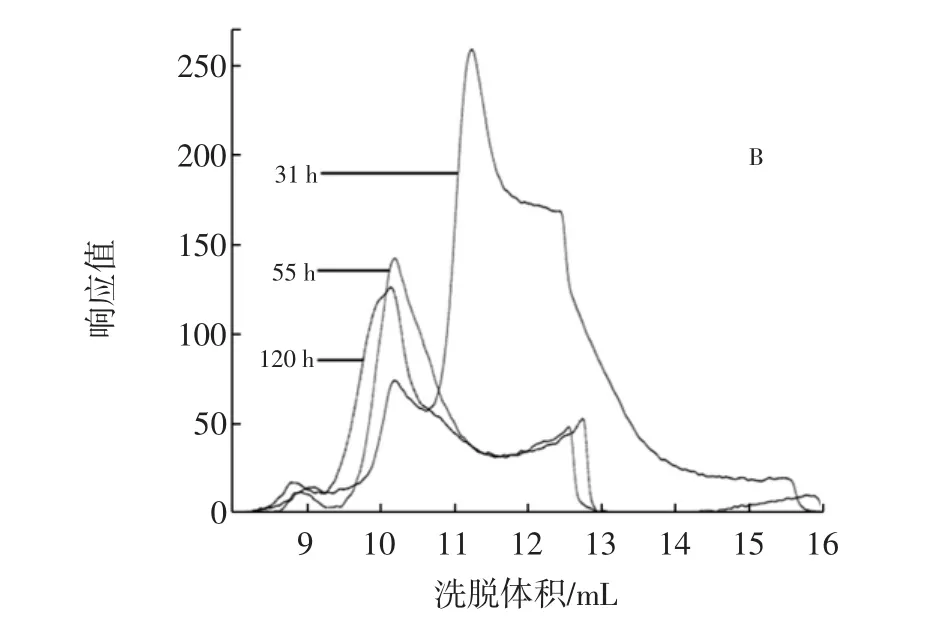
圖5 游離菌在培養基中發酵31、55 h和120 h的HPGPC譜圖疊加圖Fig.5 The overlay HPGPC chromatogram of fermentation of free bacteria after 31,55 h and 120 h in culture medium
即相同時間內,固定化菌發酵產生的葡聚糖的量多于游離菌發酵,固定化菌發酵產生的葡聚糖的分子量低于游離菌發酵,這是因為菌體被固定化之后,在葡聚糖合成反應中起主要作用的葡聚糖蔗糖酶的穩定性提高,酶促反應的作用力較均一,因此形成的具有極大分子量的葡聚糖較少,具有極小分子量的葡聚糖也少。反映在譜圖上,就表現為固定化菌發酵產生的葡聚糖產物的分子量低于游離菌發酵。
3 結論
通過固定化腸膜明串珠菌發酵蔗糖產葡聚糖的HPGPC檢測與游離腸膜明串珠菌發酵蔗糖產葡聚糖的HPGPC檢測對比,探索出一定規律,這說明通過HPGPC譜圖的分析來反應發酵過程中的某些規律是可行的。所得的規律如下:1、通過控制發酵時間可以在一定程度上控制葡聚糖合成產物的重均分子量;2、相同培養條件和相同發酵時間內,固定化菌發酵產生的葡聚糖產物的量比相同時間內游離菌發酵略多,即固定化發酵效力優于相同條件下的游離菌發酵效力;3、固定化菌發酵產生的葡聚糖分子量低于同步游離菌發酵產生的葡聚糖分子量,說明通過腸膜明串珠菌的固定化,能在一定程度上對其葡聚糖產物的分子量進行調控。
以上試驗初步探索了固定化腸膜明串珠菌生物合成葡聚糖的過程規律,可為今后實現右旋糖酐生物合成的定向控制研究提供試驗數據和理論指導。
參考文獻:
[1]Neu Bjoern,Wenby Rosalinda,Meiselman Herbert J. Effects of dextran molecular weight on red blood cell aggregation[J]. Biophysical Journal,2008,95(6):3059-3065
[2]國家藥典委員會.中國藥典[M].北京:中國醫藥科技出版社,2010:418
[3]曉原.血漿代用品國內市場.中國醫藥報[N].2006-02-09(B06)
[4]Kim Doman,Robyt John F,Lee So-Young,et al. Dextran molecular size and degree of branching as a function of sucrose concentration,pH,and temperature of reaction of Leuconostoc mesenteroides B-512FMCMdextransucrase[J].Carbohydrate Research,2003,338(11):1183-1189
[5]藍平,藍麗紅,董智芳,等.合成右旋糖酐菌體固定化研究[J].化學世界,2009(11):669-67
Research of Producing Dextran from Immobilized Leuconostoc Mesenteroides by HPGPC Detection
WANG Qing1,LIU Tao1,CHEN Shan2,*
(1. Department of Food Science,Xinyang College of Agriculture and Forestry,Xinyang 464000,Henan,China;2. Center for Sugar Engineering and Technology Research,Guangxi University,Nanning 530004,Guangxi,China)
Abstract:Glucan is the production of sucrose ferment,small molecular weight glucan(which is also called dextran)obtained after hydrolisis and purification with certain molecular weight,and high homogeneous is the internationally recognized high quality blood plasma substitution. However,the present production technique of dextran can inaccessibility meet the clinical medicine standard,therefore,it has the very obvious practical significance and the theory value to develop a new way that can synthesize dextran with specific molecular weight distribution. By HPGPC on-line detection of molecular heavy weight of fermentation products,we can control the molecular weight of Leuconostoc Mesenteroides fermentation products by immobilization technology,we found that the amount of immobilized bacteria fermentation of glucan were more than the free bacteria fermentation in the same time;and the molecular weight of dextran from immobilized bacteria fermentation produce was lower than dextran from free bacteria fermentation in the same time.
Key words:immobilized;dextran;Leuconostoc Mesenteroides;HPGPC
DOI:10.3969/j.issn.1005-6521.2016.09.033
基金項目:國家自然科學基金項目資助(21264003);廣西自然科學基金項目資助(2012GXNSFAA053029);廣西自然科學基金項目資助(2013GXNSFAA019036)
作者簡介:王清(1988—),女(漢),講師,碩士,研究方向:食品營養與檢測。
*通信作者:陳山(1968—),男(漢),教授,博士生導師。
收稿日期:2015-01-05

