微生物發酵甘薯渣產蛋白飼料的工藝優化及對育肥豬生產性能的影響
邢文會+付瑞敏+王丁+王雅雅+谷亞楠+郭彥釗+陳五嶺
摘要:以甘薯渣為原料,利用復合微生物菌劑進行固態發酵,并探討發酵產物對育肥豬生產性能的影響。采用響應面法對甘薯渣的發酵條件進行優化,在單因素試驗的基礎上,選擇接種量、發酵溫度、初始pH值3個因素,以發酵產物的真蛋白含量作為響應值進行響應面法分析,并將發酵產物作為添加物進行育肥豬飼喂試驗。結果表明,微生物發酵甘薯渣產蛋白飼料的最優工藝是:接種量1.64%、發酵溫度29.79 ℃、初始pH值 5.59。在該條件下,真蛋白含量增加至22.95%,比優化前提高了47.68%。此外,經檢測,發酵后產物各項評價指標均良好,可將其添加入育肥豬飼料中,且最佳添加比例為10%。
關鍵詞:甘薯渣;發酵條件;響應面法;育肥豬
中圖分類號: S816.4
文獻標志碼: A
文章編號:1002-1302(2016)04-0279-06
甘薯是一種高產而適應性強的糧食作物[1],甘薯塊根中含大量的淀粉、糖分、蛋白質和纖維素半纖維素等營養成分[2-5]。甘薯不僅可以用作人類的主糧,還是飼料生產、淀粉加工和乙醇制造等行業的重要原材料。研究資料表明,甘薯中的膳食纖維對維持人和動物的胃腸道健康具有極其重要的作用[6-8]。甘薯渣是甘薯淀粉廠提取甘薯淀粉后剩余的殘渣,其主要成分是淀粉、纖維素和蛋白質等,質量約占鮮質量的45%~60%。當前,飼料工業中大多采用新鮮薯渣來生產飼料,陳年薯渣由于久置生霉、產乙醇等原因不易被動物食用,故大多被廢棄,不僅污染環境,還造成了資源的浪費[9-11]。
當前,隨著生物技術與飼料加工產業的不斷融合,生物飼料的開發已逐漸成為我國飼料加工的熱點。基于生物飼料的生產特點,用有益微生物復合菌劑發酵陳年薯渣,利用菌體的生長代謝將薯渣中各種成分進行高效轉化并生產蛋白飼料,不僅解決陳年薯渣的污染等難題,還可有效提高薯渣中蛋白質的利用率。此外,由于發酵產物中含有豐富的維生素、礦物質和其他生物活性物質,將其添加于飼料中,可有效提高畜禽的生長率[12-15]。
本研究擬采用功能微生物發酵陳年甘薯渣,并以發酵殘留物中真蛋白含量為品質測定標準,對發酵條件進行優化。采用優化工藝進行蛋白飼料的擴大生產,經測定,所得產物各養分評價指標均良好,育肥豬飼喂試驗結果表明,發酵后的產物不僅可提高適口性,還可有效提高育肥豬的料肉比和鮮肉品質等生產性能。本研究結果不僅能夠有效解決陳年甘薯渣造成的環境污染問題,還可以實現其資源化,將其用于飼料生產和畜禽養殖,可有效降低生產成本,具有良好的環境和經濟效益。
1 材料與方法
1.1 試驗材料
陳年甘薯渣:取自山西美家園生物科技股份有限公司。薯渣經固液分離后,含水率為60%,攪碎成糊狀物備用。
功能微生物復合菌劑:為產朊假絲酵母、解脂假絲酵母、乳酸乳球菌、米曲霉。菌種保存于西北大學農業及環境微生物技術工程實驗室。
1.2 試驗方法
1.2.1 單因素試驗 通過對影響甘薯渣發酵的主要因素進行單因素試驗,包括:接種量、發酵溫度、初始pH值、發酵溫度。以發酵產物中真蛋白含量的變化來判斷各因素對薯渣發酵工藝的影響。
1.2.2 響應面優化發酵條件的優化 根據單因素試驗結果,利用2-Level Factorial Design試驗設計,從發酵接種量、發酵溫度、初始pH值和發酵溫度4因素中篩選出對發酵工藝影響重要的3個單因素,通過爬坡試驗確定各因素的最佳取值范圍。利用Box-Benhnken中心組合試驗設計原理,采用響應面法,以甘薯渣殘留物真蛋白含量為響應值,進行3因素3水平試驗對甘薯渣發酵條件進行優化。
1.3 甘薯渣發酵殘留物品質測定
真蛋白的測定[16]:用三氯乙酸沉淀法進行預處理后,按照GB 500905—1986《食品中蛋白質的測定》的方法測定,具體操作流程如下:取發酵產物樣品2 g,加入三氯乙酸10 mL,振蕩搖勻,靜置30 min, 3 000 r/min離心10 min,留沉淀,加入三氯乙酸,振蕩搖勻、靜置、離心,重復過程2次,收集沉淀物備用,采用凱氏定氮法[17]測定沉淀物蛋白含量即為真蛋白。粗脂肪:按照GB 6433—1986《飼料粗脂肪測定方法》中的索氏提取法測定。粗灰分:按照GB 6438—1994《飼料中粗灰分的測定方法》的高溫灼燒法測定。粗纖維:按照GB/T 6434—1994《飼料中粗纖維測定方法》中的酸堿洗滌法測定。水分:按照GB 6435—1992《飼料中水分的測定》方法測定。乳酸菌的測定用平板活菌計數法[18],采用改良MRS培養基。大腸桿菌的測定采用GB 4789.3—2010《食品微生物學檢驗 大腸菌群計數》標準執行;酵母菌的測定按照GB 4789.15—2003《食品衛生微生物學檢驗 霉菌和酵母計數》標準執行。
1.4 育肥豬的飼養試驗研究
選用生長狀況基本一致的育肥豬40頭,隨機分組,每組10頭,對照組飼喂基礎日糧,1號試驗組添加5%發酵產物,2號試驗組添加10%發酵產物,3號試驗組添加15%發酵產物。試驗周期為60 d,完成后測定料肉比、屠宰率、肉的品質。試驗地點為陜西某養豬場。
育肥豬胴體質量為:屠宰后去頭、蹄、尾及內臟,保留板油和腎臟的軀體質量。
肉的品質測定包括:pH值的測定、剪切力的測定、肉色的測定、大理石紋評分[19]。測定對象為豬肋骨處的背最長肌。用PH值S-25 數顯酸度計測定肌肉pH值;用C-L M3B型數顯式肌肉嫩度儀測定剪切力;使用美制NPPC標準比色板進行肉色測定;使用美制NPPC標準比色板進行大理石紋測定。
鮮肉肉色分為5級評定[20]:1分為灰白色(PSE肉色),2分為輕度灰白(傾向PSE肉色),3分為亮紅色(正常肉色),4分為稍深紅色(正常肉色),5分為暗紫色(DFD肉色)。
大理石紋:大理石紋是評定肉質指標之一,將最后肋骨處的背最長肌橫斷面置于4 ℃冷卻24 h后測定。評分制分為5個等級:1分為脂肪極少量,2分為脂肪微量,3分為脂肪少量,4分為脂肪適量,5分為脂肪過量。
2 結果與分析
2.1 接種量對真蛋白含量的影響
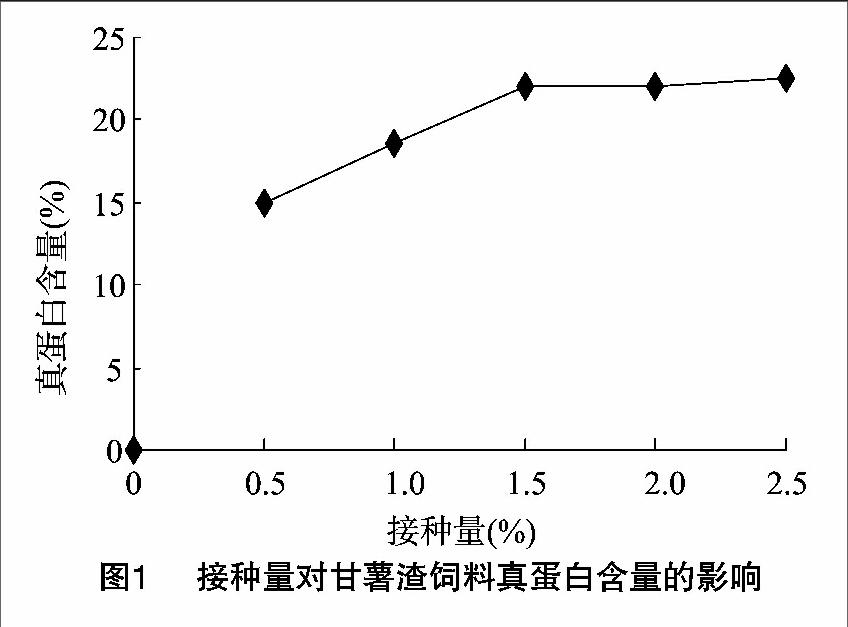
在發酵條件為發酵溫度32 ℃、發酵時間2 d、初始pH值自然的情況下,當接種量分別為0.5%、1%、1.5%、2%、25%時,真蛋白含量的變化情況如圖1所示。從圖1可知,在接種量為0.5%~1.5%范圍內,發酵產物真蛋白含量隨著接種量的增加而增加。當接種量為1.5%時,真蛋白含量達到了22.05%。當接種量超過1.5%時,真蛋白含量有所下降,從菌體生長和生產成本來看,選擇1.5%的接種量為最佳。
2.2 發酵溫度對發酵產物真蛋白含量的影響
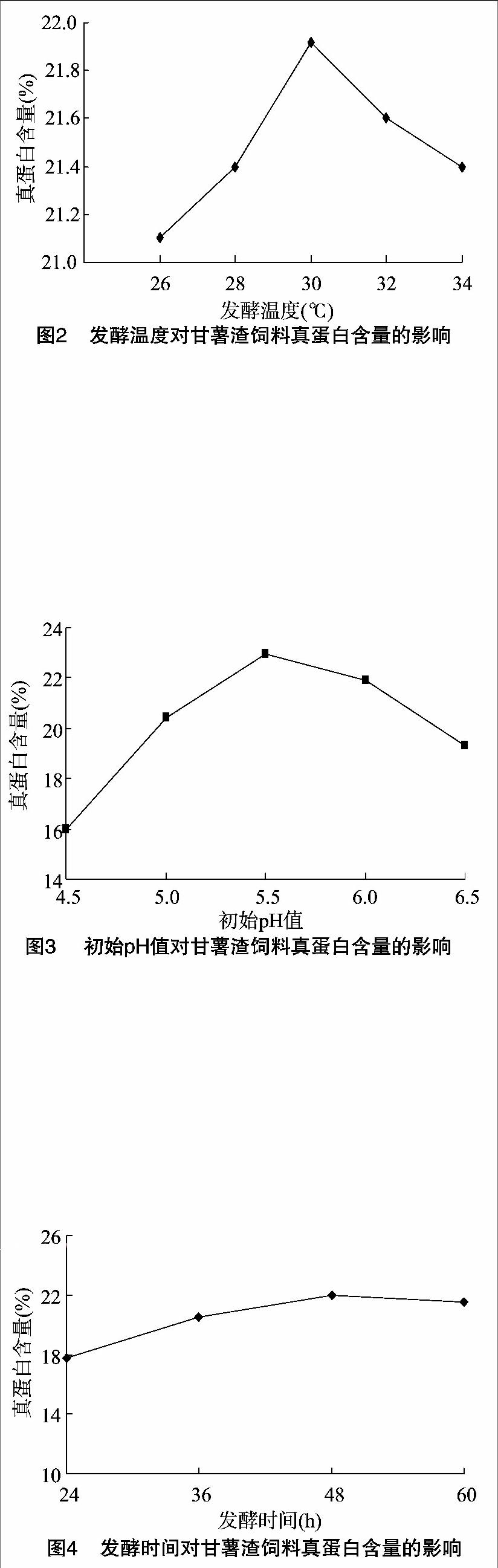
在發酵條件為發酵時間2 d、接種量1.5%、初始pH值自然,發酵溫度分別是26、28、30、32、34 ℃時,各組發酵后的真蛋白含量見圖2。由圖2可以看出,在26~30 ℃范圍內,甘薯渣發酵產物的真蛋白含量隨著溫度的升高而增加,在30 ℃時發酵產物真蛋白含量達到了21.92%。當發酵溫度超過 30 ℃,真蛋白含量下降。
2.3 初始pH值對發酵產物真蛋白含量的影響
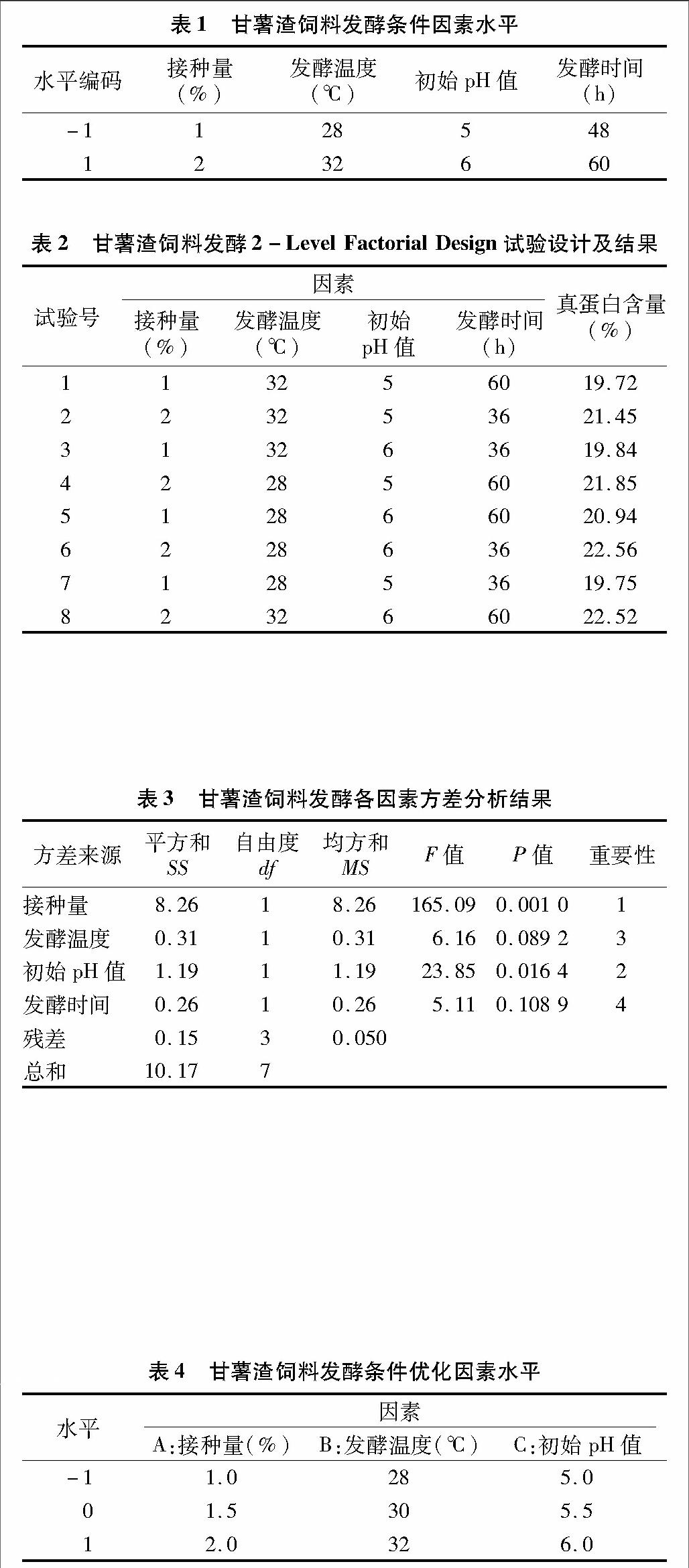
在發酵條件為發酵溫度32 ℃、接種量1.5%的情況下,發酵時間2 d,初始pH值分別設置5.0、5.5、6.0、6.5、7.0時,各組發酵后的真蛋白含量見圖3。從圖3可以看出,pH值在5.0~5.5之間,真蛋白含量的增加趨勢明顯,在pH值5.5時真蛋白含量達到了22.96%。當pH值在5.5~6.5之間,真蛋白含量呈下降趨勢。
2.4 發酵時間對發酵產物真蛋白含量的影響
在發酵溫度32 ℃、接種量1.5%,初始pH值為自然的情況下,分別設置發酵時間為24、36、48、60 h時,各組發酵后的真蛋白含量見圖4。從圖4可以看出,發酵時間在24~48 h之間時,真蛋白含量逐漸增加,當發酵時間為48 h,真蛋白含量為21.96%,當發酵時間超過48 h之后,真蛋白含量慢慢下降。可能是由于發酵物質缺乏,菌體繁殖將部分真蛋白分解。
2.5 影響發酵工藝的主要因素及其范圍
利用Design Expert 8.0.5b軟件中2-Level Factorial Design 設計試驗,從接種量、發酵溫度(℃)、初始pH值和發酵溫度中選出主要的影響因素。因素水平表以及試驗設計表見表1和表2。
方差分析結果(表3)表明,對甘薯渣發酵產物中真蛋白含量的影響因素中,依次為:接種量>初始pH值>發酵溫度。
2.6 響應曲面法優化發酵工藝
根據以上單因素試驗以及2-Level Factorial Design試驗設計的結果,采用響應曲面法對發酵工藝條件進行優化,因素水平見表4。采用響應曲面法進行多元回歸分析,以接種量、發酵溫度和初始pH值3因素3水平設計 Box-Benhnken中心試驗,響應面分析方案與結果見表5。
由NAVOA擬合結果(表6)分析可知:模型F檢驗極顯著(P<0.001),失擬項P=0.23>0.05,表明此二次回歸模型擬合性較好,決定系數r2=0.994 8,調整決定系數r2Adj=0983 5,說明回歸方程能較好地描述各影響因素與響應值之間的關系。從表6可以看出:接種量(A)、接種量(A)的二次方、初始pH值(C)的二次方對真蛋白含量的影響極顯著(P<0.01)。各影響因素對真蛋白含量的影響顯著性順序為:接種量>初始pH值>發酵溫度,該模型可用于陳年薯渣發酵條件的優化。
根據回歸方程,利用響應面軟件可以繪制出兩兩交互作用對真蛋白含量影響的等高線和響應面曲線圖,所得結果見圖5、圖6、圖7。從圖5可以看出,當初始pH值為5.5時,接種量和發酵溫度對真蛋白含量的交互影響。接種量(A)、發酵溫度(B)對真蛋白含量的影響都是明顯的,曲面比較陡峭。接種量(A)與發酵溫度(B)交互作用是不明顯的。
從圖6可以看出,接種量(A)與初始pH值(C)對真蛋白含量的含量影響明顯,響應面圖曲面較陡峭,并且2個因素的交互作用不明顯。接種量(A)與發酵溫度(B)交互作用與接種量(A)與初始pH值(C)交互作用相比,前者對真蛋白含量交互作用比后者明顯,即P值為0.111 5和0.133 4。當接種量一定時,初始pH值大于5.5時,真蛋白含量呈下降趨勢,較高的pH值不利于陳年薯渣發酵。
從圖7可以看出,發酵溫度(B)和初始pH值(C)對真蛋白含量的影響顯著,響應面曲面較為陡峭。發酵溫度(B)和初始pH值(C)2個因素的交互作用也是明顯的。
基于試驗設計軟件Design Expert 8.0.5b,對試驗結果進行優化,獲得最大真蛋白含量的各試驗條件為:接種量為164%、發酵溫度為29.79 ℃、初始pH值為5.59。為了檢驗模型的可靠性,以及實際試驗的可操作性,將接種量取為16%、發酵溫度取為30 ℃、初始pH值取為5.6,在此條件下進行驗證試驗,平行測定3次,所得到真蛋白含量的平均值為22.95%,與模型預測的結果很接近,表明該模型可信,具有實際的應用價值。
2.7 擴大驗證試驗發酵品質測定
在最優工藝條件下,根據實際生產條件,取1 kg陳年薯渣進行擴大發酵試驗,對發酵原料和發酵產物采用三點法取樣,并對發酵后產物進行各項指標測定。從表7可以看出:經過發
2.8 發酵產物對育肥豬喂養試驗研究
試驗豬基礎日糧由養殖場提供,育肥結束后,測定料肉比、屠宰率、肉品質。由表8可知,2號試驗組的料肉比最小,小于對照組,并且優于1號和3號試驗組,各試驗組屠宰率結果中,2號試驗組大于其他試驗組,因此選用添加10%的甘薯渣發酵產物作為最佳的添加量。由表9可知,鮮肉pH值在6.2左右,肉色評分在3~4分之間,色澤良好,大理石紋評分在4左右,肌肉脂肪呈適量分布。上述結果表明甘薯渣發酵產物的添加對鮮肉品質無影響。
3 結論與討論
通過利用復合微生物菌劑對陳年甘薯渣進行發酵,提高發酵產物的真蛋白含量并且應用于育肥豬的飼喂過程中。通過單因素試驗,試驗因素分別為接種量、發酵溫度、初始pH值,利用響應面法對發酵條件進行優化,在最優條件下,根據實際生產情況進行擴大驗證試驗,結果表明與預測模型十分相近,并且真蛋白含量的增加率為47.68%。將發酵產物作為飼料添加物,對育肥豬進行飼喂試驗,結果表明,當添加量為10%時,與其他組相比料肉比小、屠宰率高。說明添加10%發酵產物后的飼料適口性好,并且經過檢測鮮肉品質較之前有所提高。試驗結果表明,將陳年甘薯渣作為原材料發酵生產豬蛋白飼料,是一種可行的方法,它不僅可高效利用甘薯中的營養成分,且對生態環境沒有造成任何污染,整個過程是一個綠色高效循環的農業模式,具有良好的應用和推廣前景。
參考文獻:
[1]Lei H,Wang H L,Ning T T,et al. Protein enrichment of potato starch residue by solid state fermentation with mixed strains[J]. Journal of Animal and Veterinary Advances,2012,11(15):2700-2705.
[2]Hao Z H,Wang D J,Chen H,et al. Sweet potato starch residue as starting material to prepare polyacrylonitrile adsorbent via SI-SET-LRP[J]. Journal of Agricultural and Food Chemistry,2014,62(8):1765-1770.
[3]Minh N P. Technical factors affecting to production of sweet potato wine[J]. Int J Pure App Biosci,2015,3(2):237-240.
[4]Hsu P K,Liu C P,Liu Li Yun,et al. Protein enrichment and digestion improvement of napiergrass and pangolagrass with solid-state fermentation[J]. Journal of Microbiology,2013,46(3):171-179.
[5]Hu C C,Liu Li Yun,Yang S S. Protein enrichment,cellulase production and in vitro digestion improvement of pangolagrass with solid state fermentation[J]. Journal of Microbiology,2012,45(1):7-14.
[6]Liu G,Yang G,Fang T,et al. NMR-based metabolomic studies reveal changes in biochemical profile of urine and plasma from rats fed with sweet potato fiber or sweet potato residue[J]. RSC Advances,2014,4(45):23749-23758.
[7]Zhang K,Feng H. Fermentation potentials of Zymomonas mobilis and its application in ethanol production from low-cost raw sweet potato[J]. African Journal of Biotechnology,2010,9(37):6122-6128.
[8]Mutua F K,Dewey C,Arimi S,et al. A description of local pig feeding systems in village smallholder farms of Western Kenya[J]. Tropical Animal Health and Production,2012,44(6):1157-1162.
[9]Wang X Y,Zhang S T,Wang J,et al. Exploring optimal feed to microbes ratio for anaerobic acidogenic fermentation of cassava residue from brewery[J]. BioResources,2012,7(1):1111-1122.
[10]Onyimba I A,Ogbonna C C,Akueshi C O,et al. Changes in the nutrient composition of brewery spent grain subjected to solid state natural fermentation[J]. Nigerian Journal of Biotechnology,2015,20(1):55-60.
[11]Mussoline W A,Wilkie A C. Anaerobic digestion potential of coproducts associated with ethanol production from sweetpotato:a review[J]. Industrial Biotechnology,2015,11(2):113-126.
[12]Tsai C C,Chiu T H,Ho C Y,et al. Effects of anti-hypertension and intestinal microflora of spontaneously hypertensive rats fed gamma-aminobutyric acid-enriched Chingshey purple sweet potato fermented milk by lactic acid bacteria[J]. African Journal of Microbiological Research,2013,7(11):932-940.
[13]Díaz I,González C,Reyes J L,et al. Digestion of sweet potato(Ipomea batatass Lam)foliage in pigs Ileal and fecal in vitro digestibility[J]. Cuban Journal of Agricultural Science,2013,47(1):289.
[14]Soo C S,Yap W S,Hon W M,et al. Mini review:Hydrogen and ethanol co-production from waste materials via microbial fermentation[J]. World Journal of Microbiology and Biotechnology,2015,31(10):1475-1488.
[15]Sanusi G O,Belewu M A,Oduguwa B O,et al. Changes in chemical composition of jatroph curcas kernel cake after solid-state fermentation using some selected fungi[J]. Global Journal of Biology,Agriculture and Health Science,2013,2(2):66-68.
[16]胡艷麗,王克然.飼料中真蛋白的測定[J]. 河南畜牧獸醫,2007,28(10):31-32.
[17]張世仙,余永華,金 茜,等. 凱氏定氮法測定茅臺醬香型酒酒糟蛋白質含量[J]. 中國釀造,2013,32(1):130-132.
[18]張 艷,劉均娥,張 晶,等. 平板活菌計數法檢測糞便中的腸道菌群[J]. 首都醫科大學學報,2008,29(1):85-86.
[19]孫朋朋,宋春陽.豬肉品質的評價指標及營養因素對豬肉品質影響的研究進展[J]. 豬業科學,2014(2):112-117.
[20]周 波,黃瑞華,曲 亮,等. 色差儀和肉色板在豬肉肉色評定中的應用[J]. 江蘇農業科學,2007(2):121-124.阮國良,柯玉清,楊代勤. 限食水平和時間對黃鱔血細胞數的影響[J]. 江蘇農業科學,2016,44(4):285-287.

