限食水平和時(shí)間對(duì)黃鱔血細(xì)胞數(shù)的影響
阮國良+柯玉清+楊代勤
摘要:研究了不同水平和時(shí)間的限食對(duì)黃鱔(Monopterus albus)血細(xì)胞數(shù)量的影響,結(jié)果顯示:(1)不同程度的限食未使黃鱔血液的紅細(xì)胞數(shù)發(fā)生顯著性減少(P>0.05),但使其白細(xì)胞數(shù)均呈顯著增加趨勢(P<0.05),且隨著限食時(shí)間的延長其白細(xì)胞數(shù)增加更為明顯;(2)隨著限食時(shí)間的延長,黃鱔的淋巴細(xì)胞和血栓細(xì)胞比例顯著上升(P<0.05),而單核細(xì)胞和中性粒細(xì)胞等吞噬細(xì)胞的比例顯著下降(P<0.05)。因此,限食可迫使黃鱔產(chǎn)生防御性生理反應(yīng)且可能使其非特異性免疫能力下降,從而提示在黃鱔的間歇性限食獲得補(bǔ)償生長的投喂模式中應(yīng)避免長時(shí)間的持續(xù)限食。
關(guān)鍵詞:黃鱔(Monopterus albus);限食水平;限食時(shí)間;血細(xì)胞
中圖分類號(hào): S966.4
文獻(xiàn)標(biāo)志碼: A
文章編號(hào):1002-1302(2016)04-0285-02
黃鱔(Monoperus albus)是我國重要的經(jīng)濟(jì)養(yǎng)殖魚類[1],其網(wǎng)箱養(yǎng)殖在長江中游地區(qū)發(fā)展迅速并正朝著產(chǎn)業(yè)方向發(fā)展[2]。為節(jié)約飼料與勞力成本、提高養(yǎng)殖效益,我們的研究初步表明,黃鱔在合理的限食投喂模式中可獲得良好的生長補(bǔ)償效應(yīng)[3],但在限食投喂過程中,黃鱔的健康狀況與免疫功能有待加以評(píng)價(jià)。血細(xì)胞是魚類重要的免疫細(xì)胞,其相關(guān)指標(biāo)的變化與魚體的營養(yǎng)、代謝狀況及免疫功能等的動(dòng)態(tài)變化密切相關(guān)[4-5]。李富樂等對(duì)洞庭湖區(qū)黃鱔的血細(xì)胞進(jìn)行了分類與計(jì)數(shù)研究[6],但有關(guān)限食與黃鱔血細(xì)胞變化的相關(guān)性研究則尚未見報(bào)道。為此,本試驗(yàn)初步研究了不同水平和時(shí)間限食后黃鱔血細(xì)胞的變化,旨在評(píng)價(jià)限食程度對(duì)黃鱔免疫力的影響,從而為生產(chǎn)實(shí)踐中制定可行的限食投喂方案提供依據(jù)。
1 材料與方法
1.1 試驗(yàn)魚、餌料及飼養(yǎng)條件
試驗(yàn)用幼鱔(19.5±2.0)g來自長江大學(xué)黃鱔研究所。試驗(yàn)魚經(jīng)體質(zhì)量篩選后轉(zhuǎn)入實(shí)驗(yàn)室的塑料水族箱(70 cm×55 cm×36 cm)內(nèi)進(jìn)行飼養(yǎng)。在正式試驗(yàn)前進(jìn)行7 d飽食投喂的適應(yīng)性暫養(yǎng)。暫養(yǎng)和試驗(yàn)期間的餌料為鮮活的水蚯蚓。試驗(yàn)期間,養(yǎng)殖箱內(nèi)的溶氧量>5.2 mg/L,氨氮量<0.09 mg/L,pH值 6.5~7.2,通過雙制式空調(diào)將室溫控制在(25.0±1.0) ℃。
1.2 限食試驗(yàn)設(shè)計(jì)
試驗(yàn)設(shè)對(duì)照組和限食處理組,每組隨機(jī)放黃鱔20尾,每組3個(gè)重復(fù),試驗(yàn)時(shí)間為64 d。對(duì)照組為飽食投喂組(S0F60),即連續(xù)每天飽食喂食1次,每天傍晚時(shí)分進(jìn)行足量投喂并觀察黃鱔的攝食情況,從投喂開始至 2 h后如水族箱中水蚯蚓略有剩余則視為飽食投喂。限食水平試驗(yàn)的處理組如下:禁食1 d飽食喂食2 d組(S1F2),共20個(gè)周期;禁食1 d飽食喂食3 d組(S1F3),共15個(gè)周期;禁食1 d飽食喂食4 d組(S1F4),共12個(gè)周期。限食持續(xù)時(shí)間試驗(yàn)的處理組如下:禁食1 d飽食喂食2 d組(S1F2),共20個(gè)周期;禁食2 d飽食喂食4 d組(S2F4),共10個(gè)周期;禁食4 d飽食喂食8 d組(S4F8),共5個(gè)周期。試驗(yàn)期間,每天17:00—18:00時(shí)進(jìn)行飽食投喂1次,次日約09:00虹吸清理殘餌。
1.3 血細(xì)胞的采集、計(jì)數(shù)與數(shù)據(jù)處理
限食投喂試驗(yàn)結(jié)束后,對(duì)各個(gè)重復(fù)的水簇箱分別隨機(jī)取5尾黃鱔,采集血液樣本進(jìn)行各類血細(xì)胞計(jì)數(shù)。血液采集、血細(xì)胞的計(jì)數(shù)方法參照文獻(xiàn)[7-8]。試驗(yàn)結(jié)果用x±s表示,采用Statistica 6.0軟件進(jìn)行單因素方差分析(ANOVA),當(dāng)處理之間差異顯著(P<0.05)時(shí),用Duncans檢驗(yàn)進(jìn)行多重比較。
2 結(jié)果
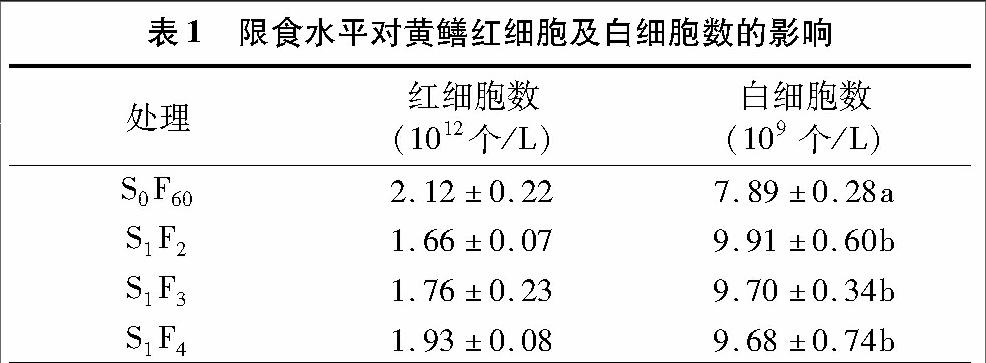
2.1 限食水平對(duì)黃鱔血細(xì)胞數(shù)量的影響
由表1可以看出,經(jīng)過60 d的重復(fù)性“饑餓—投喂”養(yǎng)殖后,限食試驗(yàn)組黃鱔較正常投喂黃鱔的紅細(xì)胞數(shù)少,并且隨著限食水平的提高呈下降趨勢,但下降不明顯(P>0.05);各試驗(yàn)組白細(xì)胞數(shù)量均顯著高于對(duì)照組S0F60(P<0.05),隨著限食水平的提高白細(xì)胞數(shù)量在各處理組之間無顯著差異。
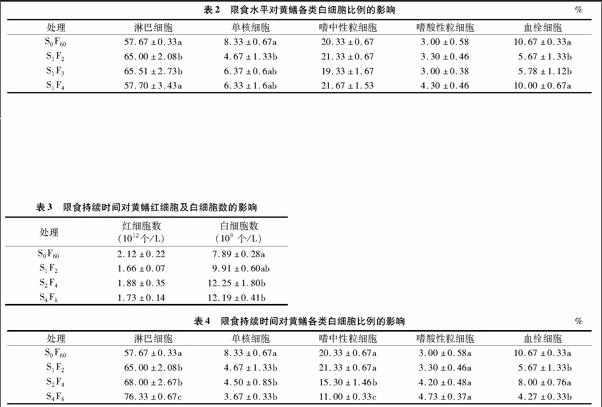
2.2 限食水平對(duì)黃鱔白細(xì)胞分類計(jì)數(shù)的影響
由表2可以看出,經(jīng)過60 d的重復(fù)性“饑餓—投喂”飼養(yǎng)后,各試驗(yàn)組的黃鱔淋巴細(xì)胞比例均呈上升趨勢,試驗(yàn)組S1F2和S1F3顯著高于對(duì)照組S0F60(P<0.05),試驗(yàn)組S1F4與其他組比較均不顯著(P>0.05);各試驗(yàn)組單核細(xì)胞比例均呈下降趨勢,試驗(yàn)組S1F2比例顯著低于對(duì)照組S0F60(P<0.05),但與其他組之間無顯著差異(P>0.05);試驗(yàn)組S1F2和S1F3的血栓細(xì)胞比例顯著低于對(duì)照組S0F60和試驗(yàn)組S1F4(P<0.05);試驗(yàn)組嗜中性粒細(xì)胞和嗜酸性粒細(xì)胞比例變化均不顯著(P>0.05)。
2.3 限食持續(xù)時(shí)間對(duì)黃鱔血細(xì)胞數(shù)的影響
由表3可以看出,經(jīng)過60 d的重復(fù)性“饑餓—投喂”飼養(yǎng)后,各試驗(yàn)組黃鱔紅細(xì)胞數(shù)量均低于對(duì)照組S0F60,但無顯著差異(P>0.05);各試驗(yàn)組白細(xì)胞數(shù)量均高于對(duì)照組S0F60,且試驗(yàn)組S2F4和S4F8顯著高于對(duì)照組S0F60(P<0.05)。但各試驗(yàn)組之間不存在顯著差異(P>0.05)。
2.4 限食持續(xù)時(shí)間對(duì)黃鱔白細(xì)胞分類計(jì)數(shù)的影響
由表4可以看出,經(jīng)過60 d的重復(fù)性“饑餓—投喂”飼養(yǎng)后,試驗(yàn)組的淋巴細(xì)胞比例均顯著高于對(duì)照組S0F60(P<005),且試驗(yàn)組S4F8顯著高于試驗(yàn)組S1F2和S2F4(P<0.05);試驗(yàn)組單核細(xì)胞比例均顯著低于對(duì)照組S0F60(P<0.05),且隨著限食持續(xù)時(shí)間的延長,呈逐漸下降趨勢;試驗(yàn)組嗜中性粒細(xì)胞均顯著低于對(duì)照組S0F60(P<0.05),隨著限食持續(xù)時(shí)間的延長,嗜中性粒細(xì)胞比例下降越來越明顯,試驗(yàn)組S4F8顯著低于試驗(yàn)組S1F2和S2F4(P<0.05);試驗(yàn)組嗜酸性粒細(xì)胞比例均有所上升,但變化不顯著(P>0.05);各試驗(yàn)組血栓細(xì)胞均低于對(duì)照組S0F60,試驗(yàn)組S1F2和S4F8顯著低于其他組(P<0.05)。
3 討論
3.1 限食對(duì)黃鱔紅細(xì)胞數(shù)和白細(xì)胞數(shù)的影響
血液作為魚類重要的組織器官之一,主要具有運(yùn)輸、交換和防御三大生理功能。血液成分的相對(duì)恒定是魚類生命活動(dòng)正常進(jìn)行的基本條件。魚類血液生理指標(biāo)變化與機(jī)體的新陳代謝、生理狀況顯著相關(guān),因而被廣泛地用來評(píng)價(jià)魚體的健康狀況及其對(duì)環(huán)境的適應(yīng)。目前,對(duì)一些魚類的研究表明,紅細(xì)胞的數(shù)量隨著饑餓時(shí)間的延長而下降[9-13]。陳曉耘等對(duì)饑餓南方幼魚血液的研究表明,饑餓使南方幼魚血液生理指標(biāo)變化顯著,紅細(xì)胞數(shù)量顯著減少[9];陳慧群等對(duì)鰻鱺的研究表明饑餓20 d后,鰻鱺紅細(xì)胞數(shù)較正常魚下降了39%[12]。本研究中,限食使黃鱔紅細(xì)胞數(shù)下降,這與以上文獻(xiàn)的許多研究結(jié)果基本一致,但這種下降與對(duì)照組相比差異不顯著(P>0.05)。氧氣運(yùn)輸是紅細(xì)胞的重要生理功能之一,故限食程度可能不影響黃鱔紅細(xì)胞攜帶和運(yùn)輸氧氣的功能。本研究發(fā)現(xiàn),不同水平的限食均引起黃鱔白細(xì)胞數(shù)有所增加,且隨著限食持續(xù)時(shí)間的增加其白細(xì)胞數(shù)顯著上升,這與持續(xù)饑餓可使某些魚類的白細(xì)胞數(shù)顯著上升[14-16]的結(jié)果基本一致。攝食不足或饑餓引起白細(xì)胞數(shù)上升很可能是魚類為適應(yīng)生存條件變化所發(fā)生的一種防御性生理反應(yīng)。
3.2 限食對(duì)黃鱔各類白細(xì)胞比例的影響
白細(xì)胞與機(jī)體的免疫功能有關(guān),通過對(duì)魚類白細(xì)胞數(shù)量和各類白細(xì)胞比例的測定可以從某個(gè)側(cè)面反映其生理狀況的變化,同時(shí)白細(xì)胞數(shù)目的變化顯示了機(jī)體的免疫系統(tǒng)受到影響。
李霞等發(fā)現(xiàn),當(dāng)饑餓時(shí)間少于20 d 時(shí),紅鰭東方鲀外周血中白細(xì)胞的數(shù)量明顯增加,但隨著饑餓時(shí)間的延長,白細(xì)胞的數(shù)量呈下降趨勢;脾臟中淋巴細(xì)胞的轉(zhuǎn)化率明顯升高,淋巴細(xì)胞的增殖能力也增加,巨噬細(xì)胞的吞噬活性增加,吞噬力增強(qiáng),但長時(shí)間饑餓后魚體淋巴增殖能力和吞噬力會(huì)降低[17]。本研究中隨著限食水平提高和限食持續(xù)時(shí)間的延長,黃鱔白細(xì)胞數(shù)及各類白細(xì)胞比例發(fā)生了不同程度的變化。限食水平試驗(yàn)組S1F2和S1F3淋巴細(xì)胞比例、血栓細(xì)胞比例顯著上升,試驗(yàn)組S1F2單核細(xì)胞比例顯著下降;限食持續(xù)時(shí)間試驗(yàn)組淋巴細(xì)胞比例均顯著高于對(duì)照組,單核細(xì)胞、中性粒細(xì)胞比例均顯著低于對(duì)照組S0F60。本研究表明,隨著限食程度的加深,黃鱔的淋巴細(xì)胞和血栓細(xì)胞比例顯著上升,而單核細(xì)胞和中性粒細(xì)胞等吞噬細(xì)胞的比例顯著下降。因此,限食作為一種營養(yǎng)脅迫促使黃鱔非特異性免疫能力發(fā)生不同程度的下降,從而提示在黃鱔的間歇性限食獲得補(bǔ)償生長的投喂模式中應(yīng)避免持續(xù)長時(shí)間的限食。
參考文獻(xiàn):
[1]Li W T,Liao X L,Yu X M,et al. Isolation and characterization of polymorphic microsatellites in a sex-reversal fish,rice field eel (Monopterus albus)[J]. Molecular Ecology Notes,2007,7(4):705-707.
[2]Chu Z J,Wu Y X,Gong S Y,et al. Effects of estradiol valerate on steroid hormones and sex reversal of female rice field eel,Monopterus albus (Zuiew)[J]. Journal of the World Aquaculture Society,2011,42(1):96-104.
[3]阮國良,劉家芳,楊代勤. 間歇性禁食對(duì)黃鱔生長、消化酶活性及血液生化指標(biāo)的影響[J]. 水產(chǎn)學(xué)報(bào),2013,37(7):1058-1065.
[4]周永燦,邢玉娜,馮全英. 魚類血細(xì)胞研究進(jìn)展[J]. 海南大學(xué)學(xué)報(bào):自然科學(xué)版,2003,21(2):171-176.
[5]高澤霞,王衛(wèi)民. 魚類外周血紅細(xì)胞研究進(jìn)展[J]. 水利漁業(yè),2008,28(2):1-3.
[6]李富樂,賀建香,陳 晨,等. 洞庭湖區(qū)黃鱔血細(xì)胞的分類與計(jì)數(shù)[J]. 內(nèi)陸水產(chǎn),2008(1):39-40.
[7]陳其才,嚴(yán)定友,吳政星. 生理學(xué)實(shí)驗(yàn)[M]. 北京:科學(xué)出版社,1995.
[8]鐵槐茂,石 丹,銀 龍,等. 瓦氏黃顙魚血液生理指標(biāo)與外周血細(xì)胞組成及顯微結(jié)構(gòu)[J]. 四川農(nóng)業(yè)大學(xué)學(xué)報(bào),2015,33(1):78-83.
[9]陳曉耘. 饑餓對(duì)南方鲇幼魚血液的影響[J]. 西南農(nóng)業(yè)大學(xué)學(xué)報(bào),2000,22(2):167-169,176.
[10]張桂蓉,嚴(yán)安生,高玉芹,等. 饑餓對(duì)異育銀鯽幾項(xiàng)血液指標(biāo)的影響[J]. 水利漁業(yè),2003,23(1):9-10.
[11]胡一中,程宏毅,王鴻艷. 饑餓對(duì)月鱧幾項(xiàng)血液指標(biāo)的影響[J]. 生物學(xué)雜志,2009(1):81-83.
[12]陳惠群,楊文鴿. 饑餓對(duì)鰻鱺某些血液指標(biāo)的影響[J]. 水產(chǎn)養(yǎng)殖,2002,20(5):32-33.
[13]錢云霞,陳惠群,孫江飛. 饑餓對(duì)養(yǎng)殖鱸魚血液生理生化指標(biāo)的影響[J]. 中國水產(chǎn)科學(xué),2002,9(2):133-137.
[14]封功能,楊文平,王愛民,等. 饑餓脅迫對(duì)鯉形體、體成分及血液生理指標(biāo)的影響[J]. 上海海洋大學(xué)學(xué)報(bào),2011,20(6):814-819.
[15]周愛國,王 超,梁日深,等. 饑餓脅迫對(duì)雜交鱧血液指標(biāo)的影響[J]. 水產(chǎn)養(yǎng)殖,2012,33(7):23-26.
[16]鄭桂紅,陳思如. 饑餓對(duì)烏鱧血液生理生化指標(biāo)的影響[J]. 江蘇農(nóng)業(yè)科學(xué),2012,40(2):186-188.
[17]李 霞,周寶祥,王茂林. 饑餓對(duì)紅鰭東方鲀免疫細(xì)胞功能的影響[J]. 大連水產(chǎn)學(xué)院學(xué)報(bào),2006,21(4):297-300.凌善鋒,蔡福歡,劉彥文,等. 3.5 mg/L水楊酸誘導(dǎo)斜生柵藻積累蝦青素的分子機(jī)理[J]. 江蘇農(nóng)業(yè)科學(xué),2016,44(4):287-290.

