醛基功能化喹啉螺旋折疊體的合成及手性識別研究
吳雯路,黎 朝,劉宇宸,林建斌,江云寶
(廈門大學 化學化工學院,譜學分析與儀器教育部重點實驗室,福建廈門361005)
醛基功能化喹啉螺旋折疊體的合成及手性識別研究
吳雯路,黎朝,劉宇宸,林建斌,江云寶*
(廈門大學 化學化工學院,譜學分析與儀器教育部重點實驗室,福建廈門361005)
摘要:設計合成了以8-氨基喹啉-4-甲酸為重復結構單元,氨基端修飾(1S,4R)-坎烷酰基,羧基端醛基功能化的螺旋折疊體分子1g~4g,進而應用這類折疊體分子探討螺旋結構與手性選擇性之間的關系.通過折疊體端基選擇的外識別方式實現對手性萘乙胺對映異構體的選擇性.實驗表明,3g對手性萘乙胺的手性選擇性最好(產物m(R3g)/m(S3g)=1.00/4.10),說明螺旋結構的形成有利于3g對手性萘乙胺的選擇性識別.
關鍵詞:螺旋折疊體;手性識別;外識別
手性即物和其鏡像不能重合的現象.化合物分子僅是手性的差異便能在生物活性方面表現出明顯的差異.DNA和多肽等天然螺旋結構在對手性分子高效選擇性識別過程中,其自身螺旋構象起著至關重要的作用.因此,通過人工折疊體模擬天然螺旋結構來研究生命體內結構與功能之間的關系,對認識生命過程有著深遠的意義.
折疊體是建立在超分子化學、物理有機化學、化學生物學等多學科基礎上發展的新興學科[1-4].其概念為一類人工合成的,受非共價作用驅動而形成的具有穩定有序構象的寡聚物或聚合物[5].折疊體可分為以多肽為骨架結構的脂肪類和以氮雜環化合物為骨架結構的芳香類兩大類.目前,折疊體在手性誘導[6]、手性傳遞[7]、手性識別[8]與手性檢測[9]等方面已有相關研究.但在折疊體識別手性分子的研究中,大多基于折疊體形成的內部空腔包裹手性小分子的方式進行識別(即內識別方式),該方式要求折疊體具有足夠的鏈長以保證所形成的內腔尺寸,因而對折疊體的合成提出了極高的要求.而基于端基選擇的外識別方式的研究卻鮮見報道,這種方式對鏈長要求較低同時識別過程還可實現螺旋鏈的增長[10].Jiang等報道了具有多個喹啉酰胺結構單元的螺旋折疊體分子[11],當具有2個及2個以上喹啉酰胺結構時,結構單元間受分子內氫鍵作用驅動形成螺旋結構,而當喹啉結構單元數為2.5時,即可形成較完整的螺旋環狀結構.
本文在螺旋結構氨基端修飾(1S,4R)-坎烷酰基誘導形成單一右手螺旋折疊體[12],羧基端醛基功能化并合成具有不同結構單元數目的分子1g~4g(圖1).通過醛基端基選擇的外識別方式與手性萘乙胺(NEA)作用模擬天然螺旋結構的手性選擇,考察螺旋結構的形成對手性選擇性識別的影響.研究結果表明,具有一個完整螺旋環結構的3g對手性NEA具有突出的選擇性.
1實驗部分
1.1儀器與試劑
Bruker AV400和AV500核磁共振(NMR)儀,Bruker En Apex ultra 7.0T傅里葉變換質譜(FT-MS)儀.
鄰硝基苯胺(98%,質量分數,下同),二氧化硒(99%),巴豆醛(98%),鈀碳(10%)購買自阿拉丁試劑公司,(1S,4R)-坎烷酰氯(98%)購買自百靈威公司,R-/S-NEA(99%)購買自安耐吉公司.氘代試劑購自Sigma-Aldrich公司.其余均為國藥集團藥業股份有限公司試劑.
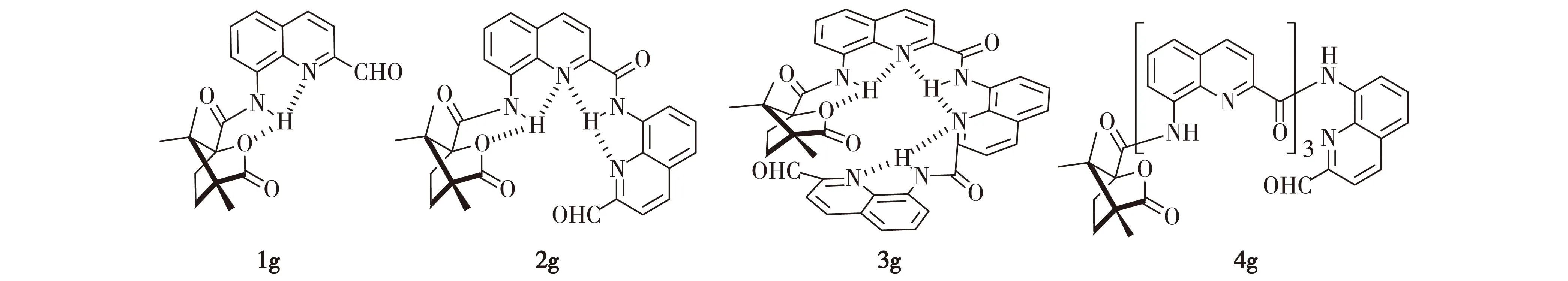
圖1 1g~4g分子結構Fig.1Chemical structures of 1g-4g
1.21g~4g分子的合成與鑒定
如圖2所示,1a(2.19 g,9.4 mmol)溶解于50 mL甲醇,加入鐵粉(1.58 g,28.2 mmol),9.4 mL乙酸,回流攪拌反應4 h.過濾除去鐵粉得到濾液,用二氯甲烷(30 mL×3,即每次30 mL,洗滌3次,下同)洗滌濾渣,合并濾液并旋轉蒸發除去有機溶劑.所得固體溶解于100 mL乙酸乙酯中,依次用飽和碳酸氫鈉溶液(100 mL×3)和飽和氯化鈉水溶液(100 mL×3)洗滌,無水硫酸鈉干燥,旋轉蒸發除去有機溶劑,得到棕色油狀1b(1.71 g,8.5 mmol),產率90.0%.
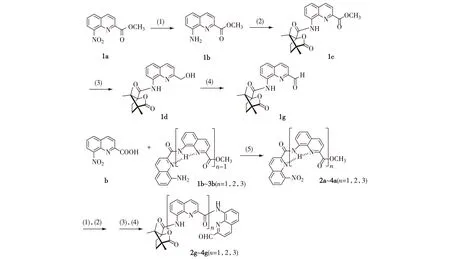
反應條件:(1) Fe,AcOH,MeOH,NaOH,回流;(2) (1S,4R)-坎烷酰氯,二氯甲烷,三乙胺,0~25 ℃;(3) NaBH4,0~25 ℃;(4) SeO2,1,4-二氧六環,90 ℃;(5) 二氯亞砜,二氧甲烷,三乙胺,0~25 ℃.圖2 1g~4g的合成Fig.2Synthesis of 1g-4g
1b(1.01 g,5.0 mmol)溶解于50 mL干燥的二氯甲烷中,加入三乙胺(2.1 mL,15.0 mmol),氮氣保護并保持冰浴條件.(1S,4R)-坎烷酰氯(1.29 g,6.0 mmol)溶解于10 mL二氯甲烷并滴加入反應體系.恢復室溫攪拌反應24 h,旋轉蒸發除去有機溶劑.所得固體溶于80 mL乙酸乙酯中,依次用飽和碳酸氫鈉溶液(80 mL×3)和飽和氯化鈉水溶液(80 mL×3)洗滌,無水硫酸鈉干燥.旋轉蒸發除去有機溶劑,硅膠色譜柱純化,洗脫劑為二氯甲烷,得到淺黃色固體1c(1.75 g,4.6 mmol),產率92.0%.
1c(0.76 g,2.0 mmol)溶解于30 mL四氫呋喃中,硼氫化鈉(0.76 g,20.0 mmol)溶解于30 mL乙醇,乙醇溶液滴加入四氫呋喃溶液中并保持冰浴條件.滴加完畢后,恢復室溫反應16 h,加入8 mL碳酸氫鈉和8 mL水終止反應.旋轉蒸發除去有機溶劑,二氯甲烷(30 mL×2)萃取水層,飽和氯化鈉水溶液(50 mL×2)洗滌有機相,無水硫酸鈉干燥,旋轉蒸發除去有機溶劑.硅膠色譜柱純化,洗脫劑為V(二氯甲烷)∶V(甲醇)=100∶0.4,得到產物為淺黃色固體1d(0.40 g,1.1 mmol),產率55.0%.
1d(0.40 g,1.1 mmol)溶解于20 mL 1,4-二氧六環,加入二氧化硒(0.24 g,2.2 mmol),90 ℃下反應2 h.冷卻至室溫,砂芯漏斗過濾得到濾液,30 mL二氯甲烷洗滌固體,旋轉蒸發除去有機溶劑.硅膠色譜柱純化,洗脫劑為二氯甲烷.得到產物為淺黃色固體1g(0.31 g,0.9 mmol),產率80.0%.
b(2.18 g,10.0 mmol)于25 mL圓底燒瓶,加入10 mL二氯亞砜,保持40 ℃攪拌反應4 h,旋轉蒸發除去有機溶劑,備用.1b(2.02 g,10.0 mmol)用50 mL干燥的二氯甲烷溶解于滴液漏斗中,加入三乙胺(4.2 mL,30 mmol),緩慢滴加入上述備用化合物中,反應12 h.反應完畢后,旋轉蒸發除去有機溶劑,依次用乙醇與乙醚洗滌得到部分純產物.旋轉蒸發除去洗液,硅膠色譜柱純化,洗脫劑為二氯甲烷.合并兩次產物,得到黃色固體2a(3.78 g,9.4 mmol),產率94.0%.3a和4a 的合成與2a類似.
2g~4g合成步驟按圖2中的條件(1)~(4)進行,不再贅述.2g為淡黃色固體,總產率17.3%;3g為黃色固體,總產率4.8%;4g為黃色固體,總產率2.2%.
產物1g~4g的NMR鑒定及FT-MS鑒定結果依次如下:
1)1H-NMR (400 MHz,CDCl3):δ10.74 (s,1H),10.29 (d,J=0.8 Hz,1H),8.89 (dd,J=7.6,1.4 Hz,1H),8.35 (dd,J=8.5,0.6 Hz,1H),8.11 (d,J=8.4 Hz,1H),7.74~7.69 (m,1H),7.66 (dd,J=8.3,1.4 Hz,1H),2.70 (ddd,J=13.3,10.6,4.3 Hz,1H),2.14 (ddd,J=13.4,9.2,4.6 Hz,1H),2.09~2.01 (m,1H),1.85~1.79 (m,1H),1.24 (s,3H),1.20 (s,3H),1.07 (s,3H).13C-NMR (125 MHz,CDCl3):δ193.01,177.66,165.98,150.70,138.31,137.69,134.40,130.10,129.94,122.36,117.91,117.83,92.64,55.51,54.40,30.64,29.21,16.80,16.71,9.80.MS(m/z):理論相對分子質量[M+H]+為353.150 1,測定值為353.149 4.
2)1H-NMR (500 MHz,CDCl3):δ11.98 (s,1H),10.63 (s,1H),10.33 (s,1H),9.12~9.00 (m,2H),8.54 (d,J=8.4 Hz,1H),8.47 (d,J=8.5 Hz,1H),8.39 (d,J=8.4 Hz,1H),8.11 (d,J=8.4 Hz,1H),7.79 (t,J=7.9 Hz,1H),7.72 (dd,J=11.9,6.5 Hz,3H),2.73 (ddd,J=14.8,10.9,4.3 Hz,1H),2.19 (ddd,J=13.8,9.3,4.5 Hz,1H),1.98 (ddd,J=15.3,10.9,4.5 Hz,1H),1.66 (ddd,J=13.4,9.3,4.3 Hz,1H),1.18 (s,3H),0.97 (s,3H),0.91 (s,3H).13C-NMR (125 MHz,CDCl3):δ193.68,176.72,166.25,162.85,150.79,149.62,138.97,138.36,137.47,137.31,135.14,134.01,130.06,129.91,129.47,128.98,122.73,122.39,120.17,118.34,118.15,117.75,92.42,55.20,54.46,30.65,28.99,16.77,16.55,9.59.MS(m/z):理論相對分子質量[M+H]+為523.198 1,測定值為523.198 3.
3)1H-NMR (500 MHz,CDCl3):δ12.28 (s,1H),12.25 (s,1H),10.16 (s,1H),9.17 (d,J=7.7 Hz,1H),9.08 (d,J=7.3 Hz,1H),8.53 (dd,J=23.0,8.5 Hz,3H),8.46 (dd,J=8.4,5.0 Hz,2H),8.05 (d,J=8.3 Hz,1H),7.94 (dd,J=7.6,1.1 Hz,1H),7.80~7.73 (m,3H),7.65~7.59 (m,1H),7.57 (dd,J=8.3,1.0 Hz,1H),7.35 (t,J=8.0 Hz,1H),7.24 (d,J=8.4 Hz,1H),2.28 (ddd,J=13.4,10.8,4.3 Hz,1H),1.96 (ddd,J=13.5,9.3,4.5 Hz,1H),1.82 (ddd,J=13.0,10.8,4.5 Hz,1H),1.68~1.62 (m,1H),0.87 (d,J=7.6 Hz,6H),0.57 (s,3H).13C-NMR (101 MHz,CDCl3):δ190.71,176.61,165.02,163.62,162.38,149.20,149.08,139.18,138.16,138.11,137.83,137.12,136.42,135.13,134.49,132.79,130.11,129.77,129.51,129.34,128.99,128.75,122.51,122.17,122.02,119.83,117.62,117.06,116.81,116.70,91.98,54.93,54.25,29.32,28.82,16.38,16.35,9.65.MS (m/z):理論相對分子質量[M+H]+為715.228 1,測定值為715.228 5.
4)1H-NMR (500 MHz,CDCl3):δ12.42 (s,1H),11.90 (s,1H),11.63 (s,1H),9.98 (s,1H),9.20 (d,J=7.4 Hz,1H),8.68 (d,J=7.5 Hz,1H),8.47 (dd,J=14.8,7.5 Hz,4H),8.09 (t,J=7.8 Hz,2H),7.99 (d,J=8.3 Hz,1H),7.95 (d,J=7.5 Hz,1H),7.90 (d,J=7.5 Hz,1H),7.80 (d,J=7.9 Hz,1H),7.76 (t,J=7.9 Hz,1H),7.71 (d,J=7.8 Hz,1H),7.66 (d,J=8.2 Hz,2H),7.57 (t,J=7.8 Hz,2H),7.37 (dd,J=16.3,8.2 Hz,2H),7.21 (d,J=8.3 Hz,1H),2.32 (t,J=9.7 Hz,1H),2.15 (d,J=9.5 Hz,1H),1.84~1.74 (m,1H),0.81 (s,3H),0.77 (s,3H),0.40 (s,3H).13C-NMR (125 MHz,CDCl3):δ190.52,176.51,164.88,163.58,160.76,160.63,149.14,149.06,148.77,147.28,138.79,138.74,138.18,137.72,137.10,137.05,136.18,134.67,134.03,133.49,132.52,129.82,129.76,129.57,129.28,129.24,129.10,128.59,128.47,122.54,122.37,122.08,121.93,119.80,119.53,118.65,117.90,116.95,116.64,116.54,116.07,92.04,54.83,54.25,29.68,29.17,28.80,16.25,9.56.MS (m/z):理論相對分子質量[M+H]+為885.276 1,測定值為885.275 5.
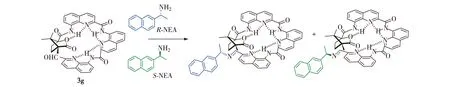
圖3 3g分別與R-NEA和S-NEA作用的化學結構示意圖Fig.3Chemical structures of 3g with R-NEA and S-NEA separately
1.3實驗方法
1.3.1樣品配制
1g~4g溶液(A)配制:稱取相應量醛基化合物溶于1.00 mL氘代三氯甲烷,配成濃度為0.015 mol/L母液.
R-/S-NEA溶液配制:稱取2.6 μgR-/S-NEA溶于1.00 mL氘代二甲亞砜,配成濃度為0.015 mol/L的母液.
1g~4g分別與R-/S-NEA作用的反應速率測定實驗溶液配制:0.20 mL A+0.20 mLR-NEA(或S-NEA)+0.20 mL氘代二甲亞砜.
1g~4g手性選擇性競爭實驗溶液配制:0.20 mL A+0.20 mLR-NEA+0.20 mLS-NEA.
1.3.2動力學擬合
反應遵循一級動力學[8],反應速度方程式為:
r=-dc/dt=kc.
其中c為t時化合物濃度,dc為時間dt時濃度,t為反應時間,k為一級動力學反應速率常數.
經過推導可得
-ln(c/c0)=kt,
其中c0為起始濃度.
2結果與討論
2.11g~4g分別與R-/S-NEA作用的反應速率分析
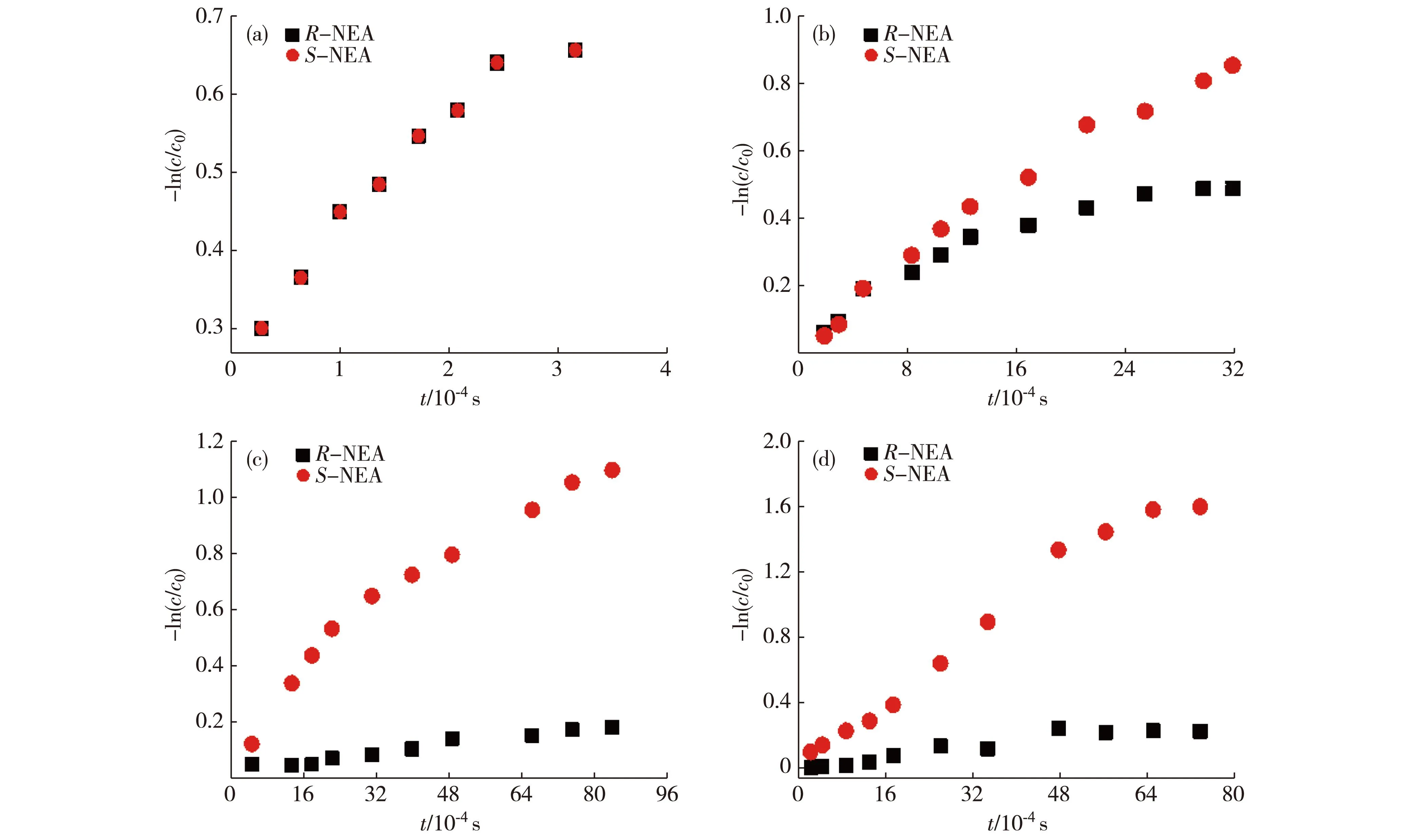
實驗檢測過程以3g分別與R-/S-NEA作用為例進行說明.3g與R-NEA和S-NEA作用生成2種產物(圖3),運用NMR技術進行實時監測(圖4),對NMR吸收峰面積積分并計算相應手性產物的含量.類似地,對1g、2g和4g分別與R-/S-NEA作用情況進行分析.通過一級動力學方程擬合(圖5),得到相應反應速率數據(表1).
由表1可見,1g~3g隨著喹啉酰胺單體數目的增多,反應速率逐漸減小.由于從1g到3g螺旋結構逐漸形成,使得在與手性NEA作用時作用位點處空間位阻不斷增大,從而導致其與R-/S-NEA作用的反應速率逐漸減低.有趣的是,4g的反應速率較3g的反應速率大,這可能是由于3g恰好形成一個完整的螺旋環結構,(1S,4R)-坎烷酰基對醛基具有較大的空間位阻效應,降低了醛基與NEA的作用.而4g是在形成螺旋環后又增加一個喹啉單體結構,導致螺旋結構繼續延伸,這樣便使(1S,4R)-坎烷酰基遠離醛基,空間位阻降低.因此在剛好形成一個完整的螺旋環結構(3g)時反應速率是最低的.
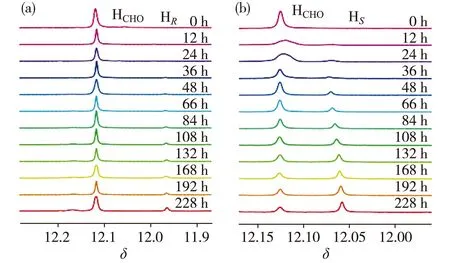
實驗條件:在室溫25 ℃、V(氘代三氯甲烷)∶V(氘代二甲亞砜)=1∶2的混合溶劑中,3g、R-NEA和S-NEA的濃度均為5 mmol/L.圖中HCHO為3g的吸收峰,HR和HS分別為3g與R-NEA和S-NEA作用產生的吸收峰.圖4 3g分別與R-NEA(a)和S-NEA(b)作用隨時間變化的1H-NMR譜圖Fig.4Time dependent 1H-NMR spectra showing reaction of 3g with R-NEA (a) and S-NEA (b) separately

實驗條件:在室溫25 ℃、V(氘代三氯甲烷)∶V(氘代二甲亞砜)=1∶2的混合溶劑中,1g、2g、3g、4g以及R-NEA和S-NEA濃度均為5 mmol/L.圖5 1g (a)、2g (b)、3g (c)、4g (d)分別與R-/S-NEA作用結果的一級動力學擬合Fig.5First-order kinetic plots for the reactions of 1g (a),2g (b),3g (c) and 4g (d) with R-and S-NEA separately
對比1g~4g分別與R-/S-NEA作用的反應速率常數kR和kS可見:由于1g還不具有螺旋結構,1g與R-/S-NEA作用反應速率常數kR與kS基本沒有區別.2g與R-/S-NEA作用反應速率常數kR與kS區別仍不顯著,此時2g僅僅初步具有螺旋結構,在與手性NEA作用時仍未表達出明顯的手性選擇性.3g與R-/S-NEA作用的kS為1.38×10-2s-1,kR僅為0.33×10-2s-1,kS約為kR的4倍,說明與R-NEA相比較,3g較容易與S-NEA反應,表現出較好的手性選擇性.由于此時3g恰好形成一個完整的螺旋環結構,說明螺旋結構的形成有利于3g對手性NEA選擇性識別.4g與R-/S-NEA作用的kR為0.66×10-2s-1,kS為1.77×10-2s-1,說明與R-NEA相比較,4g也較容易與S-NEA反應,與3g結果一致.由于3g與4g結構上的區別,使得R-/S-NEA均較容易與4g作用,導致4g對R-/S-NEA手性選擇性較3g差,因此在剛好形成一個完整的螺旋環結構(3g)時對R-/S-NEA手性選擇性最好,此時較容易與S-NEA作用.
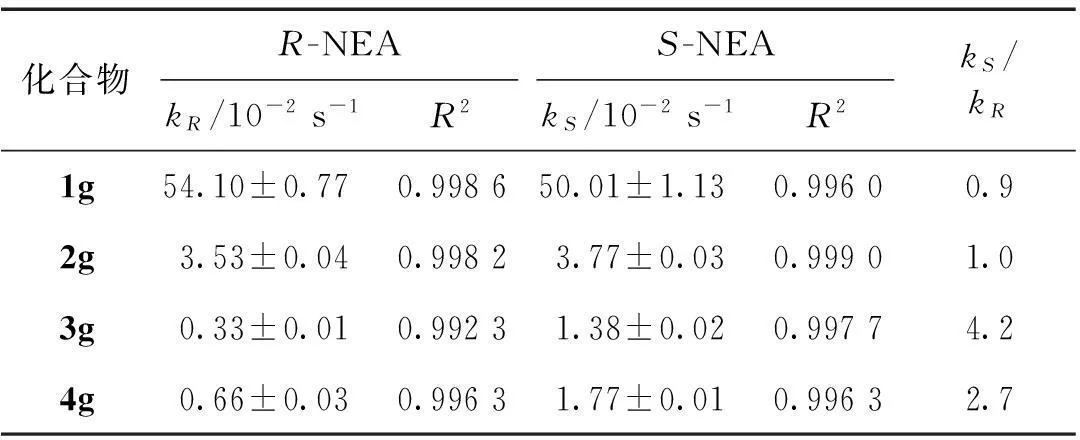
表1 1g~4g分別與R-/S-NEA作用的反應速率常數
2.21g~4g手性選擇性競爭實驗
運用NMR技術考察R-NEA和S-NEA等量共存時與1g~4g的作用情況,通過NMR吸收峰積分面積計算2種手性產物的含量,并對時間作圖(圖6).
實驗條件:在室溫25 ℃、V(氘代三氯甲烷)∶V(氘代二甲亞砜)=1∶2的混合溶劑中,1g、2g、3g、4g以及R-NEA和S-NEA濃度均為5 mmol/L.圖6 1g(a)、2g(b)、3g(c)、4g(d)與R-/S-NEA競爭作用結果Fig.6Plots for the competition reaction of racemic NEA with 1g (a),2g (b),3g (c) and 4g (d)
手性分子只有在作用位點處與螺旋構型具有較高匹配度的情況下才能優先結合獲得較大量的產物.實驗數據表明,當1g與R-NEA和S-NEA消旋體系進行作用時產物質量比m(R1g)/m(S1g)=1.00/1.00,即1g有基本相同的機會與R-NEA和S-NEA作用,作用過程中沒有表現出手性選擇性.與R-NEA相比較,2g較容易與S-NEA反應(m(R2g)/m(S2g)=1.00/1.49),可見盡管2g沒有形成一個完整的螺旋環結構,但已初步具有一定的手性選擇性.3g對手性NEA的選擇性最大(m(R3g)/m(S3g)=1.00/4.10),說明隨著螺旋結構的逐漸形成,有利于3g對手性NEA的選擇性識別.4g對手性NEA選擇性(m(R4g)/m(S4g)=1.00/3.90)較3g有所降低,說明恰好形成一個完整的螺旋環結構時對手性NEA的選擇性最好.此外,與R-NEA相比較,2g~4g均較容易與S-NEA作用.這一選擇性結果總體與2g~4g分別同R-/S-NEA作用時反應速率結果基本一致.
3結論
以喹啉酰胺為結構單元,通過在折疊體羧基末端引入活性官能團結構醛基合成了具有單一螺旋方向的人工螺旋折疊體1g~4g.其中1g對手性NEA沒有表現出手性選擇性,2g對手性NEA選擇性亦不明顯.隨著螺旋結構的逐漸形成,3g與4g可對不同手性NEA進行選擇性識別,說明螺旋結構的形成有助于對手性分子的選擇性識別,并且恰好形成一個完整的螺旋環結構時對手性NEA的選擇性最好.相較于R-NEA,2g~4g均易與S-NEA作用,說明S-NEA在與醛基作用時,其構型與螺旋構型恰好具有較高匹配度.本文研究結果將為模擬生命物質螺旋結構在手性識別方面研究提供思路.
參考文獻:
[1]SEEBACH D,MATTHEWS J L.β-peptides:a surprise at every turn[J].Chem Commun,1997,21:2015-2022.
[2]STIGERS K D,SOTH M J,NOWIEK J S.Designed molecules that fold to mimic protein secondary structures[J].Curr Opin Chem Biol,1999,3(6):714-723.
[3]SANFORD A R,GONG B.Evolution of helical foldamers[J].Curr Org Chem,2003,7(16):1649-1659.
[4]ZHANGTING L.Hydrogen bonded arylamide foldamers:from conformational control to functional evolution[J].Progress Chem,2011,23(1):1-12.
[5]HILL D J,MIO M J,MOORE J S,et al.A field guide to foldamers[J].Chem Rev,2001,101(12):3893-4012.
[6]NONOKAWA R,YASHIMA E.Detection and amplification of a small enantiomeric imbalance inα-amino acids by a helical poly(phenylacetylene) with crown ether pendants[J].J Am Chem Soc,2003,125(5):1278-1283.
[7]BROWN R A,DIEMER V,WEBB S J,et al.End-to-end conformational communication through a synthetic purinergic receptor by ligand-induced helicity switching[J].Nature Chem,2013,5(10):853-860.
[8]WU Z Q,NAGAI K,YASHIMA E,et al.Enantiomer-selective and helix-sense-selective living block copolymerization of isocyanide enantiomers initiated by single-handed helical poly(phenyl isocyanide)s[J].J Am Chem Soc,2009,131(19):6708-6718.
[9]GHOSN M W,WOLF C.Synthesis,conformational stability,and asymmetric transformation of atropisomeric 1,8-bisphenolnaphthalenes[J].J Org Chem,2011,76(10):3888-3897.
[10]BYRNE L,SOLA J,CLAYDEN J.Screw sense alone can govern enantioselective extension of a helical peptide by kinetic resolution of a racemic amino acid[J].Chem Commun,2015,51(54):10965-10968.
[11]JIANG H,LEGER J M,HUC I,et al.Aromatic δ-peptides:design,synthesis and structural studies of helical,quinoline-derived oligoamide foldamers[J].Tetrahedron,2003,59(42):8365-8374.
[12]KENDHAL A M,PONIMAN L,HUC I,et al.Absolute control of helical handedness in quinoline oligoamides[J].J Org Chem,2011,76(1):195-200.
Synthesis and Chiral Recognition of Aldehyde Group Functionalised Quinoline Helical Foldamers
WU Wenlu,LI Zhao,LIU Yuchen,LIN Jianbin,JIANG Yunbao*
(Key Laboratory of Spectrochemical Analysis & Instrumentation,Ministry of Education,College of Chemistry and Chemical Engineering,Xiamen University,Xiamen,361005,China)
Abstract:A series of oligoamides based on the 8-aminoquinoline-4-carboxylic acid repeating unit were designed and synthesized,in which the N-terminus was modified with the (1S,4R)-camphanoyl acyl group and the C-terminus was functionalised with an aldehyde group.These oligoamides were further served as a model compound to investigate the relationship between helical structure and chiral selectively.Our study revealed that 3g exhibited the largest chiral selectivity towards chiral naphthylamine (the relative ratio of competition reaction product m(R3g)/m(S3g)=1.00/4.10) in an exo recognition model,by taking advantage of the formation of a helical structure.
Key words:helical foldamers;chiral recognition;exo recognition
doi:10.6043/j.issn.0438-0479.2016.03.002
收稿日期:2015-08-23錄用日期:2015-09-11
基金項目:國家自然科學基金(91127019,21275121,J1030415);國家重點基礎研究發展計劃(973計劃)(2011CB910403)
*通信作者:ybjiang@xmu.edu.cn
中圖分類號:O 657.39
文獻標志碼:A
文章編號:0438-0479(2016)03-0309-07
引文格式:吳雯路,黎朝,劉宇宸,等.醛基功能化喹啉螺旋折疊體的合成及手性識別研究.廈門大學學報(自然科學版),2016,55(3):309-315.
Citation:WU W L,LI Z,LIU Y C,et al.Synthesis and chiral recognition of aldehyde group functionalised quinoline helical foldamers.Journal of Xiamen University(Natural Science),2016,55(3):309-315.(in Chinese)

