納他霉素高產菌株選育及發酵工藝優化
張帥瀅,韋蘭蘭,張 穎,何 佳,2,王大紅,2
(1.河南科技大學 食品與生物工程學院,河南 洛陽 471023;2.洛陽市微生物發酵工程技術研究中心,河南 洛陽 471023)
?
納他霉素高產菌株選育及發酵工藝優化
張帥瀅1,韋蘭蘭1,張穎1,何佳1,2,王大紅1,2
(1.河南科技大學 食品與生物工程學院,河南 洛陽 471023;2.洛陽市微生物發酵工程技術研究中心,河南 洛陽 471023)
摘要:以納塔爾鏈霉菌(Streptomyces natalensis)4.3505為出發菌株,以紫外線作為誘變方法,篩選抗乙酸鈉高產納他霉素的突變菌株,優化發酵條件,篩選誘導子及添加工藝。研究結果表明:高產突變菌株為納塔爾鏈霉菌HW-2,其納他霉素產量在發酵120 h后達到452.2 mg/L,比原始菌株提高了242.6%,該菌株遺傳性能穩定。納塔爾鏈霉菌HW-2生產納他霉素最佳發酵條件:接種量為發酵液總體積的6%,250 mL三角瓶裝液量為30 mL,初始pH值為7.5。乙酸鈉為最佳前體物質,乙酸鈉的質量分數為0.2%,添加時間為發酵后24 h。
關鍵詞:納塔爾鏈霉菌;納他霉素;菌株選育;發酵條件
0引言
納他霉素(natamycin,也稱匹馬菌素)是由褐黃孢鏈霉菌(Streptomycesgilvosporeus)、納塔爾鏈霉菌(Streptomycesnatalensis)和恰塔努加鏈霉菌(Streptomyceschattanoogensis)等菌株產生的一種能有效抑制真菌生長和真菌毒素產生的二十六元環多烯類抗真菌抗生素[1],具有低劑量、高效率和高安全性等特點。該物質無抗細菌活性,與乳酸鏈球菌肽結合使用可起到很好的防腐作用[2]。因此,1982年,美國食品和藥物管理局正式批準納他霉素可以用作食品防腐劑。1997年,中國衛生部批準納他霉素可以用作食品防腐劑[3]。
雖然納他霉素在食品原料保鮮和成品防腐方面的應用顯示了良好前景,但是因成本太高而限制了其使用。目前,發酵法生產納他霉素是一個很好的發展方向。工業上納他霉素的生產菌主要為納塔爾鏈霉菌和褐黃孢鏈霉菌[4]。國外關于納他霉素發酵方面的研究比較深入和成熟[5],文獻[6]報道了連續發酵法可使納他霉素產量達6~12 g/L。國內的學者也做了相關的研究工作[7-8],對褐黃孢鏈霉菌研究較多,而對納塔爾鏈霉菌的菌株選育研究較少[9]。因此,本文主要根據納他霉素的生物合成途徑,篩選抗乙酸鈉的高產突變菌株,并對其發酵工藝進行了研究。
1材料與方法
1.1材料
納塔爾鏈霉菌(Streptomycesnatalensis)4.3505,購于中國普通微生物菌種保藏管理中心;納他霉素標準品,Sigma公司生產;蛋白胨、酵母粉、麥芽浸粉、牛肉膏、胰蛋白胨,購于北京奧博星公司;葡萄糖、乙酸鈉、丙酸鈉,國藥集團生產。
試驗儀器:高效液相色譜(HPLC1260),安捷倫公司;LS-B50型滅菌器,上海博迅設備廠;HYL-C型恒溫搖床,江蘇太倉強樂實驗設備廠。
納塔爾鏈霉菌培養基分為平板培養基、種子培養基和發酵培養基。平板培養基成分為:葡萄糖10 g/L,麥芽浸粉3 g/L,蛋白胨5 g/L,酵母粉3 g/L,瓊脂20 g/L,水1 L,pH7.0。種子培養基成分為:葡萄糖10 g/L,胰蛋白胨5 g/L,氯化鈉10 g/L,水1 L,pH7.0。發酵培養基成分為:葡萄糖30 g/L,酵母浸膏2 g/L,牛肉膏10 g/L,水1 L,pH7.0。
1.2方法
1.2.1納塔爾鏈霉菌培養及孢子懸液的制備
將S.natalensis4.3505接種于斜面培養基,28 ℃培養5~7 d,觀察其生長情況。取斜面試管中生長較好的菌種,加入10 mL已經滅過菌的生理鹽水,將孢子振蕩洗下,然后倒入50 mL滅過菌的含有玻璃珠的三角瓶中,用振蕩器振蕩30 min后過濾,將溶液的孢子濃度調至108個/mL。
1.2.2納他霉素的發酵和菌體生物量的測定
將培養48 h的納他霉素種子培養基以2%(體積分數)的接種量加入發酵培養基中,在28 ℃、180 r/min條件下培養108 h。發酵結束后取3 mL發酵液置于已知質量的5 mL干燥離心管中,10 000 r/min離心10 min,棄上清液。沉淀中再加入3 mL去離子水洗滌沉淀2次,棄上清留沉淀后將沉淀置于65 ℃的烘箱內干燥8 h,稱質量。
1.2.3納他霉素含量的測定
取2 mL發酵液和18 mL甲醇混合,搖床上充分振蕩2 h后,10 000 r/min離心10 min,吸取離心后的上清液,使用0.45 μm微孔濾膜過濾,過濾液即為待測液。
色譜柱:型號為YMC-Pack ODS C18,柱長250 mm,柱直徑4.6 mm,流動相為V(水)∶V(甲醇)=35∶65,流速為0.8 mL/min,檢測波長λ=304 nm。
1.2.4高產納他霉素菌株的選育
(1)不同質量分數乙酸鈉溶液對菌體生成的影響
制備含有不同質量分數乙酸鈉溶液(0.02%、0.04%、0.08%、0.10%、0.15%和0.20%)的平板培養基,將制備好的0.2 mL孢子懸液分別涂布于平板培養基上,28 ℃恒溫培養箱中培養5~7 d。觀察不同平板培養基上的菌落生長情況,確定乙酸鈉對該菌的最低抑制質量分數。
(2)納塔爾鏈霉菌的紫外線誘變處理
取濃度為108個/mL的孢子懸液10 mL置于直徑為9 cm的已滅菌的培養皿中,在距15 W紫外燈30 cm處進行不同時間的照射 (照射時間分別為5 s、10 s、20 s、30 s、40 s、50 s和60 s),同時均勻攪拌。對每個樣品進行梯度稀釋,分別取稀釋度為10-4、10-5和10-6的菌懸液0.2 mL,將其涂布在平板培養基上,每個梯度進行3次重復,28 ℃培養,7 d后計算菌落數,統計致死率并確定誘變時間。
(3)高產菌株的篩選
選擇最佳誘變時間處理菌懸液0.2 mL,將其涂布于含有最低抑制質量分數的乙酸鈉平板培養基上,28 ℃恒溫培養7~10 d,觀察菌落生長狀況。待菌落長出后,將菌落分別接種于斜面培養基中,28 ℃培養7~10 d,測定其發酵性能。
1.2.5高產菌株的遺傳穩定性試驗
將誘變獲得的抗乙酸鈉高產菌株連續培養5代,經發酵測定其納他霉素的產量,觀察突變菌株的遺傳穩定性。
1.2.6發酵條件的優化和前體物質的篩選
分別考察接種量、溶氧和初始pH值對納他霉素產生的影響。在發酵培養基中分別添加質量分數為0.1%的乙酸鈉、丙酸鈉,體積分數為0.1%的乙醇、正丁醇、乳酸、檸檬酸和異丁醇作為前體添加物,篩選出最佳前體物質,并對添加量和添加時間進行了優化。
2結果與分析
2.1不同質量分數乙酸鈉溶液對菌體生成的影響
根據納他霉素的生物合成途徑,二碳和三碳小分子物質為其生物合成的前體,但前體也具有一定的毒性,濃度越大,其毒性越強。因此,通過測定不同質量分數乙酸鈉溶液對菌體生長的影響,確定最低抑制質量分數,結果見表1。從表1中可以看出:0.15%乙酸鈉能夠完全抑制納塔爾鏈霉菌的生長。

表1 不同質量分數乙酸鈉溶液對菌體生長的影響

圖1 紫外線照射時間對納塔爾鏈霉菌致死率的影響
2.2紫外線照射時間的確定
在一定的范圍內,照射時間越長,微生物突變率也越高,但超過此范圍時,突變率將下降。本研究采用紫外線照射,照射距離為30 cm,照射時間分別為5 s、10 s、20 s、30 s、40 s、50 s和60 s,以不經過紫外照射的菌株為對照。不同紫外線照射時間對納塔爾鏈霉菌致死率的影響結果見圖1。
致死率過高或過低都不利于誘變菌株的篩選,一般致死率為85%~90%效果較好[10],菌株的正突變概率較高,有利于突變株的進一步篩選。從圖1中可以看出:照射時間為50 s時,納塔爾鏈霉菌的致死率為87.10%,處于85%~90%區間內,所以選擇最佳誘變時間為50 s。
2.3紫外線照射誘變結果
經過紫外線照射誘變,共獲得56株突變菌株,經過發酵性能測試,其中5株菌株出現了正突變,分別命名為HW-2、HW-8、HW-10、HW-12和HW-26。5株突變菌株的納他霉素產量如表2所示。由表2可知:5株誘變菌株與親本的納他霉素產量相比,HW-2產量最高,為452.2 mg/L。

表2 5株突變菌株的納他霉素產量 mg/L
2.4突變菌株遺傳穩定性研究
為了觀察篩選到的高產突變菌株的遺傳穩定性,對誘變選育的5株菌株分別進行傳代,共傳5代,結果見表3。由表3可以看出:HW-2、HW-12和HW-26菌株遺傳性比較穩定,其中,HW-2菌株納他霉素產量基本維持在450 mg/L左右,說明突變菌HW-2具有較好的遺傳穩定性,而HW-8和HW-10菌株的遺傳穩定性較差。

表3 高產突變菌株遺傳穩定性試驗

圖2 納塔爾鏈霉菌突變菌株HW-2的發酵過程曲線
2.5納他霉素搖瓶發酵過程曲線
對納塔爾鏈霉菌HW-2的發酵時間進行了考察,在發酵第1~7天,分別檢測納他霉素和細胞生長的變化,結果如圖2所示。從圖2中可以看出:納他霉素的產量從第2天到第6天快速上升,第6天時,產量上升到513 mg/L。但是隨著發酵時間的延長,納他霉素產量下降。因此,納他霉素的最佳發酵時間是6 d。而發酵液中納塔爾鏈霉菌的菌體質量濃度在第4天時達到最大值62 g/L。
2.6發酵條件的優化
2.6.1接種量
接種量的大小與菌種特性和發酵條件等有關,不同微生物發酵的接種量有所不同。將種子液分別按體積分數為1%、2%、3%、4%、5%、6%和7%的接種量接入發酵培養基中,培養6 d后測定納他霉素的產量,結果見表4。
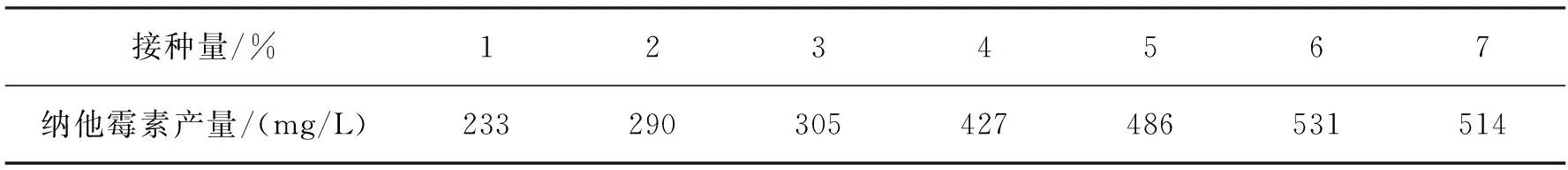
表4 接種量對納他霉素產量的影響
由表4可以看出:不同接種量對菌體產納他霉素的影響很大。菌體的生長需要一定的密度,接種量小會導致菌體生長緩慢,菌體生長會消耗掉大量營養物質,從而影響了納他霉素的產量;接種量大會使菌體生長過快,導致菌體過早衰老,也會影響納他霉素的產量。接種量在6%(體積分數)時,納他霉素的產量最大,達531 mg/L。
2.6.2溶氧
納塔爾鏈霉菌是好氧菌,氧氣對菌體生長和納他霉素產生的影響很大。在固定搖床轉速條件下,設置不同的搖瓶裝液量,導致發酵培養基中的溶解氧不同,納他霉素的產量會不同。表5為溶氧對納他霉素產量的影響。由表5可以看出:當250 mL三角瓶中裝液量為30 mL時,納他霉素產量達到最大值830 mg/L。
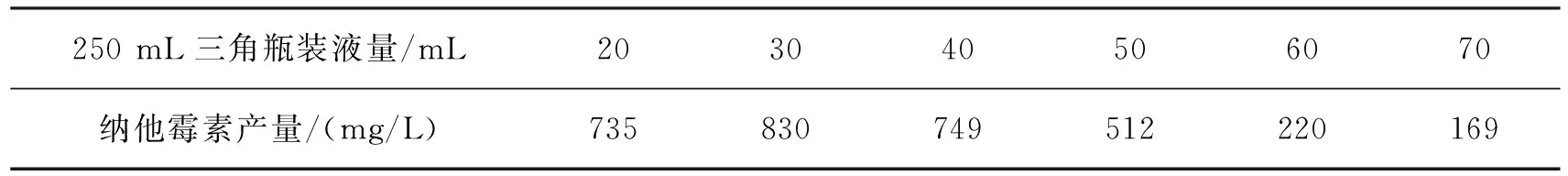
表5 溶氧對納他霉素產量的影響
2.6.3初始pH值
在250 mL三角瓶中裝入28.2 mL發酵培養基,并分別用1 mol/L HCl或1 mol/L NaOH溶液將培養基pH值調為6.0、6.5、7.0、7.5、8.0和8.5,接入1.8 mL種子液,培養6 d后,測定納他霉素的產量。結果如表6所示。

表6 初始pH值對納他霉素產量的影響
從表6可以看出:初始pH值在7.5時,納他霉素的產量最高,達885 mg/L。但隨著初始pH值的進一步升高,納他霉素產量開始下降。這可能是因為在不同的pH值條件下,納他霉素合成途徑中一些關鍵酶的活性不同。所以在納他霉素發酵時,應將初始pH值控制在7.5。
2.7前體物質對納他霉素產量的影響
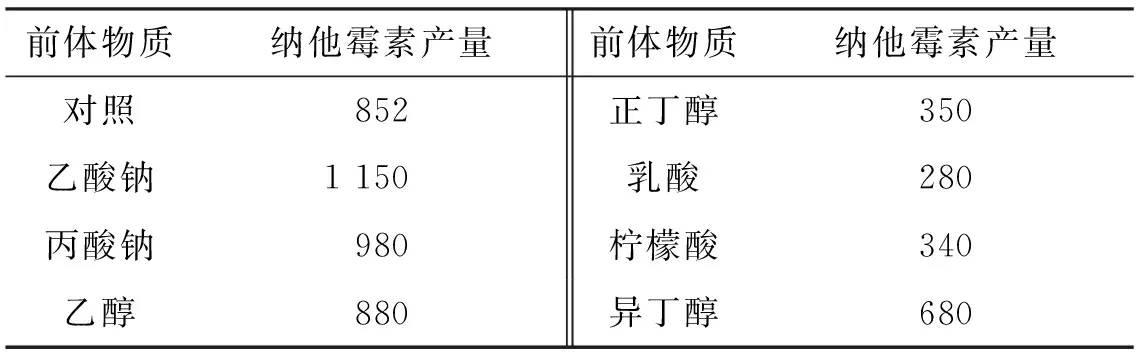
表7 不同前體物質對納他霉素合成的影響 mg/L
2.7.1不同前體物質對納他霉素產量的影響
根據納他霉素的生物合成途徑,本試驗選用乙酸鈉、丙酸鈉、乙醇、正丁醇、乳酸、檸檬酸和異丁醇作為前體添加物,在發酵時按0.1%的比例分別加入,采用上文已優化的發酵條件,發酵6 d,納他霉素產量如表7所示。由表7可知:添加乙酸鈉或丙酸鈉后,納他霉素產量有顯著的提高,其中以乙酸鈉效果最好,產量達到1 150 mg/L,比對照提高了35%。因此試驗最終選用乙酸鈉為前體物質。
2.7.2乙酸鈉添加量和添加時間對納他霉素產量的影響
分別向發酵培養基中添加質量分數為0.05%、0.10%、0.20%、0.40%、0.60%、0.80%和1.00%的乙酸鈉,發酵6 d后檢測納他霉素的產量,結果如表8所示。從表8可以看出:在乙酸鈉質量分數為0.20%時,納他霉素的產量最高,達到1 380 mg/L。當質量分數大于0.20%時,納他霉素的產量卻降低,這主要是因為大量的乙酸鈉會對菌體造成一定的毒性,導致納他霉素的產量降低,乙酸鈉質量分數越大,其毒性越大。因此,最終選擇乙酸鈉添加量為0.20%。
分別在發酵培養0 h、12 h、24 h、36 h、48 h、60 h、72 h和84 h時加入0.20%乙酸鈉,發酵6 d后檢測納他霉素的產量,結果如表9所示。由表9可看出:在發酵24 h時添加乙酸鈉效果最好,納他霉素的產量最高,達到了1 550 mg/L。因此,本試驗選擇在發酵24 h時添加0.20%乙酸鈉。

表8 乙酸鈉質量分數對納他霉素產量的影響

表9 乙酸鈉添加時間對納他霉素產量的影響
3討論
近年來,以乳酸鏈球菌素和納他霉素為代表的生物防腐劑受到全球市場的青睞,有逐漸替代化學防腐劑的趨勢。目前,納他霉素的生產主要采用發酵法。中國對于納他霉素的研究始于1995 年,研究者分別采用了菌株選育、發酵條件優化和真菌誘導等方式來提高納他霉素的產量[11-13],但與國外報道的產量相比,還有一定的差距。除此之外,采用物理方法和化學方法對微生物菌種進行選育也是最普遍的方法,并結合抗生素、前體和結構類似物等篩選劑進行選擇性篩選[14]。文獻[15-16]分別采用亞硝基胍和紫外線對納他霉素產生菌進行選育,并對其發酵條件進行優化,均獲得了較好的效果。
納他霉素的生物合成途徑可以分解為活化前體(乙酰輔酶A 和丙二酰輔酶A)的生成、大環內酯的生物合成和氨基糖的形成,二碳和三碳類物質是該物質的前體(如乙酸、丙酸和丁醇等),但過量的前體物質嚴重影響S.natalensis的生長和納他霉素的生物合成[17],因此,選育耐前體突變株是提高納他霉素產量的有效方法。本文采用紫外誘變與乙酸鈉抗性篩選相結合的方法,篩選到一株遺傳性能穩定的納他霉素高產菌株S.natalensisHW-2,并采用搖瓶發酵試驗得出篩選到的菌種性能比原始菌株提高了2倍,使原菌種生產納他霉素的能力提高,而且該突變株更能夠耐受乙酸鈉。研究了S.natalensisHW-2發酵過程曲線,優化了該菌的發酵條件。探討了不同的前體物質對納他霉素生物合成的影響,認為乙酸鈉為最佳前體物質,并優化了乙酸鈉的添加時間和添加量。通過發酵條件的優化和前體物質的添加,有效地提高了納他霉素的產量。雖然本研究所采用的抗乙酸鈉篩選方法有一定的效果,但未考慮其他生物途徑中其他前體物質對納他霉素生物合成的影響,在高產菌的篩選上存在著一定的局限性,并且誘變后菌株出現正突變的概率比較小。因此,今后可以選用化學方法誘變或者物理化學復合誘變的方法來提高納他霉素的產量。
參考文獻:
[1]CLARA F,MARTIN M,MIGUEL A,et al.Cerqueira functional characterisation and antimicrobial efficiency assessment of smart nanohydrogels containing natamycin incorporated into polysaccharide-based films[J].Food and bioprocess technology,2015,8(7):1430-1441.
[2]高玉榮,王雪平.天然抗真菌食品生物防腐劑-納他霉素的性質及在食品中的應用[J].農產品加工(學刊),2009(5):7-9.
[3]李勃,馮光利,王長曄.納他霉素產業發展現狀及前景分析[J].保鮮與加工,2011,11(2):49-53.
[4]李東,杜連祥,路福平.生物食品防腐劑-納他霉素發酵工藝研究[J].食品工業科技,2004,25(10):111-114.
[5]ATTA H M,EL-SAYED A S,EL-DESOUKEY M A,et al.Biochemical studies on the natamycin antibiotic produced byStreptomyceslydicus:fermentation,extraction and biological activities[J].Journal of Saudi chemical society,2015,19(4):360-371.
[6]P.T.奧爾森.連續發酵法生產納他霉素:CN1070688A[P].1993.
[7]LUO J,LI J,LIU D,et al.Genome shuffling ofStreptomycesgilvosporeusfor improving natamycin production[J].Journal of agriculture food chemistry,2012,60:6026-6036.
[8]LIANG J,XU Z,LIU T,et al.Effects of cultivation conditions on the production of natamycin withStreptomycesgilvosporeusLK-196[J].Enzyme microbiology technology,2008,2:145-150.
[9]駱健美.納他霉素高產菌株選育、發酵條件優化、發酵動力學及溶解度的研究[D].杭州:浙江大學,2005.
[10]卜美玲.納他霉素高產菌株的誘變選育及發酵工藝的優化[D].洛陽:河南科技大學,2012.
[11]WANG D,YUAN J,GU S,et al.Influence of fungal elicitors on biosynthesis of natamycin byStreptomycesnatalensisHW-2[J].Applied microbiololgy and biotechnology,2013,97(6):5527-5534.
[12]WANG S,LIU F,HOU Z,et al.Enhancement of natamycin production onStreptomycesgilvosporeusby chromosomal integration of the vitreoscilla hemoglobin gene (vgb)[J].World journal of microbiology and biotechnology,2014,30(4):1369-1376.
[13]LIU S P,YU P,YUAN P H,et al.Sigma factor WhiGchpositively regulates natamycin production inSreptomyceschattanoogensisL10[J].Applied microbiology and biotechnology,2015,99(6):2715-2726.
[14]劉勝男,王亞洲,石林霞,等.γ-亞麻酸產生菌的低能離子束誘變選育[J].河南科技大學學報(自然科學版),2015,36(3):76-85.
[15]楊東靖,陳冠群,王敏,等.納他霉素高產菌株的鏈霉素抗性選育及其發酵工藝的優化[J].藥物生物技術,2003,10(2):84-87.
[16]蔡秀云,朱小容,包如勝,等.納他霉素高產菌株的誘變選育[J].食品與發酵工業,2011,37(11):108-112.
[17]RECIO E,APARICIO J F,RUMBERO A,et al.Glycerol,ethylene glycol and propanediol elicit pimaricin biosynthesis in the PI factor-defective strainStreptomycesnatalensisnpi287 and increase polyene production in several wild-type actinomycetes[J].Microbiology,2006,152:3147-3156.
基金項目:國家自然科學基金項目(3140101119)
作者簡介:張帥瀅(1992-),男,河南鞏義人,碩士生;何佳(1965-),男,河南洛陽人,教授,博士,碩士生導師,主要研究方向為發酵工程.
收稿日期:2016-01-21
文章編號:1672-6871(2016)04-0081-06
DOI:10.15926/j.cnki.issn1672-6871.2016.04.017
中圖分類號:TQ927;Q939.97
文獻標志碼:A

