非水電解質溶液的狀態方程
韓正
(北京化工大學,北京100029)
研究與開發
非水電解質溶液的狀態方程
韓正
(北京化工大學,北京100029)
以甲醇為溶劑的非水電解質溶液作為研究對象,構造出了能夠準確描述非水電解質溶液熱力學性質的狀態方程。狀態方程中包含2個可調節參數,在不改變可調節參數的情況下,該狀態方程對于不同溫度、濃度的非水電解質溶液的熱力學性質保持著良好的預測能力;其中的亥姆霍斯自由能由微擾理論計算得到,并闡述了非水電解質溶液的蒸汽壓、溶劑活度的求解過程。
非水電解質溶液;狀態方程;熱力學
根據電解質溶液中溶劑的不同,人們把以水作為溶劑的電解質溶液稱作“水電解質溶液”,而把以其它物質(如甲醇、乙醇等)作為溶劑的電解質溶液稱作“非水電解質溶液”。用來描述電解質溶液熱力學性質的模型主要有2種,他們分別是活度系數模型和狀態方程模型,而本次研究所開發的模型正是針對以甲醇為溶劑的非水電解質溶液所開發的狀態方程模型。
狀態方程(Equation of State,EOS)是表征流體壓強、密度和溫度3個熱力學參量的函數關系式,在確定了流體的狀態方程之后,就可以確定流體在不同溫度下的壓力和密度。電解質溶液的狀態方程模型法是一種首先利用熱力學理論確定電解質溶液體系的亥姆霍茲自由能,然后再將該亥姆霍茲自由能與電解質溶液的其他熱力學性質進行關聯——如活度系數、滲透系數、蒸汽壓和密度等,從而在數值上對電解質溶液熱力學性質進行準確描述的模型化處理方法。
電解質溶液在化學工業生產過程之中十分常見,深入研究電解質溶液的熱力學性質對于化工生產來說具有十分重要的意義。對于電解質溶液的蒸汽壓預測工作在許多領域中扮演著非常重要的角色,這些領域包括熱泵吸附、精餾、有機溶劑循環利用和鹽湖中貴金屬的萃取等等。在過去的幾十年里,人們對于電解質溶液熱力學性質的測量和模型化處理已經在許多方面取得了很多階段性成果,但是其中絕大多數的研究成果都是局限于水電解質溶液范圍之內。到目前為止,人們對于非水電解質溶液的研究成果還是屈指可數。盡管對于水電解質溶液來說已經有很多實驗數據存在于文獻之中以供查閱,但是與之相較而言,人們可以查閱到的關于非水電解質溶液的實驗數據還是少之又少。因此,開發出簡單合理的預測性模型來描述非水電解質溶液的熱力學性質對于化工生產來說是非常有意義的。
1 理論基礎
1.1 狀態方程簡介
本研究對象是以堿金屬鹵化物為溶質、以甲醇為溶劑的非水電解質溶液。因為鹽溶質完全解離,所以溶液中存在3種粒子——(鹽)陽離子、(鹽)陰離子和甲醇分子。鹽離子被看成是帶電的Lennard-Jones(LJ)球體,它們身上具有可與甲醇分子形成氫鍵的締合點,1個甲醇分子被看成是帶有1個點偶極和3個締合點的LJ球體。
在溫度T和體積V條件下,電解質溶液系統由N個粒子組成,第i種物質的粒子數為Ni。運用微擾理論可以將整個電解質溶液系統總的亥姆霍茲自由能A微擾展開成如下形式[1]:

式中,k是玻爾茲曼常數,上角標hs、LJ、elect、assoc和chain分別代表來自硬球排斥、Lennard-Jones、靜電、締合和成鏈作用的貢獻項,其中靜電作用項(elect)包括離子-離子(cc)、離子-偶極(cd)和偶極-偶極(dd)3項。利用電介質溶液的相關熱力學理論和計算機程序可以將上述各個亥姆霍斯自由能貢獻項的數值計算出來,然后再將各個貢獻項相加,最終就可以確定電解質溶液系統總的亥姆霍茲自由能[2-4]。
從壓縮因子與密度和亥姆霍茲自由能的關系中可以得到電解質溶液系統的狀態方程:

式中,ρ是粒子數密度,組分k的化學位由下式得到:

將上述狀態方程運用于非水電解質溶液,就可以計算出非水電解質溶液的蒸汽壓、溶劑活度和密度。
1.2 狀態方程的計算功能
1.2.1溶劑活度的計算
由活度的定義出發可以將溶液中的溶劑活度定義為:

式中,as為溶劑活度,fs為溶劑的活度系數,xs為溶劑的摩爾分數;下標s代表溶劑。而溶劑的活度系數fs與剩余化學位μres的關系可以由下式確定[5]:

式中,下標0表示純態物質。
將上式帶入式(5)即可得到電解質溶液溶劑活度的表達式:
1.2.2蒸汽壓的計算
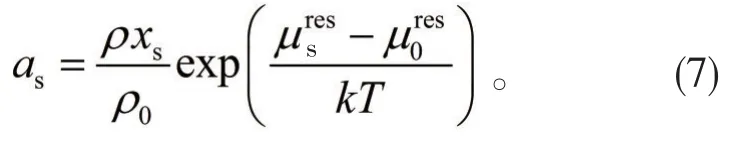

將P=ρkT帶入上式,上式可以變為:
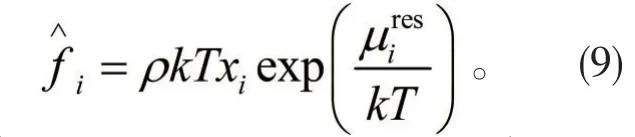
由于溶劑是電解質溶液的主要組成部分,因此可以將溶劑的蒸汽壓看做是電解質溶液的蒸汽壓,由此可以得到電解質溶液蒸汽壓的表達式:

2 狀態方程的確立
狀態方程中包含了一些參數,其中有些是可調節參數,有些是不可調節參數,不可調節參數主要包括甲醇溶劑的參數和鹽溶質的陰陽離子參數。
2.1 不可調節參數的確定
2.1.1甲醇溶劑的參數
研究針對的非水電解質溶液的溶劑是甲醇。甲醇分子是一種帶有1個點偶極和3個締合點的LJ球體。通過本狀態方程可以確定甲醇的偶極距為8.30×10-30C·m,甲醇的介電常數ε為32.49,這與298.15 K下的實驗值32.7非常之接近。
對于甲醇來說,除了偶極距以外,在本狀態方程中還有4個與溫度無關的參數需要確定,這其中包括2個LJ參數(軟球直徑σ和能量參數ε/k)和2個締合參數(締合體積參數κassoc和締合能量參數εassoc/k)。通過本狀態方程可以確定這4個參數,結果見表1。
在確定了甲醇溶劑的4個參數的同時,本狀態方程可以計算出甲醇的飽和液體在不同濃度下的密度和蒸汽壓,結果見圖1。

圖1 不同溫度下甲醇的蒸汽壓和密度Fig 1 Vapor pressure and density of methanol at different temperature

表1 甲醇的狀態方程參數和性質數據(298.15 K、0.1 MPa)Tabl 1 Methanol’s equation of state parameters and property data (298.15 K and 0.1 MPa)
由圖1可知,該計算值(曲線)與實驗值(點)吻合程度很高,其溫度是283.15~333.15 K,密度和壓力的平均絕對偏差分別為0.043%和0.087%。計算所得的甲醇在298.15 K時的密度為785.7 kg/m,這實驗值786.2 kg/m接近。
2.1.2鹽溶質的陰陽離子參數
每種鹽溶質所包含的陰陽離子有2個LJ參數:離子直徑σion和離子能量參數εion/k,其中離子直徑σion可以從Pauling離子半徑得到,離子能量參數εion/ k可以通過Mavroyannis和Stephen離散理論計算得到[6-7]。

這里αion是從文獻中得到的離子極化率[8];ne是離子中的電子數目。所有這些陰陽離子的參數都列在表2中。粒子間所有的LJ相互作用都被考慮了進去,一共包括甲醇-甲醇、甲醇-離子和離子-離子3種作用。
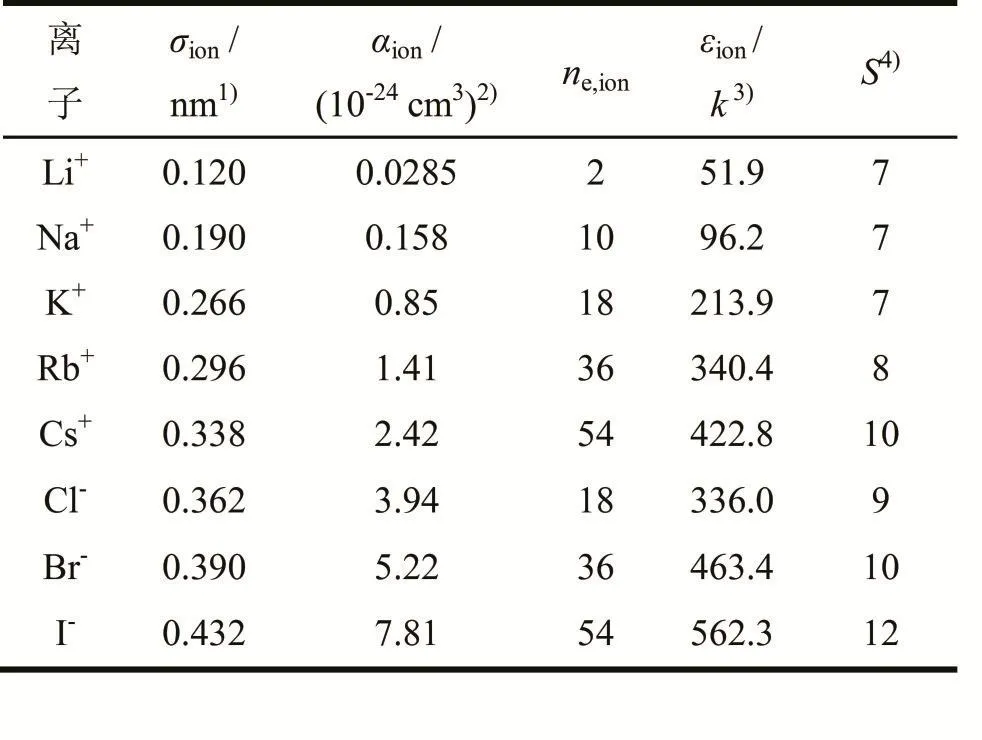
表2 陰陽離子參數Tab 2 Parameters of cations and anions
可以通過離子大小來預測每個離子上的締合點數S。在通常情況下,離子越大締合點數就越多。在本工作中,對于陽離子Li+、Na+、K+的締合點數都取7,Rb+取8,Cs+取10;對于陰離子來說,Cl-、Br-和I-的締合點數分別取9、10和12。每個離子的締合體積參數為κii=0.001。
2.2 可調節參數的確定
本狀態方程包括2個可調節參數:第1個參數是計算式(2)中Acd時所用到的有效平均離子直徑σi,它對于所有種類的鹽溶質來說都是可調節的;另1個參數就是對于每1種離子來說都不可忽略的離子-甲醇締合能量參數εassoc/k,這個參數也可以通過本狀態方程計算得到。本次工作忽略了陰離子和甲醇的締合作用,所以在本狀態方程中不存在陰離子-甲醇締合項,因此在本狀態方程中只存在2個參數。
本狀態方程通過了9種堿金屬鹵化物的甲醇電解質溶液的測試,溶液的共同狀態是0.1 MPa、298.15 K。所得溶液蒸汽壓的平均絕對偏差(AAD)的計算:

式中,NP是試驗點數,f是計算對象(p和a),上標cal和exp表明分別計算值和實驗值。
AAD和可調節參數列在表3中,用以判斷本狀態方程的準確度。

表3 狀態方程的可調節參數以及計算所得的蒸汽壓p和溶劑活度a的平均絕對偏差(AADs)Tab 3 Adjustable parameters of this equation of state(EOS) and average absolute deviations(AADs)for vapor pressure(p)and solvent activity(a)calculated
從表3可看出,本狀態方程計算出來的非水電解質溶液的蒸汽壓和溶劑活度的數值與實驗值的吻合度很高,二者總的平均絕對偏差分別是1.112%和0.106%。因此可以判斷,本狀態方程能夠準確地描述非水電解質溶液的熱力學性質。
除了可以計算活度和蒸汽壓之外,本狀態方程還可以計算非水電解質溶液的密度,與活度系數模型相比這也是本狀態方程的另一個優勢功能所在。但是由于歷史上對于非水電解質溶液的研究工作進行得太少,因此暫時還無法在歷史文獻中查詢到相關的密度實驗值作為本狀態方程所計算出的密度計算值的參照物,所以在此處就不再展示計算結果。
2.3 可調節參數的通用性
本狀態方程所包含的2個可調節參數具有很高的通用性,在不改變可調節參數的前提下,針對同一種非水電解質溶液可以計算出它在不同溫度和濃度下的蒸汽壓和溶劑活度。舉例來說,圖2和圖3展示了本狀態方程在使用表3中可調節參數的情況下計算出的相同非水電解質溶液在不同溫度下的蒸汽壓和溶劑活度(可調節參數298.15 K時),計算出來的數值是更高溫度狀態下的數值。
圖2 甲醇電解質溶液的預測蒸汽壓Fig 2 Predicted vapor pressure of methanol electrolyte solutions
由圖2和圖3可知,此時本狀態方程依然能夠準確地描述非水電解質溶液的熱力學性質,其平均絕對偏差列于表4中。
值得注意的是,本狀態方程的可調節參數的通用性還不僅僅局限于上述情況。在不改變可調節參數的情況下,把某種非水電解質溶液的濃度提高、甚至是將濃度和溶液溫度同時提高,對于其溶液壓力和溶劑活度的計算值相對于實驗值而言依然保持著很高的吻合度。圖4展示了本狀態方程使用表3中NaI-甲醇電解質溶液的可調節參數所計算出來的其在更高的濃度或者更高的溫度和濃度下的溶劑活度和溶液蒸汽壓,平均絕對偏差見表4所示(可調節參數用的是質量濃度0.024~0.755 mol/ kg下的參數,計算結果是0~4.338 mol/kg下)。
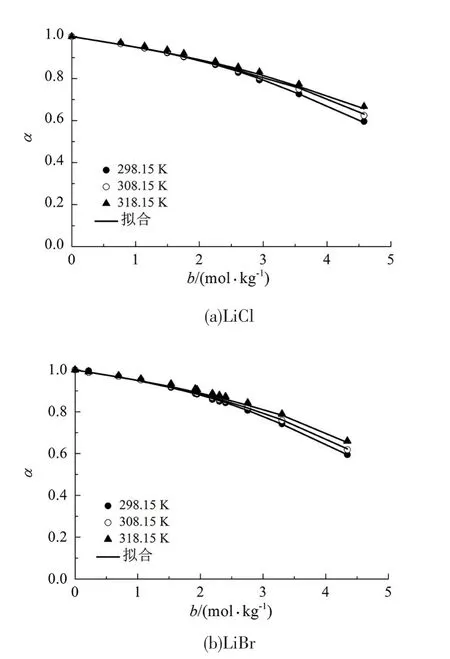
圖3 甲醇電解質溶液的預測溶劑活度Fig 3 Predicted solvent activities of methanol electrolyte solutions
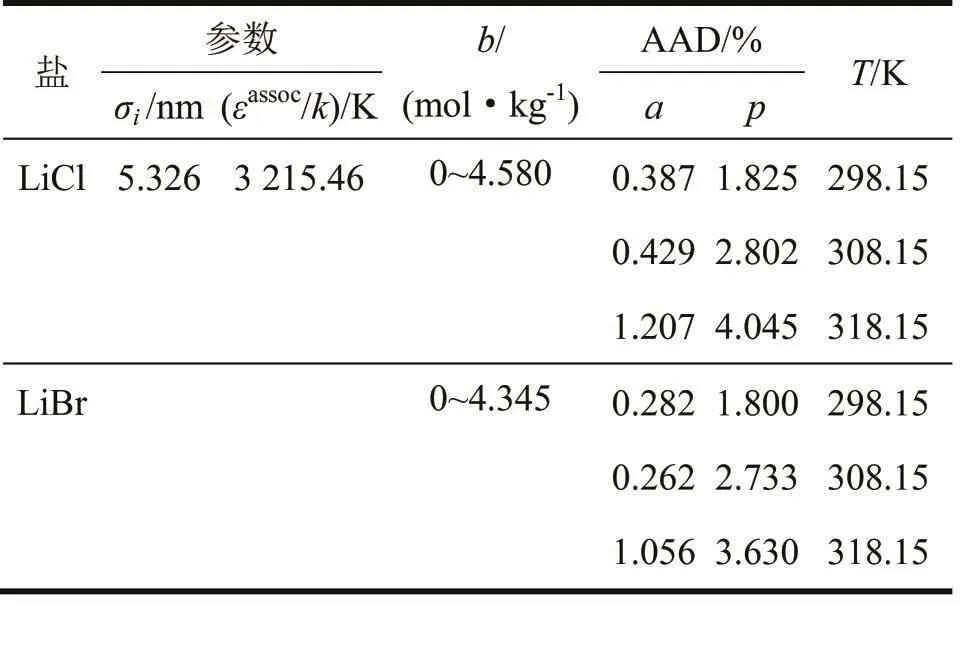
表4不改變可調節參數計算出的蒸汽壓p和溶劑活度a的平均絕對偏差(AADs)(0.1 MPa)Tab 4 Average absolute deviations(AADs)about vapor pressure(p)and solvent activity(a)calculated by adjustable parameters not change(0.1 MPa)
3 結論
目前關于電解質溶液的研究成果有很多,但是大多數研究針對的對象都是以水為溶劑的水電解質溶液,而本狀態方程所研究的對象是以甲醇為溶劑的非水電解質溶液。因此,對于電解質溶液領域來說具有填補空白的意義。
狀態方程包含了2個可調節參數,它能夠準確地計算以甲醇為溶劑、以堿金屬鹵化物為溶質的非水電解質溶液的蒸汽壓、密度和溶劑活度等熱力學性質數據。所包含的2個可調節參數具備很強的通用性——在不改變可調節參數的情況下,對于不同溫度、濃度的非水電解質溶液的熱力學性質依然具備十分準確的預測性。
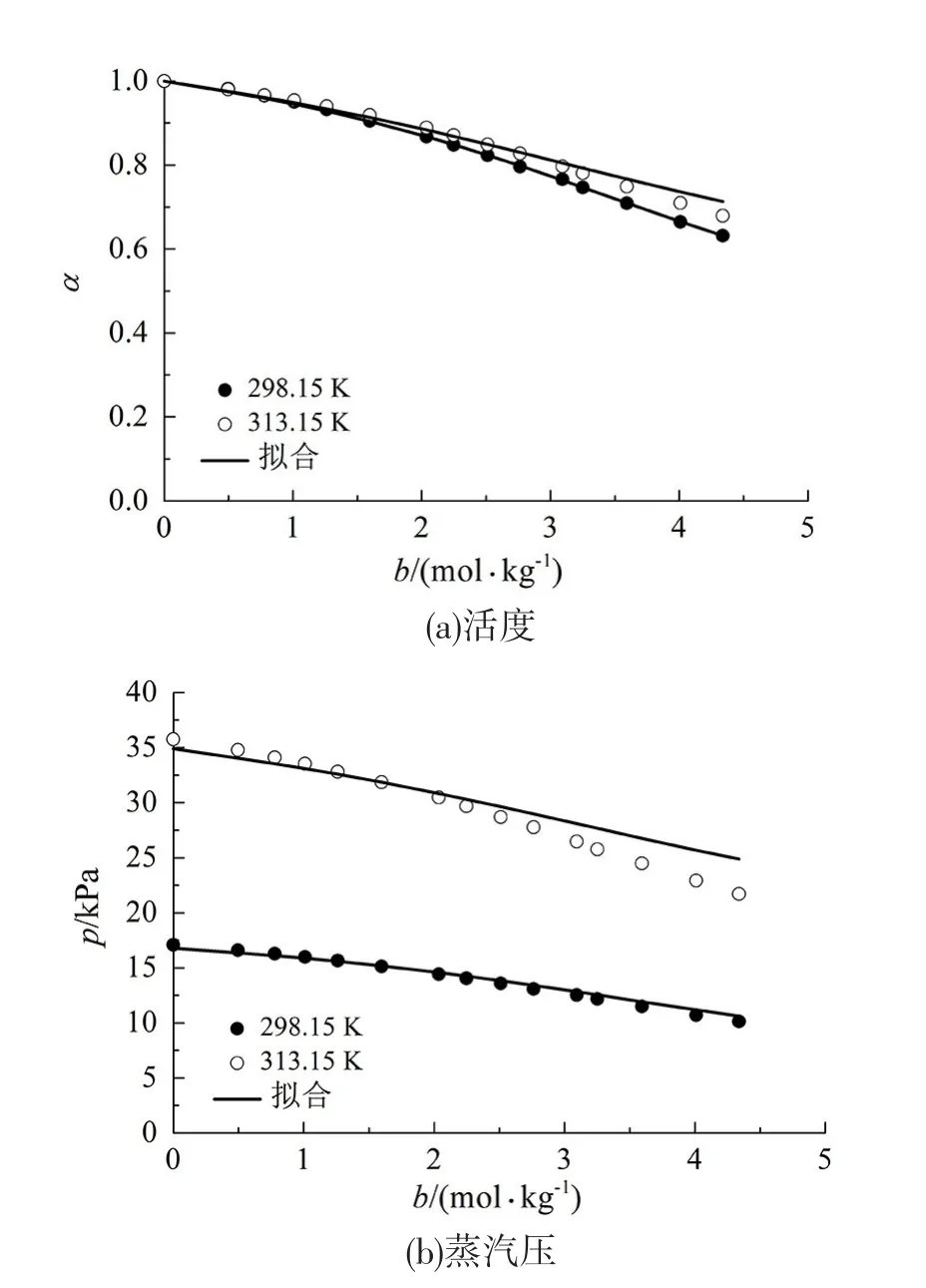
圖4 高含量下的NaI-甲醇電解質溶液的預測溶劑活度和蒸汽壓Fig 4 Predicted solvent activity and vapor pressure of NaIMethanol electrolyte solution at higher molality

表5 不改變可調節參數計算出的蒸汽壓p和溶劑活度a的平均絕對偏差(0.1 MPa)Tab 5 Average absolute deviations(AADs)about vapor pressure (p)and solvent activity(a)calculated by adjustable parameters not change(0.1 MPa)
[1]Boyle E J,Mcquarrie D A.Perturbation-theory of electrolyte -solutions[J].J Chem Phys,1985,83(6):3077-3082.
[2]Liu Z P,Wang W C,Li Y G.An equation of state for electrolyte solutions by a combination of low-density expansion of non-primitive mean spherical approximation and statistical associating fluid theory[J].Fluid Phase Equilibria,2005,227 (2):147-156.
[3]Liu W B,Li Y G,Lu J F,A new equation of state for real aqueous ionic fluids based on electrolyte perturbation theory, mean spherical approximation and statistical associating fluid theory[J].Fluid Phase Equilibria,1999,158-160:595-606.
[4]Liu W B,Liu Z P,Li Y G,Comparison of Perturbation Theory and Mean Spherical Approximation for Polar Fluids and Ion Dipole Mixtures Based on Molecular Simulation Data[J].Fluid Phase Equilibria,2001,178(1/2):45-71
[5]韓正.非水電解質溶液系統的狀態方程研究[D].北京:北京化工大學,2008:79-81.
[6]Pauling L.The NatureofChemicalBond[M].3rd ed.Ithaca,NY: Cornell University Press,1960.
[7]Mavroyannis C,Stephen M J.Dispersion forces[J].Mol Phys, 1962,5(3):629-638.
[8]CokerH.Empiricalfree-ion polarizabilitiesofthe alkalimetal, alkaline earth metal,and halide ions[J].The journalofphysical chemistry,1976,80(19):2078-2084.
TQ013.1
A DOI 10.3969/j.issn.1006-6829.2016.04.006
2016-05-27

