新疆野生及栽培一枝蒿多糖對樹突狀細胞免疫功能的影響
楊雨楊秀梅趙干俞益張慧珍張愛蓮
(1. 新疆大學生命科學與技術學院 新疆生物資源基因工程重點實驗室,烏魯木齊 830046;2. 復旦大學上海醫學院 教育部/衛生部醫學分子病毒學重點實驗室,上海 200032)
新疆野生及栽培一枝蒿多糖對樹突狀細胞免疫功能的影響
楊雨1楊秀梅1趙干2俞益1張慧珍1張愛蓮1
(1. 新疆大學生命科學與技術學院 新疆生物資源基因工程重點實驗室,烏魯木齊 830046;2. 復旦大學上海醫學院 教育部/衛生部醫學分子病毒學重點實驗室,上海 200032)
研究和比較新疆野生與栽培一枝蒿多糖對骨髓來源樹突狀細胞(dendritic cells,DCs)成熟和功能的影響。超聲法制備野生及栽培一枝蒿粗多糖;Sevage法除蛋白;蒽酮-硫酸法測定多糖含量;流式細胞術檢測DCs的成熟;ELISA法檢測IL-12和TNF-α的表達水平。結果顯示,野生及栽培一枝蒿多糖含量分別為26.18%和22.14%,去除蛋白質后多糖含量分別為30.94%和27.06%;野生及栽培一枝蒿多糖均可以顯著增強小鼠骨髓來源CD11c+DCs表面分子CD40,CD86及CD80的表達(P<0.05);顯著促進IL-12和TNF-α的表達(P<0.05);顯著降低DCs吞噬FITC-Dextran的能力;且相同劑量對DCs的免疫活性無顯著性差異(P>0.05);除蛋白和不除蛋白的野生及栽培一枝蒿多糖的免疫活性均無顯著差異(P>0.05)。新疆野生和栽培一枝蒿多糖含量差異較小,并均可以促進小鼠骨髓來源DCs的成熟和功能,且差異不大。
野生一枝蒿;栽培一枝蒿;多糖;樹突狀細胞
新疆一枝篙(Artemisia rupestris L.)別名巖蒿,為菊科蒿屬植物,是新疆哈薩克族和維吾爾族民間傳統用藥,其主要包括多糖類、黃酮類、生物堿等多種化學成分[1,2],多糖為其主要活性成分,具有抗氧化、抗病毒、調節免疫系統等多種功能[3-6]。由于新疆一枝蒿具有極高的藥用價值,野生一枝蒿難以滿足需求,栽培一枝蒿已經成功在新疆大面積種植。國內學者對新疆一枝蒿的有效成分分離及藥理作用做了大量的研究,但對一枝蒿多糖的免疫活性研究較少,尤其是比較野生與栽培一枝蒿多糖免疫活性的研究還未見報道。眾所周知,DCs是體內功能最強的專職性抗原提呈細胞,未成熟DCs通過攝取抗原逐漸成熟,成熟DCs高表達共刺激分子MHCII、CD80,CD86、CD40等,并分泌多種細胞因子,從而啟動初次免疫應答,發揮免疫調節作用[7,8]。
本研究擬通過體外培養的小鼠骨髓來源DCs為平臺,利用超聲結合水提醇沉法[9,10]制備新疆野生及栽培一枝蒿粗多糖,三氯乙酸法除蛋白[11,12],蒽酮硫酸法測定多糖含量[13];流式細胞術檢測小鼠DCs 表面分子CD40、CD86及CD80的表達水平和刺激后DCs抗原吞噬能力;ELASA法檢測細胞培養上清中IL-12和TNF-α的分泌情況,研究和比較新疆野生與栽培一枝蒿粗多糖以及除蛋白與未除蛋白一枝蒿多糖對DCs成熟和功能的影響,旨在為開發利用新疆栽培一枝蒿提供參考,也為利用新疆藥用植物篩選新型疫苗佐劑奠定一定的基礎。
1 材料與方法
1.1 材料
1.1.1 動 物 與 試 劑 5-6周,18-22 g的 雌 性C57BL/6小鼠購自新疆醫科大學動物中心。新疆野生和栽培一枝蒿(市售)。BCA蛋白測量試劑盒購自Themo公司;RPMI-1640 培養液購自Gibco公司;胎牛血清購自以色列Bioind公司;流式抗體PECD11c、APC-CD40購自美國BD公司;IL-12、TNF-α ELISA試劑盒購自武漢博士德公司;石油醚、無水乙醇、三氯甲烷、正丁醇、蒽酮、葡萄糖等均為國產分析純。
1.1.2 儀器 超凈工作臺(Heal Force公司);旋轉蒸發儀(上海亞榮生化儀器廠);全波長酶標儀(美國 Bio-TeK公司);磁力攪拌器(金壇市醫療儀器廠),二氧化碳培養箱(Heal Force公司);流式細胞儀(美國BD公司)。
1.2 方法
1.2.1 新疆野生及栽培一枝蒿粗多糖的制備 采用超聲結合水提醇沉的方法,具體步驟如下:取適量新疆野生及栽培一枝蒿粉末,加入5倍體積的石油醚超聲脫脂;加入5倍體積無水乙醇超聲;抽濾干燥后加入10倍體積蒸餾水,37℃超聲兩次,離心合并上清,減壓濃縮;加入無水乙醇靜置醇沉12 h;真空抽濾烘干后得到新疆野生及栽培一枝蒿粗多糖粉末,-80℃保存備用。
1.2.2 新疆野生及栽培一枝蒿粗多糖sevage法除蛋白 稱取適量上述制備的新疆野生及栽培一枝蒿多糖粉末,加入100倍體積蒸餾水,磁力攪拌使其溶解,加入sevage試劑(氯仿∶正丁醇=4∶1)除蛋白,離心取上清,重復多次,減壓濃縮;加入無水乙醇靜置醇沉,真空抽濾干燥,得到除蛋白的新疆野生及栽培一枝蒿多糖粉末,-80℃保存備用。
1.2.3 新疆野生及栽培一枝蒿多糖含量和蛋白含量測定 采用蒽酮-硫酸法檢測上述制備的未除蛋白及除蛋白處理后樣品中的多糖含量,以葡萄糖為標準品繪制標準曲線,得回歸方程 A=0.696 8C+0.051 9,r=0.992 6,根據標準曲線方程計算樣品中的多糖含量和得率。采用BCA蛋白測量試劑盒檢測樣品中的蛋白含量,以牛血清蛋白繪制標準曲線,得回歸方程為 A=0.571 5C+0.081 6,r=0.998 7,根據標準曲線計算樣品中的蛋白含量。
1.2.4 小鼠骨髓來源DCs的體外培養 將C57BL/6小鼠頸椎脫臼處死,無菌狀態下取股骨和脛骨,收集骨髓細胞,制成單細胞懸液,1 200 r/min離心5 min,棄上清。用含 10%血清的 RPMI-1640培養液調整細胞濃度至 1×107個/mL,加入20 ng/mL的GM-CSF,接種細胞于60 mm細胞培養皿中,置37℃,5% CO2培養箱中培養。隔天半換液,第3天全換液。每日用顯微鏡觀察細胞的形態和生長情況。第6天,離心收集培養的細胞,將細胞分組用于后續體外刺激實驗。
1.2.5 新疆野生及栽培一枝蒿多糖體外刺激DCs選用野生一枝蒿粗多糖(Wild A. rupestris crud e polysaccharides,WARCP),栽培一枝蒿粗多糖(Cultivated A. rupestris crude Polysacc-harides,CARCP),除蛋白的野生一枝蒿粗多糖(Deproteinization of wild A. rupestris crude Polysaccharides,DWARCP),除蛋白的栽培一枝蒿粗多糖(Deproteinization of cultivated A.rupestris crude polysaccharides,DCARCP)50 μg和250 μg兩個劑量,分別進行體外刺激實驗。上述培養的小鼠骨髓來源的DCs按1×106個/孔接種于24孔細胞培養板中,將DCs分成10組:WARCP 50 μg、WARCP 200 μg、CARCP 50 μg、CARCP 200 μg、DWARCP 50 μg、DWARCP 200 μg、DCARCP 50 μg、DCARCP 200 μg實 驗 組,RPMI-1640陰性對照組和LPS ng/mL陽性對照組,將各種樣品分別加入接種好的DCs中,每組3只小鼠進行獨立重復實驗,培養12 h后,用于后續檢測。
1.2.6 流式細胞術檢測一枝蒿多糖對小鼠DCs表面分子表達的影響 一枝蒿多糖刺激小鼠骨髓來源的DCs 12 h 后,收集DCs,將細胞數調整為1×106個,進行表面分子染色,室溫避光20 min,加入10 mL含0.5%胎牛血清的PBS,1 200× g離心10 min,加入300 μL PBS,過200目銅網,流式細胞術檢測CD11c+CD40、CD11c+CD86及CD11c+CD80表達情況。
1.2.7 ELISA法檢測一枝蒿多糖對DCs分泌細胞因子的影響 分別收集上述各實驗組刺激12 h后的DCs培養上清,應用ELISA kit檢測細胞培養液上清中IL-12和TNF-α的含量,具體操作按 ELISA 說明書進行。反應終止后用酶標儀檢測450 nm吸光值,根據標準曲線確定所測細胞因子的濃度。
1.2.8 流式細胞術檢測一枝蒿多糖對小鼠DCs抗原吞噬能力的影響 一枝蒿多糖刺激小鼠骨髓來源的DCs 12 h 后,各實驗組加入25 μg/mL FITC-Dextran染色,37℃培養1 h,收集DCs,將細胞數調整為1×106個,加入10 mL含0.5%胎牛血清的PBS,1 200× g離心10 min,加入300 μL PBS,過200目銅網,流式細胞術檢測CD11c+Dextran表達情況。
1.2.9 統計學分析 FlowJo 7.6 軟件處理流式細胞術檢測結果,利用 GraphPad Prism 5.0進行數據分析,數據均采用±s,進行單因素方差分析和多組均數間的比較,差異顯著標準為 P<0.05。

圖1 WARCP/CARCP對體外小鼠DCs細胞生長狀態的影響
2 結果
2.1 新疆野生及栽培一枝蒿多糖含量和蛋白含量測定
一枝蒿樣品的多糖含量和蛋白含量檢測結果如表1所示,WARCP的多糖含量為26.18%,蛋白含量為22.23%,得率4.20%;DWARCP的多糖含量為30.94%,蛋白含量為10.67%,得率為0.88%;兩者的多糖含量間無差異顯著(P>0.05),蛋白含量和多糖的得率差異顯著(P<0.05)。CARCP的多糖含量為22.14%,蛋白含量為17.69%,得率為6.50%;DCARCP的多糖含量為27.06,蛋白含量為6.46%,得率為1.20%,兩者的多糖含量間無差異顯著(P>0.05),蛋白含量和多糖的得率差異顯著(P<0.05),WARCP和CARCP的多糖含量、DWARCP和DCARCP的多糖含量間無顯著差異(P>0.05)。
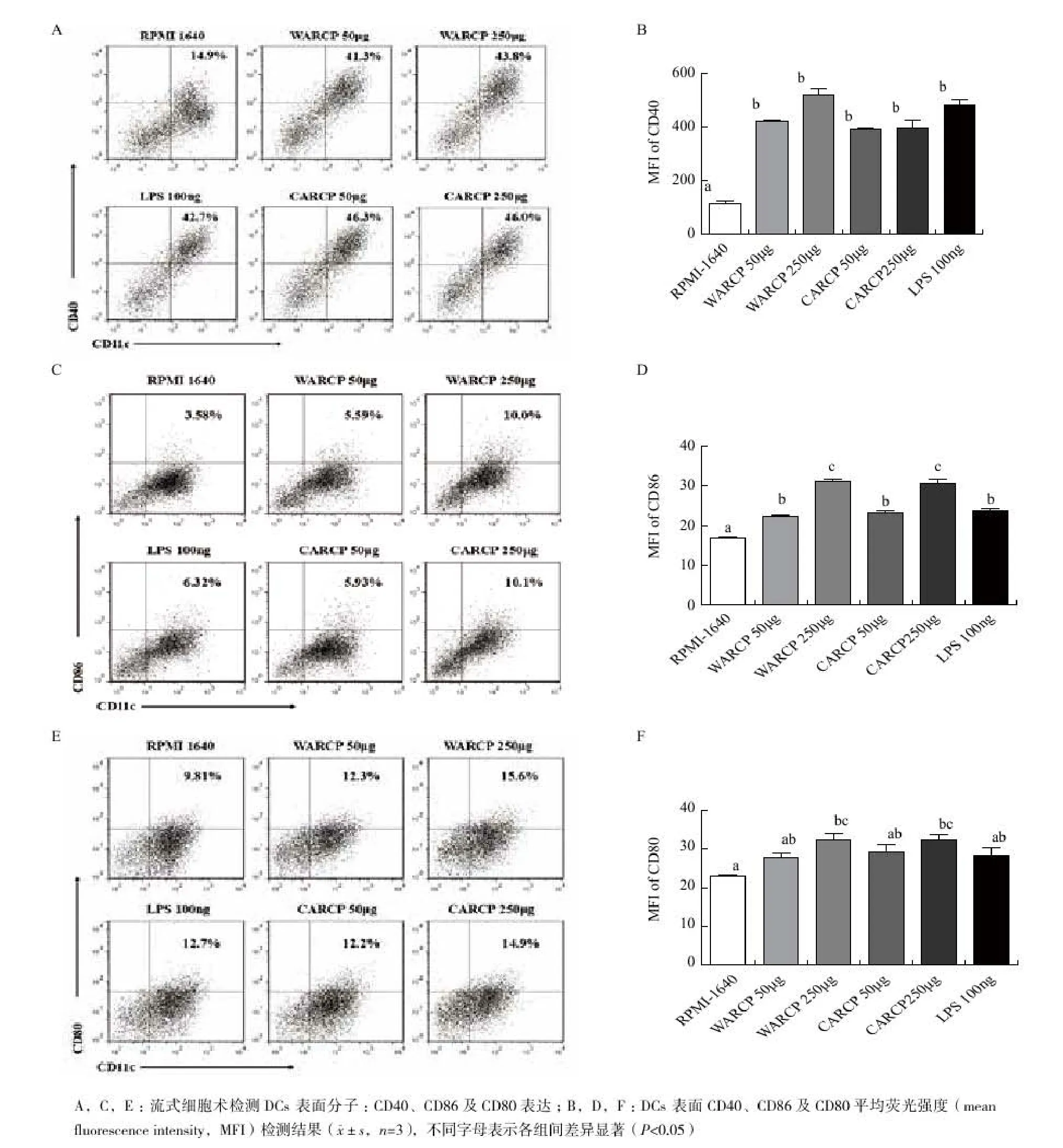
圖2 WARCP/CARCP對體外小鼠DCs表面分子表達的影響
2.2 WARCP和CARCP對DCs細胞生長狀態的影響
結果如圖1所示,WARCP和CARCP刺激DCs 12 h后,細胞群形態沒有發生變化,與陰性對照相比,各實驗組DCs的細胞數沒有顯著性差異(P>0.05)。

表1 新疆野生及栽培一枝蒿多糖樣品中的多糖及蛋白含量測定結果
2.3 WARCP和CARCP對DCs表面分子表達和細胞因子分泌的影響
DCs表面分子表達結果如圖2,與未處理的DCs相比,WARCP和CARCP均能顯著促進CD11c+CD40、CD11c+CD86及CD11c+CD80的表達(P<0.05);CD11c+CD40和CD11c+CD80的表達與陽性對照組LPS組相當(P>0.05),CD11c+CD86的表達高于陽性對照組(P<0.05);相同劑量的WARCP和CARCP對DCs成熟的促進作用沒有顯著性差異(P>0.05)。
細胞因子檢測的結果如圖3,與未處理的DCs相比,WARCP和CARCP均能顯著促進DCs細胞因子IL-12和TNF-α的分泌(P<0.05),低劑量組與陽性對照組LPS相當(P>0.05),高劑量組作用效果優于LPS對照組,且差異顯著(P<0.05);相同劑量的WARCP和CARCP對IL-12和TNF-α的分泌作用沒有顯著性差異(P>0.05)。

圖3 WARCP/CARCP對體外小鼠DCs細胞因子分泌的影響
2.4 WARCP和CARCP對DCs抗原吞噬功能的影響
DCs吞噬FITC-Dextran結果如圖4,WARCP和 CARCP均能促進DCs成熟,不同劑量刺激后DCs吞噬FITC-Dextran能力顯著下降(P<0.05);相同劑量的WARCP和CARCP對DCs吞噬FITC-Dextran能力沒有顯著性差異(P>0.05)。

圖4 WARCP/CARCP對體外小鼠DCs抗原吞噬功能的影響
2.5 DWARCP和DCARCP對DCs表面分子表達和細胞因子分泌的影響
DCs表面分子表達結果如圖5,DWARCP和DCARCP均能顯著促進CD11c+CD40、CD11c+CD86及 CD11c+CD80的 表 達(P<0.05),CD11c+CD40和CD11c+CD80的表達與陽性對照組LPS組相當(P>0.05),CD11c+CD86的表達高于陽性對照組(P<0.05);相同劑量的DWARCP和DCARCP對DCs成熟的促進作用沒有顯著性差異(P>0.05)。
細胞因子的檢測結果如圖6,DWARCP和DCARCP均能顯著促進DCs細胞因子IL-12和TNF-α的分泌(P<0.05),低劑量組間沒有顯著差異(P>0.05),與陽性對照組LPS相當(P>0.05),DWARCP高劑量組作用效果優于DCARCP高劑量組,與LPS組差異顯著(P<0.05)。

圖5 DWARCP/DCARCP對體外小鼠DCs表面分子表達的影響
2.6 DWARCP和DCARCP對DCs抗原吞噬功能影響
DCs吞噬FITC-Dextran結果如圖7,DWARCP和DCARCP均能促進DCs成熟,不同劑量刺激后DCs吞噬FITC-Dextran能力顯著下降(P<0.05);相同劑量的DWARCP和DCARCP對DCs吞噬FITC-Dextran能力沒有顯著性差異(P>0.05)。

圖6 DWARCP/DCARCP對體外小鼠DCs細胞因子分泌的影響

圖7 DWARCP/DCARCP對體外小鼠DCs抗原吞噬功能的影響
2.7 WARCP和DWARCP對DCs表面分子的表達和細胞因子分泌的影響
結果如圖8,WARCP和DWARCP均能顯著促進CD11c+CD40、CD11c+CD86及CD11c+CD80的表達,也能顯著促進DCs細胞因子IL-12和TNF-α的分泌,相同劑量的WARCP和DWARCP對DCs表面分子和細胞因子分泌的促進作用沒有顯著性差異(P>0.05)。
2.8 CARCP和DCARCP對DCs表面分子的表達和細胞因子分泌的影響
結果如圖9,CARCP和DCARCP均能顯著促進CD11c+CD40、CD11c+CD86及CD11c+CD80的表達,也能顯著促進DCs細胞因子IL-12和TNF-α的分泌,相同劑量的CARCP和DCARCP對DCs表面分子表達和細胞因子分泌的促進作用沒有顯著性差異(P>0.05)。
2.9 WARCP/DWARCP和CARCP/DCARCP對DCs抗原吞噬能力的影響
DCs吞噬FITC-Dextran結果如圖10,不同劑量WARCP/DWARCP和CARCP/DCARCP刺激后DCs吞噬FITC-Dextran能力顯著下降(P<0.05);相同劑量的WARCP/DWARCP和CARCP/DCARCP對DCs吞噬FITC-Dextran能力沒有顯著性差異(P>0.05)。
3 討論
中藥多糖是一類廣泛分布于植物界的重要生物活性成分,大量實驗證明,中藥多糖對抗腫瘤、抗病毒,抗氧化、抗衰老以及提高免疫力方面都有非常顯著的效果,國內外學者已經從多種傳統中藥中提取多糖成分研究其免疫調節的作用,如人參多糖、黃芪多糖、茯苓多糖、淫羊藿多糖等[14-16],發現中藥多糖可以通過增強DC表面分子的表達和細胞因子的分泌促進DC成熟,促進淋巴細胞增殖,啟動免疫應答[17-19]。新疆一枝蒿為典型地產藥用植物,由于用藥量的不斷增大,野生資源難以滿足需要,栽培品種已經成功在新疆大面積種植,研究者們對野生一枝蒿與人工栽培的質量及有效成分進行了比較,但是對其活性成分的免疫活性比較較少,鑒于DCs在免疫系統中發揮的關鍵作用,本研究利用DCs作為一枝蒿多糖免疫活性的檢測平臺,探討其對小鼠體外DCs的生長狀態、成熟和功能的影響,比較新疆野生及栽培一枝蒿多糖的免疫活性,為更好的開發利用栽培一枝蒿的研究提供參考。

圖8 WARCP/DWARCP對小鼠體外DCs表面分子表達和細胞因子分泌的影響

圖9 CARCP/DCARCP對小鼠體外DCs表面分子表達和細胞因子分泌的影響

圖10 WARCP/DWARCP和CARCP/DCARCP對體外小鼠DCs抗原吞噬功能的影響
本研究結果表明,野生一枝蒿與栽培一枝蒿粗多糖樣品中多糖含量差異不顯著,在一定的劑量范圍內對小鼠骨髓來源DCs的生長狀態,細胞群形態沒有影響。以多糖作為標準體外刺激小鼠骨髓來源的DCs,野生和栽培一枝蒿均可顯著促進DCs的成熟和功能,且相同劑量效果差異不大。在此基礎上,為了檢測樣品中蛋白質對多糖發揮免疫作用的影響,進行了野生一枝蒿和栽培一枝蒿樣品除蛋白后,多糖含量、蛋白含量以及對DCs成熟和功能的影響探討。研究結果發現,野生及栽培一枝蒿粗多糖樣品分別除去蛋白后,多糖含量雖有所增加,但沒有顯著差異;蛋白含量差異顯著;多糖得率差異顯著,野生一枝蒿樣品未蛋白的多糖得率為4.20%,除蛋白后的得率僅為0.88%,栽培樣品未蛋白后的多糖得率為6.50%,除蛋白后的得率為1.20%。樣體外刺激小鼠DCs后的檢測結果表明,除蛋白的野生和栽培一枝蒿樣品對DCs表面分子CD40、CD86及CD80的表達沒有顯著差異;對DCs細胞因子IL-12和TNF-α的分泌,除野生高劑量優于栽培一枝蒿外,低劑量之間沒有顯著差異;對DCs內吞抗原FITCDextran的能力沒有顯著性差異。不除蛋白和除蛋白的野生一枝蒿樣品對促進DCs成熟和功能的影響沒有顯著差異,不除蛋白和除蛋白的栽培一枝蒿樣品對促進DCs成熟和功能的影響也沒有顯著差異。這些結果表明除蛋白和不除蛋白樣品對DCs的成熟和功能沒有影響,但是除蛋白后樣品中的多糖得率顯著降低。
4 結論
本實驗采用超聲法制備野生及栽培一枝蒿粗多糖,多糖含量分別為26.18%和22.14%;Sevage法除蛋白,去除蛋白質后多糖含量分別為30.94%和27.06%。
流式細胞術檢測DCs表面分子CD40、CD86及CD80表達,ELISA法檢測細胞因子IL-12和TNF-α的表達水平,流式細胞術檢測刺激后DCs抗原吞噬能力,結果顯示,野生及栽培一枝蒿多糖均可以顯著增強DCs表面分子CD40、CD86及CD80、細胞因子IL-12和TNF-α的表達(P<0.05);降低DCs抗原吞噬能力,且相同劑量野生及栽培一枝蒿多糖對DCs的免疫活性無顯著性差異(P>0.05),除蛋白和不除蛋白的野生及栽培一枝蒿多糖的免疫活性均無顯著差異(P>0.05)。
新疆野生和栽培一枝蒿多糖含量差異較小,野生與栽培一枝蒿多糖對DCs的成熟和功能作用相當,除蛋白對野生和栽培一枝蒿的免疫活性影響不大。
[1]汪豪, 杜慧斌, 斯拉甫. 艾白, 等. 新疆一枝蒿化學成分的研究[J]. 中國藥科大學學報, 2011, 42(4):310-313.
[2]Gu DY, Abdulla R, Aisa HA, et al. Characterization and identification of chemical compositions in the extract of Artemisia rupestris L. by liquid chromatography coupled to quadrupole timeof-flight tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2012, 26:83-100.
[3]馬俊鵬, 朱位江, 盧冬梅. 一枝蒿提取物調節小鼠免疫功能的研究[J]. 西北藥學雜志, 2009, 24(3):197-199.
[4]陶海英, 孫玉華, 胡正梅, 等. 復方一枝蒿顆粒的抗炎、抗菌作用和對免疫功能的影響[J]. 中藥藥理與臨床, 2007, 23(2):64-66.
[5]孟繁龍, 李治建, 斯拉甫·艾白, 等. 一枝蒿有效部位對小鼠免疫功能的影響[J]. 時珍國醫國藥, 2011, 22(3):537-539.
[6]李軍, 劉文麗, 哈爾·札衣爾, 等. 人工栽培與野生新疆一枝蒿質量及有效成分的比較[J]. 中草藥, 1996, 235-237.
[7]Fukui H, Mitsui S, Harima N, et al. Novel functions of herbal medicines in dendritic cells:role of Amomi Semen in tumor immunity[J]. Microbiol Immunol, 2007, 51:1121-1133.
[8]Garg R, Shrivastava P, van Drunen Littel-van, et al. The role of dendritic cells in innate and adaptive immunity to respiratory syncytial virus, and implications for vaccine development[J]. Expert Rev Vaccines, 2012, 11:1441-1457.
[9]楊芳, 曹銀, 廖緒標, 等. 板栗多糖的超聲波輔助提取技術[J].湖北農業科學, 2012, 51(12):2552-2555.
[10]王如濤, 吳綿斌, 林建平, 等. 植物多糖分離提取技術的研究進展[J]. 中國生物工程雜志, 2013, 33(7):118-123.
[11]萬琴, 蕭偉. 女貞子多糖除蛋白工藝的研究[J]. 中草藥, 2010, 41(3):407-410.
[12]劉玉佳, 孔繁東, 劉兆芳, 等. 桔梗多糖Sevag法除蛋白工藝的研究[J]. 中國調味品, 2014, 39(4):5-7.
[13]孫曉燕, 蔡昌利, 徐麗莉, 等. 多糖含量測定方法的比較[J].現代中藥研究與實踐, 2015, 29(3):58-62.
[14]Zhao LH, Ma ZX, Zhu J, et al. Characterization of polysaccharide from Astragalus radix as the macrophage stimulator[J]. Cell immunol, 2011, 271:329-334.
[15]劉景田, 黨小軍, 張潔. 中藥多糖增強淋巴細胞免疫效應與機制研究[J]. 中國藥學雜志, 1999, 34(12):807-809.
[16]Kouakou K, Schepetkin IA, Yapi A, et al. Immunomodulatory activity of polysaccharides isolated from Alchornea cordifolia[J]. J Ethnopharmacol, 2013, 146:232-242
[17]Li J, Ji L, Sun L, et al. Analysis of Herba Asari polysaccharides and their immunological activity[J]. Carbohydr Polym, 2012, 87(1):551-556.
[18]Li JY, Li JY, Zhang FC, et al. The immunoregulatory effects of Chinese herbal medicine on the maturation and function of dendritic cells[J]. J Ethnopharmacology, 2015, 2(171):184-195.
[19]Jin M, Huang Q, Zhao K, et al. Biological activities and potential health benefit effects of polysaccharides isolated from Lycium barbarum L[J]. Int J Biol Macromol, 2013, 5(54):16-23.
(責任編輯 李楠)
Immunoregulative Action of Polysaccharides in Wild and Cultivated Artemisia rupestris in Xinjiang on Bone Marrow Dendritic Cells
YANG Yu1YANG Xiu-mei1ZHAO Gan2YU Yi1ZHANG Hui-zhen1ZHANG Ai-lian1
(1. Xinjiang Key Laboratory of Biological Resources and Genetic Engineering,College of Life Science and Technology,Xinjiang University,Urumqi 830046;2. Key Laboratory of Medical Molecular Virology of the Ministry of Health and Ministry of Education,Shanghai Medical College,Fudan University,Shanghai 200032)
This work is to study and compare the effects of crude polysaccharides in wild Artemisia rupestris(WARCP)and cultivated A. rupestris (CARCP)on the maturation and function of bone marrow dendritic cells(DCs). The WARCP and CARCP were isolated by ultrasonic extraction,the protein was removed by Sevage,the polysaccharides content of them were measured by anthrone-sulfuric acid method,the maturation of DCs were detected by flow cytometry,and the expressions of IL-12 and TNF-α were examined by ELISA. As results,the polysaccharides contents of WARCP and CARCP were 26.18% and 22.14% respectively,while the polysaccharides contents of WARCP and CARCP after removing protein were 30.94% and 27.06% respectively. Both WARCP and CARCP significantly enhanced the expression level of CD40,CD86 and CD80 on the CD11c + DCs from mice’s bone marrow(P < 0.05),significantly promoted the expression of IL-12 and TNF-α(P < 0.05),significantly reduced the capabilities of DCs phagocytosis to FITC-Dextran,and their immunoregulative actions at the same dose of them was not significant(P > 0.05),there was no significant differences on immunoregulative action of WARCP and CARCP between removing and not removing protein(P > 0.05). In conclusion,there is little difference between WARCP and CARCP,and both enhance the maturation and function of mouse’s bone marrow DCs in little differencen.
wild Artemisia rupestris L.;cultivated Artemisia rupestris L.;polysaccharides;dendritic cells
10.13560/j.cnki.biotech.bull.1985.2016.07.031
2016-01-26
國家自然科學基金項目(31360224)
楊雨,男,碩士研究生,研究方向:新型疫苗佐劑;E-mail:lsjyjyy@126.com
張愛蓮,女,副教授,研究方向:新型疫苗佐劑;E-mail:xjzal@163.com

